TATA결합단백질
TATA-binding protein| TBP | |||||||||
|---|---|---|---|---|---|---|---|---|---|
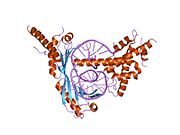
 효모 brf1-tbp-삼원복합체 결정구조 | |||||||||
| 식별자 | |||||||||
| 기호. | TBP | ||||||||
| 팜 | PF00352 | ||||||||
| 빠맘 클랜 | CL0407 | ||||||||
| 인터프로 | IPR000814 | ||||||||
| 프로 사이트 | PDOC00303 | ||||||||
| SCOP2 | 1 tbp / SCOPe / SUPFAM | ||||||||
| |||||||||
TATA 결합 단백질(TBP)은 TATA 박스라고 불리는 DNA 배열에 특이적으로 결합하는 일반적인 전사 인자입니다.이 DNA 배열은 일부 진핵생물 유전자 [5]촉진제에서 전사 시작 부위의 상류에서 약 30개의 염기쌍이 발견됩니다.
TBP유전자패밀리
TBP는 TBP 관련 [6]인자의 작은 유전자 패밀리의 구성원이다.첫 번째 TBP 관련 인자(TRF/TRF1)는 초파리 드로소필라에서 확인되었지만 파리 또는 곤충 특이적인 것으로 보인다.이후 많은 메타조안들의 게놈에서 TBPL1/TRF2가 발견된 반면, 척추동물 게놈은 제3의 척추동물 계열인 TBPL2/TRF3를 암호화했다.특정 셀 유형 또는 특정 프로모터에서 TBP는 이러한 TBP 관련 요인 중 하나로 대체될 수 있으며, 그 중 일부는 TBP와 마찬가지로 TATA 박스와 상호작용합니다.
전사 요소로서의 역할
TBP는 진핵생물 일반전사인자 TFIID의 하위 단위이다.TFIID는 RNA 중합효소 II(RNA Pol II)[7]의 전사 사전 개시 복합체를 형성하는 동안 DNA에 결합하는 첫 번째 단백질이다.DNA를 배열 특이적으로 결합하는 사전 개시 복합체 내의 몇 안 되는 단백질 중 하나로서 RNA 중합효소 II를 유전자의 전사 시작 부위에 위치시키는 것을 돕는다.그러나, 인간 프로모터의 10~20%만이 TATA 박스를 가지고 있는 것으로 추정된다.따라서, TBP는 RNA 중합효소 II의 위치에 관여하는 유일한 단백질은 아닐 것이다.인간 프로모터의 대부분은 TATA가 없는 하우스키핑 유전자 프로모터입니다.하우스키핑 유전자 [8][9]조절자에 의해 이들 프로모터에 대한 TBP 결합이 촉진된다.흥미롭게도 TATA를 포함한 프로모터의 [10]TATA 박스 하류 약 30bp의 좁은 영역 내에서 TATA가 없는 프로모터의 트랜스크립션 시작 사이트는 200bp 지역 [11][9]내에 분산되어 있습니다.
TFIID가 유전자의 프로모터 영역에서 TATA 박스에 결합하는 것은 RNA Pol II가 전사를 시작하기 위해 필요한 다른 인자의 획득을 개시한다.모집된 다른 전사 요인으로는 TFIIA, TFIIB 및 TFIIF가 있습니다.이러한 전사인자 각각은 여러 단백질 서브유닛을 포함한다.
TBP는 또한 RNA 중합효소 I 및 RNA 중합효소 III에 의한 전사에 중요하며, 따라서 세 가지 RNA [12]중합효소 모두에 의한 전사의 시작에 관여한다.
TBP는 DNA를 80° 굽힘으로써 DNA 용융(이중 가닥 분리)에 관여합니다(결합하는 AT가 풍부한 시퀀스는 용융을 용이하게 합니다).TBP는 β 시트를 사용하여 작은 홈을 결합한다는 점에서 특이한 단백질이다.
TBP의 또 다른 특징적인 특징은 단백질의 N 말단에 있는 글루타민의 긴 줄이다.이 영역은 C 말단의 DNA 결합 활성을 조절하고, DNA 결합의 변조는 전사 복합체 형성 및 전사의 시작 속도에 영향을 미친다.이 폴리글루타민로를 코드하는 CAG 반복 횟수를 확대하고, 따라서 폴리글루타민열의 길이를 늘리는 돌연변이는 폴리글루타민 질환으로 [13]분류되는 신경변성 질환인 스피노크레벨라 아탁시아17과 관련된다.
DNA-단백질 상호작용
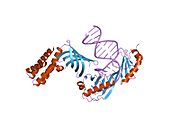
TBP는 DNA 내의 TATA 박스에 결합하면 염기쌍 사이에 아미노산 측쇄를 삽입하고 나선을 부분적으로 풀어 이중으로 꼬임으로써 DNA를 변형시킨다.변형은 단백질과 DNA 사이의 다량의 표면 접촉을 통해 이루어진다. TBP는 양전하를 띤 리신과 아르기닌 아미노산 잔기를 통해 DNA 골격에서 음전하를 띤 인산염과 결합한다.DNA의 급격한 굴곡은 4개의 부피가 큰 페닐알라닌 잔기를 작은 홈에 투영하여 생성됩니다.DNA가 구부러지면 TBP와의 접촉이 증가하여 DNA-단백질 상호작용이 강화된다.
이 상호작용을 통해 DNA에 가해지는 변형은 가닥의 용해 또는 분리를 시작합니다.DNA의 이 영역은 오직 두 개의 수소 결합을 통해 염기쌍을 이루는 아데닌과 티민 잔류물이 풍부하기 때문에, DNA 가닥은 더 쉽게 분리된다.두 가닥의 분리는 염기를 노출시키고 RNA 중합효소 II가 유전자의 전사를 시작할 수 있게 한다.
TBP의 C 말단은 (불완전하게) DNA의 T-A-T-A 영역을 보완하는 나선형 모양으로 구성되어 있습니다.이 불완전성은 DNA가 수동적으로 결합하는 것을 가능하게 한다.
세포에서의 TBP 사용에 대한 정보는 RNA 중합효소 I, RNA 중합효소 II 및 RNA 중합효소 III를 참조하십시오.
단백질-단백질 상호작용
TATA 결합 단백질은 다음과 상호작용하는 것으로 나타났다.
- BRF1,[14][15]
- BTAF1,[16][17]
- C-Fos,[18]
- 씨준 [19]씨
- EDF1,[20][21][22]
- GTF2B(TFIIB),[23][24]
- GTF2A1(TFIIA 서브유닛 [23][25][26][27]1)
- GTF2F1(TFIIF 서브유닛 [16][28][29]1)
- GTF2H4(TFIH 서브유닛 4),[16]
- Mdm2,[30][31]
- MSX1,[32][33][34]
- NFYB,[35]
- P53,[36][37]
- PAX6,[37]
- POLR2A,[16]
- POU2F1,[38]
- RELA,[39][40]
- NR2B1,[41]
- TAF1,[35][42][43][44]
- TAF4,[45]
- TAF5,[35][43][46]
- TAF6,[35][43][45]
- TAF7,[35][45]
- TAF9.[35][47]
- TAF10,[35][43]
- TAF11,[35][48][49]
- TAF13 [48]및
- TAF15.[50]
복잡한 어셈블리
TATA 박스 결합 단백질(TBP)은 TATA [51][52]박스 유무에 관계없이 촉진제로부터 RNA 중합효소 I, II 및 III에 의한 전사를 시작하기 위해 필요하다.TBATA가 없는 프로모터가 있는 경우 TBP는 TBP 관련 인자(TAF)[53][54]의 도움으로 결합합니다.TBP는 일반 전사 인자 TFIIA, -B, -D, -E 및 -H를 포함한 다수의 인자와 결합하여 코어 프로모터에 거대한 다중 서브유닛 사전 개시 복합체를 형성한다.TBP는 다른 전사인자와의 연관성을 통해 다른 RNA 중합효소로부터 전사를 시작할 수 있다.TBP 유사(TBPL) [55]단백질을 포함한 몇 가지 관련 TBP가 있습니다.
구조.
TBP의 C 말단 코어(~180잔기)는 고도로 보존되며 DNA를 가로지르는 안장 모양의 구조를 생성하는 두 개의 88-아미노산 반복체를 포함합니다. 이 영역은 TATA 박스에 결합하고 전사 인자 및 조절 [56]단백질과 상호작용합니다.반면 N단자 영역은 길이와 시퀀스가 모두 다릅니다.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000112592 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000014767 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ Kornberg RD (2007). "The molecular basis of eukaryotic transcription". Proc. Natl. Acad. Sci. U.S.A. 104 (32): 12955–61. Bibcode:2007PNAS..10412955K. doi:10.1073/pnas.0704138104. PMC 1941834. PMID 17670940.
- ^ Akhtar W, Veenstra GJ (1 January 2011). "TBP-related factors: a paradigm of diversity in transcription initiation". Cell & Bioscience. 1 (1): 23. doi:10.1186/2045-3701-1-23. PMC 3142196. PMID 21711503.
- ^ Lee TI, Young RA (2000). "Transcription of eukaryotic protein-coding genes". Annual Review of Genetics. 34: 77–137. doi:10.1146/annurev.genet.34.1.77. PMID 11092823.
- ^ Lam KC, Mühlpfordt F, Vaquerizas JM, Raja SJ, Holz H, Luscombe NM, Manke T, Akhtar A (2012). "The NSL complex regulates housekeeping genes in Drosophila". PLOS Genetics. 8 (6): e1002736. doi:10.1371/journal.pgen.1002736. PMC 3375229. PMID 22723752.
- ^ a b Lam KC, Chung HR, Semplicio G, Iyer SS, Gaub A, Bhardwaj V, Holz H, Georgiev P, Akhtar A (February 2019). "The NSL complex-mediated nucleosome landscape is required to maintain transcription fidelity and suppression of transcription noise". Genes & Development. 33 (7–8): 452–465. doi:10.1101/gad.321489.118. PMC 6446542. PMID 30819819.
- ^ Carninci P, Sandelin A, Lenhard B, Katayama S, Shimokawa K, Ponjavic J, et al. (June 2006). "Genome-wide analysis of mammalian promoter architecture and evolution". Nature Genetics. 38 (6): 626–35. doi:10.1038/ng1789. PMID 16645617. S2CID 22205897.
- ^ Ni T, Corcoran DL, Rach EA, Song S, Spana EP, Gao Y, Ohler U, Zhu J (July 2010). "A paired-end sequencing strategy to map the complex landscape of transcription initiation". Nature Methods. 7 (7): 521–7. doi:10.1038/nmeth.1464. PMC 3197272. PMID 20495556.
- ^ Vannini A, Cramer P (February 2012). "Conservation between the RNA polymerase I, II, and III transcription initiation machineries". Molecular Cell. 45 (4): 439–46. doi:10.1016/j.molcel.2012.01.023. PMID 22365827.
- ^ "Entrez Gene: TBP TATA box binding protein".
- ^ McCulloch V, Hardin P, Peng W, Ruppert JM, Lobo-Ruppert SM (August 2000). "Alternatively spliced hBRF variants function at different RNA polymerase III promoters". EMBO J. 19 (15): 4134–43. doi:10.1093/emboj/19.15.4134. PMC 306597. PMID 10921893.
- ^ Wang Z, Roeder RG (July 1995). "Structure and function of a human transcription factor TFIIIB subunit that is evolutionarily conserved and contains both TFIIB- and high-mobility-group protein 2-related domains". Proc. Natl. Acad. Sci. U.S.A. 92 (15): 7026–30. Bibcode:1995PNAS...92.7026W. doi:10.1073/pnas.92.15.7026. PMC 41464. PMID 7624363.
- ^ a b c d Scully R, Anderson SF, Chao DM, Wei W, Ye L, Young RA, Livingston DM, Parvin JD (May 1997). "BRCA1 is a component of the RNA polymerase II holoenzyme". Proc. Natl. Acad. Sci. U.S.A. 94 (11): 5605–10. Bibcode:1997PNAS...94.5605S. doi:10.1073/pnas.94.11.5605. PMC 20825. PMID 9159119.
- ^ Chicca JJ, Auble DT, Pugh BF (March 1998). "Cloning and biochemical characterization of TAF-172, a human homolog of yeast Mot1". Mol. Cell. Biol. 18 (3): 1701–10. doi:10.1128/MCB.18.3.1701. PMC 108885. PMID 9488487.
- ^ Metz R, Bannister AJ, Sutherland JA, Hagemeier C, O'Rourke EC, Cook A, Bravo R, Kouzarides T (September 1994). "c-Fos-induced activation of a TATA-box-containing promoter involves direct contact with TATA-box-binding protein". Mol. Cell. Biol. 14 (9): 6021–9. doi:10.1128/MCB.14.9.6021. PMC 359128. PMID 8065335.
- ^ Franklin CC, McCulloch AV, Kraft AS (February 1995). "In vitro association between the Jun protein family and the general transcription factors, TBP and TFIIB". Biochem. J. 305 (3): 967–74. doi:10.1042/bj3050967. PMC 1136352. PMID 7848298.
- ^ Brendel C, Gelman L, Auwerx J (June 2002). "Multiprotein bridging factor-1 (MBF-1) is a cofactor for nuclear receptors that regulate lipid metabolism". Mol. Endocrinol. 16 (6): 1367–77. doi:10.1210/mend.16.6.0843. PMID 12040021.
- ^ Mariotti M, De Benedictis L, Avon E, Maier JA (August 2000). "Interaction between endothelial differentiation-related factor-1 and calmodulin in vitro and in vivo". J. Biol. Chem. 275 (31): 24047–51. doi:10.1074/jbc.M001928200. PMID 10816571.
- ^ Kabe Y, Goto M, Shima D, Imai T, Wada T, Morohashi Ki, Shirakawa M, Hirose S, Handa H (November 1999). "The role of human MBF1 as a transcriptional coactivator". J. Biol. Chem. 274 (48): 34196–202. doi:10.1074/jbc.274.48.34196. PMID 10567391.
- ^ a b Tang H, Sun X, Reinberg D, Ebright RH (February 1996). "Protein–protein interactions in eukaryotic transcription initiation: structure of the preinitiation complex". Proc. Natl. Acad. Sci. U.S.A. 93 (3): 1119–24. Bibcode:1996PNAS...93.1119T. doi:10.1073/pnas.93.3.1119. PMC 40041. PMID 8577725.
{{cite journal}}: CS1 maint: 작성자 파라미터 사용(링크) - ^ Bushnell DA, Westover KD, Davis RE, Kornberg RD (February 2004). "Structural basis of transcription: an RNA polymerase II-TFIIB cocrystal at 4.5 Angstroms". Science. 303 (5660): 983–8. Bibcode:2004Sci...303..983B. doi:10.1126/science.1090838. PMID 14963322. S2CID 36598301.
- ^ DeJong J, Bernstein R, Roeder RG (April 1995). "Human general transcription factor TFIIA: characterization of a cDNA encoding the small subunit and requirement for basal and activated transcription". Proc. Natl. Acad. Sci. U.S.A. 92 (8): 3313–7. Bibcode:1995PNAS...92.3313D. doi:10.1073/pnas.92.8.3313. PMC 42156. PMID 7724559.
- ^ Ozer J, Mitsouras K, Zerby D, Carey M, Lieberman PM (June 1998). "Transcription factor IIA derepresses TATA-binding protein (TBP)-associated factor inhibition of TBP-DNA binding". J. Biol. Chem. 273 (23): 14293–300. doi:10.1074/jbc.273.23.14293. PMID 9603936.
- ^ Sun X, Ma D, Sheldon M, Yeung K, Reinberg D (October 1994). "Reconstitution of human TFIIA activity from recombinant polypeptides: a role in TFIID-mediated transcription". Genes Dev. 8 (19): 2336–48. doi:10.1101/gad.8.19.2336. PMID 7958900.
- ^ Ruppert S, Tjian R (November 1995). "Human TAFII250 interacts with RAP74: implications for RNA polymerase II initiation". Genes Dev. 9 (22): 2747–55. doi:10.1101/gad.9.22.2747. PMID 7590250.
- ^ Malik S, Guermah M, Roeder RG (March 1998). "A dynamic model for PC4 coactivator function in RNA polymerase II transcription". Proc. Natl. Acad. Sci. U.S.A. 95 (5): 2192–7. Bibcode:1998PNAS...95.2192M. doi:10.1073/pnas.95.5.2192. PMC 19292. PMID 9482861.
- ^ Thut CJ, Goodrich JA, Tjian R (August 1997). "Repression of p53-mediated transcription by MDM2: a dual mechanism". Genes Dev. 11 (15): 1974–86. doi:10.1101/gad.11.15.1974. PMC 316412. PMID 9271120.
- ^ Léveillard T, Wasylyk B (December 1997). "The MDM2 C-terminal region binds to TAFII250 and is required for MDM2 regulation of the cyclin A promoter". J. Biol. Chem. 272 (49): 30651–61. doi:10.1074/jbc.272.49.30651. PMID 9388200.
- ^ Shetty S, Takahashi T, Matsui H, Ayengar R, Raghow R (May 1999). "Transcriptional autorepression of Msx1 gene is mediated by interactions of Msx1 protein with a multi-protein transcriptional complex containing TATA-binding protein, Sp1 and cAMP-response-element-binding protein-binding protein (CBP/p300)". Biochem. J. 339 (3): 751–8. doi:10.1042/0264-6021:3390751. PMC 1220213. PMID 10215616.
- ^ Zhang H, Hu G, Wang H, Sciavolino P, Iler N, Shen MM, Abate-Shen C (May 1997). "Heterodimerization of Msx and Dlx homeoproteins results in functional antagonism". Mol. Cell. Biol. 17 (5): 2920–32. doi:10.1128/mcb.17.5.2920. PMC 232144. PMID 9111364.
- ^ Zhang H, Catron KM, Abate-Shen C (March 1996). "A role for the Msx-1 homeodomain in transcriptional regulation: residues in the N-terminal arm mediate TATA binding protein interaction and transcriptional repression". Proc. Natl. Acad. Sci. U.S.A. 93 (5): 1764–9. Bibcode:1996PNAS...93.1764Z. doi:10.1073/pnas.93.5.1764. PMC 39855. PMID 8700832.
- ^ a b c d e f g h Bellorini M, Lee DK, Dantonel JC, Zemzoumi K, Roeder RG, Tora L, Mantovani R (June 1997). "CCAAT binding NF-Y-TBP interactions: NF-YB and NF-YC require short domains adjacent to their histone fold motifs for association with TBP basic residues". Nucleic Acids Res. 25 (11): 2174–81. doi:10.1093/nar/25.11.2174. PMC 146709. PMID 9153318.
- ^ Seto E, Usheva A, Zambetti GP, Momand J, Horikoshi N, Weinmann R, Levine AJ, Shenk T (December 1992). "Wild-type p53 binds to the TATA-binding protein and represses transcription". Proc. Natl. Acad. Sci. U.S.A. 89 (24): 12028–32. Bibcode:1992PNAS...8912028S. doi:10.1073/pnas.89.24.12028. PMC 50691. PMID 1465435.
- ^ a b Cvekl A, Kashanchi F, Brady JN, Piatigorsky J (June 1999). "Pax-6 interactions with TATA-box-binding protein and retinoblastoma protein". Invest. Ophthalmol. Vis. Sci. 40 (7): 1343–50. PMID 10359315.
- ^ Zwilling S, Annweiler A, Wirth T (May 1994). "The POU domains of the Oct1 and Oct2 transcription factors mediate specific interaction with TBP". Nucleic Acids Res. 22 (9): 1655–62. doi:10.1093/nar/22.9.1655. PMC 308045. PMID 8202368.
- ^ Guermah M, Malik S, Roeder RG (June 1998). "Involvement of TFIID and USA components in transcriptional activation of the human immunodeficiency virus promoter by NF-kappaB and Sp1". Mol. Cell. Biol. 18 (6): 3234–44. doi:10.1128/mcb.18.6.3234. PMC 108905. PMID 9584164.
- ^ Schmitz ML, Stelzer G, Altmann H, Meisterernst M, Baeuerle PA (March 1995). "Interaction of the COOH-terminal transactivation domain of p65 NF-kappa B with TATA-binding protein, transcription factor IIB, and coactivators". J. Biol. Chem. 270 (13): 7219–26. doi:10.1074/jbc.270.13.7219. PMID 7706261.
- ^ Schulman IG, Chakravarti D, Juguilon H, Romo A, Evans RM (August 1995). "Interactions between the retinoid X receptor and a conserved region of the TATA-binding protein mediate hormone-dependent transactivation". Proc. Natl. Acad. Sci. U.S.A. 92 (18): 8288–92. Bibcode:1995PNAS...92.8288S. doi:10.1073/pnas.92.18.8288. PMC 41142. PMID 7667283.
- ^ Siegert JL, Robbins PD (January 1999). "Rb inhibits the intrinsic kinase activity of TATA-binding protein-associated factor TAFII250". Mol. Cell. Biol. 19 (1): 846–54. doi:10.1128/MCB.19.1.846. PMC 83941. PMID 9858607.
- ^ a b c d Ruppert S, Wang EH, Tjian R (March 1993). "Cloning and expression of human TAFII250: a TBP-associated factor implicated in cell-cycle regulation". Nature. 362 (6416): 175–9. Bibcode:1993Natur.362..175R. doi:10.1038/362175a0. PMID 7680771. S2CID 4364676.
- ^ O'Brien T, Tjian R (May 1998). "Functional analysis of the human TAFII250 N-terminal kinase domain". Mol. Cell. 1 (6): 905–11. doi:10.1016/S1097-2765(00)80089-1. PMID 9660973.
- ^ a b c Pointud JC, Mengus G, Brancorsini S, Monaco L, Parvinen M, Sassone-Corsi P, Davidson I (May 2003). "The intracellular localisation of TAF7L, a paralogue of transcription factor TFIID subunit TAF7, is developmentally regulated during male germ-cell differentiation". J. Cell Sci. 116 (Pt 9): 1847–58. doi:10.1242/jcs.00391. PMID 12665565.
- ^ Tao Y, Guermah M, Martinez E, Oelgeschläger T, Hasegawa S, Takada R, Yamamoto T, Horikoshi M, Roeder RG (March 1997). "Specific interactions and potential functions of human TAFII100". J. Biol. Chem. 272 (10): 6714–21. doi:10.1074/jbc.272.10.6714. PMID 9045704.
- ^ Martinez E, Palhan VB, Tjernberg A, Lymar ES, Gamper AM, Kundu TK, Chait BT, Roeder RG (October 2001). "Human STAGA complex is a chromatin-acetylating transcription coactivator that interacts with pre-mRNA splicing and DNA damage-binding factors in vivo". Mol. Cell. Biol. 21 (20): 6782–95. doi:10.1128/MCB.21.20.6782-6795.2001. PMC 99856. PMID 11564863.
- ^ a b Mengus G, May M, Jacq X, Staub A, Tora L, Chambon P, Davidson I (April 1995). "Cloning and characterization of hTAFII18, hTAFII20 and hTAFII28: three subunits of the human transcription factor TFIID". EMBO J. 14 (7): 1520–31. doi:10.1002/j.1460-2075.1995.tb07138.x. PMC 398239. PMID 7729427.
- ^ May M, Mengus G, Lavigne AC, Chambon P, Davidson I (June 1996). "Human TAF(II28) promotes transcriptional stimulation by activation function 2 of the retinoid X receptors". EMBO J. 15 (12): 3093–104. doi:10.1002/j.1460-2075.1996.tb00672.x. PMC 450252. PMID 8670810.
- ^ Hoffmann A, Roeder RG (July 1996). "Cloning and characterization of human TAF20/15. Multiple interactions suggest a central role in TFIID complex formation". J. Biol. Chem. 271 (30): 18194–202. doi:10.1074/jbc.271.30.18194. PMID 8663456.
- ^ Hochheimer A, Tjian R (June 2003). "Diversified transcription initiation complexes expand promoter selectivity and tissue-specific gene expression". Genes & Development. 17 (11): 1309–20. doi:10.1101/gad.1099903. PMID 12782648.
- ^ Pugh BF (September 2000). "Control of gene expression through regulation of the TATA-binding protein". Gene. 255 (1): 1–14. doi:10.1016/s0378-1119(00)00288-2. PMID 10974559.
- ^ Weaver, Robert Franklin (1 January 2012). Molecular biology. McGraw-Hill. ISBN 9780073525327. OCLC 789601172.
- ^ Louder RK, He Y, López-Blanco JR, Fang J, Chacón P, Nogales E (March 2016). "Structure of promoter-bound TFIID and model of human pre-initiation complex assembly". Nature. 531 (7596): 604–9. Bibcode:2016Natur.531..604L. doi:10.1038/nature17394. PMC 4856295. PMID 27007846.
- ^ Davidson I (July 2003). "The genetics of TBP and TBP-related factors". Trends in Biochemical Sciences. 28 (7): 391–8. doi:10.1016/S0968-0004(03)00117-8. PMID 12878007.
- ^ Nikolov DB, Hu SH, Lin J, Gasch A, Hoffmann A, Horikoshi M, Chua NH, Roeder RG, Burley SK (November 1992). "Crystal structure of TFIID TATA-box binding protein". Nature. 360 (6399): 40–6. Bibcode:1992Natur.360...40N. doi:10.1038/360040a0. PMID 1436073. S2CID 4307043.
외부 링크
- 스피노세레벨라 아탁시아 타입 17의 GeneReviews/NCBI/NIH/UW 엔트리
- 인터랙티브 TBP 구조(massey.ac.nz)
- 이달의 타타결합단백질 PDB 분자
- TATA-Box+Binding+단백질 미국 국립의학도서관의 의학 제목(MeSH)
- 팩터북 TBP
- PDBe-KB의 UniProt: P20226(Human TATA-box-binding protain)에 대한 PDB의 모든 구조 정보 개요.