RNA중합효소
RNA polymerase| DNA지향성 RNA중합효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
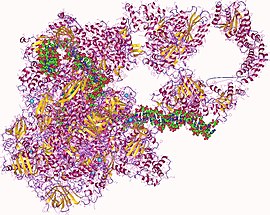 RNA 중합효소 헤테로27머, 사람 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 2.7.7.6 | ||||||||
| CAS 번호 | 9014-24-8 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||
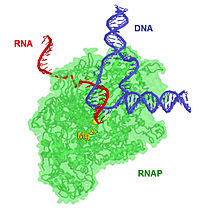
분자생물학에서 RNA 중합효소(RNAP 또는 RNApol)는 DNA 템플릿에서 RNA를 합성하는 효소이다.
효소 헬리카제를 사용하여, RNAP는 국소적으로 이중 가닥 DNA를 개방하여 노출된 뉴클레오티드의 한 가닥이 전사라고 불리는 과정인 RNA 합성을 위한 템플릿으로 사용될 수 있도록 합니다.RNAP가 DNA 풀림을 시작하기 전에 전사인자와 관련된 전사 매개체 복합체가 프로모터 영역이라고 불리는 DNA 결합 부위에 부착되어야 한다.RNA전사를 시작할 뿐만 아니라, 뉴클레오티드를 제 위치로 유도하고, 부착과 신장을 촉진하며, 내재 교정 및 치환 능력, 종단 인식 능력을 가지고 있습니다.진핵생물에서, RNAP는 240만 개의 뉴클레오티드까지 사슬을 형성할 수 있습니다.
RNAP는 기능적으로 단백질 코딩을 위한 RNA, 즉 메신저 RNA(mRNA) 또는 비코딩을 위한 RNA(이른바 "RNA 유전자")를 생산한다.적어도 네 가지 유형의 RNA 유전자가 존재한다.
- 전사 RNA(tRNA)
- 번역 중 단백질 합성의 리보솜 부위에서 성장하는 폴리펩타이드 사슬에 특정 아미노산을 전달한다.
- 리보솜 RNA(rRNA)
- 리보솜에 통합;
- 마이크로 RNA(miRNA)
- 유전자 활성을 조절하는 RNA 사일링
- 촉매 RNA(리보자임)
- 효소 활성 RNA 분자로 기능합니다.
RNA 중합효소는 생명에 필수적이며, 모든 생물과 많은 바이러스에서 발견됩니다.생체에 따라 RNA 중합효소는 단백질 복합체(다중 서브유닛 RNAP)일 수도 있고 각각 독립된 계보를 나타내는 하나의 서브유닛(단일 서브유닛 RNAP, ssRNAP)으로만 구성될 수도 있다.전자는 박테리아, 고세균, 그리고 진핵생물에서 발견되며, 비슷한 핵심 구조와 [1]메커니즘을 공유합니다.후자는 진핵 엽록체 및 미토콘드리아뿐만 아니라 파지에서 발견되며, 현대의 DNA [2]중합효소들과 관련이 있다.진핵생물 및 고고생물 RNAP는 박테리아 단위보다 더 많은 소단위를 가지고 있으며, 다르게 제어된다.
박테리아와 고세균은 하나의 RNA 중합효소만을 가지고 있다.진핵생물에는 여러 유형의 핵 RNA가 있으며, 각각은 RNA의 개별 서브셋의 합성을 담당한다.
구조.
2006년 노벨 화학상은 로저 D에게 수여되었다. 전사 [3][4]과정의 다양한 단계에서 RNA 중합효소의 상세한 분자 이미지를 생성하는 Kornberg.
대부분의 원핵생물에서, 단일 RNA 중합효소 종은 대장균으로부터 모든 종류의 RNA를 전사한다. RNA 중합효소 "핵심"은 5개의 소단위, 즉 36 kDa의 2개의 알파(α) 소단위, 150 kDa의 베타(ββ) 소단위, 155 kDa의 베타(βθ) 소단위, 그리고 작은 오메가(δ) 소단위이다.시그마(δ) 인자가 코어에 결합하여 홀로엔자임(holoenzyme)을 형성합니다.전사가 시작된 후, 인자는 결합을 풀고 핵심 효소가 작업을 [5][6]진행하도록 할 수 있습니다.핵심 RNA 중합효소 복합체는 전체 길이를 따라 [7]흐르는 내부 채널과 함께 "손톱" 또는 "손톱" 구조를 형성합니다.진핵생물 및 고생 RNA 중합효소는 많은 여분의 [8]소단위들을 가지고 있지만 비슷한 방식으로 작용합니다.
모든 RNAP에는 금속 보조인자, 특히 전사 과정에 [9][10]도움이 되는 아연과 마그네슘 양이온이 포함되어 있습니다.
기능.
유전자 전사 과정의 제어는 유전자 발현 패턴에 영향을 미쳐 세포가 변화하는 환경에 적응하고 유기체 내에서 특수한 역할을 수행하며 생존에 필요한 기초대사 과정을 유지할 수 있도록 한다.따라서 RNAP의 활동이 길고 복잡하며 고도로 규제되는 것은 놀랄 일이 아니다.대장균에서는 RNAP의 [11]활성을 변화시키는 100개 이상의 전사 인자가 확인되었다.
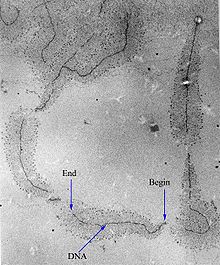
RNAP는 프로모터로 알려진 특정 DNA 배열에서 전사를 시작할 수 있습니다.그런 다음 템플릿 DNA 가닥을 보완하는 RNA 사슬을 생성한다.RNA 가닥에 뉴클레오티드를 추가하는 과정은 신장이라고 알려져 있다; 진핵생물에서, RNAP는 240만 개의 뉴클레오티드를 만들 수 있다.RNAP는 유전자 말단에서 코드된 특정 DNA 배열에서 RNA 전사를 우선적으로 방출하는데, 이는 터미네이터로 알려져 있다.
RNAP 제품에는 다음이 포함됩니다.
- 메신저 RNA(mRNA): 리보솜에 의한 단백질 합성을 위한 템플릿.
- 비코드 RNA 또는 "RNA 유전자" - 단백질로 변환되지 않은 RNA를 코드하는 광범위한 유전자.RNA 유전자의 가장 두드러진 예로는 전이 RNA와 리보솜 RNA가 있는데, 이 두 가지 모두 번역 과정에 관여한다.그러나 1990년대 후반부터 많은 새로운 RNA 유전자가 발견되었고, 따라서 RNA 유전자는 이전에 생각했던 것보다 훨씬 더 중요한 역할을 할 수 있다.
RNAP는 신규 합성을 실현한다.이것은 개시 뉴클레오티드와의 특정 상호작용이 RNAP를 단단하게 고정시켜 들어오는 뉴클레오티드에 대한 화학적 공격을 용이하게 하기 때문에 이것을 할 수 있다.그러한 특정한 상호작용은 왜 RNAP가 ATP로 전사를 시작하는 것을 선호하는지 설명한다(GTP, UTP, 그리고 CTP에 이어).DNA 중합효소와는 달리, RNAP는 헬리케이스 활성을 포함하므로 DNA를 풀 때 별도의 효소가 필요하지 않다.
액션.
개시
박테리아 중의 RNA 중합효소 결합은 (전사되는 배열의 시작 전에 위치하는) -35 및 -10 요소를 포함하는 코어 프로모터 영역을 인식하는 시그마 인자와 일부 프로모터에서는 프로모터 상류 [12]요소를 인식하는 α 서브유닛 C 말단 도메인을 포함한다.교환 가능한 시그마 계수는 여러 가지가 있으며, 각각 다른 프로모터를 인식합니다.예를 들어 대장균에서 γ는70 정상상태에서 발현되며 정상상태에서 요구되는 유전자('하우스키핑 유전자')의 프로모터를 인식하고 γ는32 고온에서 요구되는 유전자('열충격 유전자')의 프로모터를 인식한다.고세균과 진핵생물에서 세균의 일반전사인자 시그마의 기능은 함께 작용하는 복수의 일반전사인자에 의해 이루어진다.RNA 중합효소-프로모터 폐쇄 복합체는 보통 "전사 사전 개시 복합체"[13][14]라고 불립니다.
RNA 중합효소는 DNA에 결합된 후 폐쇄성 복합체에서 개방성 복합체로 전환된다.이러한 변화는 DNA 가닥의 분리를 수반하여 약 13bp의 DNA의 풀린 부분을 형성하며, 이를 "전사 거품"이라고 한다.슈퍼코일은 DNA의 풀림과 되감기 때문에 중합효소 활성에서 중요한 역할을 한다.RNAP의 앞쪽에 있는 DNA의 영역이 풀리기 때문에, 보상적인 양의 슈퍼코일이 있습니다.RNAP의 배후에 있는 영역이 되감겨져 음의 슈퍼코일이 존재합니다.[14]
프로모터 이스케이프
RNA 중합효소는 초기 DNA-RNA 헤테로듀플렉스를 합성하기 시작하고, 리보뉴클레오티드는 왓슨-크릭 염기쌍의 상호작용에 따라 템플릿 DNA 가닥에 염기쌍이 된다.위와 같이 RNA 중합효소는 프로모터 영역에 접촉한다.그러나 이러한 안정화 접촉은 효소가 DNA에 더 접근하여 전장 생성물의 합성을 억제한다.RNA 합성을 계속하기 위해서는 RNA 중합효소가 프로모터를 벗어나야 합니다.그것은 합성을 위해 더 많은 하류 DNA를 풀면서 프로모터 접촉을 유지해야 하며, 더 많은 [15]하류 DNA를 시작 복합체로 " 긁어모으기" 한다.프로모터 탈출 전환 중에 RNA 중합효소는 "스트레스 중간체"로 간주됩니다.열역학적으로 응력은 DNA 분해 및 DNA 압축 활동에서 축적된다.일단 DNA-RNA 헤테로듀플렉스가 충분히 길면(~10bp), RNA 중합효소는 상류 접점을 방출하고 효과적으로 프로모터 탈출을 신장 단계로 이행합니다.활성 중심에 있는 헤테로듀플렉스는 신장 복합체를 안정화시킵니다.
그러나 프로모터 탈출만이 유일한 결과는 아니다.RNA 중합효소는 또한 하류 접촉을 방출하여 전사를 방해함으로써 스트레스를 완화시킬 수 있습니다.일시 중지된 전사 복합체는 두 가지 옵션이 있습니다. (1) 초기 전사물을 방출하고 프로모터에서 다시 시작하거나 (2) RNA 중합효소의 촉매 활성과 프로모터 탈출을 위해 다시 DNA 스크런치를 통해 활성 부위의 초기 전사물에 새로운 3µ-OH를 재설정합니다.프로모터가 전이를 벗어나기 전에 RNA 중합효소의 비생산적 순환인 중단 개시는 중단 전사로 알려진 과정에서 약 9bp의 짧은 RNA 단편을 발생시킨다.중단 개시 정도는 전사 인자의 존재와 프로모터 접촉 [16]강도에 따라 달라집니다.
신장
17-bp 전사 복합체는 8-bp DNA-RNA 하이브리드를 가지고 있다. 즉, 8개의 염기쌍은 DNA 템플릿 [17]가닥에 결합된 RNA 전사체를 포함한다.전사가 진행됨에 따라 리보뉴클레오티드가 RNA 전사의 3' 말단에 첨가되고 RNA 복합체는 DNA를 따라 이동한다.원핵생물과 진핵생물의 특징적인 신장률은 약 10–100 nts/[18]초이다.
RNAP의 아스파틸(asp) 잔류물은 리보뉴클레오티드의 인산염을 조정하는 Mg 이온을 유지합니다2+.첫 번째2+ Mg는 첨가되는 NTP의 α-인산을 유지합니다.이를 통해 RNA 전사체로부터 3µ-OH를 친핵적으로 공격하여 사슬에 또 다른 NTP를 추가할 수 있다.두 번째2+ Mg는 [19]NTP의 피로인산을 유지합니다.전체 반응 방정식은 다음과 같습니다.
- (NMP)n + NTP → (NMP)n+1 + PPi
충실도
DNA 중합효소의 교정 메커니즘과는 달리 RNAP의 교정 메커니즘은 최근에야 연구되었다.교정은 DNA 템플릿에서 잘못 삽입된 뉴클레오티드를 분리하는 것으로 시작된다.이것에 의해, 전사가 일시정지됩니다.중합효소는 한 위치만 역추적하고 일치하지 않는 뉴클레오티드를 포함하는 디뉴클레오티드를 분해합니다.RNA 중합효소에서는 이는 중합에 사용되는 것과 동일한 활성 부위에서 발생하므로 별도의 핵산가수분해효소 활성 [20]부위에서 교정이 발생하는 DNA 중합효소와는 확연히 다르다.
전체적인 에러율은 약 10−4 ~[21]10−6 입니다.
종료
박테리아에서 RNA 전사의 종단은 rho 의존성 또는 rho 비의존성일 수 있다.전자는 DNA-RNA 헤테로듀플렉스를 불안정하게 하고 RNA [22]방출을 일으키는 rho 인자에 의존합니다.후자는 또한 내인종단으로 알려져 있으며, DNA의 회문 영역에 의존한다.영역을 전사하는 것은 RNA 전사로부터 "헤어핀" 구조의 형성을 초래하고 스스로 결합합니다.이 머리핀 구조는 종종 G-C 염기쌍이 풍부하여 DNA-RNA 하이브리드 자체보다 더 안정적입니다.그 결과 전사복합체 내의 8bp DNA-RNA 하이브리드는 4bp 하이브리드로 이행한다.마지막 4개의 염기쌍은 약한 A-U 염기쌍이며, 전체 RNA 전사체는 DNA에서 떨어집니다.
진핵생물에서의 전사 종료는 박테리아에서보다 잘 이해되지 않지만,[23] 폴리아데닐화라고 불리는 과정에서 새로운 3µ 말단에서 템플릿에 의존하지 않는 아데닌의 첨가를 수반한다.
기타 생물
DNA와 RNA 중합효소 모두 템플릿 의존성 뉴클레오티드 중합이 이루어진다는 점에서 두 가지 유형의 효소는 구조적으로 관련이 있을 것으로 예상할 수 있다.그러나 두 가지 유형의 효소에 대한 X선 결정학적 연구는 촉매 부위에서2+ 임계 Mg 이온을 포함하는 것 외에, 그것들은 사실상 서로 관련이 없다는 것을 보여준다. 실제로 템플릿 의존성 뉴클레오티드 중합 효소는 세포의 초기 진화 과정에서 독립적으로 두 번 발생한 것으로 보인다.한 계통은 현대의 DNA 중합효소 및 역전사효소뿐만 아니라 화지와 기관으로부터 [2]얻은 몇 개의 단일 서브유닛 RNA 중합효소(ssRNAP)로 이어졌다.또 다른 다중 서브유닛 RNAP 계통은 현대의 모든 세포 RNA 중합효소를 [24][1]형성했다.
박테리아
박테리아에서는 동일한 효소가 mRNA와 비부호화 RNA(ncRNA)의 합성을 촉매한다.
RNAP는 큰 분자입니다.핵심 효소는 5개의 소단위(~400kDa)[25]를 가지고 있다.
- β의
- βγ 서브유닛은 가장 큰 서브유닛이며, rpoC [26]유전자에 의해 암호화된다.β' 서브유닛은 RNA 합성을 담당하는 활성 중심부의 일부를 포함하며 DNA 및 초기 RNA와의 비배열 특이적 상호작용에 대한 결정 인자의 일부를 포함합니다.그것은 시아노박테리아와 엽록체에서 [27]두 개의 소단위로 나뉜다.
- β
- β 서브유닛은 두 번째로 큰 서브유닛이며, rpoB 유전자에 의해 암호화된다.β 서브유닛은 RNA 합성을 담당하는 나머지 활성 중심을 포함하고 DNA 및 초기 RNA와의 비배열 특이적 상호작용에 대한 나머지 결정 인자를 포함한다.
- α(αI 및II α)
- 세 번째로 큰 서브유닛인 α 서브유닛의 두 복사본이 RNAP 분자II 안에 존재한다(1과I α(1과 2).각 α 서브유닛은 αNTD(N말단 도메인)와 αCTD(C말단 도메인)의 2개의 도메인을 포함한다.αNTD는 RNAP 조립을 위한 결정인자를 포함한다.αCTD(C 말단 도메인)는 프로모터 DNA와의 상호작용을 위한 결정인자를 포함하고, 대부분의 프로모터에서 비순서 비특이적 상호작용을 하고, 상류 요소 포함 촉진인자에서의 배열 특이적 상호작용을 하며, 규제인자와의 상호작용에 대한 결정인자를 포함한다.
- ω
- γ 서브유닛은 가장 작은 서브유닛이다.sub 서브유닛은 RNAP 조립을 용이하게 하고 조립된 RNAP을 [28]안정시킵니다.
프로모터를 결합하기 위해 RNANAP 코어는 전사 개시 인자 시그마(θ)와 관련지어 RNA 중합효소 홀로엔자임을 형성한다.Sigma는 비특이적 DNA에 대한 RNAP의 친화성을 감소시키는 동시에 프로모터의 특이성을 증가시켜 정확한 부위에서 전사를 시작할 수 있게 한다.따라서 전체 홀로엔자임은 ββα와I ααII(~450kDa)의 6개의 서브유닛을 가진다.
진핵생물
진핵생물에는 각각 RNA의 개별 서브셋의 합성을 담당하는 여러 유형의 핵 RNA가 있습니다. 이 모든 것들은 구조적으로나 기계적으로 서로 관련이 있고 세균 RNAP와 관련이 있습니다.
- RNA 중합효소 I은 리보솜의 [29]주요 RNA 단면을 형성하는 28S, 18S 및 5.8S의 rRNA로 성숙하는 사전 rNA 45S(효모의 경우 35S)를 합성합니다.
- RNA 중합효소 II는 mRNA와 대부분의 snRNA [30]및 마이크로RNA의 전구체를 합성한다.이것은 가장 많이 연구되고 있는 유형으로, 전사에 대한 높은 제어가 필요하기 때문에 프로모터와의 결합에는 다양한 전사인자가 필요합니다.
- RNA 중합효소 III는 tRNA, rRNA 5S 및 핵 및 [31]세포졸에서 발견되는 다른 작은 RNA를 합성한다.
- RNA 중합효소 IV는 [32]식물에서 siRNA를 합성한다.
- RNA 중합효소 V는 식물에서 [33]siRNA 지향 헤테로크로마틴 형성에 관여하는 RNA를 합성한다.
진핵 엽록체는 박테리아 RNAP와 매우 유사한 RNAP를 포함하고 있다.그들은 핵 [34]게놈에 부호화된 시그마 인자를 사용한다.
또한 엽록체는 구조적으로나 기계적으로 무관한 두 번째 단일 서브 유닛 RNAP(Nucleus-encoded 중합효소, NEP)를 포함한다.진핵생물 미토콘드리아는 핵으로 인코딩된 단일 서브 유닛 [2]RNAP인 POLRMT(인간)를 사용한다.이러한 파지와 같은 중합효소는 [34]식물에서 RpoT라고 불립니다.
고세균
고세균은 모든 RNA의 합성을 담당하는 단일 유형의 RNA를 가지고 있다.고고 RNAP는 구조적으로나 기계적으로 박테리아 RNAP 및 진핵핵 RNAP I-V와 유사하며, 특히 구조적으로나 기계적으로 진핵핵 RNAP [8][35]II와 밀접한 관련이 있다.고대 RNA 중합효소의 발견은 매우 최근의 일이다.1971년 고세균의 RNAP에 대한 첫 번째 분석이 수행되었는데, 이때 극친열성 할로박테륨 큐티루브럼의 RNAP가 분리되고 [36]정제되었다.Sulfolobus solfataricus와 Sulfolobus shibatae의 RNAP 결정 구조는 확인된 총 고고학적 서브유닛 수를 [8][37]13개로 설정했다.
고세균은 진핵생물 Rpb1에 대응하는 서브유닛을 2개로 분할한다.유사성에 기초한 TFS(TFIIS 호몰로그)가 제안되었지만, S. 시바테 복합체에는 진핵생물 Rpb9(POLR2I)에 대한 호몰로그가 없다.Rpo13이라는 추가 서브유닛이 있으며, Rpo5와 함께 박테리아 βγ 서브유닛(Taq에서는 [8]1,377–1,420)에서 발견된 삽입으로 채워진 공간을 차지한다.S. solfataricus 구조에 대한 이전의 저해상도 연구에서는 Rpo13을 찾지 못하고 Rpo5/Rpb5에만 공간을 할당했습니다.Rpo3는 철-황 단백질이라는 점에서 주목할 만하다.일부 진핵생물에서 발견되는 RNAP I/III 서브유닛 AC40은 유사한 [37]배열을 공유하지만 [38]철과 결합하지 않는다.어느 경우든 이 도메인은 구조적인 [39]기능을 수행합니다.
고대 RNAP 서브유닛은 이전에 [1]각 서브유닛에 다른 시스템과 무관한 방식으로 문자가 할당되는 "RpoX" 명명법을 사용했다.2009년에는 진핵생물 Pol II 서브유닛 "Rpb" 번호 부여에 기초한 새로운 명명법이 [8]제안되었다.
바이러스
오르토폭스바이러스와 다른 핵세포질 대형 DNA 바이러스는 바이러스 코드화된 다중 서브유닛 RNAP를 사용하여 RNA를 합성한다.그것들은 진핵생물 RNAP와 가장 유사하며, 일부 소단위들은 최소화되거나 [40]제거된다.그들이 정확히 어떤 RNAP과 가장 유사한지는 [41]논쟁의 주제이다.RNA를 합성하는 대부분의 다른 바이러스들은 관련이 없는 메커니즘을 사용한다.
많은 바이러스는 진핵 엽록체(RpoT)와 미토콘드리아(POLRMT)의 단일 서브 유닛 RNAP와 구조적으로 그리고 더 멀리서는 DNA 중합효소 및 역전사 효소와 관련된 단일 서브 유닛 DNA 의존 RNAP(ssRNAP)를 사용한다.아마도 이러한 단일 서브유닛 RNAP은 박테리오파지 T7 RNA 중합효소일 것이다. ssRNAP은 [2]교정할 수 없다.
B. subtilis prophage SPβ는 일반적인 "오른쪽" ssRNAP과 구별되는 단량체(같은 사슬의 양쪽 배럴) RNAP를 형성하기 위해 msRNAPs의 β+β′ 서브유닛의 상동체인 YonO를 사용한다.아마도 표준 5단위 msRNAP에서 아주 오래 전에 분리되었을 것입니다. 마지막 공통 [42][43]조상의 시대 이전입니다.
다른 바이러스들은 RNA의존성 RNAP(DNA 대신 RNA를 템플릿으로 사용하는 RNAP)를 사용한다.이는 음성 가닥 RNA 바이러스와 dsRNA 바이러스에서 발생하며, 둘 다 이중 가닥 RNA로 수명 주기의 일부 동안 존재합니다.그러나 폴리오바이러스와 같은 일부 양성 가닥 RNA 바이러스에는 RNA [44]의존성 RNANAP도 포함되어 있습니다.
역사
RNAP은 1960년 [45]찰스 로, 오드리 스티븐스, 제라드 후르비츠에 의해 독립적으로 발견되었다.이때까지, 1959년 노벨 의학상 중 절반은 RNAP로 [46]믿어지는 것을 발견한 세베로 오초아에게 수여되었지만, 대신 폴리뉴클레오티드 포스포릴라아제로 밝혀졌다.
정화
RNA 중합효소는 다음과 같은 방법으로 분리될 수 있습니다.
또, 상기의 기술의 조합도 있습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d 베르너 F, Grohmann D(2011년 2월)."multisubunit RNApolymerases는 그 기초의 삶의 세 영역에서 진화하는".자연 Reviews는.미생물학. 9(2):85–98. doi:10.1038/nrmicro2507.PMID 21233849.30004345S2CID.참고 항목 크래머의 2002:CramerP(2002년 2월)."Multisubunit RNApolymerases".구조 생물학에 현재 여론. 12(1):89–97. doi:10.1016(02)00294-4.PMID 11839495.
- ^ a b c d Cermakian N, Ikeda TM, Miramontes P, Lang BF, Gray MW, Cedergren R (December 1997). "On the evolution of the single-subunit RNA polymerases". Journal of Molecular Evolution. 45 (6): 671–681. Bibcode:1997JMolE..45..671C. CiteSeerX 10.1.1.520.3555. doi:10.1007/PL00006271. PMID 9419244. S2CID 1624391.
- ^ 2006년 노벨 화학상
- ^ Stoddart, Charlotte (1 March 2022). "Structural biology: How proteins got their close-up". Knowable Magazine. doi:10.1146/knowable-022822-1. Retrieved 25 March 2022.
- ^ 그리피스 AJF, 밀러 JH, 스즈키 DT 등유전자 분석 입문제7판뉴욕: W. H. 프리먼, 2000년10장
- ^ Finn RD, Orlova EV, Gowen B, Buck M, van Heel M (December 2000). "Escherichia coli RNA polymerase core and holoenzyme structures". The EMBO Journal. 19 (24): 6833–6844. doi:10.1093/emboj/19.24.6833. PMC 305883. PMID 11118218.
- ^ Zhang G, Campbell EA, Minakhin L, Richter C, Severinov K, Darst SA (September 1999). "Crystal structure of Thermus aquaticus core RNA polymerase at 3.3 A resolution". Cell. 98 (6): 811–824. doi:10.1016/S0092-8674(00)81515-9. PMID 10499798.
- ^ a b c d e Korkhin Y, Unligil UM, Littlefield O, Nelson PJ, Stuart DI, Sigler PB, et al. (May 2009). "Evolution of complex RNA polymerases: the complete archaeal RNA polymerase structure". PLOS Biology. 7 (5): e1000102. doi:10.1371/journal.pbio.1000102. PMC 2675907. PMID 19419240.
- ^ Alberts B (2014-11-18). Molecular biology of the cell (Sixth ed.). New York, NY. ISBN 9780815344322. OCLC 887605755.
- ^ Markov D, Naryshkina T, Mustaev A, Severinov K (September 1999). "A zinc-binding site in the largest subunit of DNA-dependent RNA polymerase is involved in enzyme assembly". Genes & Development. 13 (18): 2439–2448. doi:10.1101/gad.13.18.2439. PMC 317019. PMID 10500100.
- ^ Ishihama A (2000). "Functional modulation of Escherichia coli RNA polymerase". Annual Review of Microbiology. 54: 499–518. doi:10.1146/annurev.micro.54.1.499. PMID 11018136.
- ^ InterPro: IPR011260
- ^ Roeder RG (November 1991). "The complexities of eukaryotic transcription initiation: regulation of preinitiation complex assembly". Trends in Biochemical Sciences. 16 (11): 402–408. doi:10.1016/0968-0004(91)90164-Q. PMID 1776168.
- ^ a b Watson JD, Baker TA, Bell SP, Gann AA, Levine M, Losick RM (2013). Molecular Biology of the Gene (7th ed.). Pearson.
- ^ Revyakin A, Liu C, Ebright RH, Strick TR (November 2006). "Abortive initiation and productive initiation by RNA polymerase involve DNA scrunching". Science. 314 (5802): 1139–1143. Bibcode:2006Sci...314.1139R. doi:10.1126/science.1131398. PMC 2754787. PMID 17110577.
- ^ Goldman SR, Ebright RH, Nickels BE (May 2009). "Direct detection of abortive RNA transcripts in vivo". Science. 324 (5929): 927–928. Bibcode:2009Sci...324..927G. doi:10.1126/science.1169237. PMC 2718712. PMID 19443781.
- ^ Kettenberger H, Armache KJ, Cramer P (December 2004). "Complete RNA polymerase II elongation complex structure and its interactions with NTP and TFIIS". Molecular Cell. 16 (6): 955–965. doi:10.1016/j.molcel.2004.11.040. PMID 15610738.
- ^ Milo R, Philips R. "Cell Biology by the Numbers: What is faster, transcription or translation?". book.bionumbers.org. Archived from the original on 20 April 2017. Retrieved 8 March 2017.
- ^ Svetlov V, Nudler E (January 2013). "Basic mechanism of transcription by RNA polymerase II". Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms. 1829 (1): 20–28. doi:10.1016/j.bbagrm.2012.08.009. PMC 3545073. PMID 22982365.
- ^ Sydow JF, Cramer P (December 2009). "RNA polymerase fidelity and transcriptional proofreading". Current Opinion in Structural Biology. 19 (6): 732–739. doi:10.1016/j.sbi.2009.10.009. hdl:11858/00-001M-0000-0015-837E-8. PMID 19914059.
- ^ Philips R, Milo R. "What is the error rate in transcription and translation?". Retrieved 26 March 2019.
- ^ Richardson JP (September 2002). "Rho-dependent termination and ATPases in transcript termination". Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression. 1577 (2): 251–260. doi:10.1016/S0167-4781(02)00456-6. PMID 12213656.
- ^ Lykke-Andersen S, Jensen TH (October 2007). "Overlapping pathways dictate termination of RNA polymerase II transcription". Biochimie. 89 (10): 1177–1182. doi:10.1016/j.biochi.2007.05.007. PMID 17629387.
- ^ Stiller JW, Duffield EC, Hall BD (September 1998). "Amitochondriate amoebae and the evolution of DNA-dependent RNA polymerase II". Proceedings of the National Academy of Sciences of the United States of America. 95 (20): 11769–11774. Bibcode:1998PNAS...9511769S. doi:10.1073/pnas.95.20.11769. PMC 21715. PMID 9751740.
- ^ Ebright RH (December 2000). "RNA polymerase: structural similarities between bacterial RNA polymerase and eukaryotic RNA polymerase II". Journal of Molecular Biology. 304 (5): 687–698. doi:10.1006/jmbi.2000.4309. PMID 11124018.
- ^ Monastyrskaya GS, Gubanov VV, Guryev SO, Salomatina IS, Shuvaeva TM, Lipkin VM, Sverdlov ED (July 1982). "The primary structure of E. coli RNA polymerase, Nucleotide sequence of the rpoC gene and amino acid sequence of the beta′-subunit". Nucleic Acids Research. 10 (13): 4035–4044. doi:10.1093/nar/10.13.4035. PMC 320776. PMID 6287430.
- ^ Bergsland KJ, Haselkorn R (June 1991). "Evolutionary relationships among eubacteria, cyanobacteria, and chloroplasts: Evidence from the rpoC1 gene of Anabaena sp. strain PCC 7120". Journal of Bacteriology. 173 (11): 3446–3455. doi:10.1128/jb.173.11.3446-3455.1991. PMC 207958. PMID 1904436.
- ^ Mathew R, Chatterji D (October 2006). "The evolving story of the omega subunit of bacterial RNA polymerase". Trends in Microbiology. 14 (10): 450–455. doi:10.1016/j.tim.2006.08.002. PMID 16908155.
- ^ Grummt I (1999). Regulation of mammalian ribosomal gene transcription by RNA polymerase I. Progress in Nucleic Acid Research and Molecular Biology. Vol. 62. pp. 109–54. doi:10.1016/S0079-6603(08)60506-1. ISBN 9780125400626. PMID 9932453.
- ^ Lee Y, Kim M, Han J, Yeom KH, Lee S, Baek SH, Kim VN (October 2004). "MicroRNA genes are transcribed by RNA polymerase II". The EMBO Journal. 23 (20): 4051–4060. doi:10.1038/sj.emboj.7600385. PMC 524334. PMID 15372072.
- ^ Willis I.M. (February 1993). "RNA polymerase III. Genes, factors and transcriptional specificity". Eur. J. Biochem. 212 (1): 1–11. doi:10.1111/j.1432-1033.1993.tb17626.x. PMID 8444147.
- ^ Herr AJ, Jensen MB, Dalmay T, Baulcombe DC (April 2005). "RNA polymerase IV directs silencing of endogenous DNA". Science. 308 (5718): 118–120. Bibcode:2005Sci...308..118H. doi:10.1126/science.1106910. PMID 15692015. S2CID 206507767.
- ^ Wierzbicki AT, Ream TS, Haag JR, Pikaard CS (May 2009). "RNA polymerase V transcription guides ARGONAUTE4 to chromatin". Nature Genetics. 41 (5): 630–634. doi:10.1038/ng.365. PMC 2674513. PMID 19377477.
- ^ a b Schweer J, Türkeri H, Kolpack A, Link G (December 2010). "Role and regulation of plastid sigma factors and their functional interactors during chloroplast transcription - recent lessons from Arabidopsis thaliana". European Journal of Cell Biology. 89 (12): 940–946. doi:10.1016/j.ejcb.2010.06.016. PMID 20701995.
- ^ Werner F (September 2007). "Structure and function of archaeal RNA polymerases". Molecular Microbiology. 65 (6): 1395–1404. doi:10.1111/j.1365-2958.2007.05876.x. PMID 17697097.
- ^ Louis BG, Fitt PS (February 1971). "Nucleic acid enzymology of extremely halophilic bacteria. Halobacterium cutirubrum deoxyribonucleic acid-dependent ribonucleic acid polymerase". The Biochemical Journal. 121 (4): 621–627. doi:10.1042/bj1210621. PMC 1176638. PMID 4940048.
- ^ a b Hirata A, Klein BJ, Murakami KS (February 2008). "The X-ray crystal structure of RNA polymerase from Archaea". Nature. 451 (7180): 851–854. Bibcode:2008Natur.451..851H. doi:10.1038/nature06530. PMC 2805805. PMID 18235446.
- ^ Fernández-Tornero C, Moreno-Morcillo M, Rashid UJ, Taylor NM, Ruiz FM, Gruene T, et al. (October 2013). "Crystal structure of the 14-subunit RNA polymerase I". Nature. 502 (7473): 644–649. Bibcode:2013Natur.502..644F. doi:10.1038/nature12636. PMID 24153184. S2CID 205235881.
- ^ Jennings ME, Lessner FH, Karr EA, Lessner DJ (February 2017). "The [4Fe-4S] clusters of Rpo3 are key determinants in the post Rpo3/Rpo11 heterodimer formation of RNA polymerase in Methanosarcina acetivorans". MicrobiologyOpen. 6 (1): e00399. doi:10.1002/mbo3.399. PMC 5300874. PMID 27557794.
- ^ Mirzakhanyan Y, Gershon PD (September 2017). "Multisubunit DNA-Dependent RNA Polymerases from Vaccinia Virus and Other Nucleocytoplasmic Large-DNA Viruses: Impressions from the Age of Structure". Microbiology and Molecular Biology Reviews. 81 (3). doi:10.1128/MMBR.00010-17. PMC 5584312. PMID 28701329.
- ^ Guglielmini J, Woo AC, Krupovic M, Forterre P, Gaia M (September 2019). "Diversification of giant and large eukaryotic dsDNA viruses predated the origin of modern eukaryotes". Proceedings of the National Academy of Sciences of the United States of America. 116 (39): 19585–19592. doi:10.1073/pnas.1912006116. PMC 6765235. PMID 31506349.
- ^ Forrest D, James K, Yuzenkova Y, Zenkin N (June 2017). "Single-peptide DNA-dependent RNA polymerase homologous to multi-subunit RNA polymerase". Nature Communications. 8: 15774. Bibcode:2017NatCo...815774F. doi:10.1038/ncomms15774. PMC 5467207. PMID 28585540.
- ^ Sauguet L (September 2019). "The Extended "Two-Barrel" Polymerases Superfamily: Structure, Function and Evolution". Journal of Molecular Biology. 431 (20): 4167–4183. doi:10.1016/j.jmb.2019.05.017. PMID 31103775.
- ^ Ahlquist P (May 2002). "RNA-dependent RNA polymerases, viruses, and RNA silencing". Science. 296 (5571): 1270–1273. Bibcode:2002Sci...296.1270A. doi:10.1126/science.1069132. PMID 12016304. S2CID 42526536.
- ^ Hurwitz J (December 2005). "The discovery of RNA polymerase". The Journal of Biological Chemistry. 280 (52): 42477–42485. doi:10.1074/jbc.X500006200. PMID 16230341.
- ^ 1959년 노벨상
- ^ Kelly JL, Lehman IR (August 1986). "Yeast mitochondrial RNA polymerase. Purification and properties of the catalytic subunit". The Journal of Biological Chemistry. 261 (22): 10340–10347. doi:10.1016/S0021-9258(18)67529-5. PMID 3525543.
- ^ Honda A, Mukaigawa J, Yokoiyama A, Kato A, Ueda S, Nagata K, et al. (April 1990). "Purification and molecular structure of RNA polymerase from influenza virus A/PR8". Journal of Biochemistry. 107 (4): 624–628. doi:10.1093/oxfordjournals.jbchem.a123097. PMID 2358436.
- ^ Hager DA, Jin DJ, Burgess RR (August 1990). "Use of Mono Q high-resolution ion-exchange chromatography to obtain highly pure and active Escherichia coli RNA polymerase". Biochemistry. 29 (34): 7890–7894. doi:10.1021/bi00486a016. PMID 2261443.
외부 링크
- DNAi – DNA Interactive (RNA 중합효소 정보 및 Flash 클립 포함)
- 미국 국립 의학 도서관 의학 주제 표제(MeSH)의 RNA+ 중합효소
- EC 2.7.7.6
- RNA 중합효소– DNA 템플릿에서 합성 RNA
(웨이백 머신 복사)