제약업
Pharmaceutical industry
제약업계는 치료, 백신 접종 또는 증상 [1][2]완화를 목적으로 환자에게 투여되는(또는 자가 투여되는) 의약품으로 사용되는 의약품 또는 의약품을 발견, 개발, 생산 및 판매한다.제약회사는 제네릭 또는 브랜드의 의약품과 의료기기를 취급할 수 있습니다.그들은 약물 테스트와 약물의 마케팅을 이용한 특허, 테스트, 안전성, 효능을 규정하는 다양한 법률과 규제를 받는다.세계 의약품 시장은 2020년 12억2845만달러 규모의 치료제를 생산해 연평균 복합성장률(CAGR) 1.8%[3]를 나타냈다.
역사
1800년대 중반 – 1945년 : 식물학에서 최초의 합성 의약품까지
현대 제약 산업의 시대는 모르핀과 퀴닌과 같은 식물 의약품을 유통하는 전통적인 역할에서 1800년대 중반 도매 제조로 확대된 지역 약국에서 시작되었고, 응용 연구로 인한 발견에서 비롯되었다.식물에서 의도적인 약물 발견은 1803년에서 1805년 사이에 독일의 약제사 조수 프리드리히 세르튀르너가 아편으로부터 모르핀을 분리하면서 시작되었는데, 그는 이 화합물을 그리스의 꿈의 신 모페우스의 [4]이름을 따서 이름 지었다.1880년대 후반까지, 독일 염료 제조업자들은 타르와 다른 광물원으로부터 개별 유기 화합물의 정화를 완성했고 또한 유기 화학 [5]합성의 기초적인 방법을 확립했다.합성 화학 방법의 개발은 과학자들이 화학 물질의 구조를 체계적으로 변화시키는 것을 가능하게 했고, 약리학이 부상하면서 이러한 구조 변화의 생물학적 영향을 평가할 수 있는 그들의 능력이 확장되었다.
에피네프린, 노르에피네프린 및 암페타민
1890년대까지, 부신 추출물이 많은 다른 조직 유형에 미치는 심오한 영향이 발견되어 화학적 신호 전달 메커니즘에 대한 연구와 신약 개발을 위한 이러한 관찰을 이용하려는 노력 둘 다에 대한 연구가 시작되었다.부신 추출물의 혈압 상승과 혈관 수축 효과는 지혈제 및 충격 치료제로서 외과의사들이 특히 관심을 가지고 있었으며, 많은 회사들이 활성 물질의 다양한 순도를 함유한 부신 추출물을 기반으로 제품을 개발했다.1897년 존스 홉킨스 대학의 존 아벨은 활성 원리가 에피네프린이라는 것을 확인하였고, 그는 불순한 상태에서 황산염으로 분리하였다.이후 공업용 화학자 조키치 타카민은 순수한 상태에서 에피네프린을 얻는 방법을 개발해 파르케 데이비스에 이 기술을 허가했다.파르케 데이비스는 아드레날린이라는 상표명으로 에피네프린을 판매했다.주입된 에피네프린은 천식 발작의 급성 치료에 특히 효과적인 것으로 입증되었으며, 흡입된 버전은 2011년까지 미국에서 판매되었습니다(Primatene Mist).[6][7]1929년까지 에피네프린은 코막힘 치료에 사용되는 흡입제로 제조되었다.
매우 효과적이기는 하지만, 주입 요건은 에피네프린의[clarification needed] 사용을 제한했고, 경구 활성 유도체를 모색했다.구조적으로 유사한 화합물인 에페드린(실제로 노르에피네프린과 더 유사)은 마황 공장의 일본 화학자들에 의해 확인되었고, 일라이 릴리에 의해 천식의 경구 치료제로 판매되었다.Burroughs-Wellcome의 Henry Dale과 George Barger의 연구에 이어, 학계의 화학자 Gordon Alles는 암페타민을 합성하여 1929년 천식 환자들을 대상으로 그것을 실험했다.그 약은 약간의 방목 효과만 있었지만 흥분과 두근거림을 유발했다.암페타민은 Smith, Kline, French에 의해 상표명 Benzedrine Insuler로 비강정맥 제거제로 개발되었습니다.암페타민은 결국 기면증, 뇌염 후 파킨슨병, 우울증과 다른 정신 질환의 감정 상승을 치료하기 위해 개발되었다.1937년 [8]미국 의학협회로부터 이러한 사용에 대한 새롭고 비공식적인 치료제로 승인을 받았으며,[7] 1960년대 삼환식 항우울제가 개발될 때까지 우울증에 일반적으로 사용되었다.
바르비투르산염 검출 및 개발
1903년 헤르만 에밀 피셔와 조셉 폰 머링은 디에틸말론산, 옥시염산인 및 요소의 반응으로 형성된 디에틸바르비투르산이 개의 수면을 유도한다는 사실을 밝혀냈다.이 발견은 1904년부터 수면 보조제로 Veronal이라는 상표명으로 이 화합물을 시판한 바이엘 제약사에 특허와 허가를 받았다.구조적 변화가 효력과 작용 기간에 미치는 영향에 대한 체계적인 조사는 1911년 바이엘에서 페노바르비탈을 발견했고 1912년 그것의 강력한 항간질 활성을 발견하게 되었다.페노바르비탈은 1970년대 간질 치료에 가장 널리 사용되는 약물 중 하나였으며, 2014년 현재 세계보건기구 필수 [9][10]의약품 목록에 남아 있다. 뇌전증1950년대와 1960년대는 바르비투르산염과 암페타민의 중독성과 남용 가능성에 대한 인식이 높아졌고, 그 사용에 대한 규제와 처방전에 대한 정부의 감독 증가로 이어졌다.오늘날 암페타민은 주의력 결핍 장애의 치료와 페노바르비탈의 [11][12]간질 치료에 사용하는 것이 크게 제한된다. 뇌전증
인슐린
1800년대 후반부터 1900년대 초반까지 수행된 일련의 실험에서 당뇨병은 췌장에서 정상적으로 생성되는 물질의 부재로 인해 발생한다는 것이 밝혀졌다.1869년, 오스카 민코프스키와 조셉 폰 머링은 개에게 당뇨병이 췌장의 외과적 제거에 의해 유발될 수 있다는 것을 발견했다.1921년, 캐나다 교수 Frederick Banting과 그의 학생 Charles Best는 이 연구를 반복했고 췌장 추출물 주사가 췌장 제거로 인한 증상을 반전시킨다는 것을 발견했습니다.곧, 추출물이 사람에게 효과가 있다는 것이 입증되었지만, 인슐린 요법의 일상적인 개발은 충분한 양과 재생 가능한 순도로 물질을 생산하는 데 어려움이 있어 지연되었다.연구진은 대규모 생물학적 물질 정제 경험을 바탕으로 일라이 릴리의 산업 협력자들에게 도움을 요청했다.화학자 조지 B. Eli Lilly와 Company의 Walden은 추출물의 pH를 세심하게 조절하면 비교적 순수한 수준의 인슐린이 생산된다는 것을 발견했습니다.토론토 대학의 압력과 이와 유사한 정제 방법을 독자적으로 개발한 학계 과학자들의 잠재적 특허 도전으로, 여러 회사가 인슐린 비독점 생산을 위한 합의가 이루어졌다.인슐린 요법이 발견되고 널리 보급되기 전에 당뇨병 환자의 기대수명은 몇 달 [13]밖에 되지 않았다.
초기 감염 예방 연구: 살바르산, 프론토실, 페니실린 및 백신
전염병 치료를 위한 의약품의 개발은 초기 연구 및 개발 노력의 주요 초점이었다. 1900년에는 폐렴, 결핵, 설사가 미국에서 사망의 3대 주요 원인이었으며 생후 첫 해에 사망률이 10%[14][15][failed verification]를 넘었다.
1911년 최초의 합성 항감염제인 아르스페나민은 폴 에를리히와 베를린 실험치료연구소의 화학자 알프레드 버트하임에 의해 개발되었다.그 약은 상업적인 이름인 [16]살바르산(Salvarsan이 붙여졌다.Ehrlich는 비소의 일반적인 독성과 박테리아에 의한 특정 염료의 선택적 흡수를 모두 언급하면서 유사한 선택적 흡수 특성을 가진 비소를 함유한 염료가 박테리아 감염 치료에 사용될 수 있다는 가설을 세웠다.아르스페나민은 일련의 화합물 합성 캠페인의 일환으로 제조되었으며 부분적으로 선택적인 독성을 보이는 것으로 밝혀졌다.아르스페나민은 매독에 대한 첫 번째 효과적인 치료제라는 것이 입증되었습니다. 매독은 그 이전에는 불치병이었고 심각한 피부 궤양, 신경학적 손상,[17] 그리고 죽음을 초래했습니다.
합성 화합물의 화학 구조를 체계적으로 변화시키고 이러한 변화가 생물학적 활동에 미치는 영향을 측정하는 에를리히의 접근법은 바이엘 과학자 요제프 클라러, 프리츠 미츠슈, 게르하르트 도마크를 포함한 산업 과학자들에 의해 광범위하게 추구되었다.독일 염료업계에서 구할 수 있는 화합물 시험에도 기반을 둔 이 연구는 항생제 술폰아미드 등급의 첫 대표주자인 Prontosil의 개발로 이어졌다.아르스페나민에 비해 술폰아미드는 활동 스펙트럼이 넓고 독성이 훨씬 낮아 연쇄상구균과 [18]같은 병원균에 의한 감염에 유용했다.1939년, 도막크는 이 [19][20]발견으로 노벨 의학상을 받았다.그러나 제2차 세계대전 전에 발생한 감염성 질병으로 인한 사망자가 극적으로 줄어든 것은 주로 깨끗한 물과 덜 붐비는 주택 등 공중 보건 조치가 개선되었기 때문이며,[21][22] 제2차 세계대전 이후 주로 감염성 약물과 백신의 영향이 컸다.
1928년, 알렉산더 플레밍은 페니실린의 항균 효과를 발견했지만, 인간의 질병을 치료하기 위한 개발은 페니실린의 대규모 생산과 정화를 위한 방법의 개발을 기다리고 있었다.이들은 제2차 세계대전 [23]당시 미국과 영국 정부 주도의 제약회사 컨소시엄에 의해 개발됐다.
백신 개발의 초기 진전은 이 기간 동안 주로 일반적인 전염성 질병에 책임이 있는 병원체의 식별을 위한 학술 및 정부 자금의 기초 연구의 형태로 일어났다.1885년 루이 파스퇴르와 피에르 폴 에밀 루가 최초의 광견병 백신을 만들었다.최초의 디프테리아 백신은 1914년에 디프테리아 독소와 항독소(접종된 동물의 혈청에서 생산)의 혼합물로 생산되었지만, 접종의 안전성은 미미했고 널리 사용되지 않았다.미국은 1921년에 디프테리아 206,000건을 기록했고 그 결과 15,520명이 사망했다.1923년 파스퇴르 연구소의 가스톤 라몬과 웰컴 연구소(나중에 글락소스미스클라인의 일부)의 알렉산더 글레니의 병행적인 노력은 디프테리아 독소를 [24]포름알데히드로 처리함으로써 더 안전한 백신을 생산할 수 있다는 것을 발견하게 했다.1944년 스퀴브제약의 모리스 힐먼이 일본뇌염 [25]백신을 최초로 개발했다.Hilleman은 나중에 Merck로 이사하여 홍역, 유행성 이하선염, 수두, 풍진, A형 간염, B형 간염, 뇌수막염을 예방하는 백신 개발에 중요한 역할을 하였다.
안전하지 않은 약물 및 초기 산업 규제

20세기 이전에는 의약품은 일반적으로 제조업이나 안전 및 효능에 대한 규제 통제력이 거의 없는 소규모 제조업체에 의해 생산되었다.그러한 법이 존재했을 정도로, 집행은 느슨했다.미국에서는 오염된 천연두 백신과 디프테리아 항독소의 유통으로 인한 [26]파상풍 발병과 사망으로 백신과 다른 생물학적 약물에 대한 규제가 증가했다.1902년의 생물통제법은 연방정부가 모든 생물학적 약물과 그러한 약물을 생산하는 과정과 시설에 대해 시장 전 승인을 허가하도록 요구하고 있다.이것은 1906년 순수식품의약품법에 의해 뒤따랐는데, 이 법은 부정하거나 잘못된 상표의 식품과 의약품의 주 간 유통을 금지했다.알코올, 모르핀, 아편, 코카인 또는 잠재적으로 위험하거나 중독성이 있는 다른 여러 약물이 함유되어 있고, 해당 약물의 양이나 비율을 표시하지 못한 경우, 의약품은 잘못된 상표로 간주되었다.효능에 대한 뒷받침되지 않는 주장을 한 제조사들을 기소하기 위해 이 법을 사용하려는 정부의 시도는 연방정부의 집행력을 의약품 [27]성분의 부정확한 사양으로 제한하는 대법원 판결에 의해 약화되었다.
1937년 테네시의 S.E. Massengill Company가 제조한 "E. Sulfanilamide"를 섭취한 후 100명 이상이 사망했다.이 제품은 현재 부동액으로 [28]널리 사용되는 매우 독성이 강한 용매인 디에틸렌 글리콜로 제조되었습니다.당시 존재하는 법률에 따르면, 제조사의 기소는 제품이 말 그대로 에탄올의 용액을 의미하는 "엘릭시르"로 불렸다는 전문성 하에서만 가능했다.이 사건에 대응하여, 미국 의회는 1938년 연방 식품, 의약품 및 화장품법을 통과시켰다. 이 법은 최초로 의약품 판매 전에 안전성에 대한 사전 시연을 요구하고, 허위 치료 [29]청구를 명시적으로 금지했다.
전후 1945~1970년
감염 예방 연구의 한층 더 진전
세계 대전의 후유증 항균성 drugs[30]의 세팔로스포린류(일라이 릴리에 의해 개발된 주세페 Brotzu과 에드워드 아브라함의 중요한 학업에 기반을 두고)[31일][32]스테 렙토 마이신(한Merck-funded 연구 프로그램 중에 셀먼 에이브러햄 왁스먼의 laboratory[33]에서 발견되), 테트라사이클린계 등 새로운 수업의 발견에서의 폭발을 보았다.s[34](에서 발견된Lederle Laboratories, 현재는 화이자의 일부이며, 에리트로마이신(Eli Lilly and Co.[35]에서 발견), 그리고 점점 더 광범위한 세균 병원균으로 확장된다.스트렙토마이신은 1943년 러트거스에 있는 셀만 웍스만의 연구실에서 머크가 후원한 연구 프로그램 중에 발견되어 결핵의 첫 번째 효과적인 치료제가 되었다.발견 당시 결핵 감염자 격리 요양소는 [33][36]선진국 도시 곳곳에서 볼 수 있는 특징으로 입원 후 5년 이내에 50%가 사망했다.
1958년에 발표된 연방무역위원회 보고서는 항생제 개발이 미국 공중 보건에 미치는 영향을 정량화하려고 시도했다.보고서에 따르면 1946-1955년 동안 항생제가 효과가 있는 질병 발생률은 42% 감소했고 항생제가 효과가 없는 질병 발생률은 20% 감소하는 데 그쳤다.보고서는 "항생제 사용, 조기 진단 및 기타 요인들로 인해 전염병 확산이 제한되고, 따라서 발생한 이러한 질병의 수가 제한되고 있는 것으로 보인다"고 결론지었다.이 연구는 항생제가 효과적인 치료를 제공하는 8가지 일반적인 질병(매독, 결핵, 이질, 성홍열, 백일해, 뇌수막구균 감염, 폐렴)의 사망률을 추가로 조사했고 같은 [37]기간 동안 56%의 감소율을 발견했다.그 중 주목할 만한 것은 [38]결핵으로 인한 사망률 75% 감소였다.
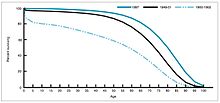
1940-1955년 동안 미국 사망률 감소율은 연간 2%에서 8%로 빨라졌다가 과거 연간 2%로 되돌아갔다.전후 몇 년간의 급격한 감소는 [40][22]전염병에 대한 새로운 치료법과 백신의 급속한 개발로 인해 발생하였다.백신 개발은 계속 가속화되었고, 이 기간 동안 가장 주목할 만한 성과는 비영리 영아 마비 국가 재단의 자금 지원 하에 1954년에 소아마비 백신을 개발한 것입니다.백신 제조 과정은 특허를 받은 적이 없고 대신 저가의 제네릭으로 제조하기 위해 제약회사에 제공되었습니다.1960년 Merck Sharp & Dohme의 Maurice Hilleman은 SV40 바이러스를 확인했는데, 이것은 후에 많은 포유류 종에서 종양을 일으키는 것으로 나타났다.나중에 SV40이 미국 [41][42]어린이 90%에게 투여된 소아마비 백신 로트에 오염 물질로 존재하는 것으로 밝혀졌다.오염은 원래 세포 스톡과 생산에 사용된 원숭이 조직 둘 다에서 발생한 것으로 보인다.2004년 미국 암 연구소는 SV40이 사람의 [43]암과 관련이 없다는 결론을 내렸다고 발표했다.
이 시기의 다른 주목할 만한 새로운 백신으로는 홍역(1962년 보스턴 아동의료센터의 존 프랭클린 엔더스, 후에 머크에서 모리스 힐먼에 의해 개량됨), 루벨라(1969년, 힐먼, 머크), 유행성 이하선염(1967년, 힐먼, 머크)[44] 등이 있다.미국의 풍진, 선천성 풍진 증후군, 홍역 및 유행성 이하선염 발병률은 광범위한 [45]예방접종 직후 95% 이상 감소했다.미국에서 홍역 백신을 처음 20년 동안 허가 받은 것은 5천 2백만 명의 환자, 17,400명의 정신지체 환자, 그리고 5,200명의 [46]사망자를 예방했다.
강압제 개발 및 판매
고혈압은 아테롬성 동맥경화증,[47] 심부전,[48] 관상동맥질환,[49][50] 뇌졸중,[51] 신장질환,[52][53][54][55] 말초동맥질환의 위험인자이며 선진국에서 [56]심혈관질환과 사망률의 가장 중요한 위험인자이다.1940년 이전에는 50세 이상의 사람 중 약 23%가 고혈압으로 인한 사망이었다.심한 고혈압은 [57]수술로 치료되었다.
고혈압 치료 분야에서의 초기 개발에는 4급 암모늄 이온 교감 신경계 차단제가 포함되었지만, 이러한 화합물은 심각한 부작용으로 인해 널리 사용되지 않았다. 고혈압의 장기적인 건강상 영향이 아직 확립되지 않았고 i에 의해 투여되어야 했기 때문이다.주입
1952년 Ciba의 연구원들은 경구용 혈관 확장제인 히드라라진을 [58]최초로 발견했다.히드라라진 모노테라피의 주요 단점은 시간이 지남에 따라 효과가 상실된다는 것이었다(타키필락시스).1950년대 중반 Karl H.Beyer, James M. Sprague, John E. Baer, Frederick C.Merck and Co.의 노벨로는 오늘날 [59]가장 널리 사용되는 강압제인 클로로티아지드를 발견하고 개발했다.이러한 발전은 고혈압 [60]환자의 사망률의 상당한 감소와 관련이 있었다.이 발명가들은 1975년 "수천명의 생명을 구하고 수백만 [61]명의 고혈압 희생자들의 고통을 완화시켜준 공로로 공중 보건 래스커 상"에 의해 인정받았다.
2009년 코크란 리뷰는 티아지드 항고혈압제가 고혈압 [62]환자의 사망 위험(RR 0.89), 뇌졸중(RR 0.63), 관상동맥 심장병(RR 0.84) 및 심혈관 질환(RR 0.70)을 감소시킨다고 결론지었다.몇 년 동안 루프 이뇨제(Lasix/furosemid, Hoechst Pharmacuticals, 1963),[63] 베타 차단제(ICI Pharmacuticals, 1964)[64] ACE 억제제 및 안지오텐신 수용체 차단제를 포함한 다른 등급의 강압제가 개발되어 복합 치료에서 널리 수용되었다.ACE 억제제는 고혈압 여부와 상관없이 [65]당뇨병 환자의 신개시 신장질환 [RR 0.71] 및 사망[RR 0.84] 위험을 감소시킨다.
경구 피임약
제2차 세계대전 이전에는 많은 나라에서 산아제한이 금지되어 미국에서는 피임방법에 대한 논의조차 컴스톡법에 따라 기소되기도 했다.따라서 경구 피임약의 개발 역사는 피임 운동과 활동가 마가렛 생어, 메리 데넷, 엠마 골드만의 노력과 밀접하게 연관되어 있다.그레고리 핀커스가 수행한 기초 연구와 신텍스의 칼 제라시와 G.D. Searle & Co.의 프랭크 콜튼이 개발한 프로게스테론의 합성 방법에 기초하여 최초의 경구 피임약인 Enovid가 E.D.에 의해 개발되었습니다.Searle & Co.와 1960년 FDA의 승인을 받았습니다.원래 제제는 호르몬의 과다 복용을 포함했고, 심각한 부작용을 야기했다.그럼에도 불구하고 1962년에는 120만 명의 미국 여성들이 피임약을 복용했고 1965년에는 650만 명으로 늘어났다.[66][67][68][69]편리한 형태의 임시 피임약의 이용은 여성들이 이용할 수 있는 생활 방식의 선택의 폭을 넓히고, 피임 관행을 위한 여성의 남성 의존도를 줄이고, 결혼의 지연을 장려하고, 결혼 전 [70]동거 생활을 늘리는 등 사회적인 변화를 가져왔다.
탈리도미드와 케파우버-해리스 개정안
미국에서는 1959년 테네시주 에스테스 케파우버 상원의원이 주도한 의회 청문회에서 FD&C법 개정안이 나왔다.청문회에서는 광고 남용, 의약품의 효능, 업계의 규제 강화 등 광범위한 정책 문제가 다뤄졌다.새로운 법안의 추진력은 장기간의 논쟁으로 일시적으로 시들해진 반면, 보다 포괄적인 규제의 필요성을 강조하고 새로운 법안의 통과를 위한 추진력을 제공하는 새로운 비극이 나타났다.
1960년 9월 12일, 미국 면허소지자인 윌리엄 S.Merrell Company of Cincinnati는 1956년부터 유럽에서 판매된 진정제인 케바돈(탈리도마이드)의 신약 신청서를 제출했다.FDA의 조사 담당의 Frances Kelsey는 탈리도마이드의 안전성을 뒷받침하는 데이터가 불완전하다고 믿었다.이 회사는 켈시와 FDA가 1961년 11월 심각한 선천성 기형과의 연관성 때문에 독일 시장에서 이 약품을 철수할 때까지 계속 적용하도록 압력을 가했다.유럽과 다른 곳에서 수천 명의 신생아들이 탈리도마이드의 기형 유발 효과를 겪었다.FDA의 승인 없이, 그 회사는 조사용으로 가장하여 1,000명이 넘는 의사들에게 케바돈을 배포했다.이 "연구"에서 624명의 임산부 환자를 포함하여 2만 명 이상의 미국인들이 탈리도마이드를 투여받았고, 약 17명의 알려진 신생아들이 이 [citation needed]약의 영향을 받았다.
탈리도마이드 비극은 의회에서 멈춰있던 약물 규제를 강화하는 케파우버의 법안을 부활시켰고, 케파우버-해리스 수정안은 1962년 10월 10일 법률이 되었다.이후 제조사들은 미국 시장에 나가기 전에 그들의 약이 효과적일 뿐만 아니라 안전하다는 것을 FDA에 증명해야 했다.FDA는 처방약 광고를 규제하고 좋은 제조 관행을 확립할 권한을 부여받았다.법은 1938년에서 1962년 사이에 도입된 모든 약물이 효과가 있어야 한다고 요구했다.FDA와 국립과학아카데미의 공동 연구는 이 제품들 중 거의 40%가 효과가 없다는 것을 보여주었다.시판 제품에 대한 이와 유사한 포괄적인 연구가 [71]10년 후에 시작되었다.
1970~1980년대
스타틴스
1971년 제약회사 산쿄에서 일하는 일본인 생화학자 엔도 아키라는 콜레스테롤 생성에 중요한 효소인 HMG-CoA 환원효소의 억제제인 페니실리움 시트리눔균에 의해 생성된 분자 메바스타틴(ML-236B)을 확인했다.동물 실험은 임상 실험과 마찬가지로 매우 좋은 억제 효과를 보였지만, 개를 대상으로 한 장기 연구는 더 높은 용량에서 독성 효과를 발견했고 그 결과 메바스타틴은 사람이 사용하기에는 너무 독성이 있다고 여겨졌다.메바스타틴은 종양, 근육 악화, 그리고 때로는 실험견의 죽음의 부작용 때문에 시판되지 않았다.
수석 과학자이자 후에 Merck & Co.의 CEO인 P. Roy Vagelos는 관심을 가지고 1975년부터 여러 차례 일본을 방문했다.1978년까지 Merck는 1987년 메바코르로 처음 [72][73][74]시판된 곰팡이 Aspergillus terreus에서 로바스타틴(메비놀린, MK803)을 분리했다.
1994년 4월, Merck가 후원한 연구, 스칸디나비아의 Simvastatin Survival Study의 결과가 발표되었습니다.연구원들은 후에 머크가 Zocor로 판매한 심바스타틴을 콜레스테롤이 높고 심장병이 있는 4,444명의 환자들을 대상으로 실험했다.5년 후, 연구는 환자들이 콜레스테롤이 35% 감소했고 심장마비로 사망할 확률은 42%[75] 감소했다고 결론지었다.1995년에 Zocor와 Mevacor는 둘 다 Merck를 10억 달러 이상 벌어들였습니다.엔도는 2006년 일본상, 2008년에는 래스커·데베이키 임상 의학 연구상을 수상했다.콜레스테롤을 [sentence fragment][76][77]낮추기 위한 새로운 종류의 분자에 대한 선구적 연구로,
연구 개발
약물 발견은 잠재적 약물이 발견되거나 설계되는 과정이다.과거에는 대부분의 약물이 전통적인 치료법으로부터 활성 성분을 분리하거나 우연한 발견에 의해 발견되었다.현대 생명공학은 종종 질병 상태나 병원체와 관련된 대사 경로를 이해하고 분자 생물학이나 생화학으로 이러한 경로를 조작하는 데 초점을 맞춘다.많은 초기 단계의 약물 발견은 전통적으로 대학과 연구 기관에 의해 수행되어 왔다.
의약품 개발은 화합물이 의약품으로서의 적합성을 확립하기 위해 잠재적 의약품으로 식별된 후 수행되는 활동을 말한다.의약품 개발의 목적은 적절한 제제와 투여를 결정하고 안전을 확립하는 것이다.이러한 영역의 연구는 일반적으로 체외 연구, 체내 연구 및 임상 시험의 조합을 포함한다.후발 개발의 비용은 보통 대형 제약회사들에 [78]의해 이루어졌다는 것을 의미한다.제약·생명공학 업종은 순매출액의 15% 이상을 연구개발에 소비하고 있어 다른 업종에 비해 점유율이 [79]높다.
종종, 대규모 다국적 기업들은 수직적 통합을 보여주며, 광범위한 의약품 발견 및 개발, 제조 및 품질 관리, 마케팅, 판매 및 유통에 참여합니다.반면 소규모 조직들은 종종 약물 후보를 발견하거나 제제를 개발하는 것과 같은 특정 측면에 초점을 맞춘다.신약 개발의 가능성을 모색하기 위해 연구 기관과 대형 제약 회사 간에 협력 협정이 체결되는 경우가 많습니다.최근에는 다국적 기업들이 의약품 [80]개발을 위해 계약 연구 기관에 점점 더 많이 의존하고 있다.
이노베이션 비용
약물 발견과 개발은 매우 비싸다. 인간 사용을 위해 조사된 모든 화합물 중 극히 일부만 정부가 지정한 의료 기관이나 이사회에 의해 결국 대부분의 국가에서 승인되고, 이들 국가에서 신약은 시판되기 전에 승인되어야 한다.2010년에 FDA는 18개의 NME(New Molecular Entities)를 승인했으며, 3개의 바이오를 총 21개로 2009년의 26개, 2008년의 24개에서 감소했다.반면 2007년에는 18건, 2006년에는 22건에 불과했다.2001년 이후 약물평가연구센터는 [81]연평균 22.9건의 승인을 받아왔다.이러한 승인은 임상 전 개발 및 임상시험에 대한 막대한 투자와 지속적인 안전성 모니터링에 대한 약속 후에만 이루어진다.이 과정에서 중간에 실패한 약물은 종종 큰 비용을 발생시키지만 그 대가로 수익을 창출하지 못한다.이러한 실패한 의약품의 비용을 고려할 경우 성공적인 신약 개발 비용(신화학기업, NCE)은 13억 달러[82](마케팅 비용 제외)로 추정된다.그러나 라이트 교수와 렉스킨 교수는 2012년 신약 승인률이 수십 [83]년간 평균 15~25%로 비교적 안정적이었다고 보고했다.
2009년에는 [84]업계 전체의 조사 및 투자가 653억달러에 달했습니다.1995년에서 2010년 사이에 미국의 연구 비용은 약 342억 달러였지만, 수익은 더 빠르게 증가했다([83]그 당시 수익은 2004억 달러 증가).
컨설팅 회사인 Bain & Company의 조사에 따르면, (마케팅 및 기타 사업 비용에서 고려된) 신약의 발견, 개발 및 출시 비용은 2003년에 [85]약 17억 달러로 5년간 증가했다고 합니다.포브스에 따르면, 2010년까지 개발 비용은 [86]약당 40억 달러에서 110억 달러 사이였다.
이러한 추정치 중 일부는 수익이 실현되기 수년 전에 자본을 투자하는 기회 비용도 고려합니다(화폐의 시간 가치 참조).의약품의 발견, 개발 및 승인에 매우 오랜 시간이 걸리기 때문에 이러한 비용은 총 비용의 거의 절반까지 누적될 수 있습니다.제약 산업 가치 사슬 내의 직접적인 결과가 주요 제약 다국적 기업들 점점 더 위험 다소 생명 공학 회사들은 점점 더 중요한 역할과 그리고 전체적인 전략 그에 따라 재정립하고 있는 산업 생태계를 바꿔 근본적인 연구와 관련된 외주 제작하는 경향이 있다.[87]기존 활성 성분(라인 확장이라고도 함)의 재공식을 기반으로 하는 의약품과 같은 일부 승인된 의약품은 개발 비용이 훨씬 저렴하다.
제품 승인
미국에서 새로운 의약품은 미국 식품의약국(FDA)의 안전성과 효능을 모두 인정받아야 한다.이 과정에는 일반적으로 임상 전 데이터를 포함한 탐색적 신약 제출이 포함되어 인체 시험 진행을 뒷받침하는 임상 전 데이터가 포함됩니다.IND 승인에 따라 점진적으로 더 큰 임상시험의 세 단계를 수행할 수 있다.1단계에서는 일반적으로 건강한 지원자를 사용하여 독성을 연구합니다.2단계는 환자의 약물동태학 및 투여를 포함할 수 있으며, 3단계는 의도된 환자 모집단의 유효성에 대한 매우 큰 연구이다.단계 III 테스트가 성공적으로 완료된 후 신약 애플리케이션이 FDA에 제출됩니다.FDA는 데이터를 검토하고 제품이 긍정적인 유익성-위해성 평가를 가지고 있는 것으로 간주되면 미국에서의 제품 시판 승인이 허가된다.[88]
가장 큰 임상시험이라도 희귀 부작용의 유병률을 효과적으로 예측할 수 없기 때문에 승인 후 감시의 4단계도 종종 필요하다.시판 후 감시는 시판 후 의약품의 안전성을 면밀히 모니터링합니다.경우에 따라서는 특정 환자 집단으로 제한해야 할 수도 있고, 그 밖의 경우에는 해당 물질이 시장에서 완전히 철수해야 할 수도 있다.
FDA는 Orange [89]Book 사이트에서 승인된 약물에 대한 정보를 제공합니다.
영국에서는 의약품 및 의료 제품 규제 기관이 약물의 사용을 승인하고 평가합니다.일반적으로 영국 및 기타 유럽 국가에서의 승인이 미국에서의 승인보다 늦게 이루어집니다.그런 다음, National Institute for Health and Care Excellence(NICE)가 National Health and Care Excellence(NICE)의 사용을 허용할지 여부와 방법을 결정합니다.영국 국립 조제법은 약사와 임상의들을 위한 핵심 안내서이다.
많은 미국 이외의 서구 국가에서는 새로운 기술을 제공하기 전에 비용 효과 분석의 '4번째 장애물'이 개발되었습니다.이는 해당 기술의 '효율성 가격표'(예를 들어 QALY당 비용)에 초점을 맞춘다.잉글랜드와 웨일즈에서 NICE는 NHS가 약물과 기술을 이용할 수 있는지 여부와 상황에 따라 결정하며, 스코틀랜드에 있는 스코틀랜드 의약품 컨소시엄과 호주의 약제혜택 자문위원회와 유사한 약정이 존재한다.제품이 승인되려면 비용 효율의 문턱을 넘어야 합니다.치료는 '돈에 대한 가치'와 사회에 대한 순 이익을 나타내야 한다.
고아약
몇몇 주요 의약품 규제 구역에는 특정 희귀 질환("고형 질환")에 대한 특별 규정이 있습니다.예를 들어, 미국에서 200,000명 미만의 환자 또는 특정 상황에서 더 많은 인구가 관련된 질병은 고아 의약품법의 [90]적용을 받는다.이러한 질병을 치료하기 위한 의약품의 의학 연구와 개발은 재정적으로 불리하기 때문에, 그렇게 하는 회사들은 그 약이 특허에 의해 보호되는지 여부에 관계없이 제한된 기간(7년) 동안 세금 감면, 수수료 면제 및 시장 독점권을 보상받는다.
글로벌 판매
| 회사 | 의약품 판매 (백만 달러) |
|---|---|
| 화이자 | 45,083 |
| 글락소스미스클라인 | 40,156 |
| 사노피 | 38,555 |
| 로체 | 27,290 |
| 아스트라제네카 / | 26,475 |
| 존슨앤드존슨 | 23,267 |
| 노바티스 | 22,576 |
| Merck & Co | 20,375 |
| 유니레버 | 24,395 |
| 와이스 | 16,884 |
| 릴리 | 15,691 |
| 브리스톨 마이어스 스퀴브 | 13,861 |
| 베링거 잉겔하임 | 13,860 |
| 암겐 | 13,858 |
| 애보트 연구소 | 12,395 |
| 바이어 | 10,162 |
| 다케다 | 8,716 |
| 셰링 플라우 | 8,561 |
| 테바 | 7,821 |
| 제너텍 | 7,640 |
| 아스텔라스 | 7,390 |
| 노보 노르디스크 | 7,087 |
| 다이이치 산쿄 | 6,790 |
| Baxter International | 6,461 |
| 머크 KGaA | 5,643 |
| 아이사이 | 4,703 |
2011년 유럽과 북미의 성장세가 다소 둔화되었지만 처방약에 대한 세계 지출은 9,540억 달러를 넘어섰다.미국은 전 세계 제약 시장의 3분의 1 이상을 차지하고 있으며, EU와 [92]일본이 뒤를 잇고 있다.중국, 러시아, 한국, 멕시코와 같은 신흥 시장이 81%[93][94]의 큰 성장률을 보이며 그 시장을 앞질렀다.
2013년 가장 많이 팔린 10대 의약품은 총 756억 달러의 매출을 올렸으며, 항염증제 휴미라는 107억 달러의 매출로 전 세계적으로 가장 많이 팔린 의약품이다.2위와 3위는 각각 [95]엔브렐과 레미케이드였다.2013년 미국에서 가장 많이 팔린 약물은 Abilify(63억 달러), Nexium(60억 달러), Humira([96]54억 달러)였다.지금까지 가장 많이 팔린 약인 Lipitor는 2011년 11월 화이자의 특허가 만료되기 전까지 연평균 130억 달러, 평생 총 1410억 달러의 순이익을 올렸다.
IMS Health는 일부 특허의 손실에도 불구하고 대부분의 부문에서 이익이 증가하는 것, 그리고 [97]곧 '블록버스터' 신약을 포함한 2007년 제약업계에서 예상되는 동향에 대한 분석을 발표했습니다.
특허 및 제네릭
기업은 여러 가지 고려사항에 따라 통상 약 [98]20년간 독점권을 부여하면서 의약품 또는 의약품 제조 과정에 대한 특허를 출원 및 부여할 수 있다.하지만 평균 10~15년이 걸리는 엄격한 연구와 테스트를 거쳐야 정부 당국이 이 약의 [99]시판 및 판매를 허가할 수 있다.특허 보호를 통해 특허 소유자는 브랜드 의약품의 높은 수익률을 통해 연구개발 비용을 회수할 수 있습니다.그 약에 대한 특허 보호가 만료되면, 일반적으로 경쟁사에 의해 복제 약이 개발되고 판매된다.제네릭스의 개발 및 승인 비용이 저렴하여 저렴한 가격에 판매할 수 있습니다.종종 상표 있는 약물의 소유자는 특허가 만료되기 전에 제네릭 [100]시장에서 유리한 고지를 차지하기 위해 제네릭 버전을 도입할 것이다.따라서 구조조정은 1990년대 "황금시대"에 출시된 제품들의 특허 만료와 기업들이 [101]손실된 수익을 대체할 만큼 충분한 블록버스터 신제품을 개발하지 못함에 따라 일상화되었다.
처방전
미국에서는 1995년부터 2005년까지 연간 34억 달러씩 처방이치가 증가해 61%의 증가율을 보였다.처방약의 소매 판매액은 720억 달러에서 2500억 달러로 250% 급증했고 처방약의 평균 가격은 30달러에서 [102]68달러로 두 배 이상 뛰었다.
마케팅.
광고는 의료 저널뿐만 아니라 주류 미디어 경로를 통해 일반적입니다.일부 국가, 특히 미국에서는 일반 대중에게 직접 광고를 할 수 있습니다.제약회사에서는 일반적으로 판매사원(흔히 '약물 판매원' 또는 더 오래된 용어인 '세부 판매원')을 고용하여 의사 및 기타 의료 서비스 제공자에게 직접 및 개인적으로 마케팅합니다.일부 국가, 특히 미국에서는 제약회사들이 정치인들에게 영향력을 행사하기 위해 로비스트를 고용하기도 합니다.미국에서 처방약 마케팅은 1987년 연방 처방약 마케팅법에 의해 규제된다.제약 마케팅 계획에는 현재 상황에서 의약품 협회와 그 품목 및 행정부를 전진시킬 지출 계획, 채널 및 생각이 포함되어 있습니다.
헬스케어 프로페셔널에게
Bad Pharma라는 책은 또한 약품 대표자들의 영향, 어떻게 대필작가가 출판할 논문을 쓰기 위해 제약회사들에 고용되었는지, 얼마나 독립적인 학술지인지, 제약회사들이 어떻게 의사들의 지속적인 교육에 자금을 대는지, 그리고 환자 단체들이 어떻게 종종 [103]산업에 의해 자금을 지원받는지에 대해 논한다.
소비자 광고로 직접 이동
1980년대 이후, 소비자들에게 처방약을 판매하는 새로운 방법이 중요해졌다.소비자 대상 미디어 광고는 FDA 소비자 지향 방송 광고에 대한 산업 지침에서 합법화되었습니다.
논쟁
마약 마케팅 및 로비
제약 마케팅과 영향력을 둘러싼 논란이 커지고 있다.의료 전문가들에게 'gifts'와 편향된 정보를 제공 마케팅의 지속적인 조항 등을 포함해 비난과 의사 및 다른 의료 전문가들에게 약을 반복을 통해 영향력의 결과, 잡지와 회견에서[104]정신 질환 광고, 그리고 건강 독립적인 의료 단체 자금 지원 촉진 campa.igns(미국의 다른 어떤 산업보다[105]) 의사 및 정치인 로비, 의과대학 또는 간호사 훈련 후원, 커리큘럼에 [106]영향을 미치는 지속적인 교육 행사 후원, 의사들을 의료 자문 위원회에서 유료 컨설턴트로 고용.
No Free Lunch 나 AllTrials 와 같은 일부 옹호 단체들은 의사들에게 약품 마케팅의 효과를 비판해왔다.[107] 왜냐하면 그들은 다른 단체들이 환자에게 더 저렴하거나 더 나을지라도 시판되는 약품을 처방하도록 의사들에게 편견을 심어주기 때문이다.
의약품 시장을 확대하기 위해 질병을 마구잡이로[108] 만든다는 관련 비난이 제기되어 왔다.그 [109]주제에 대한 첫 회의가 2006년 호주에서 열렸다.2009년, 정부 지원 국가 처방 서비스는 GP에게 독립적인 약물 분석 방법에 대한 교육을 목적으로 "증거 찾기 – 과대광고 인식"[110] 프로그램을 시작했습니다.
메타분석에 따르면 제약회사가 후원하는 정신의학 연구는 긍정적인 결과를 보고할 확률이 몇 배 더 높으며, 제약회사 직원이 관련되면 그 효과는 더 크다.[111][112][113]그 영향력은 또한 싸우고 있는 의과대학에서 의사와 간호사를 양성하는 데까지 확대되었다.
정신장애 진단 및 통계 매뉴얼의 설계와 기준의 확대가 정신의학에 [114]대한 제약회사의 영향으로 인간 본성의 의학화, 즉 "질병 혼란"이 증가하고 있다는 주장이 제기되어 왔다.직접적인 이해 상충의 가능성이 제기되었는데, 부분적으로는 DSM-IV 정신 질환을 선택하고 정의한 저자의 약 절반이 제약 [115]산업과 금전적 관계를 가지고 있거나 이전에 관계를 맺고 있었기 때문이다.
미국에서는 2013년부터 의사 재정 투명성 보고서(선샤인 법의 일부)에 따라 의료보험 및 의료보험 서비스 센터는 의사 및 병원과의 재무 관계에 대한 정보를 보고하기 위해 해당 제조업체 및 그룹 구매 조직으로부터 정보를 수집해야 합니다.데이터는 Medicare & Medicaid Services 웹사이트에서 공개됩니다.의사와 제약업계 간의 관계가 완전히 [116]투명해질 것으로 기대된다.
OpenSecrets가 실시한 보고서에 따르면, 2017년 제약업계에서 일부 자격으로 일하는 로비스트들은 1,100명이 넘습니다.2017년 1분기에 건강제품과 제약업계는 미국 의회 [117]로비에 7,800만 달러를 썼다.
의약품 가격
의약품 가격이 보건 시스템의 [118]주요 과제가 되고 있다는 주장이 제기되어 왔다.
규제에 관한 문제
Ben Goldacre는 규제 기관과 규제 기관 간의 직원 교환으로 인해 의약품 및 의료 제품 규제 기관(MHRA)이나 미국의 식품의약국(FDA)과 같은 규제 기관이 일반인의 이익보다 제약 회사의 이익을 증진시킨다고 주장했습니다.공황과 우정은 규제 기관과 회사 [119]직원들 사이에서 발전한다.그는 규제 당국이 신약이 이미 이용 가능한 약보다 개선되거나 심지어 신약이 특별히 [119]효과적이라고 요구하지 않는다고 주장한다.
다른 사람들은 과도한 규제는 치료 혁신을 억제하고 규제자가 필요한 임상시험의 현재 비용이 인간 질병의 치료를 위한 새로운 유전학적, 생물학적 지식의 완전한 이용을 방해한다고 주장해왔다.대통령 과학기술자문위원회의 2012년 보고서는 1) FDA의 가속 승인 프로세스 사용 확대 2) 좁게 정의된 모집단에서 사용하도록 의도된 의약품에 대한 신속한 승인 경로 생성 및 3) u를 포함한 신약 개발에 대한 규제 부담을 줄이기 위한 몇 가지 핵심 권고사항을 제시했다.새로운 적응형 의약품 승인 [120]프로세스의 실현 가능성을 평가하기 위해 설계된 파일럿 프로젝트 수행.
의약품 사기
이 섹션의 예와 관점은 주로 미국을 다루며, 주제에 대한 전 세계적인 관점을 나타내지 않는다.(2015년 8월 (이 및 ) |
제약사기는 제약회사에 금전적 이익을 가져다주는 사기행각을 포함한다.개인과 공공 및 민간 보험사에 영향을 미칩니다.제약업계에 특화된 의료 시스템을 사취하기 위해 사용되는 몇 가지 다른[121] 계획들이 있다.여기에는 다음이 포함됩니다.Good Manufacturing Practice(GMP) 위반, 오프 라벨 마케팅, 베스트 프라이스 사기, CME 사기, 메디케이드 가격 보고서 및 제조 복합 의약품.[122]이 중 25억 달러는 2010 회계연도에 허위청구법을 통해 회수되었습니다.사기 사례로는 글락소스미스클라인 30억달러 합의, 화이자 23억달러 합의, 머크앤코 등이 있다.6억 5천만 달러의 합의금.사기로 인한 손해는 허위청구법을 사용하여 회수할 수 있으며, 가장 일반적으로는 개인에 대해 "위선배자" 또는 계약자(법률)[123]를 보상하는 조항 하에 있습니다.
비정형 항정신병 약물인 Bristol-Myers Squibb, Eli Lilly 및 Company, Pfizer, AstraZeneca 및 Johnson & Johnson을 판매하는 모든 대기업은 허위 청구법에 따라 최근 정부 사례를 수억 달러에 해결했거나 현재 의료 사기 가능성에 대해 조사 중입니다.불법 마케팅 혐의에 이어, 두 곳의 합의는 2009년에 기업에 부과된 사상 최대 규모의 형사 벌금 기록을 세웠다.하나는 엘리 릴리의 항정신병 약물인 자이프렉사, 다른 하나는 관절염에 사용되는 항염증 약물인 벡스트라였다.벡스트라 사건의 경우 정부는 또 다른 항정신병 약물인 지오돈(Geodon)을 불법 판매한 혐의로 화이자를 기소했다. 화이자는 어떠한 [124]잘못도 인정하지 않고 3억100만 달러에 배상했다.
2012년 7월 2일 GlaxoSmithKline은 범죄 혐의를 인정하여 미국 최대 규모의 의료사기 사건과 제약회사 [125]최대 규모의 배상금 30억달러에 합의했습니다.이번 합의는 회사의 처방약 불법 홍보, 안전 데이터 [126]미신고, 의사 뇌물 수수, 허가받지 않은 의약품 홍보 등과 관련이 있다.관련된 약물은 팍실, 웰부트린, 어드바이어, 라믹탈, 조프란 등 오프라벨, 비커버드용이었다.그것들과 이미트렉스, 로트로넥스, 플로벤트, 발트렉스 약물이 리베이트 계획에 [127][128][129]연루되었다.
다음은 1991년부터 2012년까지 제약회사와 체결한 4대 합의의 목록으로, 전체 합의 규모별로 순위를 매긴다.제약업계에 대한 법적 소송은 메디케어 및 메디케이드 사기, 오프 라벨 프로모션, 부적절한 [130][131]제조 관행 등 지난 20년간 매우 다양했습니다.
| 회사 | 합의 | 위반 | 연도 | 제품 | 법률 위반 혐의 (해당하는 경우) |
|---|---|---|---|---|---|
| 글락소스미스클라인[132] | 30억달러 | 오프 라벨 프로모션/ 안전 데이터 공개 실패 | 2012 | 아반디아/웰부트린/팍실 | 허위청구법/FDCA |
| 화이자[133] | 23억달러 | 오프 라벨 프로모션 / 리베이트 | 2009 | 벡스트라/게오돈/ 자이복스/리리카 | 허위청구법/FDCA |
| 애보트 연구소[134] | 15억달러 | 오프 라벨 프로모션 | 2012 | 디파코테 | 허위청구법/FDCA |
| 엘리 릴리[135] | 14억달러 | 오프 라벨 프로모션 | 2009 | 지프렉사 | 허위청구법/FDCA |
의사 역할
2015년 5월 New England Journal of Medicine은 새로운 치료제 개발을 위한 제약 산업과 의사 간의 상호작용의 중요성을 강조하였고, 업계의 위법행위에 대한 도덕적 분노가 많은 사람들로 하여금 부당하게 이해 상충에 의해 야기된 문제들을 강조하게 만들었다고 주장했다.이 기사는 국립보건원 번역과학진흥센터, 대통령 과학기술자문회의, 세계경제포럼, 게이츠재단, 웰컴 트러스트, 식품의약국 등 주요 의료기관들이 더 많은 노력을 기울였다고 지적했다.환자에 [136][137]대한 편익을 개선하기 위해 의사와 업계 간의 오류.
COVID-19에 대한 반응
2020년 11월, 몇몇 제약회사는 감염 예방에 90 - 95%의 유효성을 가진 COVID-19 백신의 성공적인 시험을 발표했다.외부 분석가가 검토한 회사의 발표와 데이터에 따르면, 이러한 백신은 [138]용량당 3달러에서 37달러까지 가격이 매겨진다.월스트리트저널(WSJ)은 이 공적을 노벨평화상으로 [139]인정해 달라는 사설을 실었다.
국경 없는 의사회는 높은 가격과 의약품, 검사, 백신 독점 행위가 대유행을 연장시키고 생명을 앗아갈 것이라고 경고했다.그들은 캐나다, 칠레, 에콰도르, 독일,[140] 이스라엘이 이미 해왔던 것처럼, 필요에 따라 강제 라이선스를 사용하여 폭리를 취하는 것을 막도록 정부에 촉구했다.
2월 20일 46명의 미국 의원들은 민간 제조업체에 가격과 [141]가용성의 독점적 통제를 주지 않기 위해 미국 정부에 코로나 바이러스 백신과 치료제에 대한 납세자 개발비를 지급할 때 독점권을 부여하지 말 것을 요구했다.
미국에서 정부는 잠재적 COVID-19 치료제를 위한 연구 개발 및/또는 제조 공장 건설에 보조금을 지급하는 협정을 체결했다.일반적으로 이 합의는 정부가 추가 지급 없이 제품의 특정 용량에 대한 소유권을 갖는 것을 포함했다.예를 들어, 미국에서의 워프 속도 작전의 후원으로, 정부는 레제론,[142] 존슨, 존슨, 모데나, 아스트라제네카, 노바박스, 화이자, GSK의 COVID-19 백신 및 치료제 관련 연구에 보조금을 지급했다.대표적인 용어는 4억~20억 달러의 연구 보조금을 포함했으며, 성공적으로 [143]개발된 COVID-19 백신의 최초 1억 선량에 대한 정부 소유를 포함했다.
미국 제약회사 길리어드는 2020년 3월 23일 미국 식품의약국(FDA)으로부터 리메디비어의 고아 약물 지위를 찾아 취득했다.이 조항은 세금과 정부 [144][145]수수료에 대한 면제와 함께 제조업체에 강화되고 확장된 법적 독점권을 부여함으로써 200,000명 미만의 미국인들에게 영향을 미치는 의약품 개발을 장려하기 위한 것이다.렘데시비르는 COVID-19 치료의 후보자이다. 지위가 부여되었을 때, 200,000명 미만의 미국인이 COVID-19에 감염되었지만, COVID-19 대유행이 미국에 도달함에 따라 숫자는 빠르게 증가하고 있으며, 곧 임계값을 넘는 [144][145]것이 불가피하다고 간주되었다.Remdesivir는 미국 정부 [145]자금으로 7천9백만 달러 이상을 들여 길리어드에 의해 개발되었습니다.2020년 5월, 길리어드는 연방 정부에 최초로 94만 도스의 리메디비르를 [146]무료로 제공하겠다고 발표했다.여론의 강한 반응에 직면한 길르앗은 [147]3월 25일 '고판 약물' 지위를 포기했다.길르앗은 70여 [140]개국에 20년 간 렘데시비어 특허를 보유하고 있다.2020년 5월에는 개발 도상국에 리미버를 생산할 수 있는 권리를 제공하기 위해 여러 제네릭 업체와, 보다 광범위한 일반 [148]액세스를 제공하기 위해 의약품 특허 풀과 협의 중이라고 발표했습니다.
개발도상국
특허
개발 도상국에서는 특허가 기존 [149]의약품에 대한 접근을 감소시킨다고 여겨져[who?] 비판을 받아왔다.특허와 의약품에 대한 보편적 접근을 조정하는 것은 효율적인 국제 가격 차별 정책을 필요로 할 것이다.게다가 세계무역기구(WTO)의 TRIPS 협정에 따라 각국은 의약품의 특허를 허용해야 한다.2001년 WTO는 TRIPS 협정은 공중보건을 염두에 두고 읽어야 한다는 도하 선언을 채택해 특허 [150]유효기간 전이라도 강제 라이선스 또는 병행 수입에 의한 제약 독점을 회피할 수 있도록 했다.
2001년 3월 40개 다국적 제약회사가 남아프리카공화국을 상대로 의약품법 소송을 제기해 HIV 치료를 위한 항레트로바이러스제(ARV)의 일반 생산을 허용했다.이러한 약들은 특허권 [151]중임에도 불구하고 말이다.HIV는 과거에도 그랬고 지금도 남아공에서 유행하고 있으며, 당시 ARV는 환자 1인당 연간 US$10,000에서 US$15,000 사이였습니다.이것은 대부분의 남아프리카 시민들에게는 감당할 수 없는 것이었고, 그래서 남아프리카 정부는 사람들이 감당할 수 있는 가격에 ARV를 제공하기로 약속했다.그러기 위해서는 의약품에 대한 특허를 무시하고 국내에서 제네릭스를 생산하거나(강제 라이선스 사용), 해외에서 수입해야 한다.공중 보건권(메데킨스 산 프런티에르에 의한 25만 명의 서명을 포함한)을 지지하는 국제적인 항의가 있은 후, 네덜란드, 독일, 프랑스, 그리고 나중에 미국을 포함한 몇몇 선진국 정부들이 남아프리카 정부를 지지했고,[152] 그 해 4월에 소송은 기각되었다.
2016년 글락소스미스클라인(세계 6위 제약회사)은 가난한 나라에서 특허를 취하해 독립 기업들이 그 지역에서 자사 약의 버전을 만들고 판매할 수 있도록 함으로써 대중들의 [153]접근을 넓힐 것이라고 발표했다.GlaxoSmithKline은 더 이상 특허를 보유하지 않을 50개국의 목록을 발표하여 전세계 10억 명의 사람들에게 영향을 끼쳤다.
자선 프로그램
2011년에는 상위 20개 기업 자선 기부 중 4개와 상위 30개 기업 자선 기부 중 8개가 제약 회사로부터 제공되었습니다.기업 자선 기부의 대부분(2012년 기준 69%)은 비현금 자선 기부를 통해 이루어지며, 그 대부분은 다시 제약 [154]회사에 의해 기부되었다.
제약회사의 자선 프로그램, 의약품 발견 및 개발 활동에는 다음이 포함됩니다.
- "Merck's Gift"는 아프리카에[155] 수십억 개의 하천 맹인 약이 기증되었습니다.
- 남아프리카공화국[156] 에이즈 무료/할인 플루코나졸 및 기타 약품 증정
- 전 세계 림프 필라리아증을 없애기 위해 그리고 그 때까지 WHO에 무료 알벤다졸 정제를 제공하겠다는 GSK의 약속.
- 2006년, Novartis는, 전 세계의 기업 시민권 이니셔티브에 7억 5500만 미 달러(특히, 나병, 결핵, 말라리아에 감염된 환자에 대한 의약품의 기부, Glivec 환자 지원 프로그램 등, 의약 접근성 프로젝트를 통해 개발도상국의 의약품에 대한 접근성 향상에 주력하고 있습니다.긴급 의료가 [157]필요한 주요 인도주의 단체를 지원하기 위한 구호.
「 」를 참조해 주세요.
- 산업단지 목록
- 거대 제약사 음모론
- 임상 시험
- 의약품 개발
- 약물 발견
- 합법적 마약 거래
- 제약 회사 목록
- 라이선스 생산
- 아웃소싱
- 제약 마케팅
- 약국.
- 유닛 에이드
- 가치평가(금융) ①무형자산의 가치평가
레퍼런스
- ^ McGuire, John L.; Hasskarl, Horst; Bode, Gerd; Klingmann, Ingrid; Zahn, Manuel (2007). "Pharmaceuticals, General Survey". Ullmann's Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002/14356007.a19_273.pub2. ISBN 978-3527306732.
- ^ Bozenhardt, Erich H.; Bozenhardt, Herman F. (18 October 2018). "Are You Asking Too Much From Your Filler?". Pharmaceutical Online (Guest column). VertMarkets. Archived from the original on 17 November 2020. Retrieved 30 October 2018.
The core mission of the pharmaceutical industry is to manufacture products for patients to cure them, vaccinate them, or alleviate a symptom, often by manufacturing a liquid injectable or an oral solid, among other therapies.
- ^ Markets, Research and (31 March 2021). "Global Pharmaceuticals Market Report 2021: Market is Expected to Grow from $1228.45 Billion in 2020 to $1250.24 Billion in 2021 - Long-term Forecast to 2025 & 2030". GlobeNewswire News Room. Archived from the original on 29 November 2021. Retrieved 29 November 2021.
- ^ Merck, Hoffman-La Roche, Burroughs-Wellcome(현 Glaxo Smith Kline의 일부), Abbott Laboraties, Eli Lilly 및 Upjohn(현 화이자의 일부)을 포함한 다국적 기업들은 1800년대 중반에 지역 약국 상점으로 시작했다.
- ^ "Emergence of Pharmaceutical Science and Industry: 1870-1930". Chem Eng News. 83 (25). 20 June 2005. Archived from the original on 10 November 2018. Retrieved 23 July 2022.
- ^ Sneader, Walter (31 October 2005). "13 Neurohormones". Drug Discovery: A History. John Wiley & Sons. pp. 155–156. ISBN 978-0-470-01552-0. Retrieved 23 July 2022.
- ^ a b Rasmussen, Nicolas (2006). "Making the First Anti-Depressant: Amphetamine in American Medicine, 1929-1950". J Hist Med Allied Sci. 61 (3): 288–323. doi:10.1093/jhmas/jrj039. PMID 16492800. S2CID 24974454.
- ^ Rasmussen N (June 2008). "America's First Amphetamine Epidemic 1929–1971". Am J Public Health. 98 (6): 974–985. doi:10.2105/AJPH.2007.110593. PMC 2377281. PMID 18445805.
- ^ Yasiry Z, Shorvon SD (December 2012). "How phenobarbital revolutionized epilepsy therapy: the story of phenobarbital therapy in epilepsy in the last 100 years". Epilepsia. 53 Suppl 8: 26–39. doi:10.1111/epi.12026. PMID 23205960. S2CID 8934654.
- ^ López-Muñoz F, Ucha-Udabe R, Alamo C (December 2005). "The history of barbiturates a century after their clinical introduction". Neuropsychiatr Dis Treat. 1 (4): 329–43. PMC 2424120. PMID 18568113.
- ^ "Drug Abuse Control Amendments of 1965". NEJM (Editorial). 273 (22): 1222–1223. 25 November 1965. doi:10.1056/NEJM196511252732213.
Officers of the Food and Drug Administration, aware of the seriousness of the problem, estimate that approximately half the 9,000,000,000 barbiturate and amphetamine capsules and tablets manufactured annually in this country are diverted to illegal use. The profits to be gained from the illegal sale of these drugs have proved an attraction to organized crime, for amphetamine can be purchased at wholesale for less than $1 per 1000 capsules, but when sold on the illegal market, it brings $30 to $50 per 1000 and when retailed to the individual buyer, a tablet may bring as much as 10 to 25 cents.
- ^ "Sedative-Hypnotic Drugs — The Barbiturates — I". NEJM. 255 (24): 1150–1151. 1956. doi:10.1056/NEJM195612132552409.
THE barbiturates, introduced into medicine by E. Fischer and J. von Mering1 in 1903, are certainly among the most widely used and abused drugs in medicine. Approximately 400 tons of these agents are manufactured each year; this is enough to put approximately 9,000,000 people to sleep each night for that period if each were given a 0.1-gm. dose
- ^ Rosenfeld L (December 2002). "Insulin: discovery and controversy". Clin Chem. 48 (12): 2270–88. doi:10.1093/clinchem/48.12.2270. PMID 12446492.
- ^ "Leading Causes of Death, 1900-1998" (PDF). CDC.gov. Archived (PDF) from the original on 13 December 2020. Retrieved 23 July 2022.
- ^ Anderson, Robert N. (13 December 1999). "United States Life Tables, 1997" (PDF). National Vital Statistics Reports. 47 (28): 1–37. PMID 10635683. Archived from the original (PDF) on 25 October 2020. Retrieved 23 July 2022.
- ^ Sepkowitz, Kent A. (July 2011). "One hundred years of Salvarsan". N. Engl. J. Med. (Perspective). 365 (4): 291–3. doi:10.1056/NEJMp1105345. PMID 21793743.
- ^ Williams, KJ (1 August 2009). "The introduction of 'chemotherapy' using arsphenamine – the first magic bullet". J. R. Soc. Med. 102 (8): 343–348. doi:10.1258/jrsm.2009.09k036. ISSN 0141-0768. PMC 2726818. PMID 19679737.
- ^ Aminov, Rustam I. (8 December 2010). "A brief history of the antibiotic era: lessons learned and challenges for the future". Front. Microbiol. 1: 134. doi:10.3389/fmicb.2010.00134. PMC 3109405. PMID 21687759.
- ^ Hager, Thomas (2006). The Demon Under the Microscope (1st ed.). New York: Harmony Books. ISBN 978-1-4000-8213-1.
- ^ "All Nobel Prizes in Physiology or Medicine". The Nobel Prize. Retrieved 22 July 2022.
- ^ Cutler, David M.; Meara, Ellen (October 2001). Changes in the Age Distribution of Mortality Over the 20th Century (PDF) (Report). National Bureau of Economic Research. doi:10.3386/w8556. Retrieved 23 July 2022.
- ^ a b Klein, Herbert (2012). A Population History of the United States. Cambridge University Press. p. 167.
- ^ Parascandola, John (1980). The History of antibiotics: a symposium. American Institute of the History of Pharmacy No. 5. ISBN 978-0-931292-08-8.
- ^ "Diphtheria — Timelines — History of Vaccines". Archived from the original on 14 May 2016. Retrieved 24 February 2022.
- ^ Ii, Thomas H. Maugh (13 April 2005). "Maurice R. Hilleman, 85; Scientist Developed Many Vaccines That Saved Millions of Lives - Los Angeles Times". Los Angeles Times. Archived from the original on 7 November 2014.
- ^ "Significant Dates in U.S. Food and Drug Law History". Food and Drug Administration. Archived from the original on 6 March 2013. Retrieved 16 December 2019.
- ^ "FDAReview.org, a project of The Independent Institute". Archived from the original on 2 December 2015. Retrieved 24 February 2022.
- ^ "Sulfanilamide Disaster". Food and Drug Administration. Archived from the original on 25 November 2020. Retrieved 16 December 2019.
- ^ "FDA History - Part II". Food and Drug Administration. Archived from the original on 1 January 2018. Retrieved 16 December 2019.
- ^ Zaffiri L, Gardner J, Toledo-Pereyra LH (April 2012). "History of antibiotics. From salvarsan to cephalosporins". J Invest Surg. 25 (2): 67–77. doi:10.3109/08941939.2012.664099. PMID 22439833. S2CID 30538825.
- ^ Hamilton-Miller JM (March 2008). "Development of the semi-synthetic penicillins and cephalosporins". Int. J. Antimicrob. Agents. 31 (3): 189–92. doi:10.1016/j.ijantimicag.2007.11.010. PMID 18248798.
- ^ Abraham EP (1987). "Cephalosporins 1945-1986". Drugs. 34 Suppl 2 (Supplement 2): 1–14. doi:10.2165/00003495-198700342-00003. PMID 3319494. S2CID 12014890.
- ^ a b Kingston W (July 2004). "Streptomycin, Schatz v. Waksman, and the balance of credit for discovery". J Hist Med Allied Sci. 59 (3): 441–62. doi:10.1093/jhmas/jrh091. PMID 15270337. S2CID 27465970.
- ^ Nelson ML, Levy SB (December 2011). "The history of the tetracyclines". Ann. N. Y. Acad. Sci. 1241 (1): 17–32. Bibcode:2011NYASA1241...17N. doi:10.1111/j.1749-6632.2011.06354.x. PMID 22191524. S2CID 34647314.
- ^ "ERYTHROMYCIN". Br Med J. 2 (4793): 1085–6. November 1952. doi:10.1136/bmj.2.4793.1085. PMC 2022076. PMID 12987755.
- ^ Anderson, Rosaleen (2012). Antibacterial agents chemistry, mode of action, mechanisms of resistance, and clinical applications. Oxford: WiBlackwell. ISBN 9780470972458.
- ^ 연방 항생제 제조 위원회 보고서, 1958년 6월(워싱턴 D.C, 정부 인쇄국, 1958년) 98-120페이지
- ^ 연방 항생제 제조 위원회 보고서, 1958년 6월(워싱턴 D.C, 정부 인쇄국, 1958년) 277페이지
- ^ Anderson, Robert N. (13 December 1999). "United States Life Tables, 1997" (PDF). Archived (PDF) from the original on 25 October 2020. Retrieved 8 September 2017.
- ^ Cutler, David; Meara, Ellen (October 2001). "Changes in the Age Distribution of Mortality Over the 20th Century" (PDF). NBER Working Paper No. 8556. doi:10.3386/w8556. Archived (PDF) from the original on 30 July 2020. Retrieved 24 February 2022.
- ^ SWEET BH, HILLEMAN MR (November 1960). "The vacuolating virus, S.V. 40". Proc. Soc. Exp. Biol. Med. 105 (2): 420–7. doi:10.3181/00379727-105-26128. PMID 13774265. S2CID 38744505.
- ^ Shah K, Nathanson N (January 1976). "Human exposure to SV40: review and comment". Am. J. Epidemiol. 103 (1): 1–12. doi:10.1093/oxfordjournals.aje.a112197. PMID 174424.
- ^ "Studies:No Evidence That SV40 is Related to Cancer - National Cancer Institute". Archived from the original on 28 October 2014.
- ^ "History of Vaccines — A Vaccine History Project of The College of Physicians of Philadelphia". Archived from the original on 19 February 2022. Retrieved 24 February 2022.
- ^ "Prevention of Measles, Rubella, Congenital Rubella Syndrome, and Mumps, 2013". Archived from the original on 10 November 2014. Retrieved 8 September 2017.
- ^ Bloch AB, Orenstein WA, Stetler HC, et al. (1985). "Health impact of measles vaccination in the United States". Pediatrics. 76 (4): 524–32. doi:10.1542/peds.76.4.524. PMID 3931045. S2CID 6512947.
- ^ Insull W (January 2009). "The pathology of atherosclerosis: plaque development and plaque responses to medical treatment". The American Journal of Medicine. 122 (1 Suppl): S3–S14. doi:10.1016/j.amjmed.2008.10.013. PMID 19110086.
- ^ Gaddam KK, Verma A, Thompson M, Amin R, Ventura H (May 2009). "Hypertension and cardiac failure in its various forms". The Medical Clinics of North America. 93 (3): 665–80. doi:10.1016/j.mcna.2009.02.005. PMID 19427498. Retrieved 20 June 2009.
- ^ Agabiti-Rosei E (September 2008). "From macro- to microcirculation: benefits in hypertension and diabetes". Journal of Hypertension. 26 (Suppl 3): S15–21. doi:10.1097/01.hjh.0000334602.71005.52. PMID 19363848.
- ^ Murphy BP, Stanton T, Dunn FG (May 2009). "Hypertension and myocardial ischemia". The Medical Clinics of North America. 93 (3): 681–95. doi:10.1016/j.mcna.2009.02.003. PMID 19427499. Retrieved 20 June 2009.
- ^ White WB (May 2009). "Defining the problem of treating the patient with hypertension and arthritis pain". The American Journal of Medicine. 122 (5 Suppl): S3–9. doi:10.1016/j.amjmed.2009.03.002. PMID 19393824.
- ^ Truong LD, Shen SS, Park MH, Krishnan B (February 2009). "Diagnosing nonneoplastic lesions in nephrectomy specimens". Archives of Pathology & Laboratory Medicine. 133 (2): 189–200. doi:10.5858/133.2.189. PMID 19195963. Retrieved 20 June 2009.
- ^ Tracy RE, White S (February 2002). "A method for quantifying adrenocortical nodular hyperplasia at autopsy: some use of the method in illuminating hypertension and atherosclerosis". Annals of Diagnostic Pathology. 6 (1): 20–9. doi:10.1053/adpa.2002.30606. PMID 11842376.
- ^ Aronow WS (August 2008). "Hypertension and the older diabetic". Clinics in Geriatric Medicine. 24 (3): 489–501, vi–vii. doi:10.1016/j.cger.2008.03.001. PMID 18672184. Retrieved 20 June 2009.
- ^ Gardner AW, Afaq A (2008). "Management of Lower Extremity Peripheral Arterial Disease". Journal of Cardiopulmonary Rehabilitation and Prevention. 28 (6): 349–57. doi:10.1097/HCR.0b013e31818c3b96. PMC 2743684. PMID 19008688.
- ^ Novo S, Lunetta M, Evola S, Novo G (January 2009). "Role of ARBs in the blood hypertension therapy and prevention of cardiovascular events". Current Drug Targets. 10 (1): 20–5. doi:10.2174/138945009787122897. PMID 19149532. Archived from the original on 12 January 2013. Retrieved 20 June 2009.
- ^ Craig WM (1939). "Surgical Treatment of Hypertension". Br Med J. 2 (4120): 1215–9. doi:10.1136/bmj.2.4120.1215. PMC 2178707. PMID 20782854.
- ^ Sneader, Walter (2005). Drug Discovery. A History. New York: Wiley. p. 371.
- ^ Beyer KH (1993). "Chlorothiazide. How the thiazides evolved as antihypertensive therapy". Hypertension. 22 (3): 388–91. doi:10.1161/01.hyp.22.3.388. PMID 8349332.
- ^ BORHANI NO, HECHTER HH (1964). "Recent Changes in CVR Disease Mortality in California: An Epidemiologic Appraisal". Public Health Rep. 79 (2): 147–60. doi:10.2307/4592077. JSTOR 4592077. PMC 1915335. PMID 14119789.
- ^ "The Lasker Foundation - Awards". Archived from the original on 23 December 2015. Retrieved 24 February 2022.
- ^ Wright, James M.; Musini, Vijaya M.; Gill, Rupam (18 April 2018). "First-line drugs for hypertension". The Cochrane Database of Systematic Reviews. 2018 (4): CD001841. doi:10.1002/14651858.CD001841.pub3. ISSN 1469-493X. PMC 6513559. PMID 29667175.
- ^ Stason WB, Cannon PJ, Heinemann HO, Laragh JH (November 1966). "Furosemide. A clinical evaluation of its diuretic action". Circulation. 34 (5): 910–20. doi:10.1161/01.cir.34.5.910. PMID 5332332. S2CID 886870.
- ^ Black JW, Crowther AF, Shanks RG, Smith LH, Dornhorst AC (1964). "A new adrenergic betareceptor antagonist". The Lancet. 283 (7342): 1080–1081. doi:10.1016/S0140-6736(64)91275-9. PMID 14132613.
- ^ Lv J, Perkovic V, Foote CV, Craig ME, Craig JC, Strippoli GF (2012). "Antihypertensive agents for preventing diabetic kidney disease". Cochrane Database Syst Rev. 12: CD004136. doi:10.1002/14651858.CD004136.pub3. PMID 23235603.
- ^ "A brief history of the birth control pill - The pill timeline Need to Know PBS". PBS. 7 May 2010. Archived from the original on 19 January 2018. Retrieved 8 September 2017.
- ^ "Why the Oral Contraceptive Is Just Known as "The Pill"". smithsonianmag.com. Archived from the original on 28 April 2021. Retrieved 24 February 2022.
- ^ "BBC News HEALTH A short history of the pill". Archived from the original on 6 July 2021. Retrieved 24 February 2022.
- ^ "FDA's Approval of the First Oral Contraceptive, Enovid". Food and Drug Administration. Archived from the original on 23 July 2017. Retrieved 16 December 2019.
- ^ Cafe, Rebecca (4 December 2011). "BBC News - How the contraceptive pill changed Britain". BBC News. Archived from the original on 16 June 2019. Retrieved 21 June 2018.
- ^ "Brochure: The History of Drug Regulation in the United States". Food and Drug Administration. Archived from the original on 23 July 2017. Retrieved 16 December 2019.
- ^ Tobert, Jonathan A. (July 2003). "Lovastatin and beyond: the history of the HMG-CoA reductase inhibitors". Nature Reviews Drug Discovery. 2 (7): 517–526. doi:10.1038/nrd1112. ISSN 1474-1776. PMID 12815379. S2CID 3344720.
- ^ Endo A (1 November 1992). "The discovery and development of HMG-CoA reductase inhibitors". Journal of Lipid Research. 33 (11): 1569–82. doi:10.1016/S0022-2275(20)41379-3. PMID 1464741.
- ^ Endo, Akira (2004). "The origin of the statins". International Congress Series. 1262: 3–8. doi:10.1016/j.ics.2003.12.099.
- ^ Scandinaviansimvastatinsurvival (November 1994). "Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S)". Lancet. 344 (8934): 1383–9. doi:10.1016/S0140-6736(94)90566-5. PMID 7968073. S2CID 5965882.
- ^ "National Inventors Hall of Fame Honors 2012 Inductees". PRNewswire. Archived from the original on 12 May 2014. Retrieved 11 May 2014.
- ^ "How One Scientist Intrigued by Molds Found First Statin". Wall Street Journal. Archived from the original on 24 February 2022. Retrieved 11 May 2014.
- ^ "Annual Impact Report". Tufts Center for the Study of Drug Development. Archived from the original on 3 February 2022. Retrieved 24 February 2022.
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ "The Pharmaceutical Industry in Figures Key Data 2021" (PDF). European Federation of Pharmaceutical Industries and Associations. Retrieved 30 April 2022.
- ^ Outsourcing-Pharma.com. "Pfizer teams with Parexel and Icon in CRO sector's latest strategic deals". Outsourcing-Pharma.com. Archived from the original on 11 October 2013. Retrieved 24 February 2022.
- ^ "How Many New Drugs Did FDA Approve Last Year?". pharmalot.com. Archived from the original on 8 May 2011. Retrieved 23 April 2011.
- ^ "Research". Archived from the original on 20 July 2011. Retrieved 24 November 2006.
- ^ a b Perry, Susan (8 August 2012). "Donald Light and Joel Lexchin in BMJ 2012;345:e4348, quoted in: Big Pharma's claim of an 'innovation crisis' is a myth, BMJ authors say". MinnPost. Archived from the original on 11 August 2012. Retrieved 8 August 2012.
- ^ "About PhRMA - PhRMA". Archived from the original on 4 January 2013. Retrieved 23 April 2011.
- ^ "Has the Pharmaceutical Blockbuster Model Gone Bust?". bain.com. Archived from the original on 24 March 2016. Retrieved 19 May 2016.
- ^ Harper, Matthew (10 February 2012). "The Truly Staggering Cost Of Inventing New Drugs". Forbes. Archived from the original on 9 December 2020. Retrieved 8 September 2017.
- ^ IMS Health (18 June 2015). "Are European biotechnology companies sufficiently protected?". Portal of Competitive Intelligence. Archived from the original on 30 June 2015. Retrieved 27 June 2015.
- ^ Liberti L, McAuslane JN, Walker S (2011). "Standardizing the Benefit-Risk Assessment of New Medicines: Practical Applications of Frameworks for the Pharmaceutical Healthcare Professional". Pharm Med. 25 (3): 139–46. doi:10.1007/BF03256855. S2CID 45729390. Archived from the original on 6 February 2012. Retrieved 18 October 2011.
- ^ "Electronic Orange Book". U.S. Food and Drug Administration. Archived from the original on 7 April 2020. Retrieved 31 May 2007.
- ^ "The Orphan Drug Act (as amended)". U.S. Food and Drug Administration. Archived from the original on 7 April 2020. Retrieved 24 September 2007.
- ^ Gad, Shayne C., ed. (2010), "Drug Development Process and Global Pharmaceutical Marketplace", Pharmaceutical Sciences Encyclopedia, doi:10.1002/9780470571224.pse127
- ^ "Standardseite der Domain www.vfa.de" (PDF). Archived from the original (PDF) on 11 August 2016. Retrieved 24 March 2008.
- ^ Herper, Matthew & Kang, Peter (22 March 2006). "The World's Ten Best-Selling Drugs". Forbes. Archived from the original on 5 May 2006. Retrieved 31 May 2007.
- ^ "Creating Connected Solutions for Better Healthcare Performance". IMS Health. Archived from the original (PDF) on 10 May 2020. Retrieved 23 February 2022.
- ^ Kollewe, Julia (27 March 2014). "World's 10 bestselling prescription drugs made $75bn last year". the Guardian. Archived from the original on 7 April 2020. Retrieved 12 December 2016.
- ^ "Top 100 Drugs for 2013 by Sales - U.S. Pharmaceutical Statistics". Archived from the original on 31 March 2014. Retrieved 23 January 2018.
- ^ "IMS Health Forecasts 5 to 6 Percent Growth for Global Pharmaceutical Market in 2007". IMS Health. 24 October 2006. Archived from the original on 3 May 2011. Retrieved 19 June 2007.
- ^ 자주 묻는 질문(FAQ) 2013년 2월 25일 웨이백 머신에 보관
- ^ "New Drug Approvals in 2006" (PDF). March 2007. Archived from the original (PDF) on 28 February 2008. Retrieved 23 February 2008.
- ^ "Assessment of Authorized Generics in the U.S" (PDF). IMS Consulting. June 2006. Archived from the original (PDF) on 28 February 2008. Retrieved 23 February 2008.
- ^ "Sanofi Laying Off 1,700 in US". Drug Discovery & Development. Archived from the original on 11 September 2011. Retrieved 24 February 2022.
- ^ "2007 Health and Nutrition - Census" (PDF). U.S. Census Bureau. Archived (PDF) from the original on 31 July 2020. Retrieved 19 May 2016.
- ^ Goldacre, Ben (2014). Bad pharma : how drug companies mislead doctors and harm patients (First American Paperback ed.). ISBN 9780865478060.
- ^ Kaufman, Marc (6 May 2005). "Merck CEO Resigns as Drug Probe Continues". Washington Post. Archived from the original on 9 November 2020. Retrieved 23 May 2007.
- ^ "Drug Lobby Second to None: How the pharmaceutical industry gets its way in Washington". publicintegrity.org. 7 July 2005. Archived from the original on 9 June 2007. Retrieved 23 May 2007.
- ^ Moynihan, R. (29 May 2003). "Drug company sponsorship of education could be replaced at a fraction of its cost". BMJ. 326 (7400): 1163. doi:10.1136/bmj.326.7400.1163. PMC 1126044. PMID 12775595.
- ^ "Dr. No Free Lunch". Mother Jones. Archived from the original on 16 November 2020. Retrieved 19 May 2016.
- ^ Moynihan, Ray; Cassels, Alan (2005). Selling Sickness: How the Drug Companies are Turning Us All into Patients. Crows Nest, N.S.W.: Allen & Unwin. ISBN 978-1-74114-579-3.
- ^ "A Collection of Articles on Disease Mongering". Public Library of Science. Archived from the original on 7 June 2007. Retrieved 23 May 2007.
- ^ "Pharmaceutical Market Research, Trends And Analysis Reports". literated.com. Archived from the original on 19 January 2016. Retrieved 17 January 2016.
- ^ Buchkowsky, SS; Jewesson, PJ (April 2004). "Industry sponsorship and authorship of clinical trials over 20 years". Ann Pharmacother. 38 (4): 579–85. doi:10.1345/aph.1D267. PMID 14982982. S2CID 43544256.
- ^ Perlis RH, Perlis CS, Wu Y, Hwang C, Joseph M, Nierenberg AA (October 2005). "Industry sponsorship and financial conflict of interest in the reporting of clinical trials in psychiatry". Am J Psychiatry. 162 (10): 1957–60. doi:10.1176/appi.ajp.162.10.1957. PMID 16199844.
- ^ Tungaraza, T; Poole, R (July 2007). "Influence of drug company authorship and sponsorship on drug trial outcomes". Br J Psychiatry. 191 (1): 82–3. doi:10.1192/bjp.bp.106.024547. PMID 17602130.
- ^ Healy, D (2006). "The Latest Mania: Selling Bipolar Disorder". PLOS Med. 3 (4): e185. doi:10.1371/journal.pmed.0030185. PMC 1434505. PMID 16597178.
- ^ Cosgrove, Lisa; Krimsky, Sheldon; Vijayaraghavan, Manisha; Schneider, Lisa (2006). "Financial Ties between DSM-IV Panel Members and the Pharmaceutical Industry". Psychotherapy and Psychosomatics. 75 (3): 154–160. doi:10.1159/000091772. PMID 16636630. S2CID 11909535.
- ^ "Open Payments". February 2019. Archived from the original on 22 February 2022. Retrieved 24 February 2022.
- ^ Lipton, Eric; Thomas, Katie (29 May 2017). "Drug Lobbyists' Battle Cry Over Prices: Blame the Others". New York Times. Archived from the original on 20 November 2020. Retrieved 30 May 2017.
- ^ "Pricing of pharmaceuticals is becoming a major challenge for health systems". Archived from the original on 27 November 2020. Retrieved 14 November 2020.
- ^ a b Goldacre, Ben (2014). Bad pharma : how drug companies mislead doctors and harm patients (First American Paperback ed.). pp. 123–124. ISBN 9780865478060.
- ^ "Archived copy" (PDF). Office of Science and Technology Policy. Archived (PDF) from the original on 21 January 2017. Retrieved 1 March 2021 – via National Archives.
{{cite web}}: CS1 maint: 제목으로 아카이브된 복사(링크) - ^ "Financial Crimes to the Public Report 2006". FBI. 2006. Archived from the original on 29 May 2016. Retrieved 28 July 2016.
- ^ "FBI-Health Care Fraud". FBI. Archived from the original on 2 July 2016. Retrieved 28 July 2016.
- ^ "Department of Justice". Department of Justice. 19 March 2015. Archived from the original on 9 November 2014. Retrieved 22 November 2020.
- ^ Wilson, Duff (2 October 2010). "Side Effects May Include Lawsuits". The New York Times. Archived from the original on 23 June 2017. Retrieved 25 February 2017.
- ^ "GlaxoSmithKline". BBC News. 4 July 2012. Archived from the original on 17 November 2020. Retrieved 21 June 2018.
- ^ "GlaxoSmithKline Agrees to Pay $3 Billion in U.S. Drug Settlement". Bloomberg. 2 July 2012. Archived from the original on 14 May 2014. Retrieved 11 March 2017.
- ^ Mogul, Fred (2 July 2012). "NY to Get Millions in GlaxoSmithKlein Settlement". WNYC. Archived from the original on 19 April 2013. Retrieved 2 July 2012.
- ^ "BBC News -GlaxoSmithKline to pay $3bn in US drug fraud scandal". BBC Online. 2 July 2012. Archived from the original on 17 November 2020. Retrieved 2 July 2012.
- ^ Thomas, Katie & Schmidt, Michael S. (2 July 2012). "Glaxo Agrees to Pay $3 Billion in Fraud Settlement". The New York Times. Archived from the original on 2 March 2017. Retrieved 3 July 2012.
- ^ "Rapidly Increasing Criminal and Civil Penalties Against the Pharmaceutical Industry: 1991-2010". citizen.org. Archived from the original on 16 May 2016. Retrieved 19 May 2016.
- ^ Thomas, Katie; Schmidt, Michael S. (2 July 2012). "GlaxoSmithKline Agrees to Pay $3 Billion in Fraud Settlement". The New York Times. Archived from the original on 12 November 2020. Retrieved 25 February 2017.
- ^ "GlaxoSmithKline to Plead Guilty and Pay $3 Billion to Resolve Fraud Allegations and Failure to Report Safety Data". 2 July 2012. Archived from the original on 9 September 2014. Retrieved 22 November 2020.
- ^ "JUSTICE DEPARTMENT ANNOUNCES LARGEST HEALTH CARE FRAUD" (PDF). US department of Justice. Archived (PDF) from the original on 2 December 2020. Retrieved 19 May 2016.
- ^ "Abbott Labs to Pay $1.5 Billion to Resolve Criminal & Civil Investigations of Off-label Promotion of Depakote". 7 May 2012. Archived from the original on 21 August 2014. Retrieved 22 November 2020.
- ^ "#09-038: Eli Lilly and Company Agrees to Pay $1.415 Billion to Resolve Allegationsof Off-label Promotion of Zyprexa (2009-01-15)". Archived from the original on 13 March 2016. Retrieved 22 November 2020.
- ^ Drazen, Jeffrey M. (2015). "Revisiting the Commercial–Academic Interface". New England Journal of Medicine. 372 (19): 1853–1854. doi:10.1056/NEJMe1503623. PMID 25946285.
- ^ Rosenbaum, Lisa (2015). "Reconnecting the Dots — Reinterpreting Industry–Physician Relations". New England Journal of Medicine. 372 (19): 1860–1864. doi:10.1056/NEJMms1502493. PMID 25946288.
- ^ "Covid vaccine front-runners: How much they cost, who's bought them and how they're stored". CNBC. 17 November 2020. Archived from the original on 1 December 2020. Retrieved 2 December 2020.
- ^ Henninger, Daniel (2 December 2020). "Opinion Pharma Deserves the Nobel Peace Prize for the Covid Vaccines". Wall Street Journal. Archived from the original on 3 February 2021. Retrieved 4 December 2020.
- ^ a b "No profiteering on COVID-19 drugs and vaccines, says MSF". Médecins Sans Frontières (MSF) International. Archived from the original on 26 November 2021. Retrieved 22 April 2020.
- ^ Mazzucato, Mariana; Momenghalibaf, Azzi (18 March 2020). "Drug Companies Will Make a Killing From Coronavirus". The New York Times. Archived from the original on 23 November 2020. Retrieved 22 April 2020.
- ^ "HHS, DOD Collaborate with Regeneron on Large-Scale Manufacturing Demonstration Project of COVID-19 Investigational Therapeutic Treatment". 6 July 2020. Archived from the original on 18 December 2020. Retrieved 2 December 2020.
- ^ "COVID-19 Vaccines". 12 December 2020. Archived from the original on 19 December 2020. Retrieved 2 December 2020.
- ^ a b Lupkin, Sydney (24 March 2020). "FDA Grants Experimental Coronavirus Drug Benefits For Rare Disease Treatments". NPR. Archived from the original on 14 December 2020. Retrieved 24 March 2020.
- ^ a b c Conley, Julia (24 March 2020). "'This Is a Massive Scandal': Trump FDA Grants Drug Company Exclusive Claim on Promising Coronavirus Drug". Common Dreams. Archived from the original on 8 December 2020. Retrieved 22 April 2020.
- ^ Boodman, Eric (18 May 2020). "Gilead ups its donation of the Covid-19 drug remdesivir for U.S. hospitals". statnews.com. Archived from the original on 20 December 2020. Retrieved 19 July 2020.
- ^ Lawson, Alex (25 March 2020). "Don't Let Big Pharma Make a Killing by Profiteering Off COVID-19 Treatments". Common Dreams. Archived from the original on 9 November 2020. Retrieved 22 April 2020.
- ^ "Gilead Sciences Statement on Expanding Global Supply of Investigational Antiviral Remdesivir Gilead". Archived from the original on 11 December 2020. Retrieved 16 July 2020.
- ^ 예를 들어 't Hoen, Ellen'을 참조하십시오."TRIPS, 의약품 특허 및 필수 의약품 접근:시애틀에서 도하까지 먼 길.Chicago Journal of International Law, 27(43), 2002; Musungu, Sisule F. 및 Cecilia Oh. "개도국의 TRIPs 유연성 활용:그들이 약에 접근할 수 있을까요?"지적재산권, 혁신 및 공중보건에 관한 위원회, WHO, 2005.
- ^ "Declaration on the TRIPS agreement and public health". World Trade Organization. Archived from the original on 20 June 2016. Retrieved 19 May 2016.
- ^ 의약품 제조자 협회 v. 남아프리카공화국 대통령(PMA), 2002년 (2) SA 674(CC) (S. Africa).
- ^ Helfer, Laurence R.; Austin, Graeme W. (7 March 2011). Human Rights and Intellectual Property: Mapping the Global Interface. Cambridge University Press. pp. 145–148. ISBN 978-1-139-49691-9. Archived from the original on 16 November 2020. Retrieved 28 July 2016.
- ^ "GlaxoSmithKline to 'drop patents in poor countries for better drug access'". BBC News. Archived from the original on 9 November 2020. Retrieved 19 May 2016.
- ^ "Bumper Year for Corporate Donations Reveals Profit Motives". corpwatch.org. Archived from the original on 11 November 2017. Retrieved 24 February 2022.
- ^ "Merk". Archived from the original on 26 August 2006. Retrieved 30 August 2006.
- ^ "Pfizer Will Donate Fluconazole to South Africa". Archived from the original on 24 October 2010. Retrieved 30 August 2006.
- ^ "Corporate Responsibility: Novartis". novartis.com. Archived from the original on 1 September 2017. Retrieved 19 May 2016.
외부 링크
 Wikiquote 제약업계 관련 인용문
Wikiquote 제약업계 관련 인용문- "Global Medicines Use in 2020". IMS Institute for Healthcare Informatics. November 2015.
- "The pharmaceutical industry and global health - Facts & figures 2017" (PDF). International Federation of Pharmaceutical Manufacturers & Associations. February 2017.
- "Licensing Agreements in the Pharmaceutical Industry".
- "The Pharmaceutical Industry in Figures - Key Data 2018" (PDF). European Federation of Pharmaceutical Industries and Associations.





