유행성 이하선염
Mumps| 유행성 이하선염 | |
|---|---|
| 기타 이름 | 유행성 이하선염 |
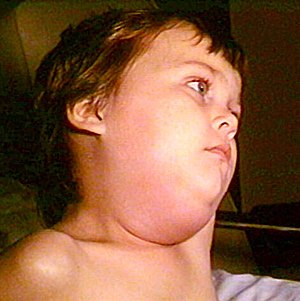 | |
| 유행성 이하선염이 있는 아이 | |
| 전문 | 전염병 |
| 증상 | 이하선염 및 발열, 두통, 불쾌감, 근육통, 식욕부진 등의 비특이적 증상 |
| 합병증 | 난청, 난청, 난청, 췌장염 등의 염증성 질환 및 드물게 불임 |
| 통상적인 개시 | 노출 후 7~25일 후 |
| 지속 | 보통 2주 미만 |
| 원인들 | 유행성 이하선염 바이러스 |
| 위험요소 | 유행성 이하선염에 걸린 사람에 대한 노출 |
| 진단 방법 | 항체검사, 바이러스 배양 및 역전사 중합효소 연쇄반응 |
| 예방 | 예방 접종 |
| 치료 | 지원하는 |
| 약 | 진통제, 정맥내 면역글로불린 |
| 예후 | 보통 우수, 10,000명당 1.6~3.8명의 사망률 |
| 빈도수. | 소아기 및 예방접종을 하지 않는 국가에서 가장 흔합니다. |
유행성 이하선염은 유행성 이하선염 바이러스에 의해 생기는 바이러스성 질환이다.초기 증상은 비특이적이며 발열, 두통, 불쾌감, 근육통, 식욕부진을 포함한다.이러한 증상들은 대개 감염의 가장 흔한 증상인 이하선염이라고 불리는 고통스런 부종이 뒤따른다.증상은 보통 바이러스에 노출된 후 16~18일 후에 발생하며 2주 이내에 해결됩니다.감염의 약 3분의 1은 증상이 없다.
합병증에는 난청과 광범위한 염증 질환이 포함되는데, 이 중 고환, 가슴, 난소, 췌장, 수막, 뇌의 염증이 가장 흔하다.고환염은 생식력 저하와 드물게 불임증을 초래할 수 있다.
인간은 파라믹소바이러스과의 RNA 바이러스인 유행성 이하선염 바이러스의 유일한 자연 숙주이다.이 바이러스는 주로 비말과 침과 같은 호흡기 분비물과 감염된 사람과의 직접적인 접촉을 통해 전염된다.유행성 이하선염은 전염성이 매우 높고 인구 밀도가 높은 환경에서 쉽게 퍼진다.증상이 나타나기 1주일 전부터 8일 후까지 전염될 수 있다.감염 중에, 바이러스는 먼저 상기도에 감염된다.거기서 침샘과 림프절까지 퍼집니다.림프절 감염은 혈액 내 바이러스의 존재로 이어져 바이러스가 몸 전체로 퍼진다.유행성 이하선염 감염은 보통 자가 제한적이며 면역체계가 감염을 제거하면서 끝이 난다.
유행성 이하선염은 임상 증상에 따라 진단할 수 있습니다.그러나 유행성 이하선염이 덜 흔한 곳에서는 항체 검사, 바이러스 배양 또는 실시간 역전사 중합효소 연쇄 반응을 이용한 실험실 진단이 필요할 수 있습니다.유행성 이하선염에 대한 특별한 치료법이 없기 때문에 치료에는 기본적으로 도움이 되며, 침대 휴식과 통증 완화가 포함됩니다.사망과 장기 합병증이 드물기 때문에 예후는 대개 양호하며 완치된다.감염은 개별 유행성 이하선염 백신 또는 홍역과 풍진으로부터 보호하는 MMR 백신과 같은 혼합 백신을 통해 예방할 수 있습니다.감염된 사람을 격리함으로써 질병의 확산을 막을 수도 있다.
유행성 이하선염은 역사적으로 매우 널리 퍼진 질병으로, 밀집된 장소에서 흔히 발병한다.예방접종이 없는 경우, 감염은 보통 5-9세에 가장 자주 소아기에 발생한다.증상과 합병증은 남성에게서 더 흔하고 청소년과 성인에게서 더 심각하다.감염은 온대 기후에서 겨울과 봄에 가장 흔하지만 열대 지방에서는 계절성이 관찰되지 않는다.유행성 이하선염에 대한 기록은 고대부터 존재해 왔으며 유행성 이하선염의 원인인 유행성 이하선염 바이러스가 1934년에 발견되었다.1970년대까지, 감염으로부터 보호하기 위해 백신이 만들어졌고, 유행성 이하선염 예방 접종을 채택한 국가들은 이 병이 거의 없어졌다.그러나 21세기 들어 백신 면역력 저하와 백신 [1]접종에 대한 반대 등 여러 요인으로 인해 많은 국가에서 주로 청소년과 젊은 층에서 예방접종을 하는 사례가 다시 증가하고 있다.
징후 및 증상
일반적인 증상
잠복기는 감염이 시작되고 증상이 나타나기 시작하는 시점까지 [2][3]약 7-25일로 평균 [4]16-18일이다.감염의 20-40%[5]는 증상이 없거나 가벼운 호흡기 증상(때로는 열이 있음)[6][7]으로 제한된다.병의 경과에 따라, 세 가지 뚜렷한 단계가 인식된다: 프로드로말, 초기 급성, 그리고 확립 급성.전단계는 전형적으로 저열, 두통, 불안감, 근육통, 식욕부진, [6][8][9]인후통 등 비특이적이고 가벼운 증상을 보인다.초기 급성 단계에서는 유행성 이하선염 바이러스가 전신으로 퍼지면서 전신 증상이 나타난다.가장 흔하게 이 시기에 이하선염이 발생한다.확립된 급성 단계에서는 난초염, 수막염, 뇌염이 발생할 수 있으며 이러한 질환이 유행성 이하선염의 [6]대부분을 차지한다.
이하샘은 귀 앞 입가에 위치한 침샘이다.이하선염이라고 불리는 이들의 염증은 가장 흔한 유행성 이하선염 증상이며 증상 사례의 [10]약 90%와 [11]전체 감염의 60-70%에서 발생한다.유행성 이하선염이 발생하는 동안, 대개 왼쪽과 오른쪽 이하선 모두 [11]통증이 있는 붓기를 경험하며,[7] 적은 비율의 사례에서 일방적인 붓기를 경험합니다.이하선염은 바이러스에 노출된 후 2-3주, 증상이 나타난 후 2-3일 이내에 발생하며 보통 2-3일 정도 지속되지만 1주일 이상 [6][8]지속될 수 있다.
이하선염의 90%는 양쪽이 동시에 [11]붓는 것보다 한쪽이 붓는 것이 지연된다.구강샘에서 입으로 타액을 공급하는 구멍인 구강관은 붉어지고 붓고 액체로 채워질 수 있다.구내염은 대개 국소적인 압통을 동반하며 때때로 귀앓이를 [3][12]동반한다.다른 침샘, 즉 턱밑샘과 설하샘도 부어오를 수 있다.이러한 분비선의 염증이 유일한 [6]증상인 경우는 드물다.
합병증
침샘 밖에서는 난초염이라고 불리는 고환의 염증이 가장 흔한 증상 감염이다.고환의 통증, 붓기, 따뜻함은 보통 이하선염 발병 후 1~2주[13] 후에 나타나지만 최대 6주 후에 발생할 수 있다.유행성 이하선염 난치염 중에는 음낭이 부드럽고 염증이 생긴다.유행성 이하선염에 걸리는 사춘기 및 사춘기 이후 남성의 10-40%에서 발생한다.보통 유행성 이하선염 난염은 한 고환에만 영향을 미치지만 10-30%[13]의 경우 모두 영향을 받는다.유행성 이하선염은 부고환이라고 불리는 부고환의 염증을 동반하며, 보통 난염 전에 발생한다.유행성 이하선염 난염의 발병은 고열, 구토, 두통, [6][11]불안과 관련이 있다.사춘기 전 남성의 경우 증상이 대개 이하선염으로 [11]제한되기 때문에 난초염은 드물다.
이하를 [6]포함한 다양한 염증성 질환이 유행성 이하선염 바이러스 감염의 결과로 발생할 수도 있습니다.
- 유방염, 유방의 염증, 사춘기[14] 후 여성의 약 30%
- 난소염인 난소염은 보통 골반통으로 나타나는 후포후 여성의 5~10%에서 발생한다.
- 무균성 수막염, 수막의 염증은 환자의[15] 5~10%와 이하선염 환자의 4~6%에서 발생하며, 일반적으로 증상이 시작된 후 4~10일 후에 발생한다.유행성 이하선염은 또한 이하선염이 없는 경우뿐만 아니라 이하선염 1주일 전까지도 발생할 수 있다.발열, 두통, 구토, 목 [16]경직 등을 동반한다.
- 췌장염, 췌장염은 약 4%로 갈비뼈 아래 상복부에 심한 통증과 압통을 일으킵니다
- 뇌의 염증인 뇌염은 [15]0.5% 미만이었습니다.유행성 이하선염 뇌염을 경험한 사람들은 전형적으로 열, 의식 변화, 발작, 그리고 쇠약함을 경험한다.뇌수막염과 마찬가지로 이하선염이 [16]없을 때 유행성 이하선염이 발생할 수 있다.
- 뇌수막염, 뇌와 주변 막의 염증.유행성 이하선염 뇌염은 보통 97%가 발열, 94%가 구토, 88.8%가 [17]두통을 동반한다.
- 신장염, 신장의 염증. 보통 유행성 이하선염에 신장이 관여하는 것은 양성이지만 소변에 바이러스가 존재하기 때문에 드물다.
- 최소한 다섯명 관절에 영향을 미칠 것 관절(관절염)의 염증은 말초 신경계에 담석증(acalculous 담낭염), 각막과 안구 혈관막(keratouveitis), thyroids(갑상선 염), 간(간염), 망막(망막염), 그리고 corneal 없이(다발성 신경염), pneumonia,[3]gallblader 여러 신경(다발성 관절염)[18].endoth모두 희귀한[6][14] 용골(각막내피염)
- 재발성 시상막염, 침샘의 염증, 빈발[3]
비교적 흔한 합병증은 난청으로,[10] 약 4%의 사례에서 발생한다.유행성 이하선염 난청은 종종 현기증과 같은 전정 증상을 동반하고 반복적이고 통제되지 않는 눈동자의 움직임을 동반한다.MuV는 심전도 이상에 근거해 심장 조직에도 감염될 가능성이 높지만, 일반적으로는 증상이 없다.드물게 심근염과 심막염이 발생할 수 있다.수두증이라고 불리는 뇌의 체액 축적도 [6][16]관찰되었다.임신 초기 3개월에는 유행성 이하선염이 유산의 위험을 증가시킬 수 있다.그렇지 않으면 유행성 이하선염은 선천성 [12][14]기형과 관련이 없습니다.
감염의 다른 희귀한 합병증:마비, 발작, 뇌신경 palsies, 소뇌 실조증, 횡단성 척수염 상행 다발성 신경근염,polio-like 병, 관절증, 자가 면역성 용혈 anemia,[6]에는 특발성 혈소판 감소성 자반증, Guillain–Barré 증후군,post-infectious encephalitis[14]encephalomyelitis,[18]과 단을 포함한다.ophagocytic 신드롬[11]사례의 최대 42%[11]에서 유행성 이하선염 증상과 함께 적어도 하나의 합병증이 발생한다.유행성 이하선염은 또한 제1형 당뇨병의 시작과 관련이 있으며, 이와 관련하여 유행성 이하선염 바이러스는 인슐린을 생성하는 베타 [19]세포에서 감염 및 복제를 할 수 있다.어린이들 사이에서 발작은 중추신경계와 [12]관련된 사례의 약 20-30%에서 발생한다.
원인
유행성 이하선염은 유행성 이하선염 바이러스(MuV)에 의해 발생하는데,[20] 이는 파라믹소바이러스과에 속하는 오르토루불라바이러스속이다.인간은 유행성 이하선염 바이러스의 유일한 자연 숙주이다.MuV의 게놈은 RNA로 구성되어 있으며 9개의 단백질을 코드하는 7개의 유전자를 포함하고 있다.MuV 입자의 게놈은 나선형 캡시드로 둘러싸여 있다.캡시드는 표면에서 돌출된 스파이크를 가진 바이러스 외피로 둘러싸여 있습니다.MuV 입자는 다형상으로 [6][21][22]지름이 100~600나노미터에 이른다.
MuV의 복제 주기는 표면에 있는 스파이크가 세포에 결합할 때 시작되는데, 이것은 외피를 숙주 세포의 세포막과 융합시켜 캡시드를 숙주 세포의 [6][23][24]세포질로 방출시킵니다.바이러스 RNA의존성 RNA중합효소(RdRp)는 게놈에서 메신저 RNA(mRNA)를 전사하여 숙주세포의 리보솜에 의해 바이러스 단백질을 합성한다.RdRp는 [6][24]그 후 자손을 생산하기 위해 바이러스 게놈 복제를 시작한다.바이러스 스파이크 단백질은 숙주 세포의 막에 융합되고,[6][23][24] 스파이크 아래의 부위에 새로운 바이러스들이 형성된다.그리고 나서 MuV는 숙주 세포 단백질을 이용하여 숙주 세포의 표면에서 싹을 틔움으로써 숙주 세포를 떠나게 하고, 숙주 세포의 막을 바이러스 [23]외피로 사용합니다.
MuV의 12가지 유전자형이 인식되며, E와 M을 제외한 A에서 N으로 명명된다.이러한 유전자형은 지역에 따라 빈도가 다르다.예를 들어, 유전자형 C, D, H, J는 서반구에서 더 흔하지만, 유전자형 F, G, I는 전지구적인 유전자형으로 간주되지만, 아시아에서는 더 흔하다.유전자형 A와 B는 1990년대 이후 야생에서 관찰되지 않았다.MuV는 오직 하나의 혈청형을 가지고 있기 때문에, 하나의 유전자형에 대한 항체는 모든 유전자형에 [10]대해 기능합니다.MuV는 비교적 안정적인 바이러스이며 새로운 변종이 [3]출현할 수 있는 항원 이동을 경험하지 않을 것으로 보인다.
전송
유행성 이하선염 바이러스는 주로 호흡기 방울이나 분비물에 흡입하거나 경구 접촉함으로써 전염된다.실험에서 유행성 이하선염은 구강이나 코를 통해 접종한 후에 생길 수 있다.호흡기 전염은 또한 이하선염이 없는 호흡기 질환의 경우, 비강 검체에서의 검출, 밀접하게 [6]접촉하는 사람 간의 전염에 의해 지원됩니다.MuV는 증상이 나타나기 약 1주일 전부터 [2]8일 후까지 침으로 배설되며, 이하선염이 [5]발병할 때 정점에 달하지만 증상이 없는 개인의 [6]침에서도 확인되었다.
모자간 전염은 다양한 형태로 관찰되고 있다.인간 이외의 영장류에서 태반 전염이 관찰되었으며, 이는 모성 이하선염 동안 자발적이고 계획적으로 낙태된 태아로부터 MuV를 분리함으로써 뒷받침된다.또한 MuV는 산모가 감염된 신생아로부터 격리되었다.MuV는 모유에서 검출되었지만,[6] 바이러스가 모유를 통해 전염될 수 있을지는 불분명하다.다른 전염 방법으로는 감염된 물방울이나 침과의 직접 접촉, 타액에 의해 오염된 자극, 그리고 가능한 [5][11][13]소변이 있습니다.대부분의 전염은 증상이 나타나기 전, 그리고 그 [5]후 최대 5일 후에 발생합니다.
민감한 모집단에서는 단일 케이스가 최대 12개의 새로운 케이스를 유발할 수 있습니다.사람이 전염되는 기간은 증상이 나타나기 2일 전부터 증상이 멈춘 후 9일까지이다.유행성 이하선염 바이러스의 무증상 보균자도 바이러스를 [11]전염시킬 수 있다.이러한 요소들이 유행성 이하선염의 확산을 통제하기 [6]어려운 이유라고 생각된다.또한 자연감염이나 예방접종 [10]후 재감염이 발생할 수 있어 감염 [15]후 평생 면역이 보장되지 않는다.예방접종을 받은 사람들은 예방접종을 [5]받지 않은 사람들보다 덜 전염되는 것으로 보인다.
기본 재생산 번호라 불리는 민감한 모집단의 단일 사례에서 발생한 새로운 사례의 평균 수는 4-7이다.이를 감안할 때 집단 면역성을 달성하기 위해서는 79~100%의 예방접종률이 필요한 것으로 추정된다.그러나 예방접종률이 90%를 넘는 곳에서 발병률이 계속 발생하고 있어 다른 요인이 질병 전파에 영향을 미칠 수 있음을 시사한다.이러한 예방접종 지역에서 발생한 발병은 학교나 [25]군 기숙사와 같이 매우 붐비는 지역에서 주로 발생한다.
병인 발생
유행성 이하선염의 병인에 대한 많은 측면은 잘 이해되지 않으며 주로 질병의 임상적 특징과 실험실 동물에서의 실험적인 감염의 관찰에 기초하여 추론된다.이러한 동물 연구는 부자연스러운 [6]접종 방법을 포함한 여러 가지 이유로 인해 신뢰할 수 없을 수 있습니다.노출 후, 바이러스는 표면에 있는 시알산 수용체를 발현하는 상부 호흡기의 상피 세포를 감염시킨다.초기 감염 후 바이러스는 이하선으로 확산되어 특징적인 이하선염을 [16]일으킨다.감염 직후 바이러스가 림프절, 특히 T세포로 퍼지는 것으로 생각되는데,[2][6] 이는 바이러스혈증이라고 불리는 혈액 내 바이러스의 존재를 초래한다.바이러스 감염은 7-10일 동안 지속되며, 이 기간 동안 MuV는 [11]몸 전체로 퍼집니다.
유행성 이하선염 난초염에서 감염은 실질 부종, 정관 충혈 또는 분리, 그리고 림프구에 의한 혈관주위 침윤으로 이어진다.튜니카 알부기니아는 부종에 대한 장벽을 형성하여 정관 괴사를 일으키는 자궁 내압의 증가를 일으킨다.정관도 히알린화(hyalinization), 즉 반투명 유리 같은 물질로 변성되어 고환의 [11][13]섬유화와 위축을 일으킬 수 있습니다.
사례의 절반까지, MuV는 뇌수막염, 뇌염 또는 수두증을 일으킬 수 있는 중추신경계에 침투합니다.유행성 이하선염은 거의 치명적이지 않기 때문에 CNS 관련 분석을 위한 사후 분석은 거의 이루어지지 않았습니다.이 중 뇌 내 수분 축적, 충혈, 출혈, 뇌 혈관 주변 공간 백혈구 침투, 신경교세포에 대한 반응적 변화, 뉴런 주변 미엘린 칼집 손상 등이 관찰됐다.뉴런은 비교적 영향을 [6]받지 않는 것으로 보인다.
설치류에 대한 실험실 테스트에서 MuV는 먼저 뇌척수액(CSF)을 통해 CNS로 들어간 후 심실 시스템으로 확산되는 것으로 보입니다.거기서, MuV는 뇌실에 늘어선 상피세포에서 복제되는데, 이것은 바이러스가 뇌실질로 들어갈 수 있게 해준다.이것은 종종 대뇌피질과 해마의 피라미드 세포를 MuV로 감염시킨다.감염된 상완세포는 염증을 일으켜 섬모를 잃고 CSF로 붕괴되는데, 이것이 유행성 이하선염 수두증을 [6]일으키는 것으로 생각되는 뇌수관이 좁아지는 원인일 수 있다.
사람에게서 유행성 이하선염 수두증은 측심실 및 제3심실 확장과 함께 뇌수관 폐쇄, 심실간공 폐쇄 또는 중앙 및 측방 개구부의 폐쇄에 기인할 수 있다.후두엽세포는 유행성 이하선염 환자의 CSF로부터 분리되어 동물과 인간이 수두증 발생을 공유한다는 것을 시사한다.그러나 수두증은 관 폐색이 없는 경우에도 관찰되었으며, 이는 폐색이 부종 조직에 의한 외부 압박의 결과일 수 있으며 [6]수두증과는 관련이 없음을 나타낸다.
유행성 이하선염으로 인한 난청은 내이의 주변 림프와 접촉하여 달팽이관 감염으로 이어질 수 있는 CSF의 MuV 감염에 의해 발생할 수 있으며, 내이에 염증을 일으키는 바이러스 감염의 결과로 발생할 수 있다.난청은 면역반응에 의해 간접적으로 발생할 수도 있다.동물 연구에서,[6] MuV는 종종 청각장애와 함께 발생하는 현기증과 같은 전정 증상을 설명할 수 있는 전정 신경절에서 분리되었습니다.
면역 반응
MuV는 혈청형이 1개뿐이지만 체외에서 다른 유전자형을 중화하는데 필요한 유전자형 특이 혈청량의 유의한 변화가 [15][26]관찰되었다.침샘의 항체를 중화시키는 것은 [2]타액을 통한 MuV 복제 및 전달을 제한하는데 중요할 수 있다. 타액 내 바이러스 분비 수준은 생성된 MuV 특이 IgA의 양과 반비례하기 때문이다.타액 IgA의 중화능력은 혈청 IgG 및 [5]IgM보다 큰 것으로 보인다.
예방접종에서 증상 감염은 예방접종의 결과로 생성된 기억 T 림프구가 필요하지만 보호에는 불충분하기 때문일 수 있다고 제안되었다.면역체계는 일반적으로 유행성 이하선염 바이러스에 대해 상대적으로 약한 반응을 보이는 것으로 보이며, 항체 생산은 주로 비중화 바이러스 단백질을 향하는 것으로 보이며, MuV 특이 기억 B 림프구가 적을 수 있다.면역력을 부여하는 데 필요한 항체의 양은 알려지지 않았다.[15]
진단.
유행성 이하선염이 유행하는 장소에서는 이하선염의 발병과 유행성 이하선염에 걸린 사람에 대한 피폭 이력을 바탕으로 진단할 수 있다.유행성 이하선염은 다른 원인이 있기 때문에 유행성 이하선염 [10]감염을 확인하기 위해 검사실 진단이 필요할 수 있다.알레르기 반응, 유방염, 홍역, 소아 HIV 감염 및 [3]풍진을 포함한 다른 질병과 증상을 비교하기 위해 차등 진단을 사용할 수 있습니다.MuV는 증상 [11]발생 후 1주일 이내에 타액, 혈액, 비인두, 침관,[8] 그리고 정액으로부터 세포 [10]배양으로부터 분리될 수 있다.뇌수막염의 경우,[16] MuV는 CSF로부터 분리될 수 있다.CNS경우, 요추 천자는 정상적인 개방 입방 mm당보다 10백혈구 pressure,[12] 보여 준다 다른 잠재적인 causes,[14], CSF에 높은 림프구 수, 시간의 25%까지 다 형 핵의 백혈구를 배제하기 위해, 종종 약간 높은 단백질 수준,며 약간 줄어드포도당 비율의 30%를 사용할 수 있다.time.[16]
혈청 또는 경구액 검체의 유행성 이하선염 특이 IgM 항체를 사용하여 유행성 이하선염을 식별할 수 있다.IgM의 양은 [10]증상 시작 후 최대 8일까지이며, IgM은 증상 시작 후 7~10일 후 효소연계면역흡수측정(ELISA)에 의해 측정될 수 있다.IgM 테스트에 대한 민감도는 가변적이며, 첫 주에 24~51%[11]에서 75%, [12]이후 100%까지 다양합니다.감염을 통해 IgM titres는 급성기와 [11]회복기 사이에 4배 증가한다.잘못된 음성은 이전에 감염되었거나 예방접종을 받은 사람에게 발생할 수 있으며, 이 경우 혈청 IgG가 증가하면 진단에 더 유용할 수 있습니다.잘못된 양성반응은 파라인플루엔자 바이러스 1, 3과 뉴캐슬병 바이러스 감염 후와 최근 유행성 이하선염 예방접종 [8][18]후 발생할 수 있다.
보체고정시험, 혈중응집측정,[16] 중화시험을 통해 항체타이터를 측정할 수도 있다.백신 접종자의 경우 급성상 혈청 샘플에서 IgM이 검출되지 않는 경우가 많기 때문에 항체 기반 진단이 어려울 수 있다.이러한 경우 구강액, 목 면봉 또는 [10]소변에서 MuV RNA를 식별하는 것이 더 쉽습니다.뇌수막염의 경우, MuV 특이 IgM은 CSF의 절반에서, IgG는 30-90%에서 발견될 수 있으며, 백혈구 수가 증가하면 1년 이상 지속되기도 한다.이러한 발견들은 [12][18]장기 합병증의 위험 증가와 관련이 없다.대부분의 이하선염 사례들은 [16]CSF의 백혈구 수를 증가시킨다.
실시간 역전사 중합효소 연쇄반응(rRT-PCR)은 증상이 나타난 첫날부터 MuV RNA를 검출하기 위해 사용될 수 있으며, 이후 [10]8-10일 동안 감소한다. 타액의 rRT-PCR은 일반적으로 이하선염이 발생하기 2~3일 전부터 4-5일 전까지 양성이며 민감도는 [18]약 70%이다.콩팥에서 MuV가 복제되기 때문에 소변에서 바이러스를 식별하는 데 사용되는 rRT-PCR은 바이러스 배양률이 30%[18] 미만으로 매우 낮지만 증상이 시작된 [12]후 2주까지 바이러스 배양과 소변에서 RNA 검출을 진단에 사용할 수 있다.뇌수막염의 경우, 중첩 RT-PCR은 감염 [12]후 최대 2년까지 CSF에서 MuV RNA를 검출할 수 있다.
시아다인염의 경우 침샘의 확대, 지방 연선, 목 앞쪽에 위치한 경추근막과 평판근육의 비후화를 영상으로 확인할 수 있다.한 쪽에서만 이하선염이 발생하는 경우 진단을 [7]위해 유행성 이하선염 특이 IgM 항체, IgG 역자 또는 PCR의 검출이 필요하다.췌장염의 경우, 침과 췌장에서 [12][16][27][28]발견되는 효소인 리파아제나 아밀라아제 수치가 높아질 수 있습니다.
유행성 이하선염은 보통 백혈구 수치에 의해 진단되며 백혈구 수치에 따라 정상 차이가 난다.전체 혈액 수치는 평균 백혈구 수보다 크거나 낮을 수 있으며 C 반응성 단백질 수치가 상승할 수 있습니다.소변 분석은 세균 감염을 배제할 수 있다.정상적인 소변 분석, 음의 요도 배양, 음의 중간 소변에서 난치염이 나타난다면 유행성 이하선염일 수 있습니다.초음파는 일반적으로 확산성 고혈관계, 고환 및 부고환의 부피 증가, 초음파 신호 복귀 능력보다 낮음, 부고환의 붓기, 그리고 하이드로셀의 형성을 보여준다.초음파만 하는 것보다 에코 컬러 [11]도플러 초음파가 난초염을 발견하는 데 더 효과적입니다.
예방
| 백신 | 부담 | MMR(V) |
|---|---|---|
| MMR II | 제릴 린 | MMR |
| 모루파 | 우라베 AM9 | MMR |
| 프리픽스 | 제릴 린 RIT 4385 | MMR |
| 트리모박스 | 우라베 AM9 | MMR |
| 트리비라텐 | 루비니 | MMR |
| 프리오릭스-테트라 | 제릴 린 RIT 4385 | MMRV |
| ProQuad | 제릴 린 | MMRV |
유행성 이하선염은 예방접종으로 예방할 수 있다.유행성 이하선염 백신은 살아있는 약독성 [3]바이러스를 사용한다.대부분의 국가에서 유행성 이하선염 예방접종을 접종 프로그램에 포함시키고 있으며 홍역과 풍진도 예방하는 MMR 백신이 가장 일반적으로 사용되는 유행성 이하선염 [10]백신이다.유행성 이하선염 예방접종은 홍역, 풍진, 수두, 대상포진에 대한 예방을 제공하는 MMRV 백신의 일부로서 자체적으로도[29] 할 수 있다.120개국 이상이 유행성 이하선염 예방접종을 채택했지만, 대부분의 아프리카, 남아시아, 동남아시아 [26]국가들에서 적용 범위가 여전히 낮습니다.유행성 이하선염 예방접종을 시행한 국가에서는 유행성 이하선염 환자 및 뇌염 등의 감염에 의한 합병증이 [10]현저하게 감소하고 있다.유행성 이하선염 백신은 일반적으로 유아기에 투여되지만, 필요하다면 [8][26][30]청소년기와 성인기에 투여될 수도 있다.백신 접종은 백신에 포함되지 않은 야생형 MuV를 [15]중화시킬 수 있을 것으로 기대된다.
유행성 이하선염 백신에는 제릴 린(JL), 레닌그라드-3, 레닌그라드-3-자그레브(L-Zagreb), 루비니(Rubini), 우라베 AM9(Urabe AM9) 등 다양한 바이러스 변종이 사용되고 있다.일반적으로 개별 국가에 국한된 일부 덜 두드러진 변종들이 존재한다.일본에서 생산된 호시노, 미야하라, 도리이, NK M-46 품종과 [2][31]이란이 사용하는 S-12 품종 등이 이에 해당한다.발열과 [8]발진을 포함한 가벼운 부작용은 비교적 흔하지만 무균성 뇌수막염도 다양한 [2][31]비율로 발생한다.다른 드문 부작용으로는 뇌수막염, 이하선염, 내이 손상으로 인한 청각장애, 난초염,[18] 췌장염 등이 있다.안전성과 효과는 [2][31]백신 종류에 따라 다릅니다.
- 루비니는 안전하지만 발병 시 효과가 낮기 때문에 사용이 중단되었습니다.
- JL은 비교적 안전하고 효과가 높다.그러나 발병의 효과는 현저히 낮다.JL 백신의 변형 버전은 RIT 4385이며, 이 또한 안전하다고 여겨진다.
- 우라베와 레닌그라드-3는 둘 다 적어도 JL만큼 효과적이지만 안전성은 떨어진다.
- 레닌그라드 3호의 변형 버전인 L-Zagreb는 발병을 포함하여 안전하고 효과적인 것으로 간주됩니다.
MMR 백신에 의한 유행성 이하선염 예방은 1회보다[32] 2회 투여 후 더 높으며 홍역 및 풍진에 대한 예방 정도보다 낮은 79~95%로 추정된다.그러나 이는 백신 접종을 하는 국가에서 유행성 이하선염을 거의 제거할 수 있을 뿐만 아니라 백신 [15]접종자들 사이의 합병증의 빈도를 크게 줄이기에 여전히 충분했다.적어도 1개의 선량이 수신되면,[26] 감염자 중에서 입원율이 약 50% 감소한다.MMR 백신에 비해 MMRV 백신은 유행성 이하선염 [33]예방 효과가 낮은 것으로 보인다.백신 효과를 평가하는 데 어려움이 있는 것은 면역의 명확한 상관관계가 없기 때문에 [15]백신으로부터 면역이 획득되었는지 여부를 예측할 수 없다는 것이다.
MMR 백신의 세 번째 복용량의 효과에 대한 데이터가 부족하다.세 번째 선량이 투여된 발병에서, 그것이 질병 발생률을 감소시키는 데 어떤 효과가 있는지는 불분명했고,[15] 이전에 유행성 이하선염에 대한 항체가 거의 없거나 전혀 없었던 사람들에서만 항체를 증가시키는 것으로 나타났다.유행성 이하선염 백신에 대한 금기사항은 성분 또는 네오마이신, 임신, 면역억제, 중간 또는 중증의 질병, 최근 혈액제제 투여, 특히 MMRV 백신의 경우 [8]발작의 개인 또는 가족력을 포함한다.또한 여성은 MMR 백신 [30]접종 후 4주 동안은 임신하지 않는 것이 좋습니다.유행성 이하선염은 바이러스에 노출된 후 효과적인 예방법이 없기 때문에 예방접종이나 피폭 후 면역글로불린을 맞아도 [8][11][12]질병 진행을 막을 수 없다.
감염이 있거나 감염이 의심되는 사람에게 있어서,[4][30] 질병의 확산을 막기 위해서는 격리가 중요하다.여기에는 학교, 육아, 일, 그리고 사람들이 모이는 다른 환경에서의 기권도 포함된다.건강관리 환경에서는 감염 가능성을 줄이고 유행성 이하선염에 걸렸을 경우 작업을 자제하기 위해 안면 마스크와 같은 예방조치를 사용하는 것이 좋습니다.보건 시설에서 취해진 추가 조치로는 유행성 이하선염 환자의 대기 시간 단축, 유행성 이하선염 환자의 마스크 착용, 유행성 이하선염 환자가 사용하는 [30]구역 청소 및 소독 등이 있습니다.이 바이러스는 포르말린, 에테르, 클로로포름, 열 또는 자외선에 [8]의해 비활성화될 수 있다.
치료
유행성 이하선염은 대개 자가 제한적이며, 이에 대한 특별한 항바이러스 치료법이 없기 때문에 치료는 증상을 완화하고 합병증을 예방하는 것을 목적으로 한다.이 병을 관리하는 비의학적 방법으로는 침대 휴식, 목과 음낭에 얼음이나 열 팩 사용, 더 많은 수분 섭취, 부드러운 음식 섭취, 따뜻한 소금물로 [9][11]양치질 등이 있습니다.레이 증후군을 [9]일으킬 수 있는 아스피린을 제외하고, 발열 [14]기간 동안 항열제를 사용할 수 있다.유행성 이하선염 [14]염증 질환으로 인한 통증을 조절하기 위해 진통제도 제공될 수 있다.발작에는 항경련제를 사용할 수 있다.심각한 신경학적 경우에는 인공호흡기를 사용하여 [12]호흡을 지원할 수 있습니다.
근육내 유행성 이하선염 면역글로불린은 초기에 투여했을 때 도움이 될 수 있지만, 발병에서는 효과가 나타나지 않았다.권장되지는 않지만, 정맥 내 면역 글로불린 치료는 [11]일부 합병증의 비율을 낮출 수 있습니다.항생제는 세균 감염을 배제할 수 없는 경우에 2차 세균 [11][13]감염을 방지하기 위해 예방책으로 사용될 수 있다.유행성 이하선염과 관련된 자가면역 기반 질환은 정맥주사 면역글로불린으로 [14]치료할 수 있다.
유행성 이하선염의 치료법은 여러 가지가 사용되었지만, 각 방법의 한계로 인해 특별한 치료는 권장되지 않습니다.이러한 조치들은 주로 고환 통증을 완화하고 고환 [11][13]위축의 가능성을 줄이기 위해 흉강 내 압력을 감소시키는 것에 기초한다.인터페론α2α는 바이러스 복제를 방해하기 때문에 고환 손상 [11]및 불임 예방에 유용하다고 가정되어 왔다.인터페론 알파-2b는 증상의 지속시간과 [13][14]합병증의 발생률을 감소시킬 수 있다.유수가 형성되면 여분의 액체를 [11]제거할 수 있습니다.
예후
유행성 이하선염은 장기 합병증과 사망이 드물기 때문에 대부분의 사람들의 예후는 양호하다.일반적으로 입원은 [5]필요하지 않다.유행성 이하선염은 보통 스스로 제한되며 면역체계가 바이러스를 [6][11]몸에서 제거함에 따라 증상은 2주 안에 저절로 해결된다.면역 결핍자와 같은 고위험군에서는 예후가 다른 그룹과 [5]동일한 것으로 간주된다.대부분의 사람들에게, 감염은 미래의 감염에 대한 평생 면역으로 이어진다.재감염은 첫 번째 [11]감염보다 더 경미하고 비정형적인 것으로 보인다.유행성 이하선염의 전체 사망률은 10,000명당 1.6-3.8명이고, 이러한 사망은 일반적으로 뇌염에 [6]걸린 사람에게서 발생한다.
유행성 이하선염은 보통 2주 안에 낫는다.20%의 경우 고환이 몇 주 더 부드러워질 수 있습니다.관련된 고환의 위축 또는 크기 감소는 난초염 사례의 30-50%에서 발생하며, 이는 낮은 정자 수, 정자 부족, 정자 운동성 감소, 13%의 경우 출산율 감소(고정성) 및 거의 불임과 같은 정자 생성과 생식력에 이상을 초래할 수 있다.그러나 위축이 없는 경우에는 저임증이 발생할 수 있다.정자 생성의 이상은 초기 감염에서 회복된 후 수개월에서 수 년 동안 지속될 수 있으며, 난초염의 심각도가 증가함에 따라 그 길이가 증가한다.검사 결과, 고환의 부피 감소, 고환의 압통, 고환 취급 시 부정합감 등이 나타납니다.불임은 두 고환에 영향을 미치는 심각한 난초염 사례와 관련이 있으며, 최초 감염 후 최대 1년까지 진행될 수 있는 고환 위축이 뒤따른다.양쪽 난초염 환자 중 30~87%가 불임을 경험한다.난초염과 고환부위와 고환종양의 [6][11][13]발생 사이에는 약한 연관성이 있다.
유행성 이하선염 뇌수막염은 일반적으로 [8]장기 합병증 없이 3~10일 이내에 해결된다.뇌수막염의 경우, CSF의 높은 단백질 수치와 낮은 CSF 포도당 대 혈당 비율은 [17]입원 기간이 길어지는 것과 관련이 있다.CNS가 영향을 받는 사람들의 약 1%가 유행성 [12][18]이하선염으로 사망한다.감염 후 뇌염은 비교적 가벼운 경향이 있는 반면, 감염 후 뇌척수염은 환자-치명률이 최대 10%이다.[18]대부분의 유행성 이하선염 난청은 한쪽 귀에만 영향을 미치며 일시적인 것이지만, 영구적인 [6][14]난청은 감염의 0.005%에서 발생한다.유행성 이하선염의 결과로 발생하는 심근염과 심막염은 심내막 섬유탄성증, 즉 심내막의 [12][14]비후화를 초래할 수 있다.드물게 유행성 이하선염의 [6]결과로 불임과 조기 폐경이 발생하고 있다.
역학
임상 연령 및 면역력
유행성 이하선염은 [3]전 세계적으로 발견된다.유행성 이하선염 예방접종이 없는 경우, 매년 인구 10만명당 100~1000명의 환자가 발생하며, 이는 인구의 0.1~1.0%가 매년 감염되는 것이다.발병 건수는 [10]2-5년마다 최고조에 달하며,[14] 5~9세 아동에서 발병률이 가장 높다.유행성 이하선염 예방접종 시작 전 혈청전환 조사에 따르면, 2-3세에 유행성 이하선염 항체 수치가 급격히 증가했다.
또한, 4-6세의 50%, 14-15세의 90%, 성인의 95%가 유행성 이하선염에 대한 사전 피폭에 양성 반응을 보였으며, 이는 거의 모든 사람이 결국 예방접종되지 않은 [2][6]인구에 감염되었음을 나타낸다.
백신 접종이 시작되기 전에는 유행성 이하선염이 뇌수막염의 10%, 뇌염의 [8]3분의 1을 차지했다.세계적으로 유행성 이하선염은 침샘의 [7]염증의 가장 흔한 원인이다.어린이의 경우 내이 손상 [6]시 한쪽 귀가 들리지 않게 되는 가장 흔한 원인은 유행성 이하선염입니다.무증상 감염은 [10]성인에게서 더 흔하며, 백신 접종 인구에서 무증상 감염의 비율은 3분의 2까지 매우 높다.유행성 이하선염 예방접종은 이전에 유행성 이하선염 [26]발병 경험이 없는 예방접종 인구에서 감염자의 평균 연령을 높이는 효과가 있다.감염률은 남성과 여성에서 동일한 것으로 보이지만, 남성은 [2][16][non-primary source needed]여성보다 높은 비율로 신경학적 개입을 포함한 증상과 합병증을 경험하는 것으로 보인다.증상은 [18]어린이보다 청소년과 성인에게서 더 심각하다.
발생 설정
유행성 이하선염이 발생하는 것은 흔한 일이다.이러한 발병은 학교, 군 막사, 교도소, 스포츠 [2][11]클럽과 같이 바이러스가 사람에서 사람으로 쉽게 퍼질 수 있는 혼잡한 장소에서 주로 발생한다.백신이 도입된 이후 유행성 이하선염의 빈도는 급격히 감소했고 유행성 이하선염에 의한 합병증도 있었다.백신 접종 국가의 역학에는 투여된 선량 수, 백신 접종 연령 및 백신 접종률이 반영된다.백신 적용 범위가 충분하지 않으면 집단 면역이 달성되지 않을 수 있으며 평균 감염 연령이 증가하여 합병증의 유병률을 높일 수 있다.위험 요소에는 연령, 유행성 이하선염에 걸린 사람에 대한 노출, 면역력 저하, 시기, 여행 이력 및 백신 [2]접종 상태가 포함된다.유행성 이하선염 예방접종은 개발도상국에서 덜 흔하며, 결과적으로 유행성 [16]이하선염의 비율이 더 높다.
지역별로 연중 다른 계절에 사례가 최고조에 달합니다.온대 기후에서는 겨울과 봄에 최고조에 달하지만 열대 지방에서는 계절성이 [26]관찰되지 않는다.온도와 습도가 높아질수록 유행성 이하선염의 빈도가 높아진다는 추가 연구결과가 나왔다.유행성 이하선염의 계절성은 멜라토닌 수치 변화와 같은 계절적 요인에 의한 인간 면역 반응의 변동, 학교 출석과 실내 혼잡과 같은 행동과 생활 방식의 변화, 그리고 온도, 밝기, 바람과 [2]습도의 변화와 같은 기상학적 요인에 의해 야기되는 것으로 생각된다.
역사
중국의 의학 문헌에 따르면, 유행성 이하선염은 [14]기원전 640년까지 기록되었다.그리스의 의사 히포크라테스는 기원전 410년경에 타소스 섬에서 발생한 발병을 기록했고 이 질병에 대한 자세한 설명을 Hippocrates의 [6][34]첫 번째 책에서 제공했다.현대에 이 병은 1790년 영국의 의사 로버트 해밀턴에 의해 [35]에든버러 왕립학회에서 처음 과학적으로 설명되었다.제1차 세계대전 동안 유행성 이하선염은 [36]병사들 사이에서 가장 쇠약하게 만드는 질병 중 하나였다.1934년, 유행성 이하선염 바이러스는 클로드 D에 의해 발견되었다.존슨과 어니스트 윌리엄 굿파스티어.그들은 질병의 초기 단계에서 인간의 타액에 노출된 붉은 반달가슴원숭이가 유행성 이하선염이 발생했다는 것을 발견했다.게다가, 그들은 유행성 이하선염이 여과되고 살균된 원숭이 이하선충 조직의 박테리아가 없는 제제를 통해 어린이들에게 전염될 수 있다는 것을 보여주었고, 이는 바이러스성 [6][34]질병이라는 것을 보여주었다.
1945년에 유행성 이하선염 바이러스는 처음으로 분리되었다.불과 몇 년 후인 1948년, 죽은 바이러스를 이용한 불활성화 백신이 발명되었다.이 백신은 단기 면역력만 제공하다가 1970년대에 중단돼 불활성화 백신보다 장기 면역력이 뛰어난 살아 있지만 약화된 바이러스를 가진 백신으로 대체됐다.이들 백신 중 첫 번째는 1967년 3월 30일 허가를 받은 Mumpsvax로, Jeryl Lynn 균주를 사용했다.Maurice Hilleman은 그의 다섯 살배기 딸 Jeryl Lynn에게서 얻은 변종을 사용하여 이 백신을 만들었다.유행성 이하선염은 1977년에 사용이 권장되었고, 오늘날에도 제릴 린 [25][34]변종은 백신에 계속 사용되고 있다.
힐먼은 약화된 유행성 이하선염 백신과 홍역 및 풍진 백신을 결합하여 MMR-1 백신을 개발했습니다.1971년, 새로운 버전인 MMR-2는 미국 식품의약국에 [25]의해 사용이 승인되었다.1980년대에, 국가들은 복수 투여의 이점을 인정하기 시작했고, 그래서 2회 접종 일정이 널리 [25][31]채택되었다.MMR-2를 포함한 5개의 MMR 백신이 1960년대 이후 개발되었으며, 다른 백신은 트리비라텐, 모루파, 프리어릭스, 트리모박스이다.2000년대 중반부터 두 개의 MMRV 백신이 사용되었습니다: Previrix-Tetra와 ProQuad.[2]
미국은 1960년대에 유행성 이하선염 예방백신을 접종하기 시작했고, 다른 나라들도 [6]그 뒤를 따랐다.1977년부터 1985년까지 매년 [11]전 세계적으로 10만 명당 290건의 환자가 발생했다.비록 백신 접종을 시작한 후 유행성 이하선염 발병률을 기록한 나라는 거의 없지만, 유행성 이하선염 발병률이 급격히 감소했다고 보고했다.1968년부터 1982년까지 미국에서는 97% 감소했고 핀란드에서는 연간 [26]인구 100,000명당 1명 미만으로 감소했으며, 1989년부터 [32]1995년까지 영국은 연간 100,000명당 160명에서 17명으로 감소했다.2001년까지 미국에서는 환자 수가 99.9% 감소했고 다른 백신 접종 [6]국가에서도 거의 거의 제거되었다.
1993년 일본에서는 URABE 변종 MMR 백신 접종 후 무균성 뇌수막염 발생률에 대한 우려로 MMR 백신이 국가 예방접종 프로그램에서 제외되어 환자 [2][6]수가 극적으로 증가하였다.일본은 현재 홍역이나 [29]풍진과는 별도로 자발적인 유행성 이하선염 예방 접종을 실시하고 있습니다.1990년대 중반부터 MMR 백신을 둘러싼 논란이 불거졌다.한 논문은 1995년 MMR 백신을 크론병과 연관시켰고, 다른 논문은 1998년 MMR 백신을 자폐증 스펙트럼 장애와 염증성 장질환과 연관시켰다.이 논문들은 현재 사기적이고 잘못된 것으로 간주되고 있으며, MMR 백신과 앞서 언급한 조건 사이의 연관성은 확인되지 않았다.그럼에도 불구하고, 그들의 발표는 백신 접종률의 현저한 저하로 이어졌고, 궁극적으로 예방접종률이 낮은 [11][13][34]곳에 홍역, 유행성 이하선염, 풍진이 재발하게 했다.
21세기의 주목할 만한 발병 사례로는 2013년 중국에서[14] 30만 건 이상, 2004-2005년 잉글랜드와 웨일스에서 56,000 건 이상이 있다.후자의 발병에서는, 대부분의 사례가 대학 및 대학에 다니고 있던 15-24세의 연령층에서 보고되었다.이 연령대는 MMR 백신 접종 시기와 [11]당시 발생했던 MMR 백신 부족 때문에 감염에 취약한 것으로 생각되었다.미국, 네덜란드, 스웨덴 및 [25]벨기에를 포함한 많은 다른 국가에서 밀집된 환경에서 유사한 발병이 자주 발생했습니다.
부활
| 연도 | 위치 | 건수 |
|---|---|---|
| 2005–2006 | 체코 공화국 | 5,998 |
| 2006 | 미국 | 6,584 |
| 2009 | 뉴욕(미국) | 1,521 |
| 2009–2011 | 예루살렘 | 3,130 |
| 2012–2013 | 벨기에 | 4,061 |
| 2013 | 폴란드 | 2,436 |
| 2014 | 미국 | 1,151 |
| 2016–2017 | 아칸소(미국) | 2,706 |
| 2017 | 미국 | 5,629 |
21세기에 유행성 이하선염은 백신 접종을 하는 많은 곳에서 재발하여 재발하고 있다.이러한 발병은 학교, 스포츠팀, 종교 모임, 군대 등 밀집된 공간에서 청소년과 청소년들에게 큰 영향을 미쳤으며 앞으로도 발생할 것으로 예상된다.이 재발의 원인은 논란의 대상이며, 백신 접종에 대한 면역력 저하, 낮은 예방접종률, 백신 실패, 유행성 이하선염 [2][6][25][26]바이러스의 항원 변이를 포함한 다양한 요인이 제안되어 왔다.
백신에 대한 면역력이 떨어지는 것이 유행성 이하선염의 재발을 일으키는 주요 원인일 수 있다.과거에, 잠재의식적인 자연 감염은 백신과 유사한 면역력을 증가시켰다.백신 사용으로 시간이 지날수록, 이러한 무증상 감염은 빈도가 감소하여 유행성 이하선염에 대한 장기 면역력 감소로 이어질 수 있다.면역력이 떨어지면서 백신 면역력 감소의 영향이 더욱 뚜렷해졌고, 백신 접종을 받은 사람들은 유행성 이하선염으로 인해 자주 병에 걸렸다.청소년기에 제공된 백신의 세 번째 복용량은 일부 연구가 이를 뒷받침하기 때문에 이를 해결하기 위해 고려되었다.다른 연구에 따르면 세 번째 선량은 [15][25]발병 시 단기 면역에만 유용할 수 있으며,[2] 이는 질병통제예방센터의 면역실무자문위원회에 의해 위험에 처한 사람에게 권장된다.
영국, 캐나다, 스웨덴 및 일본에서 일부 발병의 원인으로 낮은 백신 접종률이 관련되었으며, 미국, 체코, 네덜란드 등 다른 지역에서의 발병은 주로 백신 접종에서 발생했다.유행성 이하선염 백신은 홍역이나 풍진 백신에 비해 백신 종류에 따라 실패율이 상대적으로 높은 것으로 보인다.이는 주로 1회 용량만 투여받은 사람들 사이에서 발생한 백신 중 최근 발병으로 뒷받침되는 두 가지 백신 선량을 제공함으로써 해결되었다.마지막으로, 특정 유행성 이하선염 바이러스 계통은 유전적으로 백신 변종과 매우 다른데, 이것은 백신 변종에 대한 보호와 비백신 변종 사이의 불일치를 야기할 수 있다. 비록 연구가 이 [2][25]문제에 대해 결정적이지 않지만.
어원학
유행성 이하선염이라는 단어는 1600년경에 처음 증명되었고 "거지처럼 징징거리거나 중얼거린다는 뜻의 동사 "그림자"를 뜻하는 "mump"의 복수형식이다.이 병은 유행성 이하선염에 의한 붓기와 관련하여 유행성 이하선염이라고 불리며, 이는 얼굴 표정에 미치는 영향과 그로 인해 야기되는 고통스럽고 어려운 삼키기를 반영한다.유행성 이하선염은 17세기부터 "우울함, 시무룩함, 무언의 불쾌감"[11][37]이라는 뜻으로도 사용되었다.유행성 이하선염은 때때로 "유두혈성 이하선염"[5][9][14]이라고 불린다.
레퍼런스
- ^ Barskey, Albert E.; Glasser, John W.; LeBaron, Charles W. (19 October 2009). "Mumps resurgences in the United States: A historical perspective on unexpected elements". Vaccine. Elsevier BV. 27 (44): 6186–6195. doi:10.1016/j.vaccine.2009.06.109. ISSN 0264-410X. PMID 19815120.
- ^ a b c d e f g h i j k l m n o p q r Su SB, Chang HL, Chen AK (5 March 2020). "Current Status of Mumps Virus Infection: Epidemiology, Pathogenesis, and Vaccine". Int J Environ Res Public Health. 17 (5): 1686. doi:10.3390/ijerph17051686. PMC 7084951. PMID 32150969.
- ^ a b c d e f g h Davison P, Morris J (13 August 2020). "Mumps". NCBI. StatPearls. PMID 30521206. Retrieved 30 October 2020.
- ^ a b Levine DA (December 2016). "Vaccine-Preventable Diseases In Pediatric Patients: A Review Of Measles, Mumps, Rubella, And Varicella". Pediatr Emerg Med Pract. 13 (12): 1–20. PMID 27893360. Retrieved 30 October 2020.
- ^ a b c d e f g h i Kutty PK, Kyaw MH, Dayan GH, Brady MT, Bocchini JA, Reef SE, Bellini WJ, Seward JF (15 June 2010). "Guidance for isolation precautions for mumps in the United States: a review of the scientific basis for policy change". Clinical Infectious Diseases. 50 (12): 1619–1628. doi:10.1086/652770. PMID 20455692.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak Rubin S, Eckhaus M, Rennick LJ, Bamford CG, Duprex WP (January 2015). "Molecular biology, pathogenesis and pathology of mumps virus". J Pathol. 235 (2): 242–252. doi:10.1002/path.4445. PMC 4268314. PMID 25229387.
- ^ a b c d Kessler AT, Bhatt AA (15 November 2018). "Review of the Major and Minor Salivary Glands, Part 1: Anatomy, Infectious, and Inflammatory Processes". J Clin Imaging Sci. 8: 47. doi:10.4103/jcis.JCIS_45_18. PMC 6251248. PMID 30546931.
- ^ a b c d e f g h i j k "Mumps". Centers for Disease Control and Prevention (CDC). CDC. Retrieved 30 October 2020.
- ^ a b c d "Mumps". National Center for Biotechnology Information. A.D.A.M. Medical Encyclopedia. Archived from the original on 17 October 2014. Retrieved 30 October 2020.
- ^ a b c d e f g h i j k l m "Mumps virus nomenclature update: 2012" (PDF). Wkly Epidemiol Rec. 87 (22): 217–224. 1 June 2012. PMID 24340404. Retrieved 30 October 2020.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Davis NF, McGuire BB, Mahon JA, Smyth AE, O'Malley KJ, Fitzpatrick JM (April 2010). "The increasing incidence of mumps orchitis: a comprehensive review". BJU Int. 105 (8): 1060–1065. doi:10.1111/j.1464-410X.2009.09148.x. PMID 20070300. S2CID 20761646.
- ^ a b c d e f g h i j k l m Gupta RK, Best J, MacMahon E (14 May 2005). "Mumps and the UK epidemic 2005". BMJ. 330 (7500): 1132–1135. doi:10.1136/bmj.330.7500.1132. PMC 557899. PMID 15891229.
- ^ a b c d e f g h i Masarani M, Wazait H, Dinneen M (November 2006). "Mumps orchitis". J R Soc Med. 99 (11): 573–575. doi:10.1177/014107680609901116. PMC 1633545. PMID 17082302.
- ^ a b c d e f g h i j k l m n o Shu M, Zhang YQ, Li Z, Liu GJ, Wan C, Wen Y (18 April 2015). "Chinese medicinal herbs for mumps". Cochrane Database Syst Rev. 2015 (4): CD008578. doi:10.1002/14651858.CD008578.pub3. PMC 7198052. PMID 25887348.
- ^ a b c d e f g h i j Latner DR, Hickman CJ (7 May 2015). "Remembering mumps". PLOS Pathog. 11 (5): e1004791. doi:10.1371/journal.ppat.1004791. PMC 4423963. PMID 25951183.
- ^ a b c d e f g h i j k Junghanss T (2013). Manson's tropical diseases (23rd ed.). Oxford: Elsevier/Saunders. p. 261. ISBN 978-0-7020-5306-1. Archived from the original on 13 May 2016. Retrieved 30 October 2020.
- ^ a b Kanra G, Isik P, Kara A, Cengiz AB, Seçmeer G, Ceyhan M (December 2004). "Complementary findings in clinical and epidemiologic features of mumps and mumps meningoencephalitis in children without mumps vaccination". Pediatr Int. 46 (6): 663–668. doi:10.1111/j.1442-200x.2004.01968.x. PMID 15660864. S2CID 43534364.
- ^ a b c d e f g h i j Senanayake SN (20 October 2008). "Mumps: a resurgent disease with protean manifestations". Med J Aust. 189 (8): 456–459. doi:10.5694/j.1326-5377.2008.tb02121.x. PMID 18928441. S2CID 13771290. Retrieved 30 October 2020.
- ^ Smatti MK, Cyprian FS, Nasrallah GK, Al-Thani AA, Almishal RO, Yassine HM (19 August 2019). "Viruses and Autoimmunity: A Review on the Potential Interaction and Molecular Mechanisms". Viruses. 11 (8): 762. doi:10.3390/v11080762. PMC 6723519. PMID 31430946.
- ^ "ICTV Taxonomy history: Mumps orthorubulavirus". International Committee on Taxonomy of Viruses (ICTV). ICTV. Retrieved 30 October 2020.
- ^ Cox RM, Plemper RK (June 2017). "Structure and organization of paramyxovirus particles". Curr Opin Virol. 24: 105–114. doi:10.1016/j.coviro.2017.05.004. PMC 5529233. PMID 28601688.
- ^ Rima B, Balkema-Buschmann A, Dundon WG, Duprex P, Easton A, Fouchier R, Kurath G, Lamb R, Lee B, Rota P, Wang L (December 2019). "ICTV Virus Taxonomy Profile: Paramyxoviridae". J Gen Virol. 100 (12): 1593–1954. doi:10.1099/jgv.0.001328. PMC 7273325. PMID 31609197. Retrieved 30 October 2020.
- ^ a b c Najjar FE, Schmitt AP, Dutch RE (7 August 2014). "Paramyxovirus glycoprotein incorporation, assembly and budding: a three way dance for infectious particle production". Viruses. 6 (8): 3019–3054. doi:10.3390/v6083019. PMC 4147685. PMID 25105277.
- ^ a b c Harrison MS, Sakaguchi T, Schmitt AP (September 2010). "Paramyxovirus assembly and budding: building particles that transmit infections". Int J Biochem Cell Biol. 42 (9): 1416–1429. doi:10.1016/j.biocel.2010.04.005. PMC 2910131. PMID 20398786.
- ^ a b c d e f g h i Ramanathan R, Voigt EA, Kennedy RB, Poland GA (18 June 2018). "Knowledge gaps persist and hinder progress in eliminating mumps". Vaccine. 36 (26): 3721–3726. doi:10.1016/j.vaccine.2018.05.067. PMC 6031229. PMID 29784466.
- ^ a b c d e f g h Beleni AI, Borgmann S (31 July 2018). "Mumps in the Vaccination Age: Global Epidemiology and the Situation in Germany". Int J Environ Res Public Health. 15 (8): 1618. doi:10.3390/ijerph15081618. PMC 6121553. PMID 30065192.
- ^ Skrha J, Stepan J, Sixtova E (October 1979). "Amylase isoenzymes in mumps". Eur J Pediatr. 132 (2): 99–105. doi:10.1007/BF00447376. PMID 499265. S2CID 28963086.
- ^ "Amylase Test". Lab Tests Online. Archived from the original on 29 March 2009. Retrieved 30 October 2020.
- ^ a b "Changes in the Immunization Schedule Recommended by the Japan Pediatric Society" (PDF). Japan Pediatric Society. Japan Pediatric Society. 1 August 2018. Retrieved 30 October 2020.
- ^ a b c d "Mumps Clinical Information – Minnesota Dept. of Health". Archived from the original on 19 May 2011. Retrieved 30 October 2020.
- ^ a b c d Peltola H, Kulkarni PS, Kapre SV, Paunio M, Jadhav SS, Dhere RM (15 August 2007). "Mumps outbreaks in Canada and the United States: time for new thinking on mumps vaccines". Clin Infect Dis. 45 (4): 459–466. doi:10.1086/520028. PMID 17638194.
- ^ a b Demicheli V, Rivetti A, Debalini MG, Pietrantonj CD (15 February 2012). "Vaccines for measles, mumps and rubella in children". Cochrane Database Syst Rev. 2012 (2): CD004407. doi:10.1002/14651858.CD004407.pub3. PMC 6458016. PMID 22336803.
- ^ Ma SJ, Li X, Xiong YQ, Yao AL, Chen Q (November 2015). "Combination Measles-Mumps-Rubella-Varicella Vaccine in Healthy Children: A Systematic Review and Meta-analysis of Immunogenicity and Safety". Medicine (Baltimore). 94 (44): e1721. doi:10.1097/MD.0000000000001721. PMC 4915870. PMID 26554769.
- ^ a b c d "Tracing the story of mumps: a timeline". Pharmaceutical Technology. Pharamaceutical Technology. 25 April 2018. Retrieved 30 October 2020.
- ^ Hamilton R (1790). "IX. An Account of a Distemper, by the common People in England vulgarly called the MUMPS". Transactions of the Royal Society of Edinburgh. 2 (2): 59–72. doi:10.1017/S0263593300027280. PMC 5550187. PMID 29139995.
- ^ Van-Way CW, Marble WS, Thompson G. "Diseases in World War I". The United States World War I Centennial Commission. United States Foundation for the Commemoration of the World Wars. Retrieved 30 October 2020.
- ^ "mumps (n.)". Etymonline. Online Etymology Dictionary. Retrieved 30 October 2020.


