생화학
Biochemistry| 시리즈의 일부(on) |
| 생화학 |
|---|
 |
생물화학(生物化學, )은 생물 내의 화학적 과정을 연구하는 학문입니다.[1]생화학은 화학과 생물학의 하위 학문으로 구조 생물학, 효소학, 대사의 세 분야로 나뉠 수 있습니다.20세기의 지난 수십 년 동안 생화학은 이 세 가지 학문을 통해 생명 과정을 설명하는 데 성공했습니다.생명과학의 거의 모든 분야가 생화학적 방법론과 연구를 통해 밝혀지고 발전되고 있습니다.[2]생화학은 생물학적 분자가 살아있는 세포와 세포 사이에서 일어나는 과정들을 발생하게 하는 화학적 기초를 이해하는 것에 중점을 두고 있으며,[3] 이는 결국 유기체의 구조와 기능뿐만 아니라 조직과 장기에 대한 이해와 크게 관련되어 있습니다.[4]생화학은 생물학적 현상의 분자적 메커니즘을 연구하는 분자생물학과 밀접한 관련이 있습니다.[5]
생화학의 많은 부분은 단백질, 핵산, 탄수화물 그리고 지질과 같은 생물학적인 거대분자의 구조, 결합, 기능 그리고 상호작용을 다룹니다.그들은 세포의 구조를 제공하고 생명과 관련된 많은 기능을 수행합니다.[6]세포의 화학은 또한 작은 분자와 이온의 반응에 의존합니다.이들은 무기물(예를 들어 물과 금속 이온)이거나 유기물(예를 들어 단백질 합성에 사용되는 아미노산)일 수 있습니다.[7]세포가 화학 반응을 통해 그들의 환경으로부터 에너지를 이용하기 위해 사용하는 메커니즘은 대사라고 알려져 있습니다.생화학의 발견은 주로 의학, 영양학, 농업에 적용됩니다.의학에서 생화학자들은 질병의 원인과 치료법을 연구합니다.[8]영양학은 건강과 건강을 유지하는 방법과 영양 결핍의 영향을 연구합니다.[9]농업에서 생화학자들은 작물 재배, 작물 저장, 병해충 방제를 개선하기 위해 토양과 비료를 조사합니다.최근 수십 년간 생명화학적 원리와 방법은 생명공학의 학문인 연구, 산업 과정, 질병 진단 및 통제에 유용한 도구를 생산하기 위해 공학에서 생명 시스템을 조작하는 문제 해결 방법과 결합되어 왔습니다.[10]
역사

가장 포괄적인 정의에서 생화학은 생물체의 구성 요소와 구성, 그리고 그것들이 어떻게 결합하여 생명체가 되는지에 대한 연구로 볼 수 있습니다.이 점에서 생화학의 역사는 고대 그리스까지 거슬러 올라갈 수 있습니다.[11]그러나 구체적인 과학적 학문으로서의 생화학은 생화학의 어떤 측면에 중점을 두느냐에 따라 19세기 언젠가, 혹은 조금 더 이른 시기에 시작되었습니다.어떤 이들은 생화학의 시작이 1833년 앙셀름 파옌에 의해 최초의 효소인 디아스타아제(현재 아밀라아제라고 불리는)의 발견일 수 있다고 주장했고,[12] 다른 이들은 1897년 에두아르드 부흐너가 세포가 없는 추출물에서 복잡한 생화학적 과정의 알코올 발효를 처음으로 보여준 것이 생화학의 탄생이라고 생각했습니다.[13][14]어떤 이들은 또한 1842년 쥐스투스 폰 리빅의 영향력 있는 연구, 동물 화학, 또는 생리학과 병리학에 대한 적용에서 유기 화학의 시작으로 지적할 수도 있습니다. 이것은 신진대사에 대한 화학 이론을 제시한 것이거나,[11] 심지어 앙투안 라부아지에의 발효와 호흡에 대한 18세기 초의 연구입니다.[15][16]생화학의 복잡한 층들을 밝혀내는데 도움을 준 그 분야의 많은 다른 선구자들은 현대 생화학의 창시자로 선언되었습니다.단백질의 화학을 연구한 에밀 피셔와 [17]F. 효소와 생화학의 역동성을 연구한 고울랜드 홉킨스는 초기 생화학자들의 두가지 예를 나타냅니다.[18]
"생물화학"이라는 용어는 빈젠츠 클레진스키 (1826–1882)가 1858년에 비엔나에서 그의 "생화학 해설서"를 인쇄했을 때 처음 사용되었습니다. 생물학과 화학의 결합에서 유래되었습니다.1877년, 펠릭스 호페-세일러(Felix Hoppe-Sayler)는 이 연구 분야에 전념하는 연구소의 설립을 주장한 Zeitschrift für Physiologische Chemie(생리 화학 저널)의 첫 번째 호 서문에서 생리 화학의 동의어로 "독일어로 생물 화학"이라는 용어를 사용했습니다.[19][20]그러나 독일의 화학자 칼 노이베르그는 1903년에 그 단어를 만들었다고 자주 인용되고,[21][22][23] 반면에 어떤 사람들은 그것을 프란츠 호프마이스터에게 공을 돌렸습니다.[24]
한때 생명체와 그 물질은 무생물에서 발견되는 어떤 것과도 구별되는 어떤 본질적인 성질이나 물질을 가지고 있다고 일반적으로 믿었고, 오직 생명체만이 생명의 분자를 생산할 수 있다고 생각되었습니다.[26]1828년 프리드리히 뵐러는 시안산칼륨과 황산암모늄으로부터 우연한 요소 합성에 대한 논문을 발표했습니다. 어떤 이들은 이것이 활력소의 직접적인 전복과 유기 화학의 설립으로 간주했습니다.[27][28]그러나 뵐러 합성은 일부 사람들이 그의 손에 있는 생명력의 죽음을 거부하면서 논란을 불러일으켰습니다.[29]그 이후로 생화학은 크로마토그래피, X선 회절, 이중 편광 간섭법, NMR 분광법, 방사성 동위원소 표지, 전자 현미경 및 분자 역학 시뮬레이션과 같은 새로운 기술의 발전과 함께 특히 20세기 중반 이후 발전했습니다.이러한 기술들은 해당과정과 크렙스 순환(crebs cycle)과 같은 세포의 많은 분자와 대사 경로의 발견과 상세한 분석을 가능하게 했고, 분자 수준의 생화학을 이해하게 했습니다.
생화학의 또 다른 중요한 역사적 사건은 유전자의 발견과 세포 내 정보 전달에 있어서의 그것의 역할입니다.1950년대 제임스 D. 왓슨, 프란시스 크릭, 로잘린드 프랭클린, 모리스 윌킨스는 DNA 구조를 해결하고 정보의 유전적 전달과의 관계를 제시하는 데 중요한 역할을 했습니다.[30]1958년 조지 비들과 에드워드 테이텀은 하나의 유전자가 하나의 효소를 만들어낸다는 것을 보여주는 균류에 대한 연구로 노벨상을 받았습니다.[31]1988년, 콜린 피치포크는 DNA 증거로 살인죄로 유죄판결을 받은 첫 번째 사람이었고, 이것은 법의학의 성장으로 이어졌습니다.[32]최근엔 앤드류 Z. 파이어 앤 크레이그 C. 멜로는 유전자 발현의 침묵에 대한 RNA 간섭(RNAi)의 역할을 발견한 공로로 2006년 노벨상을 수상했습니다.[33]
출발물질 : 생명체의 화학원소
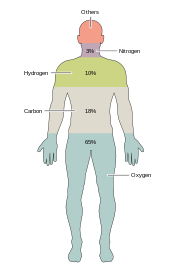
약 20개의 화학 원소들은 다양한 종류의 생물학적 생명체에 필수적입니다.지구상의 희귀 원소들은 대부분 생명체가 필요로 하지 않으며(셀레늄과 요오드는 제외),[34] 몇 가지 일반적인 원소들은 사용되지 않습니다.대부분의 유기체들은 요소의 필요성을 공유하지만, 식물과 동물 사이에는 약간의 차이가 있습니다.예를 들어, 해양 조류는 브롬을 사용하지만, 육지의 식물과 동물들은 브롬을 필요로 하지 않는 것 같습니다.모든 동물들은 나트륨을 필요로 하지만 식물에게 필수적인 요소는 아닙니다.식물은 붕소와 실리콘을 필요로 하지만 동물들은 필요하지 않을 수도 있고 아주 적은 양이 필요할 수도 있습니다.
인체를 포함하여 살아있는 세포의 질량은 탄소, 수소, 질소, 산소, 칼슘 및 인의 6가지 원소만이 거의 99%를 차지합니다(전체 목록은 인체 구성 참조).인체의 대부분을 구성하는 여섯 가지 주요 요소 외에도, 인간은 더 적은 양의 아마도 18개를 더 필요로 합니다.[35]
생체분자
생화학에서 분자의 4가지 주요 부류는 탄수화물, 지질, 단백질 그리고 핵산입니다.[36]많은 생물학적 분자들은 고분자입니다: 이 용어에서, 단량체들은 고분자로 알려진 큰 고분자를 만들기 위해 서로 연결된 비교적 작은 고분자입니다.단량체들이 생물학적 중합체를 합성하기 위해 서로 연결될 때, 그들은 탈수 합성이라고 불리는 과정을 겪습니다.다른 거대 분자들은 종종 생물학적 활동에 필요한 더 큰 복합체들로 조립될 수 있습니다.
탄수화물
탄수화물의 주요 기능 중 두 가지는 에너지 저장과 구조를 제공하는 것입니다.포도당이라고 알려진 일반적인 당 중 하나는 탄수화물이지만, 모든 탄수화물이 당인 것은 아닙니다.지구에는 알려진 다른 어떤 종류의 생체 분자보다 더 많은 탄수화물이 있습니다; 그것들은 에너지와 유전 정보를 저장하는 데 사용될 뿐만 아니라 세포 대 세포의 상호작용과 의사소통에 중요한 역할을 사용합니다.[citation needed]
가장 단순한 형태의 탄수화물은 탄소, 수소 및 산소를 포함하는 단당류이며, 대부분 1:2:1의 비율로 포함됩니다(일반식 CHOn2nn, n은 적어도 3).글루코스(CHO6126)는 가장 중요한 탄수화물 중 하나입니다; 다른 것들은 과일의 달콤한 맛과 흔히 연관되는 프룩토스(CHO6126)와 DNA의 [37][a]성분인 디옥시리보스(CHO5104)를 포함합니다.단당류는 비순환(개방 사슬) 형태와 순환 형태 사이를 전환할 수 있습니다.개방 사슬 형태는 한쪽 끝의 카보닐기와 다른 쪽 끝의 하이드록실기로부터 생성된 산소 원자에 의해 가교된 탄소 원자의 고리로 변할 수 있습니다.선형 형태가 알도스인지 케토스인지에 따라, 고리형 분자는 헤미아세탈 또는 헤미케탈 그룹을 갖습니다.[38]
이러한 고리형태에서 고리는 보통 5개 또는 6개의 원자를 가지고 있습니다.이 형태들은 각각 퓨라노스와 피라노스라고 불리는데, 이는 동일한 탄소-산소 고리를 가진 가장 단순한 화합물인 퓨란과 피란과 비유되어 있습니다.예를 들어, 알도헥소스 포도당은 1번 탄소의 하이드록실과 4번 탄소의 산소 사이에 헤미아세탈 연결을 형성하여 글루코푸라노스라고 불리는 5개의 고리를 가진 분자를 생성할 수 있습니다.탄소 1과 5 사이에 같은 반응이 일어나 글루코피라노스라고 불리는 6개의 고리를 가진 분자를 형성할 수 있습니다.헵토스라고 불리는 7원자 고리를 가진 순환형은 희귀합니다.[citation needed]
두 개의 단당류는 물 분자가 방출되는 탈수 반응을 통해 글리코시드 또는 에스테르 결합에 의해 이당류로 결합될 수 있습니다.이당류의 글리코사이드 결합이 두 개의 단당류로 분해되는 역반응을 가수분해라고 합니다.가장 잘 알려진 이당류는 포도당 분자와 과당 분자가 결합된 수크로스 또는 보통의 설탕입니다.또 다른 중요한 이당류는 우유에서 발견되는 포도당 분자와 갈락토스 분자로 구성된 락토오스입니다.락타아제는 락타아제에 의해 가수분해될 수 있으며, 이 효소의 결핍은 락타아제 불내증을 초래합니다.
몇 개(약 3~6개)의 단당류가 결합하면 올리고당(올리고- "소수"를 의미)이라고 불립니다.이 분자들은 마커와 신호로 사용되는 경향이 있을 뿐만 아니라 다른 용도로 사용되는 경향이들 분자들은 다른 용도로 사용되는 경향이 있습니다.[39]많은 단당류들이 결합하여 다당류를 형성합니다.이들은 하나의 긴 선형 사슬로 결합될 수도 있고, 분기될 수도 있습니다.가장 흔한 다당류 중 두 가지는 셀룰로스와 글리코겐으로, 둘 다 반복되는 글루코스 단량체로 구성되어 있습니다.셀룰로스는 식물의 세포벽의 중요한 구조적 구성 요소이며 글리코겐은 동물의 에너지 저장의 한 형태로 사용됩니다.
설탕은 환원 또는 환원되지 않는 끝을 가지는 것으로 특징지어질 수 있습니다.탄수화물의 환원 말단은 개방 사슬 알데히드(알도스) 또는 케토 형태(케토스)와 평형을 이룰 수 있는 탄소 원자입니다.단량체의 결합이 이러한 탄소 원자에서 이루어지면, 피라노스 또는 퓨라노스 형태의 자유 하이드록시기가 다른 당의 OH-사이드-체인과 교환되어 완전한 아세탈을 생성합니다.이렇게 하면 알데히드 또는 케토 형태로 체인이 열리는 것을 방지하고 변형된 잔여물을 환원시키지 않습니다.락토오스는 포도당 부분에 환원 말단을 포함하는 반면 갈락토스 부분은 포도당의 C4-OH 그룹과 완전한 아세탈을 형성합니다.사카로스는 포도당(C1)의 알데히드 탄소와 과당(C2)의 케토 탄소 사이의 완전한 아세탈 형성 때문에 환원 말단을 갖지 않습니다.
지질
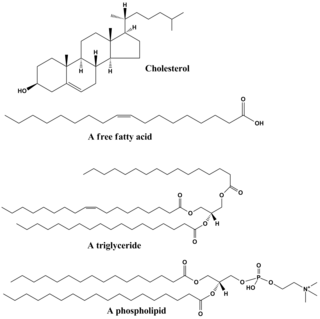
지질은 다양한 범위의 분자로 구성되며 왁스, 지방산, 지방산 유도 인지질, 스핑고지질, 글리콜지질 및 테르페노이드(예: 레티노이드 및 스테로이드)를 포함하는 생물학적 기원의 비교적 수용성 또는 비극성 화합물에 대한 캐치올입니다.일부 지질은 선형의 개방형 지방족 분자인 반면 다른 지질은 고리 구조를 가지고 있습니다.일부는 방향족(순환형 [고리] 및 평면형 [평면형] 구조)이고, 다른 일부는 그렇지 않습니다.유연한 것도 있고, 경직된 것도 있습니다.[citation needed]
지질은 보통 글리세롤 한 분자가 다른 분자와 결합되어 만들어집니다.벌크 지질의 주요 그룹인 트리글리세리드에는 글리세롤 1분자와 지방산 3개가 있습니다.지방산은 그 경우 단량체로 간주되며 포화(탄소 사슬에 이중 결합이 없음)되거나 불포화(탄소 사슬에 하나 이상의 이중 결합)될 수 있습니다.[citation needed]
대부분의 지질은 대체로 비극성일 뿐만 아니라 약간의 극성을 가지고 있습니다.일반적으로, 그들의 구조의 대부분은 비극성 또는 소수성("물 공포")인데, 이것은 그것이 물과 같은 극성 용매와 잘 상호작용하지 않는다는 것을 의미합니다.그들의 구조의 또 다른 부분은 극성 혹은 친수성 ("물을 사랑하는")이고 물과 같은 극성 용매와 연관되는 경향이 있습니다.이것은 양친매성 분자(소수성 부분과 친수성 부분을 모두 가지고 있음)를 만듭니다.콜레스테롤의 경우, 극성 그룹은 단지 -OH(하이드록실 또는 알코올)입니다.인지질의 경우, 후술하는 바와 같이, 극성 그룹은 상당히 크고 극성입니다.
지질은 우리의 일상 식단에서 필수적인 부분입니다.버터, 치즈, 기 등 우리가 요리와 먹을 때 사용하는 대부분의 기름과 우유 제품은 지방으로 구성되어 있습니다.식물성 기름에는 다양한 다불포화지방산(PUFA)이 풍부합니다.지질이 함유된 음식은 체내에서 소화작용을 거쳐 지방산과 글리세롤로 분해되는데, 글리세롤은 지방과 지질의 최종 분해 산물입니다.지질, 특히 인지질은 또한 다양한 약학 제품에 사용되며, (예를 들어 비경구 주입에서) 공동 용해제로서 또는 다른 약물 전달체 성분으로서(예를 들어, 리포좀 또는 전사체에서) 사용됩니다.
단백질
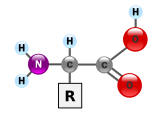
단백질은 아미노산이라고 불리는 단량체로 만들어진 매우 큰 분자인 매크로 바이오 폴리머입니다.아미노산은 아미노기에 결합된 알파 탄소 원자, –NH2, 카르복실산기, –COOH(생리학적 조건에서 –NH3+ 및 –COO로 존재함에도 불구하고), 단순한 수소 원자 및 일반적으로 "–R"로 표시되는 측쇄로 구성됩니다.측쇄 "R"은 20개의 표준 아미노산이 있는 아미노산마다 다릅니다.각각의 아미노산을 다르게 만든 것은 이 "R" 그룹이며, 곁사슬의 특성은 단백질의 전체적인 3차원 입체 구조에 큰 영향을 미칩니다.어떤 아미노산들은 그 자체로 또는 변형된 형태로 기능을 합니다; 예를 들어, 글루타메이트는 중요한 신경 전달 물질로서 기능합니다.아미노산은 펩타이드 결합을 통해 결합될 수 있습니다.이 탈수 합성에서, 물 분자가 제거되고 펩티드 결합은 한 아미노산의 아미노기의 질소와 다른 아미노산의 카르복실산기의 탄소를 연결합니다.결과적인 분자는 디펩타이드라고 불리고, 아미노산의 짧은 신장(보통 30개 미만)은 펩타이드 또는 폴리펩타이드라고 불립니다.긴 스트레칭은 타이틀 단백질의 가치가 있습니다.예를 들어, 중요한 혈중 혈청 단백질 알부민은 585개의 아미노산 잔기를 포함하고 있습니다.[42]


단백질은 구조적 및/또는 기능적 역할을 가질 수 있습니다.예를 들어, 단백질의 움직임은 액틴과 미오신이 궁극적으로 골격근의 수축에 책임이 있습니다.많은 단백질이 가지고 있는 한 가지 특성은 특정 분자 또는 분자 부류에 특별히 결합한다는 것입니다. 결합하는 것이 매우 선택적일 수 있습니다.항체는 특정한 종류의 분자에 붙는 단백질의 한 예입니다.항체는 무겁고 가벼운 사슬로 구성되어 있습니다.두 개의 중쇄는 아미노산 사이의 이황화 결합을 통해 두 개의 경쇄에 연결됩니다.항체는 N 말단 도메인의 차이에 따른 변이를 통해 특이적입니다.[43]
항체를 사용하는 효소연계면역흡착제 검사(ELISA)는 현대 의학이 다양한 생체분자를 검출하기 위해 사용하는 가장 민감한 검사 중 하나입니다.그러나 아마도 가장 중요한 단백질은 효소일 것입니다.사실상 살아있는 세포의 모든 반응은 반응의 활성화 에너지를 낮추는 효소를 필요로 합니다.이 분자들은 기질이라고 불리는 특정한 반응 분자들을 인식하고 그들 사이의 반응을 촉매합니다.활성화 에너지를 낮춤으로써 효소는 반응 속도를11 10배 이상 빠르게 합니다. 자발적으로 완료하는 데 보통 3,000년 이상이 걸리는 반응은 효소의 경우 1초 미만이 걸릴 수 있습니다.효소 자체는 공정에서 사용되지 않으며 새로운 기질 세트로 동일한 반응을 자유롭게 촉매할 수 있습니다.다양한 조절제를 사용하여 효소의 활성을 조절하여 세포 전체의 생화학을 조절할 수 있습니다.
단백질의 구조는 전통적으로 4단계의 계층구조로 설명됩니다.단백질의 1차 구조는 아미노산의 선형 서열로 구성됩니다. 예를 들어, 알라닌-글리신-트립토판-세린-글루타메이트-아스파라긴-글리신-라이신-.... 2차 구조는 국소 형태학(구조에 대한 연구인 형태학)과 관련이 있습니다.아미노산의 일부 조합은 α-헬릭스라고 불리는 코일에서 또는 β-시트라고 불리는 시트로 말려 들어가는 경향이 있습니다. 일부 α-헬릭스는 위의 헤모글로빈 도식에서 볼 수 있습니다.3차 구조는 단백질의 전체 3차원 형태입니다.이 모양은 아미노산의 배열에 의해 결정됩니다.사실, 한 번의 변화로 전체 구조가 바뀔 수 있습니다.헤모글로빈의 알파 사슬은 146개의 아미노산 잔기를 포함합니다; 6번 위치의 글루탐산 잔기를 발린 잔기로 치환하면 헤모글로빈의 행동이 너무 많이 변화하여 낫 세포 질환을 초래합니다.마지막으로, 4차 구조는 헤모글로빈과 같이 4개의 소단위를 갖는 다수의 펩타이드 소단위를 갖는 단백질의 구조와 관련이 있습니다.모든 단백질이 하나 이상의 소단위를 가지는 것은 아닙니다.[44]

섭취된 단백질은 대개 소장에서 단일 아미노산 또는 디펩타이드로 분해된 후 흡수됩니다.그리고 나서 그들은 결합되어 새로운 단백질을 형성할 수 있습니다.해당과정, 시트르산 회로, 그리고 오탄당 인산 경로의 중간생성물은 20개의 아미노산을 모두 형성하는데 사용될 수 있고, 대부분의 박테리아와 식물은 그것들을 합성하는데 필요한 모든 효소를 가지고 있습니다.하지만 인간과 다른 포유동물들은 그들 중 절반만 합성할 수 있습니다.그들은 이소류신, 류신, 라이신, 메티오닌, 페닐알라닌, 트레오닌, 트립토판, 발린을 합성할 수 없습니다.꼭 섭취해야 하기 때문에 필수 아미노산입니다.포유류는 알라닌, 아스파라긴, 아스파르트산, 시스테인, 글루타메이트, 글루타민, 글리신, 프롤린, 세린, 그리고 비필수 아미노산인 티로신을 합성하는 효소를 가지고 있습니다.그들은 아르기닌과 히스티딘을 합성할 수는 있지만, 성장하는 어린 동물들에게는 충분한 양의 아르기닌을 생산할 수 없기 때문에 종종 필수 아미노산으로 여겨집니다.
아미노산에서 아미노기를 제거하면 α-케토산이라고 불리는 탄소 골격을 남깁니다.트랜스아미나제라고 불리는 효소는 아미노기를 한 아미노산에서 다른 α-케토산으로 쉽게 옮길 수 있습니다.이것은 아미노산의 생합성에서 중요한데, 많은 경로의 경우 다른 생화학적 경로의 중간체가 α-케토산 골격으로 전환된 후 아미노기가 추가되며, 종종 트랜스아민화를 통해 생성됩니다.아미노산은 서로 연결되어 단백질을 형성할 수 있습니다.
비슷한 과정이 단백질을 분해하는데 사용됩니다.먼저 구성 성분인 아미노산으로 가수분해됩니다.혈중 암모늄 이온(NH4+)으로 존재하는 유리 암모니아(NH3)는 생명체에 독성이 있습니다.따라서 그것을 배설하기 위한 적절한 방법이 존재해야 합니다.동물의 필요에 따라 다른 전략이 동물마다 진화해왔습니다.단세포 생물은 암모니아를 환경으로 방출합니다.마찬가지로 경골 어류는 암모니아를 물 속으로 방출할 수 있고, 암모니아는 빠르게 희석됩니다.일반적으로 포유류는 요소순환을 통해 암모니아를 요소로 전환합니다.
두 단백질이 관련이 있는지, 다시 말해서 상동인지 아닌지를 결정하기 위해, 과학자들은 서열 비교 방법을 사용합니다.서열 정렬 및 구조 정렬과 같은 방법은 과학자들이 관련 분자 간 상동성을 식별하는 데 도움을 주는 강력한 도구입니다.단백질 간의 상동성을 찾는 것의 관련성은 단백질 가족의 진화적 패턴을 형성하는 것을 넘어섭니다.두 단백질 서열이 얼마나 유사한지를 발견함으로써, 우리는 그들의 구조와 따라서 그들의 기능에 대한 지식을 얻습니다.
핵산

세포핵에 널리 존재하기 때문에 소위 불리는 핵산은 생체고분자의 총칭입니다.그것들은 모든 살아있는 세포와 바이러스에서 유전적 정보를 전달할 수 있는 복잡하고 고분자량의 생화학적 거대분자입니다.[2]그 단량체들은 뉴클레오티드라고 불리고, 각각은 질소성 헤테로고리 염기 (퓨린 또는 피리미딘), 펜토스 당, 그리고 인산기의 세 가지 성분으로 구성됩니다.[45]
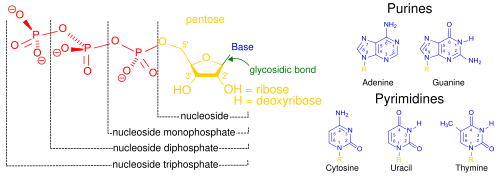
가장 흔한 핵산은 디옥시리보핵산(DNA)과 리보핵산(RNA)입니다.각각의 뉴클레오티드의 인산기와 당은 서로 결합하여 핵산의 뼈대를 형성하고, 질소 염기의 배열은 정보를 저장합니다.가장 흔한 질소 염기는 아데닌, 사이토신, 구아닌, 티민, 유라실입니다.핵산의 각 가닥의 질소 염기는 (지퍼와 유사한) 상보적인 핵산 가닥에서 특정 다른 질소 염기와 수소 결합을 형성할 것입니다.아데닌은 티민, 유라실과 결합하고, 티민은 아데닌과만 결합하고, 사이토신과 구아닌은 서로만 결합할 수 있습니다.아데닌과 티민&아데닌, 우라실은 두 개의 수소 결합을 포함하고 있고, 사이토신과 구아닌 사이에 형성된 수소 결합은 세 개입니다.
세포의 유전적 물질 이외에도, 핵산은 종종 모든 살아있는 유기체에서 발견되는 주요 에너지 전달 분자인 아데노신 삼인산(ATP)의 기본 분자를 형성할 뿐만 아니라 두 번째 전달자로서의 역할을 합니다.또한, 두 핵산에서 가능한 질소 염기는 다릅니다: 아데닌, 사이토신, 구아닌은 RNA와 DNA 모두에서 발생하는 반면, 티민은 DNA에서만 발생하고 유라실은 RNA에서 발생합니다.
신진대사
에너지원으로서의 탄수화물
포도당은 대부분의 생명체에서 에너지원입니다.예를 들어, 다당류는 효소에 의해 그 단량체로 분해됩니다(글리코겐 인산화효소는 다당류인 글리코겐으로부터 포도당 잔기를 제거합니다).락토오스나 수크로스와 같은 이당류는 두 성분의 단당류로 분해됩니다.[citation needed]
해당과정 (무기질)
포도당은 주로 해당과정이라고 불리는 매우 중요한 열 단계 경로에 의해 대사되는데, 그 결과 한 분자의 포도당을 두 분자의 피루브산으로 분해하는 것입니다.이것은 또한 NAD+(니코틴아마이드 아데닌 다이뉴클레오티드: 산화된 형태)를 NADH(니코틴아마이드 아데닌 다이뉴클레오티드: 환원된 형태)로 변환시키는 2개의 환원 당량과 함께 세포의 에너지 통화인 ATP의 순 2분자를 생성합니다.산소가 없으면(또는 세포가 산소를 사용할 수 없으면) 피루브산을 젖산(젖산) 또는 에탄올과 이산화탄소(효모)로 전환하여 NAD를 복구합니다(예: 효모).갈락토스와 과당과 같은 다른 단당류는 해당과정의 중간생성물로 전환될 수 있습니다.[46]
에어로빅
대부분의 인간 세포와 마찬가지로 충분한 산소를 가진 호기성 세포에서 피루브산은 추가적으로 대사됩니다.이것은 아세틸-CoA로 비가역적으로 전환되어 하나의 탄소 원자를 이산화탄소로 방출하고 NADH와 같은 또 다른 환원당량을 생성합니다.두 분자의 아세틸-CoA(한 분자의 포도당으로부터)는 시트르산 회로로 들어가 ATP 두 분자, NADH 여섯 분자, UBI2 퀴논 두 개를 더 생성하고 남은 탄소 원자를 이산화탄소로 방출합니다.생성된 NADH와 퀴놀 분자는 궁극적으로 전자를 산소로 전달하고 방출된 에너지를 막(진핵생물의 미토콘드리아 내막) 위에 양성자 기울기 형태로 보존하는 전자 수송 시스템인 호흡 사슬의 효소 복합체에 공급됩니다.따라서 산소가 물로 환원되고 원래의 전자 수용체 NAD와+ 퀴논이 재생됩니다.이것이 인간이 산소를 들이마시고 이산화탄소를 내뿜는 이유입니다.NADH와 퀴놀의 고에너지 상태에서 전자를 전달할 때 방출되는 에너지는 먼저 양성자 구배로 보존되고 ATP 합성효소를 통해 ATP로 변환됩니다.이것은 추가적으로 28개의 ATP를 생성하며(8개의 NADH + 2개의 퀴놀로부터 4개의 NADH로부터 24개), 분해된 포도당 1개당 총 32개의 ATP를 생성합니다([47]해당과정으로부터 2개 + 시트레이트 사이클로부터 2개).포도당을 완전히 산화시키기 위해 산소를 사용하는 것이 어떤 산소 독립적인 대사 특성보다 훨씬 더 많은 에너지를 유기체에게 제공한다는 것은 분명하며, 이것이 지구 대기가 많은 양의 산소를 축적한 후에야 복잡한 생명체가 나타난 이유라고 생각됩니다.
포도당신생합성
척추동물에서, 격렬하게 수축하는 골격근은 (예를 들어, 역도나 단거리 경주 중에) 에너지 수요를 충족시키기에 충분한 산소를 공급받지 못하므로, 포도당을 젖산으로 전환하는 혐기성 대사로 전환됩니다.지방과 단백질과 같은 비탄수화물에서 유래된 포도당의 조합.이것은 간에 있는 글리코겐 공급물이 다 닳았을 때만 일어납니다.이 경로는 피루브산에서 포도당으로의 해당과정의 결정적인 반전이며 아미노산, 글리세롤 및 크렙스 사이클과 같은 많은 공급원을 사용할 수 있습니다.대규모 단백질과 지방의 이화작용은 보통 기아나 특정 내분비 질환으로 고통 받을 때 일어납니다.[48]간은 포도당신생합성이라는 과정을 이용하여 포도당을 재생합니다.이 과정은 해당과정과 정반대는 아니며, 실제로 해당과정에서 얻은 에너지의 3배를 필요로 합니다(해당과정에서 얻은 두 분자에 비해 ATP가 6개 사용됨).위의 반응과 유사하게, 생성된 포도당은 에너지가 필요한 조직에서 해당과정을 거치거나, 글리코젠(또는 식물의 전분)으로 저장되거나, 다른 단당류로 전환되거나, 디- 또는 올리고당으로 결합될 수 있습니다.운동 중 해당과정, 젖산이 혈류를 통해 간으로 교차하는 것, 이후 포도당신합성 및 포도당이 혈류로 방출되는 것을 코리 사이클이라고 합니다.[49]
다른 "분자 규모" 생물과학과의 관계

생화학의 연구자들은 생화학 고유의 특정한 기술들을 사용하지만, 점점 유전학, 분자 생물학, 생물 물리학 분야에서 발전된 기술과 아이디어를 결합합니다.이들 분야 사이에는 정의된 선이 없습니다.생화학은 분자의 생물학적 활동에 필요한 화학을 연구하고, 분자생물학은 그들의 생물학적 활동을 연구하고, 유전학은 그들의 유전을 연구하고, 유전학은 그들의 유전을 연구합니다.이는 필드 간의 관계에 대한 가능한 한 가지 보기를 나타내는 다음 도식에 나와 있습니다.
- 생화학은 살아있는 유기체에서 일어나는 화학물질과 중요한 과정을 연구하는 학문입니다.생화학자들은 생체 분자의 역할, 기능, 구조에 집중합니다.생물학적 과정 뒤에 있는 화학에 대한 연구와 생물학적 활성 분자의 합성은 생화학의 응용입니다.생화학은 생명체를 원자와 분자 수준으로 연구합니다.
- 유전학은 생물체의 유전적 차이의 영향을 연구하는 학문입니다.이것은 종종 정상적인 구성 요소(예: 하나의 유전자)의 부재로 추론될 수 있습니다."돌연변이"에 대한 연구 – 소위 "야생형" 또는 정상 표현형에 대해 하나 이상의 기능적 구성 요소가 부족한 유기체.유전적 상호작용(에피스타시스)은 종종 그러한 "녹아웃" 연구에 대한 간단한 해석을 혼란스럽게 할 수 있습니다.
- 분자생물학은 분자합성, 변형, 메커니즘 및 상호작용에 초점을 맞춘 생물학적 현상의 분자적 기초를 연구하는 학문입니다.유전 물질이 RNA로 전사되고 지나치게 단순화되었음에도 불구하고 단백질로 번역되는 분자생물학의 중심 교조는 여전히 이 분야를 이해하는 데 좋은 출발점을 제공합니다.이 개념은 RNA의 새로운 역할을 고려하여 수정되었습니다.
- 화학 생물학은 그 기능에 대한 상세한 정보를 제공하면서 생물학적 시스템의 동요를 최소화할 수 있는 작은 분자에 기반한 새로운 도구를 개발하려고 합니다.또한, 화학 생물학은 생물학적 시스템을 사용하여 생체 분자와 합성 장치(예: 유전자 치료 또는 약물 분자를 전달할 수 있는 비어있는 바이러스 캡시드) 사이에 비자연적인 하이브리드를 생성합니다.
참고 항목
목록
참고 항목
메모들
a. ^ 과당은 과일에서 발견되는 유일한 설탕이 아닙니다.포도당과 자당은 또한 다양한 과일에서 다양한 양으로 발견되며, 때로는 존재하는 과당을 초과하기도 합니다.예를 들어, 24%의 과당과 8%의 자당과 비교하여, 날짜에서 먹을 수 있는 부분의 32%는 포도당입니다.그러나 복숭아에는 과당(0.93%)이나 포도당(1.47%)[50]보다 자당(6.66%)이 더 많이 들어 있습니다.
참고문헌
- ^ "Biological/Biochemistry". acs.org.
- ^ a b Voet (2005), p. 3.
- ^ Karp (2009), p. 2.
- ^ 밀러(2012). 62쪽.
- ^ 애스트베리 (1961), 페이지 1124.
- ^ 엘드라(2007), p. 45.
- ^ 마크스(2012), 14장.
- ^ 핑켈(2009), 1-4쪽.
- ^ 유니세프 (2010), 61, 75쪽.
- ^ "Biotechnology in Biochemistry". Unacademy. Retrieved 1 August 2023.
- ^ a b 헬부르트(2000), 페이지 81.
- ^ 헌터(2000), 페이지 75.
- ^ 햄블린(2005), 페이지 26.
- ^ Hunter (2000), 페이지 96–98.
- ^ Berg (1980), pp. 1–2.
- ^ 홈즈 (1987), p. xv.
- ^ Feldman (2001), 페이지 206.
- ^ 레이너-캔햄(2005), 페이지 136.
- ^ 지삭(1999), 169쪽.
- ^ 클라인카우프(Kleinkauf, 1988), 페이지 116.
- ^ 벤-메나헴(2009), 페이지 2982.
- ^ Amsler (1986), p. 55.
- ^ 호튼(2013), 페이지 36.
- ^ 클라인카우프(Kleinkauf, 1988), 페이지 43.
- ^ Edwards (1992), pp. 1161–1173.
- ^ 피스케 (1890), 페이지 419-20.
- ^ Wöhler, F. (1828). "Ueber künstliche Bildung des Harnstoffs". Annalen der Physik und Chemie. 88 (2): 253–256. Bibcode:1828AnP....88..253W. doi:10.1002/andp.18280880206. ISSN 0003-3804.
- ^ 카우프만(2001), 121-133쪽
- ^ Lipman, Timothy O. (August 1964). "Wohler's preparation of urea and the fate of vitalism". Journal of Chemical Education. 41 (8): 452. Bibcode:1964JChEd..41..452L. doi:10.1021/ed041p452. ISSN 0021-9584.
- ^ Tropp (2012), pp. 19–20.
- ^ 크렙스(2012), p. 32.
- ^ 버틀러 (2009), p. 5.
- ^ Chandan (2007), pp. 193–194.
- ^ Cox, Nelson, Lehninger (2008). Lehninger Principles of Biochemistry. Macmillan.
{{cite book}}: CS1 유지 : 여러 이름 : 저자 목록 (링크) - ^ 닐슨 (1999), pp. 283–303.
- ^ Slabaugh (2007), pp. 3-6.
- ^ Whiting (1970), pp. 1-31.
- ^ Voet (2005), pp. 358–359.
- ^ Varki (1999), p. 17.
- ^ Stryer (2007), 페이지 328.
- ^ Voet (2005), Ch. 12 지질 및 막
- ^ Metzler (2001), p. 58.
- ^ Feige, Matthias J.; Hendershot, Linda M.; Buchner, Johannes (2010). "How antibodies fold". Trends in Biochemical Sciences. 35 (4): 189–198. doi:10.1016/j.tibs.2009.11.005. PMC 4716677. PMID 20022755.
- ^ Fromm and Hargrove (2012), pp. 35–51.
- ^ 생거(1984), 페이지 84.
- ^ Fromm and Hargrove (2012), pp. 163–180.
- ^ Voet (2005), Ch. 17 당분해.
- ^ A Dictionary of Biology. Oxford University Press. 17 September 2015. ISBN 9780198714378.
- ^ Fromm and Hargrove (2012), pp. 183–194.
- ^ Whiting, G.C. (1970), p. 5.
인용문헌
- Amsler, Mark (1986). The Languages of Creativity: Models, Problem-solving, Discourse. University of Delaware Press. ISBN 978-0-87413-280-9.
- Astbury, W.T. (1961). "Molecular Biology or Ultrastructural Biology ?". Nature. 190 (4781): 1124. Bibcode:1961Natur.190.1124A. doi:10.1038/1901124a0. PMID 13684868. S2CID 4172248.
- Ben-Menahem, Ari (2009). Historical Encyclopedia of Natural and Mathematical Sciences. Springer. p. 2982. Bibcode:2009henm.book.....B. ISBN 978-3-540-68831-0.
- Burton, Feldman (2001). The Nobel Prize: A History of Genius, Controversy, and Prestige. Arcade Publishing. ISBN 978-1-55970-592-9.
- Butler, John M. (2009). Fundamentals of Forensic DNA Typing. Academic Press. ISBN 978-0-08-096176-7.
- Sen, Chandan K.; Roy, Sashwati (2007). "MiRNA: Licensed to Kill the Messenger". DNA and Cell Biology. 26 (4): 193–194. doi:10.1089/dna.2006.0567. PMID 17465885. S2CID 10665411.
- Clarence, Peter Berg (1980). The University of Iowa and Biochemistry from Their Beginnings. University of Iowa. ISBN 978-0-87414-014-9.
- Edwards, Karen J.; Brown, David G.; Spink, Neil; Skelly, Jane V.; Neidle, Stephen (1992). "Molecular structure of the B-DNA dodecamer d(CGCAAATTTGCG)2 an examination of propeller twist and minor-groove water structure at 2·2Åresolution". Journal of Molecular Biology. 226 (4): 1161–1173. doi:10.1016/0022-2836(92)91059-x. PMID 1518049.
- Eldra P. Solomon; Linda R. Berg; Diana W. Martin (2007). Biology, 8th Edition, International Student Edition. Thomson Brooks/Cole. ISBN 978-0-495-31714-2. Archived from the original on 2016-03-04.
- Fariselli, P.; Rossi, I.; Capriotti, E.; Casadio, R. (2006). "The WWWH of remote homolog detection: The state of the art". Briefings in Bioinformatics. 8 (2): 78–87. doi:10.1093/bib/bbl032. PMID 17003074.
- Fiske, John (1890). Outlines of Cosmic Philosophy Based on the Doctrines of Evolution, with Criticisms on the Positive Philosophy, Volume 1. Boston and New York: Houghton, Mifflin. Retrieved 16 February 2015.
- Finkel, Richard; Cubeddu, Luigi; Clark, Michelle (2009). Lippincott's Illustrated Reviews: Pharmacology (4th ed.). Lippincott Williams & Wilkins. ISBN 978-0-7817-7155-9.
- Krebs, Jocelyn E.; Goldstein, Elliott S.; Lewin, Benjamin; Kilpatrick, Stephen T. (2012). Essential Genes. Jones & Bartlett Publishers. ISBN 978-1-4496-1265-8.
- Fromm, Herbert J.; Hargrove, Mark (2012). Essentials of Biochemistry. Springer. ISBN 978-3-642-19623-2.
- Hamblin, Jacob Darwin (2005). Science in the Early Twentieth Century: An Encyclopedia. ABC-CLIO. ISBN 978-1-85109-665-7.
- Helvoort, Ton van (2000). Arne Hessenbruch (ed.). Reader's Guide to the History of Science. Fitzroy Dearborn Publishing. ISBN 978-1-884964-29-9.
- Holmes, Frederic Lawrence (1987). Lavoisier and the Chemistry of Life: An Exploration of Scientific Creativity. University of Wisconsin Press. ISBN 978-0-299-09984-8.
- Horton, Derek, ed. (2013). Advances in Carbohydrate Chemistry and Biochemistry, Volume 70. Academic Press. ISBN 978-0-12-408112-3.
- Hunter, Graeme K. (2000). Vital Forces: The Discovery of the Molecular Basis of Life. Academic Press. ISBN 978-0-12-361811-5.
- Karp, Gerald (2009). Cell and Molecular Biology: Concepts and Experiments. John Wiley & Sons. ISBN 978-0-470-48337-4.
- Kauffman, George B.; Chooljian, Steven H. (2001). "Friedrich Wöhler (1800–1882), on the Bicentennial of His Birth". The Chemical Educator. 6 (2): 121–133. doi:10.1007/s00897010444a. S2CID 93425404.
- Kleinkauf, Horst; Döhren, Hans von; Jaenicke Lothar (1988). The Roots of Modern Biochemistry: Fritz Lippmann's Squiggle and its Consequences. Walter de Gruyter & Co. p. 116. ISBN 978-3-11-085245-5.
- Knowles, J.R. (1980). "Enzyme-Catalyzed Phosphoryl Transfer Reactions". Annual Review of Biochemistry. 49: 877–919. doi:10.1146/annurev.bi.49.070180.004305. PMID 6250450. S2CID 7452392.
- Metzler, David Everett; Metzler, Carol M. (2001). Biochemistry: The Chemical Reactions of Living Cells. Vol. 1. Academic Press. ISBN 978-0-12-492540-3.
- Miller G; Spoolman Scott (2012). Environmental Science – Biodiversity Is a Crucial Part of the Earth's Natural Capital. Cengage Learning. ISBN 978-1-133-70787-5. Retrieved 2016-01-04.
- Nielsen, Forrest H. (1999). "Ultratrace minerals". In Maurice E. Shils; et al. (eds.). Modern Nutrition in Health and Disease. Baltimore: Williams & Wilkins. pp. 283–303. hdl:10113/46493.
- Peet, Alisa (2012). Marks, Allan; Lieberman Michael A. (eds.). Marks' Basic Medical Biochemistry (Lieberman, Marks's Basic Medical Biochemistry) (4th ed.). Lippincott Williams & Wilkins. ISBN 978-1-60831-572-7.
- Rayner-Canham, Marelene F.; Rayner-Canham, Marelene; Rayner-Canham, Geoffrey (2005). Women in Chemistry: Their Changing Roles from Alchemical Times to the Mid-Twentieth Century. Chemical Heritage Foundation. ISBN 978-0-941901-27-7.
- Rojas-Ruiz, Fernando A.; Vargas-Méndez, Leonor Y.; Kouznetsov, Vladimir V. (2011). "Challenges and Perspectives of Chemical Biology, a Successful Multidisciplinary Field of Natural Sciences". Molecules. 16 (3): 2672–2687. doi:10.3390/molecules16032672. PMC 6259834. PMID 21441869.
- Saenger, Wolfram (1984). Principles of Nucleic Acid Structure. New York: Springer-Verlag. ISBN 978-0-387-90762-8.
- Slabaugh, Michael R.; Seager, Spencer L. (2013). Organic and Biochemistry for Today (6th ed.). Pacific Grove: Brooks Cole. ISBN 978-1-133-60514-0.
- Sherwood, Lauralee; Klandorf, Hillar; Yancey, Paul H. (2012). Animal Physiology: From Genes to Organisms. Cengage Learning. ISBN 978-0-8400-6865-1.
- Stryer L, Berg JM, Tymoczko JL (2007). Biochemistry (6th ed.). San Francisco: W.H. Freeman. ISBN 978-0-7167-8724-2.
- Tropp, Burton E. (2012). Molecular Biology (4th ed.). Jones & Bartlett Learning. ISBN 978-1-4496-0091-4.
- UNICEF (2010). Facts for life (PDF) (4th ed.). New York: United Nations Children's Fund. ISBN 978-92-806-4466-1. Archived (PDF) from the original on 2022-10-09.
- Ulveling, Damien; Francastel, Claire; Hubé, Florent (2011). "When one is better than two: RNA with dual functions" (PDF). Biochimie. 93 (4): 633–644. doi:10.1016/j.biochi.2010.11.004. PMID 21111023. S2CID 22165949. Archived (PDF) from the original on 2022-10-09.
- Varki A, Cummings R, Esko J, Jessica F, Hart G, Marth J (1999). Essentials of glycobiology. Cold Spring Harbor Laboratory Press. ISBN 978-0-87969-560-6.
- Voet, D; Voet, JG (2005). Biochemistry (3rd ed.). Hoboken, NJ: John Wiley & Sons Inc. ISBN 978-0-471-19350-0. Archived from the original on September 11, 2007.
- Whiting, G.C (1970). "Sugars". In A.C. Hulme (ed.). The Biochemistry of Fruits and their Products. Vol. 1. London & New York: Academic Press. ISBN 978-0-12-361201-4.
- Ziesak, Anne-Katrin; Cram Hans-Robert (1999). Walter de Gruyter Publishers, 1749–1999. Walter de Gruyter & Co. ISBN 978-3-11-016741-2.
- Ashcroft, Steve. "Professor Sir Philip Randle; Researcher into metabolism: [1st Edition]". Independent. ProQuest 311080685.
추가열람
- 프루톤, 조셉 S. 단백질, 효소, 유전자: 화학과 생물학의 상호작용.예일대학교 출판부:1999년 뉴헤이븐ISBN 0-300-07608-8
- Keith Roberts, Martin Raff, Bruce Alberts, Peter Walter, Julian Lewis, Alexander Johnson, 세포분자생물학
- 제4판, 루틀리지, 2002년 3월, 하드커버, 1616쪽ISBN 0-8153-3218-1
- 제3판, Garland, 1994, ISBN 0-8153-1620-8
- 제2판, Garland, 1989, ISBN 0-8240-3695-6
- 콜러, 로버트.의학 화학에서 생화학으로: 생물의학 분야를 만드는 것.캠브리지 대학 출판부, 1982.
- Maggio, Lauren A.; Willinsky, John M.; Steinberg, Ryan M.; Mietchen, Daniel; Wass, Joseph L.; Dong, Ting (2017). "Wikipedia as a gateway to biomedical research: The relative distribution and use of citations in the English Wikipedia". PLOS ONE. 12 (12): e0190046. Bibcode:2017PLoSO..1290046M. doi:10.1371/journal.pone.0190046. PMC 5739466. PMID 29267345.
외부 링크
| 라이브러리 리소스정보 생화학 |
- "Biochemical Society".
- 생화학, 분자생물학, 세포생물학 가상도서관
- 생화학, 5번째.NCBI 제공 Berg, Tymoczko, Stryer 전문.
- SystemsX.ch – 스위스 시스템 생물학 이니셔티브
- 생화학 입문 교재 케빈과 인디라의 생화학 전문.







