항생제
Antibiotic| 항생제 | |
|---|---|
| 약물반 | |
 항생제에 대한 황색포도상구균의 민감도를 Kirby-Bauer 디스크 확산 방법으로 테스트 – 항생제가 포함된 디스크에서 확산되고 황색포도상구균의 성장을 억제하여 억제 영역이 발생합니다. | |
| 법적 지위 | |
| 위키데이터에서 |
항생제는 박테리아에 대해 활성인 항균 물질의 한 종류입니다. 세균 감염과 싸우기 위한 가장 중요한 종류의 항균제이며, 항생제는 이러한 감염의 치료와 예방에 널리 사용됩니다.[1][2] 그들은 박테리아의 성장을 죽이거나 억제할 수 있습니다. 제한된 수의 항생제도 항원충 활성을 가지고 있습니다.[3][4] 항생제는 감기나 인플루엔자를 일으키는 바이러스에 효과가 없습니다.[5] 바이러스의 성장을 억제하는 약을 항생제보다는 항바이러스제 또는 항바이러스제라고 합니다. 또한 곰팡이에 효과적이지 않습니다. 곰팡이의 성장을 억제하는 약을 항진균제라고 합니다.
때때로, 항생제는 그리스어의 ἀντι 안티(anti)와 β ίος 바이오스(bios)로부터 "생명과 반대되는 생명"이라는 용어로 널리 사용되지만, 일반적인 의학적 용도에서 항생제는 (한 미생물이 다른 미생물과 싸워) 자연적으로 생산되는 것을 말합니다. 비 antib 항생제 항균제(술폰아미드 및 방부제 등)는 완전히 합성된 반면. 그러나 두 부류 모두 미생물을 죽이거나 증식을 막는다는 목표는 같고, 둘 다 항균 화학요법에 포함됩니다. "항균제"에는 살균제, 정균제, 항균 비누 및 화학 소독제가 포함되는 반면, 항생제는 의약품[6] 및 때로는 가축 사료에 더 구체적으로 사용되는 중요한 종류의 항균제입니다.
항생제는 예로부터 사용되어 왔습니다. 고대 이집트, 누비아, 중국, 세르비아, 그리스 및 로마에서 발생한 유익한 효과에 대해 많은 언급과 함께 많은 문명이 곰팡이가 핀 빵의 국소 적용을 사용했습니다.[7] 감염을 치료하기 위한 곰팡이의 사용을 직접적으로 기록한 최초의 사람은 존 파킨슨(1567–1650)입니다. 항생제는 20세기에 의학에 혁명을 일으켰습니다. 항균제의 과학과 개발로서 합성항생제 화학요법은 1880년대 후반 폴 에를리히와 함께 독일에서 시작되었습니다.[8] 알렉산더 플레밍(Alexander Fleming, 1881–1955)은 1928년 현대 페니실린을 발견했는데, 이 페니실린의 광범위한 사용은 전시에 상당히 유익한 것으로 입증되었습니다. 최초의 술폰아미드와 최초의 전신 활성 항균 약물인 프론토실은 1932년 또는 1933년 독일 IG 파벤 대기업의 바이엘 연구소에서 게르하르트 도마그크가 이끄는 연구팀에 의해 개발되었습니다.[9][10][11] 하지만, 항생제에 대한 효과와 쉬운 접근성으로 인해 항생제를 남용하게[12] 되었고 일부 박테리아는 항생제에 대한 내성을 진화시켰습니다.[1][13][14][15] 세계보건기구는 항생제 내성을 광범위한 "더 이상 미래에 대한 예측이 아니며, 지금 세계의 모든 지역에서 일어나고 있으며, 모든 연령대와 모든 국가에서 영향을 미칠 가능성이 있다"고 분류했습니다.[16] 항생제 내성으로 인한 전 세계 사망자는 2019년 127만 명에 달했습니다.[17]
어원
'생명에 대항한다'는 뜻의 '항생제'라는 용어는 프랑스의 세균학자 장 폴 뷔일민(Jean Paul Vuillemin)이 이 초기 항균제들이 보여주는 현상을 설명하는 이름으로 소개했습니다.[8][18][19] 항생제는 1877년 루이스 파스퇴르(Louis Pasteur)와 로베르트 코흐(Robert Koch)가 공기 중의 바실러스가 탄저균의 성장을 억제할 수 있다는 것을 관찰하면서 박테리아에서 처음 기술되었습니다.[18][20] 이 약들은 나중에 1947년에 미국의 미생물학자인 셀만 왁스먼에 의해 항생제로 이름이 바뀌었습니다.[21]
항생제라는 용어는 1942년 셀만 와크스만과 그의 협력자들이 저널 기사에서 다른 미생물의 성장에 길항하는 미생물에 의해 생성되는 모든 물질을 고희석에서 설명하기 위해 처음 사용되었습니다.[18][22] 이 정의는 박테리아를 죽이지만 미생물에 의해 생성되지 않는 물질(예: 위액 및 과산화수소)을 제외했습니다. 또한 술폰아미드와 같은 합성 항균 화합물을 제외했습니다. 현재 사용 중인 항생제는 미생물에 의해 만들어지는 약인지 아닌지에 관계없이 박테리아를 죽이거나 박테리아의 성장을 억제하는 모든 약물에 적용됩니다.[23][24]
"항생제"라는 용어는 항 + β ιωτικός(bioticos), "생명에 적합한, 생기있는"에서 유래하며, 이는 β ίωσις(biosis), "생명의 방식", 그리고 β ίος(bios), "생명"에서 유래합니다. "항박테리아"라는 용어는 그리스어 ἀντί(anti), "대항" + βα κτήριον(bakt ē리온), βα κτηρία(bakt ē리아)의 감소, "직원, 지팡이"에서 유래했습니다. 왜냐하면 최초로 발견된 박테리아가 막대 모양이었기 때문입니다.
사용.
의료용
항생제는 세균 감염,[32] 때로는 원생동물 감염을 치료하거나 예방하는 데 사용됩니다. (메트로니다졸은 여러 기생충 질환에 효과가 있습니다.) 감염이 질병의 원인으로 의심되지만 원인 병원체가 확인되지 않은 경우 경험적 요법을 채택합니다.[33] 여기에는 제시된 징후와 증상을 기반으로 광범위한 항생제를 투여하는 것이 포함되며 며칠이 걸릴 수 있는 실험실 결과가 나올 때까지 시작됩니다.[32][33]
책임 있는 병원성 미생물이 이미 알려져 있거나 확인되었을 때 확정적인 치료를 시작할 수 있습니다. 이것은 일반적으로 좁은 스펙트럼의 항생제를 사용하는 것을 포함합니다. 주어진 항생제의 선택은 또한 비용에 따라 결정됩니다. 동정은 항생제 치료의 비용과 독성을 줄일 수 있고 또한 항생제 내성의 출현 가능성을 줄일 수 있기 때문에 매우 중요합니다.[33] 수술을 피하기 위해 합병증이 없는 급성 맹장염에 항생제를 투여할 수 있습니다.[34]
항생제는 예방책으로 투여될 수 있으며, 이는 일반적으로 면역체계가 약화된 사람들(특히 폐렴을 예방하기 위한 HIV의 경우), 면역억제제를 복용하는 사람들, 암 환자들, 그리고 수술을 받는 사람들과 같은 위험에 처한 사람들로 제한됩니다.[32] 수술 절차에 사용하는 것은 절개의 감염을 예방하는 데 도움이 됩니다. 그들은 그들의 사용이 균혈증과 그로 인한 감염성 심내막염을 예방할 수 있는 치과 항생제 예방에 중요한 역할을 합니다. 항생제는 특히 암과 관련된 호중구감소증의 경우 감염을 예방하는 데에도 사용됩니다.[35][36]
관상동맥 심장질환의 2차 예방을 위한 항생제 사용은 현재의 과학적 증거에 의해 뒷받침되지 않으며 실제로 심혈관 사망률, 모든 원인에 의한 사망률 및 뇌졸중 발생을 증가시킬 수 있습니다.[37]
행정경로
항생제 치료를 위한 다양한 투여 경로가 있습니다. 항생제는 보통 입으로 복용합니다. 더 심한 경우, 특히 심부 전신 감염의 경우 항생제를 정맥 주사 또는 주사로 투여할 수 있습니다.[1][33] 감염 부위에 쉽게 접근할 수 있는 경우 결막염의 경우 결막에 점안제 형태로 항생제를 투여하거나 귀 감염 및 수영하는 사람의 급성 귀 감염의 경우 점안제를 투여할 수 있습니다. 국소 사용은 여드름 및 봉와직염을 포함한 일부 피부 상태에 대한 치료 옵션 중 하나입니다.[38] 국소 적용의 장점은 감염 부위에서 항생제의 높은 농도와 지속적인 농도를 달성하는 것을 포함합니다. 전신 흡수 및 독성의 가능성을 줄이고 필요한 항생제의 총 부피를 줄임으로써 항생제 오남용의 위험을 줄일 수 있습니다.[39] 특정 유형의 수술 상처에 적용된 국소 항생제는 수술 부위 감염 위험을 줄이는 것으로 보고되었습니다.[40] 그러나 항생제의 국소 투여와 관련하여 우려되는 특정한 일반적인 원인이 있습니다. 항생제의 전신 흡수가 일부 일어날 수 있고, 항생제의 도포량이 정확하게 투여되기 어렵고 국소 과민반응이나 접촉성 피부염이 발생할 가능성도 있습니다.[39] 특히 생명을 위협하는 감염자에게는 가능한 한 빨리 항생제를 투여하는 것이 좋습니다. 많은 응급 부서에서 이를 위해 항생제를 비축합니다.[41]
글로벌소비
항생제 소비는 국가에 따라 매우 다릅니다. 2018년에 발표된 WHO 항생제 소비 감시 보고서는 65개국의 2015년 데이터를 분석했습니다. 1일 거주자 1,000명당 정의된 일일 선량으로 측정됩니다. 소비율은 몽골이 64.4%로 가장 높았습니다. 부룬디가 4.4로 가장 낮았습니다. 아목시실린과 아목시실린/클라불란산이 가장 많이 섭취되었습니다.[42]
부작용

항생제는 임상용으로 승인되기 전에 부정적인 영향이 있는지 검사되며, 일반적으로 안전하고 내약성이 좋은 것으로 간주됩니다. 그러나 일부 항생제는 사용되는 항생제의 종류, 표적 미생물 및 개별 환자에 따라 경미한 것에서 매우 심각한 것에 이르는 광범위한 부작용과 관련이 있습니다.[43][44] 부작용은 항생제의 약리학적 또는 독성학적 특성을 반영하거나 과민 반응 또는 알레르기 반응을 수반할 수 있습니다.[4] 부작용은 발열, 메스꺼움부터 광피부염, 아나필락시스를 포함한 주요 알레르기 반응까지 다양합니다.[45]
경구 항생제의 일반적인 부작용으로는 설사, 예를 들어 클로스트리디움 디피실레와 같은 병원성 박테리아의 과증식으로 인한 설사가 있습니다.[46] 항생제 치료 과정에서 생균제를 복용하면 항생제 관련 설사를 예방하는 데 도움이 될 수 있습니다.[47] 항균제는 또한 질 식물군에 영향을 미칠 수 있으며 외음부에 있는 칸디다 속 효모 종의 과증식을 초래할 수 있습니다.[48] 퀴놀론계 항생제와 전신 코르티코스테로이드 투여로 인한 힘줄 손상 가능성과 같은 다른 약물과의 상호 작용으로 인해 추가 부작용이 발생할 수 있습니다.[49]
일부 항생제는 또한 인간 세포를 포함한 진핵생물에서 발견되는 박테리아 유래 소기관인 미토콘드리아를 손상시킬 수 있습니다.[citation needed] 미토콘드리아 손상은 세포의 산화 스트레스를 유발하며 플루오로퀴놀론에 의한 부작용의 기전으로 제시되었습니다.[50] 엽록체에도 영향을 미치는 것으로 알려져 있습니다.[51]
상호작용
피임약
항생제 사용이 경구 피임 실패 위험을 높이는지에 대한 잘 통제된 연구는 거의 없습니다.[52] 항생제로 인한 피임약의 실패율이 매우 낮다는 임상연구 [53]등 대부분의 연구는 항생제가 피임약을 방해하지 않는다는 것을 보여줍니다(약 1%).[54] 경구피임제 실패의 위험을 높일 수 있는 상황으로는 부적합(알약 복용 누락), 구토, 설사 등이 있습니다. 위장 장애 또는 경구 피임 흡수의 환자 간 가변성이 혈액 내 에티닐에스트라디올 혈청 수치에 영향을 미칩니다.[52] 생리불순이 있는 여성은 실패 위험이 더 높을 수 있으므로 항생제 치료 중과 완료 후 1주일 동안은 백업피임제를 사용하는 것이 좋습니다. 경구피임약효 감소에 대한 환자별 위험인자가 의심되는 경우 백업피임약을 권장합니다.[52]
광범위 항생제 리팜피신과 같이 피임약의 효율에 영향을 미치는 항생제가 제시된 경우, 이러한 경우는 간 효소의 활성 증가로 인해 알약의 활성 성분 분해가 증가하기 때문일 수 있습니다.[53] 대장에서 에스트로겐의 흡수를 감소시킬 수 있는 장내 세균총에 대한 영향도 제안되었지만 그러한 제안은 결정적이지 않고 논란의 여지가 있습니다.[55][56] 임상의들은 경구피임제와 상호 작용이 의심되는 항생제를 사용한 치료 중에 추가 피임 조치를 적용할 것을 권고했습니다.[53] 항생제와 피임약(구강피임제) 사이의 가능한 상호작용에 대한 더 많은 연구와 함께 백업 피임약의 필요성을 일축하기 전에 잠재적인 경구 수축제 실패에 대한 환자별 위험 요소에 대한 신중한 평가가 필요합니다.[52]
술
알코올과 특정 항생제 사이의 상호작용이 발생할 수 있으며 부작용과 항생제 치료의 효과 저하를 유발할 수 있습니다.[57][58] 적당한 알코올 섭취가 많은 일반적인 항생제를 방해할 가능성은 낮지만, 알코올 섭취가 심각한 부작용을 일으킬 수 있는 특정한 종류의 항생제가 있습니다.[59] 따라서 부작용과 효과의 잠재적인 위험은 투여되는 항생제의 종류에 따라 달라집니다.[60]
메트로니다졸, 티니다졸, 세파만돌, 라타목시프, 세페페라존, 세프메녹심, 푸라졸리돈 등의 항생제는 아세트알데히드 탈수소효소에 의한 분해를 억제하여 알코올과 디설피람 유사 화학반응을 일으켜 구토, 메스꺼움, 호흡곤란 등을 일으킬 수 있습니다.[59] 또한, 알코올 섭취에 의해 독시사이클린과 에리트로마이신 숙시네이트의 효능이 감소될 수 있습니다.[61] 항생제 활성에 대한 알코올의 다른 영향으로는 항생제 화합물을 분해하는 간 효소의 활성 변화가 있습니다.[27]
약동학
항균 화합물을 사용한 항균 요법의 성공적인 결과는 여러 요인에 달려 있습니다. 여기에는 숙주 방어 메커니즘, 감염 위치, 항균제의 약동학적 및 약동학적 특성이 포함됩니다.[62] 항균제의 살균 활성은 박테리아 성장 단계에 따라 다를 수 있으며, 지속적인 대사 활동과 박테리아 세포의 분열이 필요한 경우가 많습니다.[63] 이러한 연구 결과는 실험실 연구를 기반으로 하며 임상 환경에서도 박테리아 감염을 제거하는 것으로 나타났습니다.[62][64] 항균제의 활성은 농도에 따라 자주 달라지기 때문에,[65] 항균 활성의 시험관 내 특성화는 일반적으로 항균제의 최소 억제 농도 및 최소 살균 농도의 결정을 포함합니다.[62][66] 임상 결과를 예측하기 위해 항균제의 항균 활성은 일반적으로 약동학적 프로파일과 결합되며 여러 약리학적 매개변수가 약물 효능의 마커로 사용됩니다.[67]
병용요법
결핵을 포함한 중요한 전염병에서, 내성의 출현을 지연시키거나 예방하기 위해 조합 요법(즉, 두 가지 이상의 항생제를 동시에 적용하는 것)이 사용되어 왔습니다. 급성 세균성 감염에서는 두 항생제의 복합 효과가 개별 효과보다 더 좋기 때문에 치료 결과를 개선하기 위해 복합 요법의 일환으로 항생제를 처방합니다.[68][69] 포스포마이신은 항생제 중 가장 많은 시너지 효과가 있는 조합으로 거의 항상 파트너 약물로 사용됩니다.[70] 메티실린 내성 황색포도상구균 감염증은 푸시드산과 리팜피신의 병용요법으로 치료할 수 있습니다.[68] 조합하여 사용하는 항생제도 길항작용이 있을 수 있으며, 두 항생제의 조합 효과는 항생제 중 하나를 단독요법으로 투여했을 때보다 적을 수 있습니다.[68] 예를 들어 클로람페니콜과 테트라사이클린은 페니실린에 대한 길항제입니다. 그러나 이것은 박테리아의 종에 따라 다를 수 있습니다.[71] 일반적으로 정균 항생제와 살균 항생제의 조합은 길항작용을 합니다.[68][69]
한 항생제와 다른 항생제를 결합하는 것 외에도 항생제는 내성 변형제와 함께 투여되기도 합니다. 예를 들어, β-락탐 항생제는 환자가 β-락타마제를 생성하는 박테리아 균주에 감염되었을 때 클라불란산 또는 설박탐과 같은 β-락타마제 억제제와 함께 사용될 수 있습니다.[72]
반
- 세균 세포에 대한 항생제의 분자 표적
- 단백질 합성억제제(항생제)
항생제는 일반적으로 작용 메커니즘, 화학 구조 또는 활성 스펙트럼에 따라 분류됩니다. 대부분 박테리아 기능이나 성장 과정을 대상으로 합니다.[8] 박테리아 세포벽(페니실린 및 세팔로스포린) 또는 세포막(폴리믹신)을 표적으로 하거나 필수 박테리아 효소(리파마이신, 리파마이신, 퀴놀론 및 술폰아미드)를 방해하는 것은 살균 활성이 있어 박테리아를 죽입니다. 단백질 합성 억제제(macrolide, lincosamide 및 tetracycline)는 일반적으로 정균 작용을 하여 (박테리아성 아미노글리코사이드를 제외하고) 추가 성장을 억제합니다.[73] 추가 분류는 목표 특수성을 기반으로 합니다. "좁은 스펙트럼" 항생제는 그람 음성 또는 그람 양성과 같은 특정 유형의 박테리아를 대상으로 하는 반면, 넓은 스펙트럼 항생제는 광범위한 박테리아에 영향을 미칩니다. 항균 화합물의 종류를 발견하는 데 40년 동안 중단된 후, 2000년대 후반과 2010년대 초반에 네 가지 새로운 종류의 항생제가 임상에 도입되었습니다: 순환 리포펩티드(답토마이신 등), 글리실사이클린(티게사이클린 등), 옥사졸리디논(리네졸리드 등) 및 리피아미신(피닥소마이신 등).[74][75]
생산.
의학 화학의 발전으로 대부분의 현대 항균제는 다양한 천연 화합물의 반합성 변형입니다.[76] 여기에는 예를 들어, 페니실린(Penicillium 속 곰팡이에 의해 생성됨), 세팔로스포린 및 카바페넴을 포함하는 베타-락탐 항생제가 포함됩니다. 살아있는 유기체에서 여전히 추출된 화합물은 아미노글리코사이드인 반면, 다른 항균제, 예를 들어 술폰아미드, 퀴놀론 및 옥사졸리디논은 화학적 합성에 의해서만 생성됩니다.[76] 많은 항균 화합물은 분자량이 1000달톤 미만인 비교적 작은 분자입니다.[77]
1939년 하워드 플로리와 체인의 첫 선구적인 노력 이후, 의학에 대한 항균제를 포함한 항생제의 중요성은 항균제를 대규모로 생산하는 것에 대한 집중적인 연구로 이어졌습니다. 광범위한 박테리아에 대한 항균제를 선별한 후 활성 화합물의 생산은 일반적으로 강한 호기성 조건에서 발효를 사용하여 수행됩니다.[78]
레지스탕스
항생제 내성균의 출현은 주로 과용/오용으로 인해 발생하는 일반적인 현상입니다. 전 세계적으로 건강에 대한 위협을 나타냅니다.[79]
내성의 출현은 종종 항생제 치료 중에 일어나는 진화 과정을 반영합니다. 항생제 치료는 고용량의 항생제에서 생존할 수 있는 생리학적 또는 유전적으로 강화된 능력을 가진 박테리아 균주를 선택할 수 있습니다. 특정 조건에서는 내성균의 우선적인 성장을 초래할 수 있는 반면, 감수성균의 성장은 약물에 의해 억제됩니다.[80] 예를 들어, 이전에 획득한 항균 내성 유전자를 가진 균주에 대한 항균 선택은 1943년 Luria-Delbrück 실험에 의해 입증되었습니다.[81] 많은 박테리아 종과 균주에 대해 높은 효능을 보이던 페니실린과 에리트로마이신과 같은 항생제는 많은 박테리아 균주의 내성 증가로 인해 효과가 떨어졌습니다.[82]
내성은 약을 복용한 돼지 배설물을 통해 설파메타진에 도입된 설파메타진 분해 토양 박테리아와 같은 의약품의 생분해 형태를 취할 수 있습니다.[83] 세균의 생존은 유전적인 내성에서 비롯되는 경우가 많지만,[84] 항균제에 대한 내성의 성장은 수평적인 유전자 전달을 통해서도 발생합니다. 수평 이동은 항생제 사용이 잦은 곳에서 발생할 가능성이 더 높습니다.[85]
항균 내성은 생물학적 비용을 부과하여 내성 균주의 적합성을 감소시킬 수 있으며, 이는 예를 들어 항균 화합물이 없는 경우 항균 내성 박테리아의 확산을 제한할 수 있습니다. 그러나 추가 돌연변이는 이러한 건강 비용을 보상할 수 있으며 이러한 박테리아의 생존에 도움이 될 수 있습니다.[86]
고생물학적 데이터는 항생제와 항생제 내성이 모두 고대 화합물과 메커니즘임을 보여줍니다.[87] 유용한 항생제 표적은 돌연변이가 박테리아 번식이나 생존 가능성에 부정적인 영향을 미치는 표적입니다.[88]
항균 내성의 여러 분자 메커니즘이 존재합니다. 고유 항균 내성은 박테리아 균주의 유전적 구성의 일부일 수 있습니다.[89][90] 예를 들어, 박테리아 유전체에 항생제 표적이 없을 수 있습니다. 후천적 내성은 박테리아 염색체의 돌연변이 또는 염색체외 DNA의 획득으로 인해 발생합니다.[89] 항균을 생성하는 박테리아는 항균 내성 균주와 유사한 것으로 나타났으며 항균 내성 균주로 옮겨졌을 수도 있는 내성 메커니즘을 진화시켰습니다.[91][92] 항균 내성의 확산은 종종 성장 중 돌연변이의 수직 전파와 수평적 유전자 교환에 의한 DNA의 유전적 재조합을 통해 발생합니다.[84] 예를 들어, 항균 내성 유전자는 이러한 내성 유전자를 운반하는 플라스미드를 통해 서로 다른 박테리아 균주 또는 종 사이에서 교환될 수 있습니다.[84][93] 여러 다른 내성 유전자를 보유하는 플라스미드는 여러 항균제에 대한 내성을 부여할 수 있습니다.[93] 단일 유전자에 의해 암호화된 내성 메커니즘이 하나 이상의 항균 화합물에 내성을 전달할 때 여러 항균제에 대한 교차 내성이 발생할 수도 있습니다.[93]
때때로 "슈퍼버그"라고 불리는 항균 내성 균주와 종들은 이제 한동안 잘 통제되었던 질병의 출현에 기여합니다. 예를 들어, 이전에 효과적인 항균 치료에 내성이 있는 결핵을 유발하는 새로운 박테리아 균주는 많은 치료적 도전을 제기합니다. 매년 전 세계적으로 거의 50만 건의 새로운 다제내성결핵(MDR-TB) 환자가 발생하는 것으로 추정됩니다.[94] 예를 들어, NDM-1은 광범위한 베타-락탐 항균제에 대한 박테리아 내성을 전달하는 새로 확인된 효소입니다.[95] 영국 보건보호청은 "NDM-1 효소를 가진 대부분의 분리주가 중증 감염 치료를 위한 모든 표준 정맥 항생제에 내성을 보인다"고 밝혔습니다.[96] 2016년 5월 26일, 미국에서 "마지막 방어선" 항생제인 콜리스틴에 내성이 있는 대장균 "슈퍼버그"가 확인되었습니다.[97][98] 최근 몇 년 동안 역사적으로 내성 측면에서 덜 우려되는 것으로 간주되는 혐기성 박테리아조차도 페니실린에 대한 내성률이 90%[99]를 초과하는 것으로 보고된 박테로이데스, 특히 Bacteroides의 높은 항생제 내성률을 입증했습니다.
오용

ICU Book에 따르면 "항생제의 첫 번째 규칙은 항생제를 사용하지 않도록 노력하는 것이고, 두 번째 규칙은 항생제를 너무 많이 사용하지 않도록 노력하는 것입니다."[100] 부적절한 항생제 치료와 과도한 항생제 사용이 항생제 내성균의 출현에 기여했습니다. 그러나 항생제로 인한 잠재적인 손상은 항생제 내성의 선택을 넘어 확장되며, 항생제의 남용은 환자 자체에 대한 부작용과 관련이 있으며, 이는 중환자실의 중환자에서 가장 명확하게 나타납니다.[101] 항생제를 자가 처방하는 것이 오남용의 한 예입니다.[102] 항생제에 반응하지 않거나 치료 없이 해결될 가능성이 높은 증상이나 질환을 치료하기 위해 항생제를 자주 처방합니다. 또한 특정 세균 감염에 대해서도 부정확하거나 최적이 아닌 항생제가 처방됩니다.[43][102] 페니실린과 에리트로마이신과 같은 항생제의 남용은 1950년대 이후 새로운 항생제 내성과 관련이 있습니다.[82][103] 병원에서 항생제를 널리 사용하는 것은 가장 흔한 항생제로 더 이상 치료에 반응하지 않는 박테리아 균주와 종의 증가와도 관련이 있습니다.[103]
일반적인 형태의 항생제 오남용에는 여행자에게 예방적 항생제를 과도하게 사용하고 의료 전문가가 환자의 체중과 이전 사용 이력에 근거하여 정확한 항생제 용량을 처방하지 않는 것이 포함됩니다. 다른 형태의 오용에는 항생제의 전체 규정된 과정을 복용하지 않거나, 잘못된 용량과 투여 또는 충분한 회복을 위해 휴식을 취하지 않는 것이 포함됩니다. 예를 들어, 부적절한 항생제 치료는 감기와 같은 바이러스 감염을 치료하기 위한 처방입니다. 호흡기 감염에 대한 한 연구는 "의사들이 기대하는 것처럼 보이는 환자들에게 항생제를 처방할 가능성이 더 높았다"는 것을 발견했습니다.[104] 의사와 환자 모두를 대상으로 하는 다인성 중재는 항생제의 부적절한 처방을 줄일 수 있습니다.[105][106] 특히 자원이 제한된 환경에서 신속한 진료 진단 검사의 부족은 항생제 오남용의 원인 중 하나로 간주됩니다.[107]
항생제 내성과 관련된 몇몇 단체들은 불필요한 항생제 사용을 없애기 위해 로비를 벌이고 있습니다.[102] 항생제의 오남용과 남용 문제는 미국의 항생제 내성에 관한 기관간 태스크포스를 구성함으로써 해결되었습니다. 이 태스크포스는 항생제 내성을 적극적으로 해결하는 것을 목표로 하며, 미국 질병통제예방센터, 식품의약국(FDA), 국립보건원을 비롯해 미국의 다른 기관들이 협력하고 있습니다.[108] 비정부기구 캠페인 그룹은 항생제를 계속 사용하세요.[109] 프랑스에서는 "항생제는 자동적이지 않다"는 정부 캠페인이 2002년에 시작되어 특히 어린이들에게 불필요한 항생제 처방을 현저하게 줄였습니다.[110]
항생제 내성의 출현은 1970년 영국에서 항생제 사용에 제한을 초래하였고(Swann 보고서 1969), 유럽연합은 2003년부터 항생제를 성장촉진제로 사용하는 것을 금지하고 있습니다.[111] 또한 여러 기관(세계보건기구, 미국국립과학원, 미국 식품의약국 포함)은 식용 동물 생산에서 항생제 사용을 제한하는 것을 옹호했습니다.[112][unreliable medical source?] 그러나 일반적으로 항생제 사용을 제한하기 위한 규제 및 입법 조치가 지연되고 있는데, 이는 부분적으로 항생제를 사용하거나 판매하는 산업의 그러한 규제에 대한 저항과 항생제 사용과 내성 사이의 인과 관계를 테스트하기 위한 연구에 필요한 시간에 기인합니다. 미국 식용 동물의 항생제 비치료적 사용을 단계적으로 중단하기 위한 두 개의 연방 법안(S.742[113] 및 H.R. 2562[114])이 제안되었지만 통과되지 않았습니다.[113][114] 이 법안들은 미국 홀리스틱 간호사 협회, 미국 의사 협회, 미국 공중 보건 협회를 포함한 공중 보건 및 의료 기관들에 의해 승인되었습니다.[115][116]
항생제를 처리한 동물에서 나오는 고기를 줄이거나 없애겠다는 식품 회사와 식당의 약속에도 불구하고 농장 동물에서 사용할 항생제 구매는 매년 증가하고 있습니다.[117]
축산업에서 항생제의 광범위한 사용이 있었습니다. 미국에서는 1977년 미국 식품의약국(FDA)에 의해 가축의 항생제 사용으로 인한 항생제 내성균주의 출현 문제가 제기되었습니다. 2012년 3월, 미국 뉴욕 남부 지방 법원은 천연 자원 방어 위원회 등이 제기한 조치에서 FDA에 명령을 내렸고, 이는 FDA 규정을 위반한 것입니다.[118]
연구에 따르면 일반적인 가벼운 질병을 치료하기 위한 항생제의 효과와 필요성에 대한 일반적인 오해가 항생제 남용의 원인이 된다고 합니다.[119][120]
항생제 관련 피해의 다른 형태로는 아나필락시스, 특히 신장 및 간 손상, 내성 유기체에 의한 슈퍼 감염 등이 있습니다. 항생제는 또한 미토콘드리아 기능에 영향을 미치는 것으로 알려져 있으며,[121] 이는 패혈증에서 볼 수 있는 면역세포의 생체 에너지 장애의 원인이 될 수 있습니다.[122] 그들은 또한 장, 폐 및 피부의 미생물군집을 변화시키며,[123] 이는 클로스트리디움 디피실리 관련 설사와 같은 부작용과 관련이 있을 수 있습니다. 항생제는 세균 감염 환자에게 분명히 생명을 구할 수 있지만, 특히 감염을 진단하기 어려운 환자에게 과도하게 사용하면 여러 메커니즘을 통해 해를 끼칠 수 있습니다.[101]
역사
20세기 초 이전에는 감염 치료법이 주로 약학 민속에 기반을 두고 있었습니다. 감염 치료에 사용된 항균 특성을 가진 혼합물은 2,000년 전에 설명되었습니다.[124] 고대 이집트인과 고대 그리스인을 포함한 많은 고대 문화들은 감염을 치료하기 위해 특별히 선별된 곰팡이와 식물 재료를 사용했습니다.[125][126] 1990년대에 연구된 누비아 미라에는 상당한 수준의 테트라사이클린이 포함되어 있는 것으로 밝혀졌습니다. 그 당시에 우려낸 맥주가 공급원이었을 것으로 추측됩니다.[127]
현대 의학에서 항생제의 사용은 염료에서 유래한 합성 항생제의 발견에서 시작되었습니다.[8][128][11][129][9]다양한 에센셜 오일은 항균성이 있는 것으로 나타났습니다.[130] 이와 함께, 이러한 오일이 유래된 식물은 틈새 항균제로 사용될 수 있습니다.[131]
염료 유래 합성 항생제

항균제의 과학과 개발로서 합성항생제 화학요법은 1880년대 후반 폴 에를리히와 함께 독일에서 시작되었습니다.[8] Ehrlich는 특정 염료가 인간, 동물 또는 박테리아 세포를 착색하는 반면 다른 염료는 착색하지 않는다고 언급했습니다. 그리고 나서 그는 인간 숙주를 해치지 않고 박테리아와 결합하여 죽이는 선택적인 약물 역할을 하는 화학 물질을 만드는 것이 가능할 수도 있다는 아이디어를 제안했습니다. 그는 다양한 유기체에 대해 수백 가지의 염료를 선별한 후 1907년 의학적으로 유용한 약물을 발견했는데, 이는 현재 아르세나민으로 불리는 최초의 합성 항균 유기 비소 화합물 살바르산입니다.[8][128][11]

이것은 1907년 알프레드 베르트하임과 에를리히가 비소 유래 합성 항생제를 잇달아 발견하면서 시작된 항균 치료 시대를 예고한 것입니다.[129][9] 에를리히(Ehrlich)와 버트하임(Bertheim)은 쥐의 트리파노소미아증(trypanosomiasis)과 토끼의 스피로케타(spirochaeta) 감염을 치료하기 위해 염료에서 유래한 다양한 화학 물질을 실험했습니다. 그들의 초기 화합물이 너무 독성이 있었지만, 매독을 치료하는 약을 찾기 위해 Ehrlich와 함께 일하는 일본인 세균학자인 Sahachiro Hata는 그들의 일련의 실험에서 606번째 화합물로 성공을 거두었습니다. 1910년, 에르리히와 하타는 비스바덴에서 열린 내과 학회에서 약물 "606"이라고 부르는 그들의 발견을 발표했습니다.[132] ho스트사는 1910년 말경 현재 아르스페나민으로 알려진 살바르산이라는 이름으로 이 화합물을 시판하기 시작했습니다. 이 약은 20세기 전반에 매독 치료에 사용되었습니다. 1908년 에를리히는 면역학에 대한 공헌으로 노벨 생리학·의학상을 수상했습니다.[133] 1911년 노벨 화학상, 1912년과 1913년 노벨 생리학·의학상 후보에 올랐습니다.[134]
최초의 술폰아미드이자 최초의 전신 활성 항균제인 프론토실은 1932년 또는 1933년 독일 IG 파르벤 대기업의 바이엘 연구소에서 게르하르트 도마크가 이끄는 연구팀에 의해 개발되었으며,[9][10][11] 도마크는 1939년 노벨 생리학·의학상을 수상했습니다.[135] 프론토실의 유효 약물인 설파닐아미드는 이미 몇 년 전부터 염료 산업에서 사용되고 있었기 때문에 특허를 받을 수 없었습니다.[10] Prontosil은 그람 양성 구균에 대해 비교적 광범위한 효과를 나타냈지만 장내세균에 대해서는 효과가 없었습니다. 연구는 그 성공으로 한 걸음 더 나아갔습니다. 이 술폰아미드 제제의 발견과 개발로 항균 시대가 열렸습니다.[136][137]
페니실린 및 기타 천연 항생제
다른 미생물의 성장을 저해하는 일부 미생물의 성장에 대한 관찰은 19세기 후반부터 보고되고 있습니다. 이러한 미생물 간의 항생제 관찰은 천연 항균제의 발견으로 이어졌습니다. 루이스 파스퇴르는 "만약 우리가 몇몇 박테리아들 사이에서 관찰되는 길항작용에 개입할 수 있다면, 그것은 아마도 치료제에 대한 가장 큰 희망을 제공할 것입니다"라고 관찰했습니다.[138]
1874년, 의사 윌리엄 로버츠 경은 일부 종류의 블루 치즈를 만드는 데 사용되는 곰팡이 페니실리움 글라우쿰의 배양체가 박테리아 오염을 나타내지 않았다고 언급했습니다.[139]
1895년 이탈리아 의사 빈센조 티베리오는 곰팡이 추출물의 항균력에 관한 논문을 발표했습니다.[140]
1897년, 박사과정 학생인 어니스트 뒤센은 "미생물의 중요한 경쟁에 대한 연구에 대한 공헌: 곰팡이와 미생물 사이의 길항작용"이라는 논문을 제출했습니다.[141] microbial 방지 활동으로 인해 발생하는 곰팡이의 치료 능력을 고려한 최초의 알려진 학술적 연구. 뒤센은 그의 논문에서 박테리아와 곰팡이가 생존을 위해 끊임없이 싸우는 것을 제안했습니다. 듀센은 대장균이 페니실리움 글라우쿰(Penicillium glaucum)에 의해 제거되는 것을 관찰했습니다. 그는 또한 실험동물에게 페니실리움 글라우쿰과 함께 치사량의 장티푸스균을 접종했을 때 동물들이 장티푸스에 걸리지 않는다는 것을 관찰했습니다. 학위를 받은 뒤 뒤센의 군대 복무로 인해 더 이상의 연구를 할 수 없었습니다.[142] 듀센은 현재 항생제로 치료되는 병인 결핵으로 사망했습니다.[142]
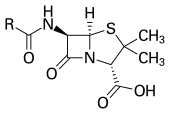
1928년, 알렉산더 플레밍 경은 특정 종류의 박테리아를 죽이거나 막는 특정 곰팡이에 의해 생성되는 분자인 페니실린의 존재를 가정했습니다. 플레밍은 질병을 일으키는 박테리아의 배양을 연구하던 중 배양 플레이트 중 하나에서 녹색 곰팡이인 페니실리움 루벤스의 [143]포자를 발견했습니다. 그는 곰팡이의 존재가 박테리아의 성장을 죽이거나 막는다는 것을 관찰했습니다.[144] 플레밍은 곰팡이가 항균 물질을 분비해야 한다고 가정했고, 1928년에 페니실린이라는 이름을 붙였습니다. 플레밍은 그것의 항균성을 화학요법에 이용할 수 있다고 믿었습니다. 그는 처음에 그 생물학적 특성의 일부를 특징지었고, 일부 감염을 치료하기 위해 조잡한 제제를 사용하려고 시도했지만 훈련된 화학자의 도움 없이는 더 이상의 발전을 추구할 수 없었습니다.[145][146]
에른스트 체인, 하워드 플로리, 에드워드 에이브러햄은 1942년 최초의 페니실린인 페니실린 G를 정제하는 데 성공했지만 1945년 이전에는 연합군 외부에서 널리 사용되지 못했습니다. 이후 노먼 히틀리(Norman Heatley)는 페니실린을 대량으로 효율적으로 정제하기 위한 등 추출 기술을 개발했습니다. 페니실린의 화학구조는 1942년[147] 아브라함이 처음 제안한 뒤 1945년 도로시 크로풋 호지킨이 확인했습니다. 정제된 페니실린은 광범위한 박테리아에 대해 강력한 항균 활성을 나타냈고 사람에게서는 낮은 독성을 보였습니다. 또한 합성 술폰아미드와 달리 고름과 같은 생물학적 성분에 의해 활성이 억제되지 않았습니다. (아래 참조) 페니실린의 개발은 효능과 안전성이 비슷한 항생제 화합물의 탐색에 대한 새로운 관심으로 이어졌습니다.[148] 플레밍이 우연히 발견했지만 스스로 개발하지 못한 페니실린을 치료 약물로 성공적으로 개발한 공로로 체인과 플로리는 플레밍과 함께 1945년 노벨 의학상을 공동 수상했습니다.[149]
플로리는 르네 두보스가 고의적이고 체계적으로 항균 화합물을 찾는 접근법을 개척한 것이 그라미시딘의 발견으로 이어졌고 페니실린에 대한 플로리의 연구를 되살렸다고 생각합니다.[150] 1939년, 제2차 세계 대전이 시작될 무렵, Dubos는 Bacillus brevis로부터 20% gramicidin과 80% tyrocidine의 화합물인 최초의 자연 유래 항생제인 tyrothricin을 발견했다고 보고했습니다. 최초로 상업적으로 제조된 항생제 중 하나로 2차 세계대전 당시 상처와 궤양 치료에 매우 효과적이었습니다.[150] 그러나 그라미시딘은 독성 때문에 체계적으로 사용할 수 없었습니다. 티로시딘은 전신에 사용하기에는 너무 독성이 있는 것으로 판명되었습니다. 그 기간 동안 얻은 연구 결과는 제2차 세계대전 동안 추축국과 연합국 간에 공유되지 않았고 냉전 기간 동안 제한된 접근이 가능했습니다.[151]
20세기 후반
20세기 중반 동안 의료용으로 도입되는 새로운 항생 물질의 수가 크게 증가했습니다. 1935년부터 1968년까지 12개 학급이 새로 출범했습니다. 그러나 이 후, 1969년과 2003년 사이에 단 두 개의 새로운 학급만 도입되면서 새로운 학급의 수가 현저하게 감소했습니다.[152]
항생제 파이프라인
WHO와 미국감염병학회 모두 취약한 항생제 파이프라인이 박테리아의 내성 발현 능력 증가와 일치하지 않는다고 보고했습니다.[153][154] 미국 감염병학회 보고서는 연간 시판 허가를 받은 새로운 항생제의 수가 감소하고 있으며, 현재 2상 또는 3상 임상시험 중인 그람 음성 간균에 대한 7가지 항생제를 확인했다고 언급했습니다. 그러나 이 약물들은 그람 음성 간균의 내성 스펙트럼 전체를 다루지 못했습니다.[155][156] WHO에 따르면 2017년 5월 현재 새로운 치료제인 항생제(조합 포함)가 임상 1-3상을 진행 중입니다.[153] 다제내성 그람양성 병원체를 표적으로 하는 항생제는 여전히 높은 우선순위로 남아 있습니다.[157][153]
지난 7년 동안 몇 가지 항생제가 시판 허가를 받았습니다. 세팔로스포린 세프타롤린과 리포글리코펩티드 오리타반신 및 텔라반신은 급성 세균성 피부 및 피부 구조 감염 및 지역사회 획득 세균성 폐렴 치료에 승인되었습니다.[158] 리포글리코펩티드 달바반신과 옥사졸리디논테디졸리드도 급성 세균성 피부 및 피부 구조 감염 치료에 사용할 수 있도록 승인되었습니다. 새로운 종류의 좁은 스펙트럼 매크로사이클릭 항생제 중 첫 번째인 fidaxomicin이 C. difficile colitis 치료에 승인되었습니다.[158] 또한 승인된 새로운 세팔로스포린-락타마제 억제제 조합에는 복잡한 요로 감염 및 복강 내 감염에 대한 세프타지딤-아비박탐 및 세프톨로잔-아비박탐이 포함됩니다.[158]
- Ceftolozane/tazobactam (CXA-201; CXA-101/tazobactam): 항사이드로모날 세팔로스포린/β-락타마제 억제제 조합(세포벽 합성 억제제). FDA는 2014년 12월 19일에 승인했습니다.
- 세프타지딤/아비박탐(ceftazidime/NXL104): 항사이도모날 세팔로스포린/β-락타마제 억제제 조합(세포벽 합성 억제제).[159] 2015년 2월 25일 FDA 승인.
- Ceftaroline/avibactam (CPT-avibactam; ceftaroline/NXL104): 항-MRSA 세팔로스포린/β-락타마제 억제제 조합(세포벽 합성 억제제).
- 세피데로콜: 세팔로스포린 사이드로포어.[159] 2019년 11월 14일 FDA 승인.
- 이미페넴/relebactam: 카바페넴/β-락타마제 억제제 조합(세포벽 합성 억제제).[159] 2019년 7월 16일 FDA 승인.
- 메로페넴/바보박탐: 카바페넴/β-락타마제 억제제 조합(세포벽 합성 억제제).[159] 2017년 8월 29일 FDA 승인.
- 델라플록사신: 퀴놀론(DNA 합성 억제제).[159] FDA는 2017년 6월 19일에 승인했습니다.
- 플라조마이신(ACHN-490): 반합성 아미노글리코사이드 유도체(단백질 합성 억제제).[159] FDA 승인 2018년 6월 25일.
- 에라바사이클린(TP-434): 합성 테트라사이클린 유도체(세균 리보솜을 표적으로 하는 단백질 합성 억제제).[159] 2018년 8월 27일 FDA 승인.
- 오마다사이클린: 반합성 테트라사이클린 유도체(세균 리보솜을 표적으로 하는 단백질 합성 억제제).[159] FDA는 2018년 10월 2일에 승인했습니다.
- Lefamulin: pleuromutilin 항생제.[159] 2019년 8월 19일 FDA 승인.
- Brilacidin (PMX-30063): 펩타이드 방어 단백질 모방 (세포막 파괴) 2단계.
- 조수라발핀 (RG-6006): 지질다당류 수송 억제제 1단계.[160][161]
가능한 개선 사항으로는 FDA의 임상 시험 규정을 명확히 하는 것이 있습니다. 또한 적절한 경제적 인센티브를 통해 제약 회사가 이러한 노력에 투자하도록 설득할 수 있습니다.[156] 미국에서는 '슈퍼버그'의 증가하는 위협에 대처하기 위해 항생제 개발을 신속하게 추적하기 위한 목적으로 '환자 치료 선진화를 위한 항생제 개발(ADAPT)법'이 도입됐습니다. 이 법에 따라 FDA는 소규모 임상 시험을 기반으로 생명을 위협하는 감염을 치료하는 항생제 및 항진균제를 승인할 수 있습니다. CDC는 항생제 사용과 새로운 내성을 감시하고 데이터를 발표할 것입니다. FDA 항생제 라벨링 프로세스인 '미생물에 대한 민감도 검사 해석 기준' 또는 '중단점'은 의료 전문가에게 정확한 데이터를 제공할 예정입니다.[162] 퓨 채리티 트러스트의 건강 프로그램 수석 이사인 앨런 쿠켈은 "의약품 개발자들이 더 작은 데이터 세트에 의존할 수 있도록 하고, 위험/편익 계산을 할 때 이러한 약물에 대해 더 높은 수준의 불확실성을 견딜 수 있는 FDA의 권한을 명확히 함으로써, ADAPT는 임상 시험을 더 실현 가능하게 만들 것입니다."라고 말했습니다.[163]
항생제 파이프라인 보충 및 기타 새로운 치료법 개발
항생제 내성균주가 지속적으로 출현하고 확산되고 있기 때문에 새로운 항균 치료제 개발의 필요성이 지속적으로 제기되고 있습니다. Current strategies include traditional chemistry-based approaches such as natural product-based drug discovery,[164][165] newer chemistry-based approaches such as drug design,[166][167] traditional biology-based approaches such as immunoglobulin therapy,[168][169] and experimental biology-based approaches such as phage therapy,[170][171] fecal microbiota transplants,[168][172] 안티센스 RNA 기반 치료제 [168][169][168][169][173]및 CRISPR-Cas9 기반 치료제
천연물 기반 항생제 발굴
Most of the antibiotics in current use are natural products or natural product derivatives,[165][174] and bacterial,[175][176] fungal,[164][177] plant[178][179][180][181] and animal[164][182] extracts are being screened in the search for new antibiotics. 유기체는 생태학적, 민족 의학적, 유전체 또는 역사적 합리성을 기반으로 테스트를 위해 선택될 수 있습니다.[165] 예를 들어, 약용 식물은 전통적인 치료자가 감염을 예방하거나 치료하기 위해 사용하므로 항균 화합물을 포함할 수 있다는 것에 기초하여 스크리닝됩니다.[183][184] 또한 토양 박테리아는 역사적으로 매우 풍부한 항생제 공급원이었다는 근거로 선별됩니다(현재 사용 중인 항생제의 70~80%는 방선균에서 유래함).[165][185]
직접적인 항균 활성을 위해 천연물을 선별하는 것 외에도 항생제 내성과 항생제 내성을 억제하는 능력이 있는지 선별하기도 합니다.[184][186] 예를 들어, 일부 2차 대사산물은 약물 유출 펌프를 억제하여 세포 표적에 도달할 수 있는 항생제의 농도를 증가시키고 항생제에 대한 박테리아 내성을 감소시킵니다.[184][187] 박테리아 유출 펌프를 억제하는 것으로 알려진 천연물에는 알칼로이드 라이저골,[188] 카로티노이드 캡산틴 및 캡소루빈,[189] 플라보노이드 로테논 및 크리신이 포함됩니다.[189] 다른 천연물, 이번에는 2차 대사산물이 아닌 1차 대사산물이 항생제 내성을 없애는 것으로 나타났습니다. 예를 들어, 포도당, 만니톨 및 과당은 대장균 및 황색포도상구균의 항생제 내성을 감소시켜 아미노글리코사이드 항생제에 의한 사멸에 더 취약하게 만듭니다.[186]
천연물도 박테리아 독성 인자를 억제하는 능력에 대해 스크리닝될 수 있습니다. 독성 인자는 박테리아가 신체의 면역 방어(예를 들어, 요소분해효소, 스타필록산틴)를 회피하고, 인간 세포(예를 들어, IV형 필리, 부착소, 인터날린)로 이동, 부착 및/또는 침입을 가능하게 하는 분자, 세포 구조 및 조절 시스템, 독성 유전자의 활성화(예를 들어, 쿼럼 감지), 질병(예: 외독소)을 유발합니다.[168][181][190][191][192] 항바이러스 활성을 갖는 천연물의 예로는 플라보노이드 에피갈로카테킨 갈레이트(리스테리오리신 O 억제),[190] 퀴논 테트랑고마이신(스타필록산틴 억제),[191] 세스퀴테르펜 제럼본(시네토박터 바우만니이 운동성 억제)이 있습니다.[193]
그러나 이러한 천연물(항생제) 중 일부는 감염 치료에 있어 처방전 없이 살 수 있는 항생제 대신 사용될 수 있습니다. 마늘, 꿀, 생강, 강황, 백리향 에센셜 오일이 포함될 수 있습니다.[194]
면역글로불린 요법
항체(항파상풍 면역글로불린)는 1910년대부터 파상풍의 치료 및 예방에 사용되어 왔으며,[195] 이러한 접근법은 세균성 질병을 제어하는 유용한 방법으로 계속 사용되고 있습니다. 예를 들어, 단일클론항체 베즐로톡수맙은 재발성 클로스트리디움 디피실 감염에 대해 미국 FDA 및 EMA로부터 승인을 받았으며, 다른 단일클론항체는 개발 중에 있습니다(예: 황색포도상구균 인공호흡기 관련 폐렴의 보조 치료를 위한 AR-301). 항체 치료제는 박테리아 외독소 및 기타 독성 인자에 결합하고 중화하는 작용을 합니다.[168][169]
파지요법

항생제 내성균주를 치료하는 방법으로 파지요법이 연구 중입니다. 파지 요법은 박테리아 병원체를 바이러스로 감염시키는 것을 포함합니다. 박테리오파지와 그 숙주 범위는 특정 박테리아에 매우 특이적이므로 항생제와 달리 숙주 유기체의 장내 미생물군을 방해하지 않습니다.[197] 파지라고도 하는 박테리오파지는 주로 용해 주기 동안 박테리아를 감염시키고 죽입니다.[197][196] 파지는 그들의 DNA를 박테리아에 삽입하고, 거기서 그것은 전사되어 새로운 파지를 만드는 데 사용되고, 그 후 세포는 용해되어 같은 균주의 더 많은 박테리아를 감염시키고 파괴할 수 있는 새로운 파지를 방출합니다.[196] 파지의 높은 특이성은 "좋은" 박테리아를 파괴로부터 보호합니다.[198]
그러나 박테리오파지 사용에 대한 몇 가지 단점도 있습니다. 박테리오파지는 유전체에 독성 인자 또는 독성 유전자를 보유할 수 있으며 사용 전에 유전체 시퀀싱을 통해 알려진 독성 인자 또는 독소와 유사한 유전자를 식별하는 것이 현명할 수 있습니다. 또한, 세균 감염 근절을 위한 파지의 경구 및 IV 투여는 국소 도포보다 훨씬 높은 안전 위험을 초래합니다. 또한, 이러한 대형 항원 칵테일에 대한 불확실한 면역 반응의 추가적인 우려가 있습니다.[citation needed]
그러한 치료법을 위해 제거해야 할 상당한 규제 장애물이 있습니다.[197] 수많은 도전에도 불구하고 기존 항생제에 더 이상 반응하지 않는 MDR 병원체에 대한 항균제를 대체하는 박테리오파지의 사용은 여전히 매력적인 옵션으로 남아 있습니다.[197][199]
분변 미생물총 이식

분변 미생물군 이식은 건강한 인간 기증자(변의 형태)로부터 C. difficile 감염 환자에게 장내 미생물군 전체를 이전하는 것을 포함합니다. 이 절차는 미국 FDA의 공식 승인을 받지 않았지만 항생제 내성 C. difficile 감염 환자의 경우 일부 조건에서 사용이 허용됩니다. 완치율은 90% 내외로 대변은행, 표준화된 제품, 경구 배송 방법 등을 개발하기 위한 작업이 진행 중입니다.[168] 분변 미생물군 이식은 염증성 장 질환에도 최근에 사용되고 있습니다.[200]
안티센스 RNA 기반 치료법
안티센스 RNA 기반 치료(유전자 침묵 요법이라고도 함)는 (a) 필수 단백질을 암호화하는 박테리아 유전자(예를 들어, 녹농균 유전자 acpP, lpxC 및 rpsJ)를 식별하는 것, (b) 이러한 필수 단백질을 암호화하는 mRNA에 상보적인 단일 가닥 RNA를 합성하는 것을 포함하는, (c) 단일 가닥 RNA를 세포 투과성 펩티드 또는 리포좀을 사용하여 감염 부위로 전달하는 것. 그런 다음 안티센스 RNA는 박테리아 mRNA와 혼성화되어 필수 단백질로의 번역을 차단합니다. 안티센스 RNA 기반 치료는 P. aeruginosa 폐렴의 생체 내 모델에서 효과적인 것으로 나타났습니다.[168][169]
필수 박테리아 유전자를 침묵시키는 것 외에도 안티센스 RNA를 사용하여 항생제 내성을 담당하는 박테리아 유전자를 침묵시킬 수 있습니다.[168][169] 예를 들어, S. aureus mecA 유전자(변형된 페니실린 결합 단백질 2a를 암호화하고 S. aureus 균주를 메티실린 내성으로 만드는 유전자)를 침묵시키는 안티센스 RNA가 개발되었습니다. mecA mRNA를 표적으로 하는 안티센스 RNA는 시험관 내 및 생체 내 연구 모두에서 옥사실린에 대한 메티실린 내성 포도상구균의 민감도를 회복시키는 것으로 나타났습니다.[169]
CRISPR-Cas9 기반 치료제
2000년대 초반에는 세균이 침입하는 바이러스로부터 스스로를 방어할 수 있는 시스템이 발견되었습니다. CRISPR-Cas9로 알려진 이 시스템은 (a) DNA를 파괴하는 효소(뉴클레아제 Cas9)와 (b) 이전에 마주친 바이러스 침입자(CRISPR)의 DNA 서열로 구성되어 있습니다. 이러한 바이러스 DNA 서열은 뉴클레아제가 자가(박테리아) DNA가 아닌 외래(바이러스) DNA를 표적으로 할 수 있게 합니다.[201]
자연에서 CRISPR-Cas9의 기능은 박테리아를 보호하는 것이지만, 시스템의 CRISPR 구성 요소의 DNA 서열은 Cas9 뉴클레아제가 바이러스 유전자 대신 박테리아 내성 유전자 또는 박테리아 독성 유전자를 표적으로 하도록 변형될 수 있습니다. 그런 다음 수정된 CRISPR-Cas9 시스템을 플라스미드 또는 박테리오파지를 사용하여 박테리아 병원체에 투여할 수 있습니다.[168][169] 이 접근법은 생체 내 감염 모델에서 항생제 내성을 억제하고 장출혈성 대장균의 독성을 줄이는 데 성공적으로 사용되었습니다.[169]
항생제 내성에 대한 선택 압력 감소

새로운 항균 치료제 개발과 더불어 항생제 내성의 출현과 확산을 위해서는 선택 압력을 줄이는 것이 중요합니다. 이를 달성하기 위한 전략에는 인프라 개선(예: 덜 붐비는 주택),[203][204] 더 나은 위생(예: 안전한 식수 및 식품)[205][206] 및 백신 개발과 같은 잘 확립된 감염 관리 조치,[171] 항생제 관리와 같은 기타 접근 방식이 포함됩니다.[207][208] 그리고 감염을 예방하기 위해 프리바이오틱스와 프로바이오틱스를 사용하는 것과 같은 실험적 접근.[209][210][211][212] 미생물 질병을 치료하기 위해 임상의가 항생제를 번갈아 사용하는 항생제 사이클링이 제안되고 있지만, 최근 연구에 따르면 이러한 전략은 항생제 내성에 효과가 없는 것으로 나타났습니다.[213][214]
백신
백신은 면역 조절이나 증강에 의존합니다. 백신 접종은 감염을 막기 위해 숙주의 면역 능력을 자극하거나 강화하여 대식세포의 활성화, 항체의 생성, 염증 및 기타 고전적인 면역 반응을 유도합니다. 항균 백신은 세계적인 세균성 질병의 급격한 감소에 책임이 있습니다.[215] 약독화된 전체 세포 또는 용해물로 만들어진 백신은 주로 단백질 운반체에 대한 캡슐 다당류 및 그 결합체를 포함한 정제된 구성 요소로 구성된 덜 반응성인 무세포 백신으로 대체되었습니다.[216]
참고 항목
참고문헌
- ^ a b c "Antibiotics". NHS. 5 June 2014. Archived from the original on 18 January 2015. Retrieved 17 January 2015.
- ^ "Factsheet for experts". European Centre for Disease Prevention and Control. Archived from the original on 21 December 2014. Retrieved 21 December 2014.
- ^ 예를 들어 메트로니다졸:
- ^ a b Chemical Analysis of Antibiotic Residues in Food. John Wiley & Sons, Inc. 2012. pp. 1–60. ISBN 978-1-4496-1459-1.
- ^ "Why antibiotics can't be used to treat your cold or flu". www.health.qld.gov.au. 6 May 2017. Archived from the original on 9 August 2020. Retrieved 13 May 2020.
- ^ "General Background: Antibiotic Agents". Alliance for the Prudent Use of Antibiotics. Archived from the original on 14 December 2014. Retrieved 21 December 2014.
- ^ Gould K (March 2016). "Antibiotics: from prehistory to the present day". Journal of Antimicrobial Chemotherapy. 71 (3): 572–575. doi:10.1093/jac/dkv484. ISSN 0305-7453. PMID 26851273.
- ^ a b c d e f 칼데론 CB, 사분다요 BP (2007). 항균 분류: 벌레를 위한 약물. 슈발버, 스틸 무어, 굿윈 AC에서. 항균제 민감도 시험 프로토콜. CRC Press. 테일러&프란세스 그룹. ISBN 978-0-8247-4100-6
- ^ a b c d Goodman LS, Gilman A (1941). The Pharmacological Basis of Therapeutics. New York: Macmillan.
- ^ a b c Aminov RI (2010). "A brief history of the antibiotic era: lessons learned and challenges for the future". Frontiers in Microbiology. 1: 134. doi:10.3389/fmicb.2010.00134. PMC 3109405. PMID 21687759.
- ^ a b c d Bosch F, Rosich L (2008). "The contributions of Paul Ehrlich to pharmacology: a tribute on the occasion of the centenary of his Nobel Prize". Pharmacology. 82 (3): 171–9. doi:10.1159/000149583. PMC 2790789. PMID 18679046.
- ^ Laxminarayan R, Duse A, Wattal C, Zaidi AK, Wertheim HF, Sumpradit N, et al. (December 2013). "Antibiotic resistance-the need for global solutions". The Lancet. Infectious Diseases. 13 (12): 1057–98. doi:10.1016/S1473-3099(13)70318-9. hdl:10161/8996. PMID 24252483. S2CID 19489131. Archived from the original on 10 June 2020. Retrieved 25 August 2020.
- ^ Brooks M (16 November 2015). "Public Confused About Antibiotic Resistance, WHO Says". Medscape Multispeciality. Archived from the original on 20 November 2015. Retrieved 21 November 2015.
- ^ Gould K (March 2016). "Antibiotics: from prehistory to the present day". The Journal of Antimicrobial Chemotherapy. 71 (3): 572–5. doi:10.1093/jac/dkv484. PMID 26851273.
- ^ Gualerzi CO, Brandi L, Fabbretti A, Pon CL (4 December 2013). Antibiotics: Targets, Mechanisms and Resistance. John Wiley & Sons. p. 1. ISBN 978-3-527-33305-9.
- ^ Antimicrobial resistance: global report on surveillance (PDF). The World Health Organization. April 2014. ISBN 978-92-4-156474-8. Archived (PDF) from the original on 6 June 2016. Retrieved 13 June 2016.
- ^ Murray CJ, Ikuta KS, Sharara F, Swetschinski L, Robles Aguilar G, Gray A, et al. (February 2022). "Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis". Lancet. 399 (10325): 629–655. doi:10.1016/S0140-6736(21)02724-0. PMC 8841637. PMID 35065702.
- ^ a b c Saxena S (2015). "Chapter 8: Microbes in Production of Fine Chemicals (Antibiotics, Drugs, Vitamins, and Amino Acids)". Applied Microbiology. Springer India. pp. 83–120. doi:10.1007/978-81-322-2259-0. ISBN 978-81-322-2258-3. S2CID 36527513.
- ^ Foster W, Raoult A (December 1974). "Early descriptions of antibiosis". The Journal of the Royal College of General Practitioners. 24 (149): 889–894. PMC 2157443. PMID 4618289.
- ^ Landsberg H (1949). "Prelude to the discovery of penicillin". Isis. 40 (3): 225–7. doi:10.1086/349043. S2CID 143223535.
- ^ Waksman SA (1947). "What is an antibiotic or an antibiotic substance?". Mycologia. 39 (5): 565–569. doi:10.1080/00275514.1947.12017635. PMID 20264541.
- ^ Waksman SA (1947). "What is an antibiotic or an antibiotic substance?". Mycologia. 39 (5): 565–9. doi:10.2307/3755196. JSTOR 3755196. PMID 20264541.
- ^ Scholar EM, Pratt WB (2000). The Antimicrobial Drugs. Oxford University Press, US. pp. 3. ISBN 978-0-19-512529-0.
- ^ Davies J, Davies D (September 2010). "Origins and evolution of antibiotic resistance". Microbiology and Molecular Biology Reviews. 74 (3): 417–33. doi:10.1128/MMBR.00016-10. PMC 2937522. PMID 20805405.
- ^ Liddell HG, Scott R (eds.). "βιωτικός". A Greek-English Lexicon. Archived from the original on 25 April 2023. Retrieved 20 February 2021 – via Perseus Project.
- ^ Liddell HG, Scott R (eds.). "βίωσις". A Greek-English Lexicon. Archived from the original on 25 February 2021. Retrieved 20 February 2021 – via Perseus Project.
- ^ a b "Antibiotics FAQ". McGill University, Canada. Archived from the original on 16 February 2008. Retrieved 17 February 2008.
- ^ Liddell HG, Scott R (eds.). "βίος". A Greek-English Lexicon. Archived from the original on 27 February 2021. Retrieved 20 February 2021 – via Perseus Project.
- ^ Liddell HG, Scott R (eds.). "ἀντί". A Greek-English Lexicon. Archived from the original on 10 October 2012. Retrieved 20 February 2021 – via Perseus Project.
- ^ Liddell HG, Scott R (eds.). "βακτηρία". A Greek-English Lexicon. Archived from the original on 24 February 2021. Retrieved 20 February 2021 – via Perseus Project.
- ^ 2021년 8월 27일 옥스포드 사전의 웨이백 머신에서 박테리아 아카이브
- ^ a b c Antibiotics Simplified. Jones & Bartlett Publishers. 2011. pp. 15–17. ISBN 978-1-4496-1459-1.
- ^ a b c d Leekha S, Terrell CL, Edson RS (February 2011). "General principles of antimicrobial therapy". Mayo Clinic Proceedings. 86 (2): 156–67. doi:10.4065/mcp.2010.0639. PMC 3031442. PMID 21282489.
- ^ Rollins KE, Varadhan KK, Neal KR, Lobo DN (October 2016). "Antibiotics Versus Appendicectomy for the Treatment of Uncomplicated Acute Appendicitis: An Updated Meta-Analysis of Randomised Controlled Trials". World Journal of Surgery. 40 (10): 2305–18. doi:10.1007/s00268-016-3561-7. PMID 27199000. S2CID 4802473.
- ^ Flowers CR, Seidenfeld J, Bow EJ, Karten C, Gleason C, Hawley DK, et al. (February 2013). "Antimicrobial prophylaxis and outpatient management of fever and neutropenia in adults treated for malignancy: American Society of Clinical Oncology clinical practice guideline". Journal of Clinical Oncology. 31 (6): 794–810. doi:10.1200/JCO.2012.45.8661. PMID 23319691.
- ^ Bow EJ (July 2013). "Infection in neutropenic patients with cancer". Critical Care Clinics. 29 (3): 411–41. doi:10.1016/j.ccc.2013.03.002. PMID 23830647.
- ^ Sethi NJ, Safi S, Korang SK, Hróbjartsson A, Skoog M, Gluud C, et al. (Cochrane Heart Group) (February 2021). "Antibiotics for secondary prevention of coronary heart disease". The Cochrane Database of Systematic Reviews. 2 (5): CD003610. doi:10.1002/14651858.CD003610.pub4. PMC 8094925. PMID 33704780.
- ^ Pangilinan R, Tice A, Tillotson G (October 2009). "Topical antibiotic treatment for uncomplicated skin and skin structure infections: review of the literature". Expert Review of Anti-Infective Therapy. 7 (8): 957–65. doi:10.1586/eri.09.74. PMID 19803705. S2CID 207217730.
- ^ a b Lipsky BA, Hoey C (November 2009). "Topical antimicrobial therapy for treating chronic wounds". Clinical Infectious Diseases. 49 (10): 1541–9. doi:10.1086/644732. PMID 19842981.
- ^ Heal CF, Banks JL, Lepper PD, Kontopantelis E, van Driel ML (November 2016). "Topical antibiotics for preventing surgical site infection in wounds healing by primary intention". The Cochrane Database of Systematic Reviews. 2016 (11): CD011426. doi:10.1002/14651858.CD011426.pub2. PMC 6465080. PMID 27819748.
- ^ Hung KK, Lam RP, Lo RS, Tenney JW, Yang ML, Tai MC, et al. (December 2018). "Cross-sectional study on emergency department management of sepsis". Hong Kong Medical Journal = Xianggang Yi Xue Za Zhi. 24 (6): 571–578. doi:10.12809/hkmj177149. PMID 30429360.
- ^ "UK antibiotic consumption twice that of the Netherlands, WHO report finds". Pharmaceutical Journal. 14 November 2018. Archived from the original on 22 December 2018. Retrieved 22 December 2018.
- ^ a b Slama TG, Amin A, Brunton SA, File TM, Milkovich G, Rodvold KA, et al. (July 2005). "A clinician's guide to the appropriate and accurate use of antibiotics: the Council for Appropriate and Rational Antibiotic Therapy (CARAT) criteria". The American Journal of Medicine. 118 (7A): 1S–6S. doi:10.1016/j.amjmed.2005.05.007. PMID 15993671.
- ^ Slama TG, Amin A, Brunton SA, File TM, Milkovich G, Rodvold KA, et al. (Council for Appropriate Rational Antibiotic Therapy (CARAT)) (July 2005). "A clinician's guide to the appropriate and accurate use of antibiotics: the Council for Appropriate and Rational Antibiotic Therapy (CARAT) criteria". The American Journal of Medicine. 118 (7A): 1S–6S. doi:10.1016/j.amjmed.2005.05.007. PMID 15993671.
- ^ "Antibiotics – Side effects". NHS Choices. National Health Service (NHS), UK. 6 May 2014. Archived from the original on 7 February 2016. Retrieved 6 February 2016.
- ^ "Antibiotic-Associated Diarrhea – All you should know". Archived from the original on 25 April 2015. Retrieved 28 December 2014.
- ^ Rodgers B, Kirley K, Mounsey A (March 2013). "PURLs: prescribing an antibiotic? Pair it with probiotics". The Journal of Family Practice. 62 (3): 148–50. PMC 3601687. PMID 23520586.
- ^ Pirotta MV, Garland SM (September 2006). "Genital Candida species detected in samples from women in Melbourne, Australia, before and after treatment with antibiotics". Journal of Clinical Microbiology. 44 (9): 3213–7. doi:10.1128/JCM.00218-06. PMC 1594690. PMID 16954250.
- ^ Lewis T, Cook J (1 January 2014). "Fluoroquinolones and tendinopathy: a guide for athletes and sports clinicians and a systematic review of the literature". Journal of Athletic Training. 49 (3): 422–7. doi:10.4085/1062-6050-49.2.09. PMC 4080593. PMID 24762232.
- ^ Marchant J (March 2018). "When antibiotics turn toxic". Nature. 555 (7697): 431–433. Bibcode:2018Natur.555..431M. doi:10.1038/d41586-018-03267-5. PMID 29565407.
- ^ Wang X, Ryu D, Houtkooper RH, Auwerx J (October 2015). "Antibiotic use and abuse: a threat to mitochondria and chloroplasts with impact on research, health, and environment". BioEssays. 37 (10): 1045–53. doi:10.1002/bies.201500071. PMC 4698130. PMID 26347282.
- ^ a b c d Anderson KC, Schwartz MD, Lieu SO (January 2013). "Antibiotics and OC effectiveness". JAAPA. 26 (1): 11. doi:10.1097/01720610-201301000-00002. PMID 23355994.
- ^ a b c Weaver K, Glasier A (February 1999). "Interaction between broad-spectrum antibiotics and the combined oral contraceptive pill. A literature review". Contraception. 59 (2): 71–8. doi:10.1016/S0010-7824(99)00009-8. PMID 10361620.
- ^ Weisberg E (May 1999). "Interactions between oral contraceptives and antifungals/antibacterials. Is contraceptive failure the result?". Clinical Pharmacokinetics. 36 (5): 309–13. doi:10.2165/00003088-199936050-00001. PMID 10384856. S2CID 25187892.
- ^ Hassan T (March 1987). "Pharmacologic considerations for patients taking oral contraceptives". Connecticut Dental Student Journal. 7: 7–8. PMID 3155374.
- ^ Orme ML, Back DJ (December 1990). "Factors affecting the enterohepatic circulation of oral contraceptive steroids". American Journal of Obstetrics and Gynecology. 163 (6 Pt 2): 2146–52. doi:10.1016/0002-9378(90)90555-L. PMID 2256523. Archived from the original on 13 July 2015. Retrieved 11 March 2009.
- ^ Lwanga J, Mears, Bingham JS, Bradbeer CS (2008). "Do antibiotics and alcohol mix? The beliefs of genitourinary clinic attendees". BMJ. 337: a2885. doi:10.1136/bmj.a2885. S2CID 58765542.
- ^ "antibiotics-and-alcohol". Archived from the original on 12 June 2011."antibiotics-and-alcohol". Archived from the original on 12 June 2011.메이요 클리닉
- ^ a b "Can I drink alcohol while taking antibiotics?". NHS Direct (UK electronic health service). Archived from the original on 24 October 2010. Retrieved 17 February 2008.
- ^ Moore AA, Whiteman EJ, Ward KT (March 2007). "Risks of combined alcohol/medication use in older adults". The American Journal of Geriatric Pharmacotherapy. 5 (1): 64–74. doi:10.1016/j.amjopharm.2007.03.006. PMC 4063202. PMID 17608249.
- ^ Stockley IH (2002). Stockley's Drug Interactions (6th ed.). London: Pharmaceutical Press.[페이지 필요]
- ^ a b c Pankey GA, Sabath LD (March 2004). "Clinical relevance of bacteriostatic versus bactericidal mechanisms of action in the treatment of Gram-positive bacterial infections". Clinical Infectious Diseases. 38 (6): 864–70. doi:10.1086/381972. PMID 14999632.
- ^ Mascio CT, Alder JD, Silverman JA (December 2007). "Bactericidal action of daptomycin against stationary-phase and nondividing Staphylococcus aureus cells". Antimicrobial Agents and Chemotherapy. 51 (12): 4255–60. doi:10.1128/AAC.00824-07. PMC 2167999. PMID 17923487.
- ^ Pelczar MJ, Chan EC, Krieg NR (2010). "Host-Parasite Interaction; Nonspecific Host Resistance". Microbiology Concepts and Applications (6th ed.). New York: McGraw-Hill. pp. 478–479.
- ^ Rhee KY, Gardiner DF (September 2004). "Clinical relevance of bacteriostatic versus bactericidal activity in the treatment of gram-positive bacterial infections". Clinical Infectious Diseases. 39 (5): 755–6. doi:10.1086/422881. PMID 15356797.
- ^ Wiegand I, Hilpert K, Hancock RE (January 2008). "Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances". Nature Protocols. 3 (2): 163–75. doi:10.1038/nprot.2007.521. PMID 18274517. S2CID 3344950.
- ^ Dalhoff A, Ambrose PG, Mouton JW (August 2009). "A long journey from minimum inhibitory concentration testing to clinically predictive breakpoints: deterministic and probabilistic approaches in deriving breakpoints". Infection. 37 (4): 296–305. doi:10.1007/s15010-009-7108-9. PMID 19629383. S2CID 20538901.
- ^ a b c d Ocampo PS, Lázár V, Papp B, Arnoldini M, Abel zur Wiesch P, Busa-Fekete R, et al. (August 2014). "Antagonism between bacteriostatic and bactericidal antibiotics is prevalent". Antimicrobial Agents and Chemotherapy. 58 (8): 4573–82. doi:10.1128/AAC.02463-14. PMC 4135978. PMID 24867991.
- ^ a b Bollenbach T (October 2015). "Antimicrobial interactions: mechanisms and implications for drug discovery and resistance evolution". Current Opinion in Microbiology. 27: 1–9. doi:10.1016/j.mib.2015.05.008. PMID 26042389.
- ^ Antonello RM, Principe L, Maraolo AE, Viaggi V, Pol R, Fabbiani M, et al. (August 2020). "Fosfomycin as Partner Drug for Systemic Infection Management. A Systematic Review of Its Synergistic Properties from In Vitro and In Vivo Studies". Antibiotics. 9 (8): 500. doi:10.3390/antibiotics9080500. PMC 7460049. PMID 32785114.
- ^ "antagonism". Archived from the original on 26 August 2014. Retrieved 25 August 2014.
- ^ Drawz SM, Bonomo RA (January 2010). "Three decades of beta-lactamase inhibitors". Clinical Microbiology Reviews. 23 (1): 160–201. doi:10.1128/CMR.00037-09. PMC 2806661. PMID 20065329.
- ^ Finberg RW, Moellering RC, Tally FP, Craig WA, Pankey GA, Dellinger EP, et al. (November 2004). "The importance of bactericidal drugs: future directions in infectious disease". Clinical Infectious Diseases. 39 (9): 1314–20. doi:10.1086/425009. PMID 15494908.
- ^ Cunha BA (2009). Antibiotic Essentials. Jones & Bartlett Learning. p. 180. ISBN 978-0-7637-7219-2.
- ^ Srivastava A, Talaue M, Liu S, Degen D, Ebright RY, Sineva E, et al. (October 2011). "New target for inhibition of bacterial RNA polymerase: 'switch region'". Current Opinion in Microbiology. 14 (5): 532–43. doi:10.1016/j.mib.2011.07.030. PMC 3196380. PMID 21862392.
- ^ a b von Nussbaum F, Brands M, Hinzen B, Weigand S, Häbich D (August 2006). "Antibacterial natural products in medicinal chemistry--exodus or revival?". Angewandte Chemie. 45 (31): 5072–129. doi:10.1002/anie.200600350. PMID 16881035.
- ^ Dougherty TJ, Pucci MJ (2011). Antibiotic Discovery and Development. Springer. p. 800. ISBN 978-1-4614-1400-1.
- ^ Fedorenko V, Genilloud O, Horbal L, Marcone GL, Marinelli F, Paitan Y, et al. (2015). "Antibacterial Discovery and Development: From Gene to Product and Back". BioMed Research International. 2015: 591349. doi:10.1155/2015/591349. PMC 4538407. PMID 26339625.
- ^ Sample I (26 March 2018). "Calls to rein in antibiotic use after study shows 65% increase worldwide". The Guardian. Archived from the original on 8 April 2018. Retrieved 28 March 2018.
- ^ Levy SB (October 1994). "Balancing the drug-resistance equation". Trends in Microbiology. 2 (10): 341–2. doi:10.1016/0966-842X(94)90607-6. PMID 7850197.
- ^ Luria SE, Delbrück M (November 1943). "Mutations of Bacteria from Virus Sensitivity to Virus Resistance". Genetics. 28 (6): 491–511. doi:10.1093/genetics/28.6.491. PMC 1209226. PMID 17247100.
- ^ a b Pearson C (28 February 2007). "Antibiotic Resistance Fast-Growing Problem Worldwide". Voice of America. Archived from the original on 2 December 2008. Retrieved 29 December 2008.
- ^ Topp E, Chapman R, Devers-Lamrani M, Hartmann A, Marti R, Martin-Laurent F, et al. (2013). "Accelerated Biodegradation of Veterinary Antibiotics in Agricultural Soil following Long-Term Exposure, and Isolation of a Sulfamethazine-degrading sp". Journal of Environmental Quality. 42 (1): 173–8. doi:10.2134/jeq2012.0162. PMID 23673752. Archived from the original on 12 December 2013. Retrieved 22 November 2013.
- ^ a b c Witte W (September 2004). "International dissemination of antibiotic resistant strains of bacterial pathogens". Infection, Genetics and Evolution. 4 (3): 187–91. doi:10.1016/j.meegid.2003.12.005. PMID 15450197.
- ^ Dyer BD (2003). "Chapter 9, Pathogens". A Field Guide To Bacteria. Cornell University Press. ISBN 978-0-8014-8854-2.
- ^ Andersson DI (October 2006). "The biological cost of mutational antibiotic resistance: any practical conclusions?". Current Opinion in Microbiology. 9 (5): 461–5. doi:10.1016/j.mib.2006.07.002. PMID 16890008.
- ^ D'Costa VM, King CE, Kalan L, Morar M, Sung WW, Schwarz C, et al. (August 2011). "Antibiotic resistance is ancient". Nature. 477 (7365): 457–61. Bibcode:2011Natur.477..457D. doi:10.1038/nature10388. PMID 21881561. S2CID 4415610.
- ^ Gladki A, Kaczanowski S, Szczesny P, Zielenkiewicz P (February 2013). "The evolutionary rate of antibacterial drug targets". BMC Bioinformatics. 14 (1): 36. doi:10.1186/1471-2105-14-36. PMC 3598507. PMID 23374913.
- ^ a b Alekshun MN, Levy SB (March 2007). "Molecular mechanisms of antibacterial multidrug resistance". Cell. 128 (6): 1037–50. doi:10.1016/j.cell.2007.03.004. PMID 17382878. S2CID 18343252.
- ^ Pawlowski AC, Wang W, Koteva K, Barton HA, McArthur AG, Wright GD (December 2016). "A diverse intrinsic antibiotic resistome from a cave bacterium". Nature Communications. 7: 13803. Bibcode:2016NatCo...713803P. doi:10.1038/ncomms13803. PMC 5155152. PMID 27929110.
- ^ Marshall CG, Lessard IA, Park I, Wright GD (September 1998). "Glycopeptide antibiotic resistance genes in glycopeptide-producing organisms". Antimicrobial Agents and Chemotherapy. 42 (9): 2215–20. doi:10.1128/AAC.42.9.2215. PMC 105782. PMID 9736537.
- ^ Nikaido H (February 2009). "Multidrug resistance in bacteria". Annual Review of Biochemistry. 78 (1): 119–46. doi:10.1146/annurev.biochem.78.082907.145923. PMC 2839888. PMID 19231985.
- ^ a b c Baker-Austin C, Wright MS, Stepanauskas R, McArthur JV (April 2006). "Co-selection of antibiotic and metal resistance". Trends in Microbiology. 14 (4): 176–82. doi:10.1016/j.tim.2006.02.006. PMID 16537105.
- ^ "보건장관, 내약성 결핵 퇴치 노력 가속화" 세계보건기구(WHO).
- ^ Boseley S (12 August 2010). "Are you ready for a world without antibiotics?". The Guardian. London. Archived from the original on 30 November 2010.
- ^ "Multi-resistant hospital bacteria linked to India and Pakistan". Health Protection Report. Health Protection Agency. 3 July 2009. Archived from the original on 14 July 2014. Retrieved 16 August 2010.
- ^ McGann P, Snesrud E, Maybank R, Corey B, Ong AC, Clifford R, et al. (July 2016). "Escherichia coli Harboring mcr-1 and blaCTX-M on a Novel IncF Plasmid: First Report of mcr-1 in the United States". Antimicrobial Agents and Chemotherapy. 60 (7): 4420–1. doi:10.1128/AAC.01103-16. PMC 4914657. PMID 27230792.
- ^ Moyer MW (27 May 2016). "Dangerous New Antibiotic-Resistant Bacteria Reach U.S." Scientific American. Archived from the original on 28 July 2020. Retrieved 27 May 2016.
- ^ Di Bella S, Antonello RM, Sanson G, Maraolo AE, Giacobbe DR, Sepulcri C, et al. (June 2022). "Anaerobic bloodstream infections in Italy (ITANAEROBY): A 5-year retrospective nationwide survey". Anaerobe. 75: 102583. doi:10.1016/j.anaerobe.2022.102583. hdl:11368/3020691. PMID 35568274. S2CID 248736289.
- ^ Marino PL (2007). "Antimicrobial therapy". The ICU book. Hagerstown, MD: Lippincott Williams & Wilkins. p. 817. ISBN 978-0-7817-4802-5.
- ^ a b Arulkumaran N, Routledge M, Schlebusch S, Lipman J, Conway Morris A (February 2020). "Antimicrobial-associated harm in critical care: a narrative review". Intensive Care Medicine. 46 (2): 225–235. doi:10.1007/s00134-020-05929-3. PMC 7046486. PMID 31996961.
- ^ a b c Larson E (2007). "Community factors in the development of antibiotic resistance". Annual Review of Public Health. 28 (1): 435–47. doi:10.1146/annurev.publhealth.28.021406.144020. PMID 17094768.
- ^ a b Hawkey PM (September 2008). "The growing burden of antimicrobial resistance". The Journal of Antimicrobial Chemotherapy. 62 (Supplement 1): i1-9. CiteSeerX 10.1.1.629.3960. doi:10.1093/jac/dkn241. PMID 18684701.
- ^ Ong S, Nakase J, Moran GJ, Karras DJ, Kuehnert MJ, Talan DA (September 2007). "Antibiotic use for emergency department patients with upper respiratory infections: prescribing practices, patient expectations, and patient satisfaction". Annals of Emergency Medicine. 50 (3): 213–20. doi:10.1016/j.annemergmed.2007.03.026. PMID 17467120.
- ^ Metlay JP, Camargo CA, MacKenzie T, McCulloch C, Maselli J, Levin SK, et al. (September 2007). "Cluster-randomized trial to improve antibiotic use for adults with acute respiratory infections treated in emergency departments". Annals of Emergency Medicine. 50 (3): 221–30. doi:10.1016/j.annemergmed.2007.03.022. PMID 17509729.
- ^ Coxeter P, Del Mar CB, McGregor L, Beller EM, Hoffmann TC (November 2015). "Interventions to facilitate shared decision making to address antibiotic use for acute respiratory infections in primary care". The Cochrane Database of Systematic Reviews. 11 (11): CD010907. doi:10.1002/14651858.CD010907.pub2. PMC 6464273. PMID 26560888.
- ^ Mendelson M, Røttingen JA, Gopinathan U, Hamer DH, Wertheim H, Basnyat B, et al. (January 2016). "Maximising access to achieve appropriate human antimicrobial use in low-income and middle-income countries". Lancet. 387 (10014): 188–98. doi:10.1016/S0140-6736(15)00547-4. PMID 26603919. S2CID 13904240.
- ^ "[1] 2017년 12월 27일 Wayback Machine에 보관" 질병 통제 및 예방 센터. 2009년 3월 12일 회수.
- ^ "Keep Antibiotics Working". Keep Antibiotics Working. Archived from the original on 24 October 2010. Retrieved 21 May 2010.
- ^ Sabuncu E, David J, Bernède-Bauduin C, Pépin S, Leroy M, Boëlle PY, et al. (June 2009). Klugman KP (ed.). "Significant reduction of antibiotic use in the community after a nationwide campaign in France, 2002-2007". PLOS Medicine. 6 (6): e1000084. doi:10.1371/journal.pmed.1000084. PMC 2683932. PMID 19492093.
- ^ "Regulation (EC) No 1831/2003 of the European Parliament and of the Council". Archived from the original on 9 January 2009.
- ^ "The Overuse of Antibiotics in Food Animals Threatens Public Health". Consumer Reports. Archived from the original on 28 June 2016. Retrieved 4 July 2016.
- ^ a b "Preservation of Antibiotics for Medical Treatment Act of 2005 (2005 - S. 742)". GovTrack.us. Archived from the original on 15 April 2019. Retrieved 15 April 2019.
- ^ a b "Preservation of Antibiotics for Medical Treatment Act of 2005 (2005 - H.R. 2562)". GovTrack.us. Archived from the original on 15 April 2019. Retrieved 15 April 2019.
- ^ "Kee Antibiotics Working" (PDF). Archived from the original (PDF) on 25 March 2009. Retrieved 12 November 2008.
- ^ "The Preservation of Antibiotics for Medical Treatment Act of 2005 (S. 742/H.R. 2562)" (PDF). The Institute for Agriculture and Trade Policy. Archived (PDF) from the original on 30 October 2020. Retrieved 4 October 2020.
- ^ Charles D (22 December 2016). "Despite Pledges To Cut Back, Farms Are Still Using Antibiotics". NPR. Archived from the original on 26 July 2020. Retrieved 5 April 2018.
- ^ Gever J (23 March 2012). "FDA Told to Move on Antibiotic Use in Livestock". MedPage Today. Archived from the original on 27 April 2021. Retrieved 24 March 2012.
- ^ Barnes S. "Rutgers study finds antibiotic overuse is caused by misconceptions, financial incentives". The Daily Targum. Archived from the original on 6 December 2021. Retrieved 16 February 2021.
- ^ Blaser MJ, Melby MK, Lock M, Nichter M (February 2021). "Accounting for variation in and overuse of antibiotics among humans". BioEssays. 43 (2): e2000163. doi:10.1002/bies.202000163. PMID 33410142. S2CID 230811912. Archived from the original on 16 February 2021. Retrieved 16 February 2021.
- ^ Kalghatgi S, Spina CS, Costello JC, Liesa M, Morones-Ramirez JR, Slomovic S, et al. (July 2013). "Bactericidal antibiotics induce mitochondrial dysfunction and oxidative damage in Mammalian cells". Science Translational Medicine. 5 (192): 192ra85. doi:10.1126/scitranslmed.3006055. PMC 3760005. PMID 23825301.
- ^ Singer M (January 2014). "The role of mitochondrial dysfunction in sepsis-induced multi-organ failure". Virulence. 5 (1): 66–72. doi:10.4161/viru.26907. PMC 3916385. PMID 24185508.
- ^ Alagna L, Bandera A, Patruno A, Muscatello A, Citerio G, Gori A (May 2019). "Microbiota in ICU, not only a gut problem". Intensive Care Medicine. 45 (5): 733–737. doi:10.1007/s00134-018-05516-7. PMID 30671622. S2CID 58949829.
- ^ Lindblad WJ (June 2008). "Considerations for determining if a natural product is an effective wound-healing agent". The International Journal of Lower Extremity Wounds. 7 (2): 75–81. doi:10.1177/1534734608316028. PMID 18483011. S2CID 5059255.
- ^ Forrest RD (March 1982). "Early history of wound treatment". Journal of the Royal Society of Medicine. 75 (3): 198–205. doi:10.1177/014107688207500310. PMC 1437561. PMID 7040656.
- ^ Wainwright M (1989). "Moulds in ancient and more recent medicine". Mycologist. 3 (1): 21–23. doi:10.1016/S0269-915X(89)80010-2.
- ^ Armelagos, George (2000). "Take Two Beers and Call Me in 1,600 Years: Use of Tetracycline by Nubians and Ancient Egyptians" (PDF). Natural History (5, May): 50–53. Retrieved 13 March 2017.[영구 데드링크]
- ^ a b Limbird LE (December 2004). "The receptor concept: a continuing evolution". Molecular Interventions. 4 (6): 326–36. doi:10.1124/mi.4.6.6. PMID 15616162.
- ^ a b Williams KJ (August 2009). "The introduction of 'chemotherapy' using arsphenamine - the first magic bullet". Journal of the Royal Society of Medicine. 102 (8): 343–348. doi:10.1258/jrsm.2009.09k036. PMC 2726818. PMID 19679737.
- ^ Chouhan S, Sharma K, Guleria S (August 2017). "Antimicrobial Activity of Some Essential Oils-Present Status and Future Perspectives". Medicines. 4 (3): 58. doi:10.3390/medicines4030058. PMC 5622393. PMID 28930272.
- ^ Cowan MM (October 1999). "Plant products as antimicrobial agents". Clinical Microbiology Reviews. 12 (4): 564–582. doi:10.1128/CMR.12.4.564. PMC 88925. PMID 10515903.
- ^ a b Frith J. "Arsenic – the "Poison of Kings" and the "Saviour of Syphilis"". Journal of Military and Veterans' Health. 21 (4). Archived from the original on 26 February 2017. Retrieved 31 January 2017.
- ^ "The Nobel Prize in Physiology or Medicine 1908". NobelPrize.org. Archived from the original on 14 August 2018. Retrieved 13 June 2017.
- ^ "Nomination Archive". NobelPrize.org. April 2020. Archived from the original on 26 July 2020. Retrieved 13 June 2017.
- ^ "Physiology or Medicine 1939 – Presentation Speech". Nobel Foundation. Archived from the original on 14 January 2015. Retrieved 14 January 2015.
- ^ Wright PM, Seiple IB, Myers AG (August 2014). "The evolving role of chemical synthesis in antibacterial drug discovery". Angewandte Chemie. 53 (34): 8840–69. doi:10.1002/anie.201310843. PMC 4536949. PMID 24990531.
- ^ Aminov RI (1 January 2010). "A brief history of the antibiotic era: lessons learned and challenges for the future". Frontiers in Microbiology. 1: 134. doi:10.3389/fmicb.2010.00134. PMC 3109405. PMID 21687759.
- ^ Kingston W (June 2008). "Irish contributions to the origins of antibiotics". Irish Journal of Medical Science. 177 (2): 87–92. doi:10.1007/s11845-008-0139-x. PMID 18347757. S2CID 32847260.
- ^ Foster W, Raoult A (December 1974). "Early descriptions of antibiosis". The Journal of the Royal College of General Practitioners. 24 (149): 889–94. PMC 2157443. PMID 4618289.
the first scientific observations of the antagonistic actions of various micro-organisms were made ... by William Roberts of Manchester (1874) and John Tyndall of London (1876).
- ^ Bucci R, Gallì P (11 May 2012). "Public Health History Corner Vincenzo Tiberio: a misunderstood researcher". Italian Journal of Public Health. 8 (4). Archived from the original on 20 September 2018. Retrieved 30 September 2017.
- ^ Duchesne E (23 September 2017). Duchesne's Antagonism between molds and bacteria, an English Colloquial Translation. Translated by Witty M. Independently Published. ISBN 978-1-5498-1696-3.
- ^ a b Straand J, Gradmann C, Simonsen GS, Lindbæk M (2008). International Encyclopedia of Public Health: Antibiotic Development and Resistance. Academic Press. p. 200. Archived from the original on 4 October 2016. Retrieved 31 January 2017.
- ^ Pathak A, Nowell RW, Wilson CG, Ryan MJ, Barraclough TG (September 2020). "Comparative genomics of Alexander Fleming's original Penicillium isolate (IMI 15378) reveals sequence divergence of penicillin synthesis genes". Scientific Reports. 10 (1): Article 15705. Bibcode:2020NatSR..1015705P. doi:10.1038/s41598-020-72584-5. PMC 7515868. PMID 32973216.
- ^ Tan SY, Tatsumura Y (July 2015). "Alexander Fleming (1881-1955): Discoverer of penicillin". Singapore Medical Journal. 56 (7): 366–7. doi:10.11622/smedj.2015105. PMC 4520913. PMID 26243971.
- ^ Fleming A (1980). "Classics in infectious diseases: on the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae by Alexander Fleming, Reprinted from the British Journal of Experimental Pathology 10:226-236, 1929". Reviews of Infectious Diseases. 2 (1): 129–39. doi:10.1093/clinids/2.1.129. PMC 2041430. PMID 6994200.Fleming A (1980). "Classics in infectious diseases: on the antibacterial action of cultures of a penicillium, with special reference to their use in the isolation of B. influenzae by Alexander Fleming, Reprinted from the British Journal of Experimental Pathology 10:226-236, 1929". Reviews of Infectious Diseases. 2 (1): 129–39. doi:10.1093/clinids/2.1.129. PMC 2041430. PMID 6994200.재인쇄:
- ^ Sykes R (2001). "Penicillin: from discovery to product". Bulletin of the World Health Organization. 79 (8): 778–9. PMC 2566502. PMID 11545336.
- ^ Jones DS, Jones JH (1 December 2014). "Sir Edward Penley Abraham CBE. 10 June 1913 – 9 May 1999". Biographical Memoirs of Fellows of the Royal Society. 60: 5–22. doi:10.1098/rsbm.2014.0002. ISSN 0080-4606.
- ^ Florey HW (November 1945). "Use of Micro-organisms for Therapeutic Purposes". British Medical Journal. 2 (4427): 635–42. doi:10.1136/bmj.2.4427.635. PMC 2060276. PMID 20786386.
- ^ "The Nobel Prize in Physiology or Medicine 1945". The Nobel Prize Organization. Archived from the original on 23 May 2020. Retrieved 13 January 2018.
- ^ a b Van Epps HL (February 2006). "René Dubos: unearthing antibiotics". The Journal of Experimental Medicine. 203 (2): 259. doi:10.1084/jem.2032fta. PMC 2118194. PMID 16528813.
- ^ Capocci M (1 January 2014). "Cold drugs. Circulation, production and intelligence of antibiotics in post-WWII years". Medicina Nei Secoli. 26 (2): 401–21. PMID 26054208.
- ^ Conly J, Johnston B (May 2005). "Where are all the new antibiotics? The new antibiotic paradox". The Canadian Journal of Infectious Diseases & Medical Microbiology. 16 (3): 159–60. doi:10.1155/2005/892058. PMC 2095020. PMID 18159536.
- ^ a b c 임상 개발 중인 항균제 : 결핵을 포함한 항균 임상 개발 파이프라인 분석 제네바: 세계보건기구; 2017(WHO/EMP/IAU/2017.12). 라이선스: CC BY-NC-SA 3.0 IGO.
- ^ Boucher HW, Talbot GH, Benjamin DK, Bradley J, Guidos RJ, Jones RN, et al. (June 2013). "10 x '20 Progress--development of new drugs active against gram-negative bacilli: an update from the Infectious Diseases Society of America". Clinical Infectious Diseases. 56 (12): 1685–94. doi:10.1093/cid/cit152. PMC 3707426. PMID 23599308.
- ^ Steenhuysen J (18 April 2013). "Drug pipeline for worst superbugs 'on life support': report". Reuters. Archived from the original on 25 December 2015. Retrieved 23 June 2013.
- ^ a b Boucher HW, Talbot GH, Benjamin DK, Bradley J, Guidos RJ, Jones RN, et al. (June 2013). Infectious Diseases Society of America. "10 x '20 Progress--development of new drugs active against gram-negative bacilli: an update from the Infectious Diseases Society of America". Clinical Infectious Diseases. 56 (12): 1685–94. doi:10.1093/cid/cit152. PMC 3707426. PMID 23599308.
- ^ Liu J, Bedell TA, West JG, Sorensen EJ (June 2016). "Design and Synthesis of Molecular Scaffolds with Anti-infective Activity". Tetrahedron. 72 (25): 3579–3592. doi:10.1016/j.tet.2016.01.044. PMC 4894353. PMID 27284210.
- ^ a b c Fernandes P, Martens E (June 2017). "Antibiotics in late clinical development". Biochemical Pharmacology. 133: 152–163. doi:10.1016/j.bcp.2016.09.025. PMID 27687641.
- ^ a b c d e f g h i Butler MS, Paterson DL (June 2020). "Antibiotics in the clinical pipeline in October 2019". The Journal of Antibiotics. 73 (6): 329–364. doi:10.1038/s41429-020-0291-8. PMC 7223789. PMID 32152527.
- ^ Zampaloni C, Mattei P, Bleicher K, Winther L, Thäte C, Bucher C, et al. (3 January 2024). "A novel antibiotic class targeting the lipopolysaccharide transporter". Nature. 625 (7995): 566–571. Bibcode:2024Natur.625..566Z. doi:10.1038/s41586-023-06873-0. PMC 10794144. PMID 38172634.
- ^ Pahil KS, Gilman M, Baidin V, Clairfeuille T, Mattei P, Bieniossek C, et al. (3 January 2024). "A new antibiotic traps lipopolysaccharide in its intermembrane transporter". Nature. 625 (7995): 572–577. Bibcode:2024Natur.625..572P. doi:10.1038/s41586-023-06799-7. PMC 10794137. PMID 38172635.
- ^ "Antibiotic Development to Advance Patient Treatment Act of 2013" (PDF). US Congress. 12 December 2013. Archived (PDF) from the original on 9 October 2022.
- ^ Clarke T (19 September 2014). "U.S. Congress urged to pass bill to speed development of antibiotics". Reuters. Reuters. Archived from the original on 9 December 2015. Retrieved 19 September 2014.
- ^ a b c Moloney MG (August 2016). "Natural Products as a Source for Novel Antibiotics". Trends in Pharmacological Sciences. 37 (8): 689–701. doi:10.1016/j.tips.2016.05.001. PMID 27267698. S2CID 3537191. Archived from the original on 27 July 2021. Retrieved 25 August 2020.
- ^ a b c d e Cushnie TP, Cushnie B, Echeverría J, Fowsantear W, Thammawat S, Dodgson JL, et al. (June 2020). "Bioprospecting for Antibacterial Drugs: a Multidisciplinary Perspective on Natural Product Source Material, Bioassay Selection and Avoidable Pitfalls". Pharmaceutical Research. 37 (7): 125. doi:10.1007/s11095-020-02849-1. PMID 32529587. S2CID 219590658. Archived from the original on 2 December 2020. Retrieved 17 September 2020.
- ^ Mashalidis EH, Lee SY (August 2020). "Structures of Bacterial MraY and Human GPT Provide Insights into Rational Antibiotic Design". Journal of Molecular Biology. 432 (18): 4946–4963. doi:10.1016/j.jmb.2020.03.017. PMC 8351759. PMID 32199982.
- ^ Xia J, Feng B, Wen G, Xue W, Ma G, Zhang H, et al. (July 2020). "Bacterial Lipoprotein Biosynthetic Pathway as a Potential Target for Structure-based Design of Antibacterial Agents". Current Medicinal Chemistry. 27 (7): 1132–1150. doi:10.2174/0929867325666181008143411. PMID 30360704. S2CID 53097836.
- ^ a b c d e f g h i j k Theuretzbacher U, Piddock LJ (July 2019). "Non-traditional Antibacterial Therapeutic Options and Challenges". Cell Host & Microbe. 26 (1): 61–72. doi:10.1016/j.chom.2019.06.004. PMID 31295426.
- ^ a b c d e f g h i Ghosh C, Sarkar P, Issa R, Haldar J (April 2019). "Alternatives to Conventional Antibiotics in the Era of Antimicrobial Resistance". Trends in Microbiology. 27 (4): 323–338. doi:10.1016/j.tim.2018.12.010. PMID 30683453. S2CID 59274650.
- ^ Abedon ST, Kuhl SJ, Blasdel BG, Kutter EM (March 2011). "Phage treatment of human infections". Bacteriophage. 1 (2): 66–85. doi:10.4161/bact.1.2.15845. PMC 3278644. PMID 22334863.
- ^ a b Czaplewski L, Bax R, Clokie M, Dawson M, Fairhead H, Fischetti VA, et al. (February 2016). "Alternatives to antibiotics-a pipeline portfolio review" (PDF). The Lancet. Infectious Diseases. 16 (2): 239–51. doi:10.1016/S1473-3099(15)00466-1. PMID 26795692. S2CID 21677232. Archived (PDF) from the original on 17 August 2019. Retrieved 22 November 2018.
- ^ Moayyedi P, Yuan Y, Baharith H, Ford AC (August 2017). "Faecal microbiota transplantation for Clostridium difficile-associated diarrhoea: a systematic review of randomised controlled trials". The Medical Journal of Australia. 207 (4): 166–172. doi:10.5694/mja17.00295. PMID 28814204. S2CID 24780848.
- ^ Vrancianu CO, Gheorghe I, Czobor IB, Chifiriuc MC (June 2020). "Antibiotic Resistance Profiles, Molecular Mechanisms and Innovative Treatment Strategies of Acinetobacter baumannii". Microorganisms. 8 (6): Article 935. doi:10.3390/microorganisms8060935. PMC 7355832. PMID 32575913.
- ^ Hutchings MI, Truman AW, Wilkinson B (October 2019). "Antibiotics: past, present and future". Current Opinion in Microbiology. 51: 72–80. doi:10.1016/j.mib.2019.10.008. PMID 31733401.
- ^ Holmes NA, Devine R, Qin Z, Seipke RF, Wilkinson B, Hutchings MI (January 2018). "Complete genome sequence of Streptomyces formicae KY5, the formicamycin producer". Journal of Biotechnology. 265: 116–118. doi:10.1016/j.jbiotec.2017.11.011. PMID 29191667.
- ^ "hutchingslab Resources and Information". ww3.hutchingslab.uk. Archived from the original on 7 April 2023. Retrieved 22 August 2022.
- ^ Bills GF, Gloer JB, An Z (October 2013). "Coprophilous fungi: antibiotic discovery and functions in an underexplored arena of microbial defensive mutualism". Current Opinion in Microbiology. 16 (5): 549–65. doi:10.1016/j.mib.2013.08.001. PMID 23978412.
- ^ Kenny CR, Furey A, Lucey B (2015). "A post-antibiotic era looms: can plant natural product research fill the void?". British Journal of Biomedical Science. 72 (4): 191–200. doi:10.1080/09674845.2015.11665752. PMID 26738402. S2CID 41282022.
- ^ Al-Habib A, Al-Saleh E, Safer AM, Afzal M (June 2010). "Bactericidal effect of grape seed extract on methicillin-resistant Staphylococcus aureus (MRSA)". The Journal of Toxicological Sciences. 35 (3): 357–64. doi:10.2131/jts.35.357. PMID 20519844.
- ^ Smullen J, Koutsou GA, Foster HA, Zumbé A, Storey DM (2007). "The antibacterial activity of plant extracts containing polyphenols against Streptococcus mutans". Caries Research. 41 (5): 342–9. doi:10.1159/000104791. PMID 17713333. S2CID 44317367.
- ^ a b Monte J, Abreu AC, Borges A, Simões LC, Simões M (June 2014). "Antimicrobial Activity of Selected Phytochemicals against Escherichia coli and Staphylococcus aureus and Their Biofilms". Pathogens. 3 (2): 473–98. doi:10.3390/pathogens3020473. PMC 4243457. PMID 25437810.
- ^ Tanaka N, Kusama T, Kashiwada Y, Kobayashi J (April 2016). "Bromopyrrole Alkaloids from Okinawan Marine Sponges Agelas spp". Chemical & Pharmaceutical Bulletin. 64 (7): 691–4. doi:10.1248/cpb.c16-00245. PMID 27373625.
- ^ Cowan MM (October 1999). "Plant products as antimicrobial agents". Clinical Microbiology Reviews. 12 (4): 564–82. doi:10.1128/CMR.12.4.564. PMC 88925. PMID 10515903.
- ^ a b c Abreu AC, McBain AJ, Simões M (September 2012). "Plants as sources of new antimicrobials and resistance-modifying agents". Natural Product Reports. 29 (9): 1007–21. doi:10.1039/c2np20035j. PMID 22786554.
- ^ Mahajan GB, Balachandran L (June 2017). "Sources of antibiotics: Hot springs". Biochemical Pharmacology. 134: 35–41. doi:10.1016/j.bcp.2016.11.021. PMID 27890726.
- ^ a b Allison KR, Brynildsen MP, Collins JJ (May 2011). "Metabolite-enabled eradication of bacterial persisters by aminoglycosides". Nature. 473 (7346): 216–20. Bibcode:2011Natur.473..216A. doi:10.1038/nature10069. PMC 3145328. PMID 21562562.
- ^ Marquez B (December 2005). "Bacterial efflux systems and efflux pumps inhibitors". Biochimie. 87 (12): 1137–47. doi:10.1016/j.biochi.2005.04.012. PMID 15951096.
- ^ Cushnie TP, Cushnie B, Lamb AJ (November 2014). "Alkaloids: an overview of their antibacterial, antibiotic-enhancing and antivirulence activities". International Journal of Antimicrobial Agents. 44 (5): 377–86. doi:10.1016/j.ijantimicag.2014.06.001. PMID 25130096. S2CID 205171789. Archived from the original on 18 August 2020. Retrieved 19 July 2019.
- ^ a b Molnár J, Engi H, Hohmann J, Molnár P, Deli J, Wesolowska O, et al. (2010). "Reversal of multidrug resistance by natural substances from plants". Current Topics in Medicinal Chemistry. 10 (17): 1757–68. doi:10.2174/156802610792928103. PMID 20645919.
- ^ a b Cushnie TP, Lamb AJ (August 2011). "Recent advances in understanding the antibacterial properties of flavonoids". International Journal of Antimicrobial Agents. 38 (2): 99–107. doi:10.1016/j.ijantimicag.2011.02.014. PMID 21514796. Archived from the original on 26 July 2020. Retrieved 19 July 2019.
- ^ a b Xue L, Chen YY, Yan Z, Lu W, Wan D, Zhu H (July 2019). "Staphyloxanthin: a potential target for antivirulence therapy". Infection and Drug Resistance. 12: 2151–2160. doi:10.2147/IDR.S193649. PMC 6647007. PMID 31410034.
- ^ Mok N, Chan SY, Liu SY, Chua SL (July 2020). "Vanillin inhibits PqsR-mediated virulence in Pseudomonas aeruginosa". Food & Function. 11 (7): 6496–6508. doi:10.1039/D0FO00046A. hdl:10397/88306. PMID 32697213. S2CID 220699939.
- ^ Kim HR, Shin DS, Jang HI, Eom YB (August 2020). "Anti-biofilm and anti-virulence effects of zerumbone against Acinetobacter baumannii". Microbiology. 166 (8): 717–726. doi:10.1099/mic.0.000930. PMID 32463353.
- ^ "5 Natural Antibiotics Used Instead Of Over The Counter Antibiotics (Drugs)". 5 March 2024. Retrieved 12 March 2024.
- ^ Plotkin SA, Orenstein WA, Offit PA (2012). Vaccines. Elsevier Health Sciences. pp. 103, 757. ISBN 978-1-4557-0090-5. Archived from the original on 9 January 2017.
- ^ a b c Sulakvelidze A, Alavidze Z, Morris JG (March 2001). "Bacteriophage therapy". Antimicrobial Agents and Chemotherapy. 45 (3): 649–59. doi:10.1128/aac.45.3.649-659.2001. PMC 90351. PMID 11181338.
- ^ a b c d Gill EE, Franco OL, Hancock RE (January 2015). "Antibiotic adjuvants: diverse strategies for controlling drug-resistant pathogens". Chemical Biology & Drug Design. 85 (1): 56–78. doi:10.1111/cbdd.12478. PMC 4279029. PMID 25393203.
- ^ Dunne M, Rupf B, Tala M, Qabrati X, Ernst P, Shen Y, et al. (October 2019). "Reprogramming Bacteriophage Host Range through Structure-Guided Design of Chimeric Receptor Binding Proteins". Cell Reports. 29 (5): 1336–1350.e4. doi:10.1016/j.celrep.2019.09.062. hdl:20.500.11850/374453. PMID 31665644. S2CID 204967212.
- ^ Opal SM (December 2016). "Non-antibiotic treatments for bacterial diseases in an era of progressive antibiotic resistance". Critical Care. 20 (1): 397. doi:10.1186/s13054-016-1549-1. PMC 5159963. PMID 27978847.
- ^ D'Odorico I, Di Bella S, Monticelli J, Giacobbe DR, Boldock E, Luzzati R (June 2018). "Role of fecal microbiota transplantation in inflammatory bowel disease". Journal of Digestive Diseases. 19 (6): 322–334. doi:10.1111/1751-2980.12603. PMID 29696802. S2CID 24461869.
- ^ Ishino Y, Krupovic M, Forterre P (April 2018). "History of CRISPR-Cas from Encounter with a Mysterious Repeated Sequence to Genome Editing Technology". Journal of Bacteriology. 200 (7): e00580-17. doi:10.1128/JB.00580-17. PMC 5847661. PMID 29358495.
- ^ Ritchie, Roser, Mispy, Ortiz-Ospina (2018) "지속 가능한 개발 목표를 향한 진행 상황 측정." (SDG 6) 2020년 11월 1일 Wayback Machine SDG-Tracker.org , 웹사이트에서 보관.
- ^ "Household crowding". World Health Organization. Archived from the original on 6 January 2021. Retrieved 17 September 2020.
- ^ Ali SH, Foster T, Hall NL (December 2018). "The Relationship between Infectious Diseases and Housing Maintenance in Indigenous Australian Households". International Journal of Environmental Research and Public Health. 15 (12): Article 2827. doi:10.3390/ijerph15122827. PMC 6313733. PMID 30545014.
- ^ "Water, sanitation and hygiene links to health". World Health Organization. Archived from the original on 7 September 2020. Retrieved 17 September 2020.
- ^ Curtis V, Schmidt W, Luby S, Florez R, Touré O, Biran A (April 2011). "Hygiene: new hopes, new horizons". The Lancet. Infectious Diseases. 11 (4): 312–21. doi:10.1016/S1473-3099(10)70224-3. PMC 7106354. PMID 21453872.
- ^ Gentry EM, Kester S, Fischer K, Davidson LE, Passaretti CL (March 2020). "Bugs and Drugs: Collaboration Between Infection Prevention and Antibiotic Stewardship". Infectious Disease Clinics of North America. 34 (1): 17–30. doi:10.1016/j.idc.2019.10.001. PMID 31836329. S2CID 209358146.
- ^ Fierens J, Depuydt PO, De Waele JJ (August 2019). "A Practical Approach to Clinical Antibiotic Stewardship in the ICU Patient with Severe Infection". Seminars in Respiratory and Critical Care Medicine. 40 (4): 435–446. doi:10.1055/s-0039-1693995. PMID 31585470. S2CID 203720304.
- ^ Newman AM, Arshad M (September 2020). "The Role of Probiotics, Prebiotics and Synbiotics in Combating Multidrug-Resistant Organisms". Clinical Therapeutics. 42 (9): 1637–1648. doi:10.1016/j.clinthera.2020.06.011. PMC 7904027. PMID 32800382.
- ^ Giordano M, Baldassarre ME, Palmieri V, Torres DD, Carbone V, Santangelo L, et al. (May 2019). "Management of STEC Gastroenteritis: Is There a Role for Probiotics?". International Journal of Environmental Research and Public Health. 16 (9): Article 1649. doi:10.3390/ijerph16091649. PMC 6539596. PMID 31083597.
- ^ Jha R, Das R, Oak S, Mishra P (October 2020). "Probiotics (Direct-Fed Microbials) in Poultry Nutrition and Their Effects on Nutrient Utilization, Growth and Laying Performance, and Gut Health: A Systematic Review". Animals. 10 (10): 1863. doi:10.3390/ani10101863. PMC 7602066. PMID 33066185.
- ^ Jha R, Mishra P (April 2021). "Dietary fiber in poultry nutrition and their effects on nutrient utilization, performance, gut health, and on the environment: a review". Journal of Animal Science and Biotechnology. 12 (1): 51. doi:10.1186/s40104-021-00576-0. PMC 8054369. PMID 33866972.
- ^ Beckley AM, Wright ES (October 2021). "Identification of antibiotic pairs that evade concurrent resistance via a retrospective analysis of antimicrobial susceptibility test results". The Lancet. Microbe. 2 (10): e545–e554. doi:10.1016/S2666-5247(21)00118-X. PMC 8496867. PMID 34632433.
- ^ Ma Y, Chua SL (15 November 2021). "No collateral antibiotic sensitivity by alternating antibiotic pairs". The Lancet Microbe. 3 (1): e7. doi:10.1016/S2666-5247(21)00270-6. ISSN 2666-5247. PMID 35544116. S2CID 244147577.
- ^ Donald RG, Anderson AS (2011). "Current strategies for antibacterial vaccine development". In Miller PF (ed.). Emerging trends in antibacterial discovery: answering the call to arms. Horizon Scientific Press. p. 283.
- ^ Miller AA (2011). Miller PF (ed.). Emerging trends in antibacterial discovery: answering the call to arms. Caister Academic Press. ISBN 978-1-904455-89-9.[페이지 필요]
추가읽기
- Gould K (March 2016). "Antibiotics: from prehistory to the present day". The Journal of Antimicrobial Chemotherapy. 71 (3): 572–5. doi:10.1093/jac/dkv484. PMID 26851273.
- Davies J, Davies D (September 2010). "Origins and evolution of antibiotic resistance". Microbiology and Molecular Biology Reviews. 74 (3): 417–33. doi:10.1128/MMBR.00016-10. PMC 2937522. PMID 20805405.
- "Antibiotics: MedlinePlus". nih.gov. Archived from the original on 27 July 2016. Retrieved 19 July 2016.
- "WHO's first global report on antibiotic resistance reveals serious, worldwide threat to public health". WHO. Archived from the original on 30 April 2014.
- Pugh R, Grant C, Cooke RP, Dempsey G (August 2015). "Short-course versus prolonged-course antibiotic therapy for hospital-acquired pneumonia in critically ill adults". The Cochrane Database of Systematic Reviews. 2015 (8): CD007577. doi:10.1002/14651858.CD007577.pub3. PMC 7025798. PMID 26301604.
- Giedraitienė A, Vitkauskienė A, Naginienė R, Pavilonis A (1 January 2011). "Antibiotic resistance mechanisms of clinically important bacteria". Medicina. 47 (3): 137–46. doi:10.3390/medicina47030019. PMID 21822035.
외부 링크
| 라이브러리 리소스정보 항생제 |