유황
Sulfur | ||||||||||||||||||||||||||||||||||||
| 유황 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 대체명 | 유황(영문 맞춤법) | |||||||||||||||||||||||||||||||||||
| 동소체 | 유황 동소체를 보다. | |||||||||||||||||||||||||||||||||||
| 외모 | 레몬 옐로우 소결 마이크로 크리스탈 | |||||||||||||||||||||||||||||||||||
| 표준 원자량 Ar°(S) | ||||||||||||||||||||||||||||||||||||
| 주기율표의 황 | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||
| 원자번호 (Z) | 16 | |||||||||||||||||||||||||||||||||||
| 그룹. | 16족(칼코겐) | |||||||||||||||||||||||||||||||||||
| 기간 | 3교시 | |||||||||||||||||||||||||||||||||||
| 블록 | p-블록 | |||||||||||||||||||||||||||||||||||
| 전자구성 | [Ne] 3s2 3p4 | |||||||||||||||||||||||||||||||||||
| 쉘당 전자수 | 2, 8, 6 | |||||||||||||||||||||||||||||||||||
| 물성 | ||||||||||||||||||||||||||||||||||||
| 단계 STP에서 | 단단한 | |||||||||||||||||||||||||||||||||||
| 융점 | 388.36 K (115.21 °C, 239.38 °F) | |||||||||||||||||||||||||||||||||||
| 끓는점 | 717.8 K (444.6 °C, 832.3 °F) | |||||||||||||||||||||||||||||||||||
| 밀도 (근처) | 알파(α-S8): 2.07g/cm3 beta (β-S8): 1.96 g/cm3 감마(γ-S): 1.92g/cm | |||||||||||||||||||||||||||||||||||
| 유동적일 때 | 1.819g/cm3 | |||||||||||||||||||||||||||||||||||
| 임계점 | 1314 K, 20.7 MPa | |||||||||||||||||||||||||||||||||||
| 핵융합열 | beta (β-S8): 1.727 kJ/mol | |||||||||||||||||||||||||||||||||||
| 기화열 | 베타(β-S8) : 45kJ/mol | |||||||||||||||||||||||||||||||||||
| 몰 열용량 | 22.75 J/(mol·K) | |||||||||||||||||||||||||||||||||||
증기압
| ||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||
| 산화상태 | -2, -1, 0, +1, +2, +3, +4, +5, +6(강산성 산화물) | |||||||||||||||||||||||||||||||||||
| 전기음성도 | 폴링 척도: 2.58 | |||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||
| 공유 반지름 | 105±3pm | |||||||||||||||||||||||||||||||||||
| 반데르발스 반지름 | 오후 180시 | |||||||||||||||||||||||||||||||||||
| 기타속성 | ||||||||||||||||||||||||||||||||||||
| 자연발생 | 원시의 | |||||||||||||||||||||||||||||||||||
| 결정구조 | 알파(α-S8): 사방정계(oF128) | |||||||||||||||||||||||||||||||||||
| 격자 상수 | a = 1.0460 nm b = 1.2861 nm c = 2.4481 nm (at 20 °C)[3] | |||||||||||||||||||||||||||||||||||
| 결정구조 | 베타(β-S8): 단사정계(mP48) | |||||||||||||||||||||||||||||||||||
| 격자 상수 | a = 1.0923 nm b = 1.0851 nm c = 1.0787 nm β = 95.905° (at 20 °C)[3] | |||||||||||||||||||||||||||||||||||
| 열전도율 | 0.205 W/(m⋅K) (amorphous) | |||||||||||||||||||||||||||||||||||
| 전기저항 | 2×1015 Ω⋅m (at 20 °C) (amorphous) | |||||||||||||||||||||||||||||||||||
| 자기순서 | 반자성의[4] | |||||||||||||||||||||||||||||||||||
| 몰 자기 감수성 | 알파(α-S8) : -15.5x10cm−63/mol (298K)[5] | |||||||||||||||||||||||||||||||||||
| 벌크 모듈러스 | 7.7 GPa | |||||||||||||||||||||||||||||||||||
| 모스 경도 | 2.0 | |||||||||||||||||||||||||||||||||||
| CAS 번호 | 7704-34-9 | |||||||||||||||||||||||||||||||||||
| 역사 | ||||||||||||||||||||||||||||||||||||
| 디스커버리 | 기원전[6] 2000년 이전에 | |||||||||||||||||||||||||||||||||||
| 에 의해 요소로 인식됨 | 앙투안 라부아지에 (1777) | |||||||||||||||||||||||||||||||||||
| 황 동위 원소 | ||||||||||||||||||||||||||||||||||||
34S의 풍부함은 자연 샘플에서 매우 다양합니다(3.96~4.77%). | ||||||||||||||||||||||||||||||||||||
황(黃, )은 화학 원소로 기호 S와 원자 번호 16을 가지고 있습니다. 풍부하고 다가적이며 비금속적입니다. 정상적인 조건에서 황 원자는 화학식 S와8 함께 고리 모양의 팔원자 분자를 형성합니다. 황 원소는 상온에서 밝은 노란색의 결정질 고체입니다.
황은 우주에서 질량으로 10번째로 풍부한 원소이며 지구상에서 5번째로 풍부한 원소입니다. 때때로 순수한 천연 형태로 발견되지만, 지구의 황은 보통 황화물과 황산염 광물로 발생합니다. 천연 형태로 풍부한 유황은 고대 인도, 고대 그리스, 중국 및 고대 이집트에서 사용된 것으로 언급되어 고대에 알려졌습니다. 역사적으로 그리고 문헌적으로 유황은 "불타는 돌"을 의미하는 [7]브림스톤이라고도 불립니다.[8] 오늘날 거의 모든 원소 유황은 천연가스와 석유에서 유황을 함유한 오염물질을 제거하는 부산물로 생산됩니다.[9][10] 이 원소의 가장 큰 상업적 용도는 황산염 및 인산염 비료 및 기타 화학 공정을 위한 황산 생산입니다. 황은 성냥, 살충제 및 살균제에 사용됩니다. 많은 유황 화합물은 냄새가 나고, 냄새가 나는 천연가스, 스컹크 향, 구취, 자몽, 마늘 냄새는 유기유황 화합물 때문입니다. 황화수소는 썩은 달걀과 다른 생물학적 과정에 특징적인 냄새를 줍니다.
황은 거의 항상 유기황 화합물 또는 금속 황화물의 형태로 모든 생명체에 필수적인 원소입니다. 아미노산(시스테인과 메티오닌, 그리고 시스틴, 타우린 등)과 2가지 비타민(비오틴과 티아민)은 생명에 중요한 유기황 화합물입니다. 글루타티온을 포함한 많은 보조인자에는 황과 철-황 단백질도 포함되어 있습니다. 이황화물, S-S 결합은 외피, 모발, 깃털에서 발견되는 단백질 케라틴의 기계적 강도와 불용성을 부여합니다. 황은 생화학적 기능에 필요한 핵심적인 화학 원소 중 하나로 모든 생명체의 원소 다량영양소입니다.
특성.
물성

황은 여러 개의 다원자 분자를 형성합니다. 가장 잘 알려진 동소체는 옥타설퍼, 사이클로-S입니다8. 사이클로-S의8 점군은 D이고4d 쌍극자 모멘트는 0 D입니다.[11] 옥타설퍼는 부드럽고 밝은 노란색의 고체로 냄새가 나지 않지만 불순한 샘플은 성냥과 비슷한 냄새가 납니다.[12] 이것은 115.21 °C (239.38 °F)에서 녹고, 444.6 °C (832.3 °F)[7]에서 끓고, 20 °C (68 °F)에서 50 °F (122 °F) 사이에서 부글부글 끓습니다.[13] 95.2 °C(203.4 °F)에서 사이클로옥타황은 용융 온도 아래에서 α-옥타황에서 β-폴리모프로 바뀝니다.[14] 이8 상변화에 의해 S 고리의 구조는 사실상 변하지 않으며, 이는 분자 간 상호작용에 영향을 미칩니다. 옥타설퍼는 녹는 온도와 끓는 온도 사이에서 다시 동소체를 변화시켜 β-옥타설퍼에서 γ-설퍼로 바뀌며, 다시 밀도는 낮지만 폴리머의 형성으로 인해 점도가 증가합니다. 더 높은 온도에서는 해중합이 발생함에 따라 점도가 감소합니다. 녹은 황은 200 °C(392 °F) 이상의 검붉은 색을 가정합니다. 황의 밀도는 동소체에 따라 약 2g/cm이며3, 안정한 동소체는 모두 우수한 전기 절연체입니다.
황은 물에는 불용성이지만 이황화탄소와 벤젠, 톨루엔과 같은 다른 비극성 유기 용매에는 덜 용해됩니다.
화학적 성질
정상적인 조건에서 황은 매우 느리게 가수분해되어 주로 황화수소와 황산을 형성합니다.
8 + 4 H
2O → 3 H
2S + H
2SO
4
반응은 S
8 클러스터에 양성자를 흡착한 후 반응 생성물로 불균형을 초래합니다.[15]
황의 두 번째, 네 번째 및 여섯 번째 이온화 에너지는 각각 2252 kJ/mol, 4556 kJ/mol 및 8495.8 kJ/mol입니다. 황과 산화제의 반응 생성물(및 산화 상태)의 구성은 반응 에너지에서 방출이 이러한 임계값을 극복하는지 여부에 달려 있습니다. 촉매를 적용하거나 외부 에너지를 공급하면 황의 산화 상태와 반응 생성물의 구성이 달라질 수 있습니다. 정상 조건에서 황과 산소 사이의 반응은 이산화황(산화 상태 +4)을 제공하지만, 삼산화황(산화 상태 +6)의 형성은 온도 400-600 °C(750-1,100 °F) 및 촉매의 존재를 필요로 합니다.
전기음성도가 낮은 원소와의 반응에서 산화제로 반응하여 황화물을 형성하는데, 여기서 산화 상태 -2를 갖습니다.
황은 비활성으로 악명 높은 금속 이리듐(이황화 이리듐을 생성함)을 사용하더라도 비활성 가스를 제외한 거의 모든 다른 원소와 반응합니다.[16] 이러한 반응 중 일부는 온도 상승이 필요합니다.[17]
동소체

황은 다른 어떤 원소보다도 많은 30개 이상의 고체 동소체를 형성합니다.[18] S8 외에도 여러 개의 고리가 알려져 있습니다.[19] 크라운에서 원자 하나를 제거하면 S가7 생성되는데, 이는 S8. HPLC에서 "원소 황"을 분석한 결과 주로 S의8 평형 혼합물을 나타내지만,[20] S와712 소량의18 S를6 포함한 더 큰 고리가 준비되었습니다.[21][22]
무정형 또는 "플라스틱" 유황은 용융된 유황을 급속 냉각하여 생성됩니다. 예를 들어, 냉수에 부어줍니다. X-선 결정학 연구에 따르면 비정질 형태는 회전당 8개의 원자를 갖는 나선형 구조를 가질 수 있습니다. 긴 코일 모양의 고분자 분자는 갈색 물질을 탄력 있게 만들고, 이 형태는 대부분 조잡한 고무의 느낌을 줍니다. 이 형태는 실온에서 준안정적이며 점차 결정질 분자 동소체로 되돌아가 더 이상 탄성이 없습니다. 이 과정은 몇 시간에서 며칠 사이에 발생하지만 빠르게 촉매될 수 있습니다.
동위 원소
황은 23개의 알려진 동위 원소를 가지고 있으며, 그 중 4개는 안정합니다: S(94.99%±0.26%), S(0.75%±0.02%), S(4.25%±0.24%), S(0.01%±0.01%).[23][24] S를 제외한 황의 방사성 동위원소는 반감기가 87일로 3시간 미만입니다.
S의 우세는 폭발하는 별에서 소위 알파 과정(핵융합 반응의 주요 부류 중 하나)에서 생성되는 것으로 설명됩니다. 다른 안정한 황 동위원소는 Ar과 관련된 우회 과정에서 생성되며, 그 구성은 항성 폭발의 종류에 따라 달라집니다. 예를 들어 초신성보다 초신성에서 비례적으로 더 많은 S가 나옵니다.[25]
행성 지구에서 황 동위원소 조성은 태양에 의해 결정되었습니다. 서로 다른 황 동위원소의 분포는 어느 정도 같아야 한다고 가정하지만, 가장 풍부한 두 황 동위원소 S와 S의 비율은 샘플마다 다르다는 것이 밝혀졌습니다. 시료의 동위원소 비율(δS)을 분석하면 화학적 이력에 대한 제안을 할 수 있으며, 다른 방법의 지원을 통해 시료의 연대를 측정하고, 광석과 물 사이의 평형 온도를 추정하고, pH와 산소 퍼가시티를 결정할 수 있습니다. 시료가 형성될 때 황산염-reducing 박테리아의 활성을 확인하거나 생태계 내 주요 황 공급원을 제시합니다. 그러나 δ S 이동, 생물학적 활동 또는 예금 후 변화의 진짜 이유가 무엇인지에 대한 지속적인 논의가 있습니다.
예를 들어, 황화물 광물이 침전될 때 고체와 액체 사이의 동위원소 평형은 공동 유전 광물의 δ S 값에 작은 차이를 일으킬 수 있습니다. 광물 간의 차이는 평형 온도를 추정하는 데 사용할 수 있습니다. 탄산염 광물과 황화물이 공존하는 δ C와 δ S는 광석 형성 중 광석 함유 유체의 pH와 산소 퓨가시티를 결정하는 데 사용될 수 있습니다.
과학자들은 과거 바다의 산화환원 상태를 연구하기 위해 암석과 퇴적물에 있는 광물의 황 동위원소를 측정합니다. 해양 퇴적물에 있는 황산염 환원 박테리아는 황산염을 흡수하고 황화물을 생성하면서 황 동위원소를 분별합니다. 2010년대 이전에는 황산염 환원이 mil당[28] 최대 46개의 황 동위원소를 분획할 수 있으며 침전물에 기록된 mil당 46개보다 큰 분획은 침전물에 포함된 황 화합물의 불균형으로 인한 것임에 틀림없습니다. 이러한 관점은 2010년대 이후 실험을 통해 황산염 환원 박테리아가 mil당 66개로 분획될 수 있음을 보여줌에 따라 바뀌었습니다.[29] 불균형 기질은 황산염 환원 생성물에 의해 제한되므로 불균형의 동위원소 효과는 대부분의 퇴적 환경에서 mil당 16개 미만이어야 합니다.[30]
대부분의 산림 생태계에서 황산염은 대부분 대기에서 파생됩니다. 광석 광물과 증발물의 풍화작용은 약간의 황을 기여합니다. 독특한 동위원소 구성을 가진 황은 오염원을 식별하는 데 사용되었으며 농축 황은 수문 연구에서 추적자로 추가되었습니다. 자연적인 풍부함의 차이는 생태계 구성 요소의 S에 충분한 변화가 있는 시스템에서 사용될 수 있습니다. 황산염의 대기 공급원에 의해 지배되는 것으로 생각되는 록키 마운틴 호수는 황산염의 유역 공급원에 의해 지배되는 것으로 생각되는 호수와 상당히 다른 S 값을 갖는 것으로 밝혀졌습니다.
방사성 S는 대기 Ar의 우주선 분열에서 형성됩니다. 이 사실은 다양한 것에서 최근(1년 이하) 대기 퇴적물의 존재를 증명하는 데 사용될 수 있습니다. 이 동위원소는 다른 방법으로 인공적으로 얻을 수 있습니다. 실제로 염화칼륨에 중성자를 조사하여 Cl + n → S + p 반응을 사용합니다. 동위원소 S는 많은 생물학적 연구, 예를 들어 허쉬-체이스(Hershey-Chase) 실험의 방사성 추적자로 다양한 황 함유 화합물에 사용됩니다.
S의 베타 활성이 약하기 때문에 S의 화합물은 체내에 섭취되거나 흡수되지 않는 한 비교적 안전합니다.[32]
자연발생




32S는 실리콘의 핵 하나와 헬륨의 핵 하나가 융합되어 온도가 2.5×109 K를 넘는 거대한 별 내부에서 생성됩니다.[33] 이 핵반응은 원소를 풍부하게 만들어내는 알파과정의 일부이기 때문에 황은 우주에서 10번째로 흔한 원소입니다.
일반적으로 황화물인 황은 많은 유형의 운석에 존재합니다. 일반 콘드라이트는 평균 2.1%의 유황을 함유하고 있으며, 탄소질 콘드라이트는 무려 6.6%를 함유하고 있을 수 있습니다. 일반적으로 트로일라이트(FeS)로 존재하지만, 탄소질 콘드라이트에는 유리 황, 황산염 및 기타 황 화합물이 포함되어 있는 예외가 있습니다.[34] 목성의 화산 위성 이오의 독특한 색깔은 다양한 형태의 녹은 황, 고체 및 기체 황에 기인합니다.[35]
이 원소는 지구에서 다섯 번째로 질량이 많은 원소입니다. 황 원소는 전 세계 많은 지역의 온천과 화산 지역, 특히 태평양 불의 고리를 따라 발견될 수 있습니다. 그러한 화산 퇴적물은 현재 인도네시아, 칠레, 일본에서 채굴되고 있습니다. 이 퇴적물은 다결정이며, 문서화된 가장 큰 단결정의 크기는 22×16×11 cm입니다.[36] 역사적으로 시칠리아는 산업혁명의 주요 유황 공급원이었습니다.[37] 물의 끓는점이 유황의 녹는점보다 높은 수심의 해저 화산과 관련된 최대 직경 200m(660ft)의 녹은 유황 호수가 해저에서 발견되었습니다.[38]
천연 황은 소금 돔에서 석고와 같은 황산염 광물에 작용하는 혐기성 박테리아에 의해 합성됩니다.[39][40] 소금 돔의 상당한 퇴적물은 멕시코 만 연안과 동유럽과 서아시아의 증발물에서 발생합니다. 천연 황은 지질학적 과정만으로 생산될 수 있습니다. 미국, 러시아, 투르크메니스탄, 우크라이나에서는 소금 돔에서 나오는 화석을 기반으로 한 황 퇴적물이 상업적 생산의 기반이 되기도 했습니다.[41] 현재 폴란드 오시에크 광산에서 아직 상업 생산이 진행되고 있습니다. 이러한 소스는 이제 2차 상업적으로 중요하며 대부분은 더 이상 작동하지 않습니다.
일반적인 자연 발생 황 화합물에는 황철광(황화철), 신나바르(황화수은), 갈레나(황화납), 스팔레라이트(황화아연), 스티브나이트(황화항)와 같은 황화광물과 석고(황화칼슘), 알루나이트(황화알루미늄칼륨), 바라이트(황화바륨)와 같은 황화광물이 포함됩니다. 지구에서는 목성의 달 이오와 마찬가지로 열수 분출구의 방출을 포함한 화산 방출에서 원소 황이 자연적으로 발생합니다.
황의 주요 산업 공급원은 현재 석유 및 천연 가스입니다.[9]
화합물
황의 일반적인 산화 상태는 -2 ~ +6입니다. 황은 비활성 기체를 제외한 모든 원소와 안정한 화합물을 형성합니다.
전자 이동 반응

3) 때문입니다.
황이 강산성 용액에서 산화제와 반응할 때 황82+ 폴리케이션, S42+, S, S가162+ 생성됩니다.[42] 유황을 기름에 녹여서 만들어진 착색 용액은 일찍이 1804년 C.F.에 의해 처음 보고되었습니다. 부콜츠(Bucholz), 그러나 색상과 관련된 폴리케이션의 구조의 원인은 1960년대 후반에서야 밝혀졌습니다. S는82+ 짙은 파란색, S는42+ 노란색, S는162+ 빨간색입니다.[14]
황의 환원은 화학식 S를x2− 갖는 다양한 폴리설파이드를 제공하며, 이들 중 다수는 결정질 형태로 얻어집니다. 테트라황화나트륨의 생산이 대표적입니다.
이들 음이온 중 일부는 해리되어 라디칼 음이온을 생성하는데, 예를 들어 S는3− 암석 라피스 라줄리의 파란색을 생성합니다.

이 반응은 황의 독특한 특성을 강조합니다. 그것은 사슬의 형성에 의해 스스로와 결합하는 능력입니다. 이러한 폴리설파이드 음이온의 양성자화는 폴리설판, HS를 생성하며, 여기서 x = 2, 3, 4입니다. 궁극적으로 황의 환원은 황화물 염을 생성합니다.
이 종들의 상호 전환은 나트륨-황 전지에서 이용됩니다.
수소화
황을 수소로 처리하면 황화수소가 생깁니다. 황화수소는 물에 녹으면 약산성입니다.[7]
황화수소 가스 및 황화수소 음이온은 시안화물 및 아지드화수소와 유사한 방식으로 헤모글로빈 및 특정 사이토크롬의 산소 운반 능력을 억제하기 때문에 포유동물에게 매우 독성이 있습니다(아래, 예방 조치 참조).
연소
두 가지 주요 황산화물은 황을 태워서 얻을 수 있습니다.
황이 풍부한 산화물에는 일산화황, 일산화이황, 이산화이황 및 퍼옥소기를 포함하는 상위 산화물이 포함된 다른 많은 황 산화물이 관찰됩니다.
할로겐화
황은 불소와 반응하여 반응성이 높은 사불화황과 불활성이 높은 육불화황을 생성합니다.[45] 불소는 S(IV) 및 S(VI) 화합물을 제공하는 반면, 염소는 S(II) 및 S(I) 유도체를 제공합니다. 따라서 황의 염소화는 황의 염소화에 의해 황의 디클로라이드, 이황의 디클로라이드 및 더 높은 클로로설판을 생성합니다. 염화설푸릴과 염화클로로황산은 황산의 유도체이며, 염화티오닐(SOCl2)은 유기 합성에서 일반적인 시약입니다.[46] 브롬은 또한 황을 산화시켜 황 디브롬화물과 이황 디브롬화물을 형성합니다.[46]
슈도할리데스
황은 시안화물과 아황산염을 산화시켜 각각 티오시아네이트와 티오황산염을 만듭니다.
금속황화물
황은 많은 금속과 반응합니다. 전기 양성 금속은 폴리설파이드 염을 제공합니다. 구리, 아연, 은은 유황의 공격을 받습니다. 태닝을 보세요. 많은 금속 황화물이 알려져 있지만 대부분은 원소의 고온 반응에 의해 제조됩니다.[47] 지구과학자들은 또한 과거 지구의 환경 조건을 연구하기 위해 암석과 퇴적물에 있는 금속 황화물의 동위원소를 연구합니다.[48]
유기화합물
- 예시적인 유기황 화합물
- 티오에테르를 포함하는 아미노산인 메티오닌
- 티아민 또는 비타민1 B
- 비오틴 또는 비타민7 B
- 항생제인 페니실린("R"은 변수 그룹)
- 마늘에 들어있는 화학적 화합물인 알리신
- 대표적인 이황화물인 디페닐 이황화물
- 원유의 성분인 디벤조티오펜
- 계면활성제인 PFOS(Perfluorooctanesulfonic acid)
황 함유 유기 화합물의 주요 부류로는 다음과 같은 것들이 있습니다.[49]
- 티올 또는 머캅탄은 알코올의 황 유사체이며, 티올을 염기로 처리하면 티올 이온이 생성됩니다.
- 티오에테르는 에테르의 황 유사체입니다.
- 술포늄 이온은 양이온 황 중심에 3개의 그룹이 붙어 있습니다. 디메틸술포니오프로피오네이트(DMSP)는 해양 유기 황 순환에 중요한 화합물 중 하나입니다.
- 설폭사이드와 설폰은 황 원자에 각각 1개와 2개의 산소 원자가 붙어 있는 티오에테르입니다. 가장 간단한 설폭사이드인 디메틸 설폭사이드는 일반적인 용매이고, 일반적인 설폭사이드는 설폭사이드입니다.
- 술폰산은 많은 세제에 사용됩니다.
이산화탄소와 구조적으로 유사한 휘발성 무색 액체인 이황화탄소를 제외하고 탄소-황의 다중 결합을 갖는 화합물은 흔하지 않습니다. 고분자 레이온과 많은 유기황 화합물을 만드는 시약으로 사용됩니다. 일산화탄소와 달리 일황화탄소는 태양계 사이에서 발견되는 극도로 희석된 기체로만 안정적입니다.[50]
유기황 화합물은 부패하는 유기물의 불쾌한 냄새 중 일부를 담당합니다. 국내 천연가스, 마늘 냄새, 스컹크 스프레이 등의 냄새는 물론 구취의 성분으로도 널리 알려져 있습니다. 모든 유기 황 화합물이 모든 농도에서 불쾌한 냄새가 나는 것은 아닙니다. 소량의 황 함유 모노테르페노이드 자몽 머캅탄이 자몽의 특징적인 향이지만, 더 많은 농도에서 일반적인 티올 냄새가 납니다. 강력한 소포제인 유황 겨자는 제1차 세계대전에서 불능화제로 사용되었습니다.[51]
황-황 결합은 단백질을 단단하게 만드는 이황화 다리와 유사하게 고무를 단단하게 만드는 데 사용되는 구조적 구성 요소입니다(아래 생물학 참조). 가장 일반적인 산업용 "경화" 또는 천연 고무의 경화 및 강화 유형에서 황 원소는 화학 반응이 중합체의 이소프렌 단위 사이에 이황화 다리를 형성할 정도로 고무로 가열됩니다. 1843년에 특허를 받은 이 공정은 고무를 특히 자동차 타이어의 주요 산업 제품으로 만들었습니다. 열과 유황 때문에, 그 과정은 로마의 대장간과 화산 활동의 신의 이름을 따서 가황이라고 이름 지어졌습니다.
역사
고대

천연 형태로 풍부하게 이용 가능한 유황은 고대에 알려져 있었고 토라(창세기)에서 언급됩니다. 기독교 성경의 영어 번역은 흔히 불타는 유황을 "브림스톤"이라고 불렀고, 듣는 사람들이 믿지 않고 회개하지 않는 사람들을 기다리는 영원한 지옥의 운명을 상기시키는 "불과 브림스톤" 설교라는 용어를 만들었습니다. 지옥이 "유황 냄새"에 암시되는 것은 성경의[52] 이 부분에서입니다(아마도 화산 활동과 연관되어 있기 때문일 것입니다). 에베르스 파피루스에 따르면, 유황 연고는 고대 이집트에서 과립성 눈꺼풀을 치료하기 위해 사용되었습니다. 유황은 고전기 그리스에서 훈증에 사용되었습니다.[53] 이것은 오디세이에 언급되어 있습니다.[54] 플리니우스 대제는 자연사 35권에서 황에 대해 언급하며, 황의 가장 잘 알려진 근원은 멜로스 섬이라고 말합니다. 그는 훈증, 약 및 표백 천에 사용한다고 언급합니다.[55]
실로황(石硫黄)으로 알려진 황의 자연적인 형태는 기원전 6세기부터 중국에서 알려져 있었고 한중에서 발견되었습니다. 3세기까지 중국인들은 황철석에서 황을 추출할 수 있다는 것을 발견했습니다.[56] 중국 도학자들은 유황의 가연성과 특정 금속과의 반응성에 관심이 있었지만, 최초의 실용적인 용도는 전통적인 중국 의학에서 발견되었습니다.[56] 서기 1044년의 우징 종야오는 질산칼륨(KNO
3), 숯, 황이 혼합된 중국 흑분에 대한 다양한 공식을 설명했습니다.[57]
인도의 연금술사들은 "화학의 과학"(산스크리트어: रसशास्त्र, 로마자: rasa ś āstra)의 실천가로서 서기 8세기 이후부터 수은과의 연금술 작업에서 황의 사용에 대해 광범위하게 썼습니다. 라사 ś 전통에서, 유황은 "냄새나는" (गन्धक, 간다카)라고 불립니다.
초기 유럽의 연금술사들은 유황에게 독특한 연금술 기호, 즉 십자가 (🜍) 위에 삼각형을 부여했습니다. (이것은 때때로 2 팔라스의 천문학적인 십자형 기호 ⚴와 혼동됩니다.) 브림스톤(brimstone)이라고 알려진 변형은 렘니스케이트(🜏) 위에 두 개의 막대로 된 십자가를 결합한 상징을 가지고 있습니다. 전통적인 피부 치료에서 원소 유황은 (주로 크림에) 딱지, 링웜, 건선, 습진 및 여드름과 같은 상태를 완화하기 위해 사용되었습니다. 황 원소는 천천히 산화되지만, (황산염의 작용을 통해) 약한 환원 및 항균제인 황산으로 산화됩니다.[60][61][62]
근세

유황은 1718년 화학표의 고정(비산) 알칼리 열에 나타납니다.[64] 앙투안 라부아지에(Antoine Lavoisier)는 1777년에 황을 연소 실험에 사용했으며, 이 중 일부를 작성했습니다.[65]
시칠리아의 유황 매장지는 1세기 이상 지배적인 공급원이었습니다. 18세기 후반까지 프랑스 마르세유에는 르블랑 공정에 사용할 황산 생산을 위해 연간 약 2,000톤의 황이 수입되었습니다. 1824년 소금에 대한 관세가 철폐되면서 영국을 산업화하면서 시칠리아의 유황에 대한 수요가 급증했습니다. 황의 채굴, 정제, 운송에 대한 영국의 통제와 개발 증가는 시칠리아의 낙후되고 가난한 경제를 변화시키기 위한 이 수익성 있는 수출의 실패와 함께 1840년의 황 위기를 불러 일으켰고, 페르디난도 2세는 황 산업의 독점권을 프랑스 회사에 넘겼습니다. 영국과의 1816년 초 무역 협정을 위반한 것입니다. 평화적인 해결책은 결국 프랑스에 의해 협상되었습니다.[66][67]
1867년 루이지애나와 텍사스의 지하 퇴적물에서 황 원소가 발견되었습니다. 매우 성공적인 프라쉬 프로세스는 이 리소스를 추출하기 위해 개발되었습니다.[68]
18세기 후반, 가구 제조업자들은 장식용 인레이를 생산하기 위해 용융된 유황을 사용했습니다.[69] 용융 유황은 바닥 장착 장비 부착 지점에 대해 높은 내충격성이 요구되는 드릴링된 콘크리트 구멍에 강철 볼트를 설정하는 데 여전히 사용됩니다. 순수 분말 유황은 약용 강장제와 완하제로 사용되었습니다.[41]
접촉 공정의 출현으로 오늘날 대부분의 황은 광범위한 용도, 특히 비료의 용도로 황산을 만드는 데 사용됩니다.[70]
최근에는 황의 주요 공급원이 석유 및 천연 가스가 되었습니다. 산성비를 막기 위해 연료에서 유황을 제거해야 하기 때문에 유황이 과잉 상태에 빠졌습니다.[9]
철자와 어원
유황은 라틴어 sulpur에서 유래되었는데, 라틴어 단어가 그리스어에서 왔다는 잘못된 믿음에서 유황으로 헬레니즘화되었습니다. 이 철자법은 나중에 /f/ 소리를 나타내는 것으로 재해석되어 고전 시대가 끝날 무렵 라틴어로 나타나는 철자 유황으로 이어졌습니다. 황을 뜻하는 진정한 고대 그리스어 θεῖον î 온(theeion)은 국제적인 화학 접두사 티오-의 근원입니다. 유황을 뜻하는 현대 표준 그리스어 단어는 θείο, 이오입니다.
12세기 영불에서는 유황이었습니다. 14세기에 잘못 헬레니즘화된 라틴어-ph-가 중세 영국 유황에서 복원되었습니다. 15세기에 이르러 전체 라틴어 철자 변형인 유황과 유황이 영어에서 일반화되었습니다. 평행한 f~ph 철자법은 단어가 유황으로 표준화된 19세기까지 영국에서 계속되었습니다.[71] 반면 유황은 미국에서 선택한 형태인 반면 캐나다는 둘 다 사용합니다.
IUPAC는 인용된 출처에 따라 1990년 또는 1971년에 철자 유황을 채택했으며 [72]1992년 왕립 화학 협회의 명명 위원회도 철자 유황을 영국에 복원했습니다.[73] 옥스퍼드 사전은 "화학 및 기타 기술적 용도에서... -f- 맞춤법은 현재 영국어뿐만 아니라 미국어에서도 이와 관련된 단어의 표준 형태이며, 일반적인 맥락에서도 점점 더 많이 사용되고 있습니다."[74]
생산.


황은 그 자체로 발견될 수 있고 역사적으로 보통 이런 형태로 얻어졌습니다; 황철석은 또한 황의 공급원이었습니다.[75] 시칠리아의 화산 지역에서는 고대에 지구 표면에서 발견되었으며, 황 퇴적물을 사이에 두고 경사진 언덕에 지어진 벽돌 가마에 쌓아서 쌓아두는 '시칠리아 공정'이 사용되었습니다. 그런 다음 일부 유황이 분쇄되어 쌓인 광석 위에 펼쳐지고 점화되어 유리 유황이 언덕 아래로 녹았습니다. 결국 지표면에서 생성된 퇴적물이 발생했고, 광부들은 시칠리아 풍경에 미로 같은 광산이 있는 정맥을 발굴했습니다. 채굴은 기계화되지 않고 노동집약적이었으며, 채굴자들이 암석에서 광석을 방출하고, 광산 소년들이나 카루시들이 광석 바구니를 지표면으로 운반하며, 종종 1마일 또는 그 이상의 터널을 통해 이루어졌습니다. 광석이 표면에 있으면 제련 오븐에서 줄이고 추출했습니다. 시칠리아 유황 광산의 상황은 끔찍했고, 부커 T. 워싱턴은 "나는 지금 당장 내가 다음 세상에 물리적 지옥을 어느 정도까지 믿는지 말할 준비가 되어 있지 않지만, 시칠리아의 유황 광산은 내가 이번 생에 볼 것이라고 기대하는 지옥과 가장 가까운 것에 관한 것입니다."라고 썼습니다.[76] 유황은 여전히 인도네시아와 같은 화산이 있는 가난한 나라들의 지표면 퇴적물에서 채굴되고 있으며, 부커 T. 워싱턴 시절 이후 노동자들의 환경은 크게 개선되지 않았습니다.[77]
원소 황은 20세기 후반까지 염돔(때로는 거의 순수한 형태로 발생하기도 함)에서 추출되었습니다. 이제 황은 정유와 같은 다른 산업 공정의 부산물로 생성되며, 이 과정에서 황은 원하지 않습니다. 소금 돔 아래의 천연 황은 광물로서 황산염 퇴적물에 대한 혐기성 박테리아의 작용에 의해 생성되는 화석 광물 자원으로 생각됩니다. 주로 프래쉬 공정에 의해 그러한 염도 광산에서 제거되었습니다.[41] 이 방법에서는 과열수를 천연 황 퇴적물에 펌핑하여 황을 녹인 다음 압축 공기를 통해 99.5% 순수하게 녹인 생성물을 표면으로 되돌렸습니다. 20세기 내내 이 과정은 더 이상의 정제가 필요 없는 원소 황을 만들어냈습니다. 이러한 황 매장량의 수가 제한적이고 작업 비용이 비싸기 때문에 황을 채굴하는 이 공정은 2002년 이후 세계 어느 곳에서도 주요하게 사용되지 않았습니다.[78][79]

오늘날 황은 석유, 천연 가스 및 관련 화석 자원에서 생산되며, 여기서 주로 황화수소로 얻어집니다.[9] 석유의 바람직하지 않은 불순물인 유기황 화합물은 C-S 결합을 절단하는 탈수소화를 통해 업그레이드될 수 있습니다.[78][79]
이 과정에서 생성된 황화수소는 천연 가스에서 발생하는 것과 마찬가지로 클로스 과정에 의해 원소 황으로 변환됩니다. 이 과정은 일부 황화수소를 이산화황으로 산화시킨 다음 두 가지를 비례화하는 것을 수반합니다.[78][79]
아타바스카 오일 샌즈의 높은 황 함량 때문에, 이 과정에서 나오는 원소 황의 비축량은 현재 캐나다 앨버타 전역에 존재합니다.[80] 황을 저장하는 또 다른 방법은 콘크리트용 바인더로서, 생성된 생성물은 일부 바람직한 특성을 갖습니다(황 콘크리트 참조).[81]
2011년 세계 황 생산량은 6,900만 톤(Mt)에 달하며, 15개국 이상이 각각 1Mt 이상을 기여하고 있습니다. 5 Mt 이상을 생산하는 국가는 중국(9.6), 미국(8.8), 캐나다(7.1), 러시아(7.1)입니다.[82] 생산량은 1900년부터 2010년까지 천천히 증가해 왔으며, 1980년대와 2010년경에는 가격이 불안정했습니다.[83]
적용들
황산
황 원소는 주로 다른 화학 물질의 전구체로 사용됩니다. 약 85%(1989)가 황산(HSO24)으로 전환됩니다.

2010년에 미국은 다른 어떤 무기 공업 화학 물질보다도 많은 황산을 생산했습니다.[83] 산의 주요 용도는 비료 제조 생산을 위한 인산염 광석의 추출입니다. 황산의 다른 용도로는 정유, 폐수 처리 및 광물 추출이 있습니다.[41]
기타 중요한 유황화학
황은 메탄과 직접 반응하여 이황화탄소를 만들고, 이는 셀로판과 레이온을 제조하는 데 사용됩니다.[41] 황 원소의 용도 중 하나는 폴리설파이드 사슬이 유기 폴리머를 가교하는 고무의 가황입니다. 다량의 아황산염은 종이를 표백하고 말린 과일을 보존하는 데 사용됩니다. 많은 계면활성제 및 세제(예: 황산나트륨 라우릴 설페이트)는 황산염 유도체입니다. 황산칼슘, 석고(CaSO4·2)HO2)는 포틀랜드 시멘트 및 비료에 사용하기 위해 매년 1억 톤 규모로 채굴됩니다.
은 기반 사진이 널리 퍼졌을 때 나트륨과 티오황산암모늄은 "고정제"로 널리 사용되었습니다. 유황은 화약("검은 가루")의 성분입니다.
비료
메티오닌과 시스테인과 같은 생물체에 의해 합성되는 아미노산은 유기황기(각각 티오에스테르와 티올)를 포함합니다. 활성산소와 산화스트레스로부터 많은 생명체를 보호하는 항산화 글루타티온에도 유기황이 함유되어 있습니다. 양파와 마늘과 같은 일부 작물은 또한 라크릴 자극(양파)을 담당하는 syn-propanethial-S-oxide 또는 디알릴 이황화 및 알리신(마늘)과 같은 다양한 유기황 화합물을 생성합니다. 토양과 지하수에서 흔히 발견되는 황산염은 종종 식물과 박테리아에 충분한 천연 황 공급원입니다. 이산화황(SO2)의 대기 퇴적은 토양에 대한 황의 일반적인 인공 공급원(석탄 연소)이기도 합니다. 대부분의 농업 토양에서 유황은 식물과 미생물의 제한적인 영양소가 아닙니다(Liebig의 배럴 참조). 그러나 일부 상황에서는 토양이 황산염에서 고갈될 수 있습니다. 예를 들어 나중에 유성수(비)에 의해 침출되거나 일부 유형의 작물에 대한 황의 요구 사항이 높을 경우입니다. 이것은 점점 유황이 비료의 성분으로 인식되고 사용되고 있다는 것을 설명해 줍니다. 비료용 황의 가장 중요한 형태는 황산칼슘으로, 자연에서 광물 석고(CaSO4·2HO2)로 흔히 발견됩니다. 황 원소는 소수성(물에 녹지 않음)으로 식물이 직접 사용할 수 없습니다. 원소 황(ES)은 유기황에서 요구되는 작물의 고갈된 토양을 수정하기 위해 벤토나이트와 혼합되기도 합니다. 시간이 지남에 따라 대기 중 산소와 토양 박테리아와의 산화 비생물적 과정은 황 원소를 산화시키고 가용성 유도체로 전환시켜 미생물과 식물이 사용할 수 있습니다. 황은 다른 필수 식물 영양소, 특히 질소와 인의 효율을 향상시킵니다.[84] 생물학적으로 생성된 황 입자는 바이오폴리머 코팅으로 인해 자연적으로 친수성을 가지며 희석된 슬러리 스프레이로 땅 위에 분산되기 쉬워 식물에 의한 흡수가 더 빠릅니다.
황에 대한 식물 요구 사항은 인에 대한 요구 사항과 같거나 초과합니다. 식물 성장, 콩과 식물의 뿌리 결절 형성, 면역 및 방어 시스템에 필수적인 영양소입니다. 유황 결핍은 유럽의 많은 국가에서 널리 퍼졌습니다.[85][86][87] 황의 대기 투입량이 계속 감소하기 때문에 황 비료를 사용하지 않으면 황 투입량/산출량의 적자가 증가할 가능성이 높습니다. 산성비를 제한하기 위한 조치로 인해 황의 대기 유입이 감소합니다.[88][84]
살균제 및 농약

황 원소는 가장 오래된 살균제와 살충제 중 하나입니다. 가루 형태의 유황인 "분진 유황"은 포도, 딸기, 많은 채소 및 기타 작물에 일반적인 살균제입니다. 흑점뿐만 아니라 광범위한 가루 곰팡이병에도 좋은 효능을 가지고 있습니다. 유기 생산에서 황은 가장 중요한 살균제입니다. 더 추운 조건에서 주요 질병인 사과 딱지에 대항하여 유기농 사과 생산에 사용되는 유일한 살균제입니다. 바이오황(친수성 특성을 갖는 생물학적으로 생성된 원소 황)은 이러한 용도에도 사용될 수 있습니다.
표준 제형의 더스트 유황은 유황 더스트기가 있는 작물이나 더스트 평면에서 적용됩니다. 습윤성 유황은 추가 성분으로 제조된 유황을 물과 섞일 수 있도록 먼지를 제거하는 상업적 이름입니다.[81][89] 유사한 용도를 가지며 식물 및 토양의 곰팡이 및 기타 곰팡이 관련 문제에 대한 살균제로 사용됩니다.
황 원소 분말은 진드기와 진드기에 대한 "유기"(즉, "녹색") 살충제(사실은 살비제)로 사용됩니다. 일반적인 도포 방법은 유황 분말로 옷이나 팔다리를 먼지를 털어내는 것입니다.
석회유황 희석액(수산화칼슘과 물속의 황 원소를 결합하여 만든 것)은 애완동물을 위한 침지로 사용되어 링웜(진균), 망지, 기타 피부병 및 기생충을 파괴합니다.
거의 순수한 유황의 양초는 건물과 와인 통을 훈증하기 위해 불에 탔지만, 현재는 거주지에 너무 유독한 것으로 여겨집니다.
의약품
황(특히 옥타설퍼, S8)은 여드름 및 기타 상태의 치료를 위한 약용 피부 제제에 사용됩니다. 각화작용제 역할을 하며 박테리아, 곰팡이, 딱지 진드기 및 기타 기생충도 죽입니다.[90] 침강유황과 콜로이드유황은 로션, 크림, 분말, 비누 및 목욕 첨가제의 형태로 여드름, 여드름 장미, 지루성 피부염의 치료에 사용됩니다.[91]
많은 약물에는 황이 포함되어 있습니다.[92] 초기의 예로는 항균성 술폰아미드, 술파 약물이 있습니다. 더 최근의 예는 점액 분해성 아세틸시스테인입니다. 황은 많은 박테리아 방어 분자의 일부입니다. 페니실린, 세팔로스포린 및 모노박탐을 포함한 대부분의 β-락탐 항생제에는 황이 포함되어 있습니다.[49]
건전지
높은 에너지 밀도와 황의 가용성으로 인해 충전식 리튬-황 배터리를 개발하는 연구가 계속되고 있습니다. 지금까지 탄산염 전해질은 한 번의 사이클을 거치면 이런 배터리에 고장이 발생했습니다. 2022년 2월, 드렉셀 대학의 연구원들은 4000회 충전 사이클을 지속하는 원형 배터리를 만들었을 뿐만 아니라 95도 이하에서 안정적으로 유지된 최초의 단사정계 감마 유황을 발견했습니다.[93]
생물학적 역할
황은 모든 살아있는 세포의 필수 성분입니다. 인체에서 무게로 8번째로 풍부한 원소로 [94]칼륨과 거의 맞먹으며 나트륨과 염소보다 약간 더 많습니다.[95] 70kg(150lb)의 인체에는 약 140g(4.9oz)의 유황이 포함되어 있습니다.[96] 인간을 위한 황의 주요 식이 공급원은 식물과 동물의 단백질에서 발견될 수 [97]있는 황 함유 아미노산입니다.[98]
무기 분자와 생체 분자 간의 황 전달
1880년대 세르게이 위노그라드스키는 베기아토아(황이 풍부한 환경에 사는 세균)를 연구하던 중 황화수소(HS2)를 에너지원으로 산화시켜 세포 내 황 방울을 형성한다는 사실을 발견했습니다. 위노그라드스키는 이러한 형태의 대사를 무기화합물의 산화(inorgoxidation, 무기화합물의 산화)라고 불렀습니다.[99] 그것을 계속 연구한 또 다른 공헌자는 셀만 워크스만이었습니다.[100] 로버트 밸러드가 발견한 바와 같이 심해 화산 구멍 주변에 사는 원시 박테리아는 영양분을 위해 황화수소를 산화시킵니다.[10]
황 산화제는 황화수소, 황 원소, 아황산염, 티오설페이트 및 다양한 폴리티오네이트(예: 테트라티오네이트)를 포함한 환원된 황 화합물을 에너지원으로 사용할 수 있습니다.[101] 그들은 황을 황산염으로 산화시키기 위해 황 산소화효소와 아황산염 산화효소와 같은 효소에 의존합니다. 일부 암석영양생물은 황 화합물에 포함된 에너지를 사용하여 당을 생성할 수도 있는데, 이 과정을 화학 합성이라고 합니다. 일부 박테리아와 고세균은 화학 합성에서 물 대신 황화수소를 전자 공여체로 사용하는데, 이 과정은 광합성과 유사하게 설탕을 생성하고 산소를 전자 수용체로 사용합니다. 황을 기반으로 한 화학 합성은 광합성과 비교하여 단순화할 수 있습니다.
녹색 유황 박테리아와 보라색 유황 박테리아라는 이 두 가지 영양 방법을 결합한 박테리아가 있습니다.[102] 또한 황을 산화시키는 박테리아는 더 큰 유기체와 공생할 수 있으므로 후자는 황화수소를 산화되는 음식으로 사용할 수 있습니다. 예: 거대한 튜브 벌레.[103]
반대로 산소 대신 "황산염을 호흡"하는 황산염 환원 박테리아가 있습니다. 그들은 에너지원으로 유기 화합물이나 분자 수소를 사용합니다. 그들은 황을 전자 수용체로 사용하고 다양한 산화된 황 화합물을 황화수소, 종종 황화수소로 환원시킵니다. 그들은 다른 부분적으로 산화된 황 화합물(예: 티오황산염, 티오네이트, 폴리설파이드, 아황산염)에서 자랄 수 있습니다.
고대 바다의 바닥이었던 곳에 많은 토종 황의 퇴적물이 생물학적 기원을 가지고 있다는 연구 결과가 있습니다.[104][105][106] 이러한 연구는 이 천연 황이 생물학적 활동을 통해 얻어졌음을 나타내지만, 그 원인이 무엇인지(황산화균 또는 황산염 환원균)는 아직 확실히 알려져 있지 않습니다.
황은 토양에서 식물 뿌리에 황산염으로 흡수되어 인산 에스테르로 운반됩니다. 황산염은 시스테인 및 기타 유기황 화합물에 통합되기 전에 아황산염을 통해 황화물로 환원됩니다.[107]
먹이 사슬을 통해 동물에게 황을 전달하는 식물의 역할은 어느 정도 알려져 있지만, 황 박테리아의 역할은 이제 막 연구되고 있습니다.[108][109]
단백질 및 유기 대사 생성물
모든 형태의 생명체에서 황의 대부분은 두 개의 단백질 생성 아미노산(시스테인과 메티오닌)에 포함되어 있으며, 따라서 황의 원소는 각각의 펩티드뿐만 아니라 이러한 아미노산을 포함하는 모든 단백질에 존재합니다.[110] 황의 일부는 특정 대사 산물(대부분은 보조 인자)과 결합 조직의 황산화 다당류(콘드로이틴 설페이트, 헤파린)에 포함되어 있습니다.
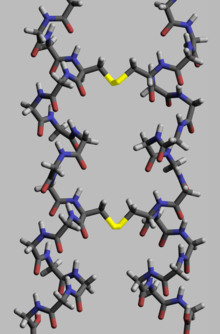
단백질은 생물학적 기능을 수행하기 위해 특정 공간 기하학적 구조를 가져야 합니다. 이 기하학적 구조의 형성은 단백질 접힘이라는 과정에서 수행되며, 분자 내 및 분자 간 결합에 의해 제공됩니다. 프로세스에는 여러 단계가 있습니다. 수소 결합으로 인해 폴리펩티드 사슬이 접히는 동안, 이후 단계에서 접힘은 사슬의 서로 다른 위치(tertiary 단백질 구조)에 있는 두 개의 시스테인 잔기(이황화 다리라고도 함)의 두 황 원자와 두 개의 분리된 단백질 소단위(4차 단백질 구조)에 있는 두 개의 시스테인 잔기 사이의 공유 결합에 의해 제공됩니다. 두 구조 모두 인슐린에서 쉽게 볼 수 있습니다. 공유 이황화 다리의 결합 에너지가 좌표 결합 또는 소수성 상호작용의 에너지보다 높기 때문에 이황화 다리 함량이 높을수록 단백질 변성에 필요한 에너지가 증가합니다. 일반적으로 이황화 결합은 세포 공간 밖에서 기능하는 단백질에서 필요하며, 이들은 단백질의 형태(기하학)를 변화시키지 않지만 안정제 역할을 합니다.[111] 세포질 내에서 단백질의 시스테인 잔기는 티오레독신에 의해 환원된 상태(즉, -SH 형태)로 저장됩니다.[112]
이 속성은 다음과 같은 예로 나타납니다. 리소자임은 약물로 적용할 수 있을 정도로 안정적입니다.[113] 깃털과 머리카락은 상대적인 힘을 가지고 있으며, 그 안에서 구성된 케라틴은 대부분의 유기체에 의해 소화되지 않는 것으로 간주됩니다. 그러나 케라틴화효소를 함유한 곰팡이와 박테리아가 있으며 케라틴을 파괴할 수 있습니다.
많은 중요한 세포 효소는 -SH 부분으로 끝나는 보철 그룹을 사용하여 아실 함유 생화학 물질과 관련된 반응을 처리합니다. 기본 대사의 두 가지 일반적인 예는 조효소 A와 알파-리포산입니다.[114] 시스테인 관련 대사산물인 호모시스테인과 타우린은 구조는 비슷하지만 DNA에 의해 암호화되지 않은 다른 황 함유 아미노산으로 단백질의 주요 구조의 일부가 아니며 포유류 생리학의 다양한 위치에 참여합니다.[115][116] 13가지 고전 비타민 중 2가지인 비오틴과 티아민은 황을 함유하고 있으며 여러 효소의 보조인자 역할을 합니다.[117][118] 세포 내 화학에서 황은 세포 산화의 복구를 위해 수소와 그 전자를 환원시키는 운반체 역할을 합니다. 황 함유 트리펩티드인 환원된 글루타티온은 시스테인으로부터 유래된 설프히드릴(-SH) 부분을 통한 환원제입니다.
세계 대부분의 메탄으로 가는 경로인 메탄 생성은 이산화탄소의 다단계 생화학적 변환입니다. 이 전환에는 여러 유기황 보조인자가 필요합니다. 여기에는 메탄의 즉각적인 전구체인 조효소 M, CHSCHSO가3223− 포함됩니다.[119]
금속단백질 및 무기질 보조인자
활성 부위가 시스테인 잔기의[120] 황 원자에 의해 종종 조정되는 전이 금속 이온(또는 금속-황화물 클러스터)인 금속 단백질은 전자 전달 과정에 관여하는 효소의 필수 구성 요소입니다. 예를 들면, 플라스토시아닌(Cu2+) 및 아산화질소 환원효소(Cu-S)가 있습니다. 이러한 효소의 기능은 전이금속 이온이 산화환원 반응을 겪을 수 있다는 사실에 달려 있습니다. 다른 예로는 [121]철-황 클러스터뿐만 아니라 많은 아연 단백질이 있습니다. 가장 널리 퍼진 것은 세포에서 전자 셔틀 역할을 하는 페로독신입니다. 박테리아에서 중요한 질소 분해 효소는 Fe-Mo-S 클러스터를 포함하고 있으며, 질소 고정의 중요한 기능을 수행하는 촉매이며, 미생물과 식물이 생명에 필요한 단백질, DNA, RNA, 알칼로이드 및 기타 유기 질소 화합물을 만드는 데 사용할 수 있는 대기 질소를 암모니아로 전환합니다.[122]
황산염
결핍증
인간의 경우 메티오닌은 필수 아미노산입니다. 시스테인은 조건부로 필수적이며 비필수 세린으로부터 합성될 수 있습니다(이 경우 황 공여체는 메티오닌입니다). 식이 결핍은 일반적인 상태에서는 거의 발생하지 않습니다. 인공 메티오닌 결핍은 암 치료에 적용하려고 시도하지만,[124] 그 방법은 여전히 잠재적으로 위험합니다.[125]
분리된 아황산염 산화효소 결핍은 아황산염을 아황산염으로 대사하는 데 필요한 아황산염 산화효소 생성을 방해하는 희귀하고 치명적인 유전 질환입니다.[126]
주의사항
| 위험성 | |
|---|---|
| GHS 라벨: | |
  | |
| 경고문 | |
| H315[127] | |
| NFPA 704 (파이어다이아몬드) | |

황 원소는 피부를 통해 최소한으로만 흡수되고 사람에게는 독성이 낮지만, 황 먼지를 흡입하거나 눈이나 피부에 접촉하면 자극을 일으킬 수 있습니다. 유황을 과다 섭취할 경우 타오르는 느낌이나 설사를 유발할 수 있으며,[129] 환자들이 민간요법으로 의도적으로 유황을 섭취한 후 생명을 위협하는 대사성 산증의 사례가 보고되고 있습니다.[130][131]
황화합물의 독성
황이 공기 중에서 연소되면 이산화황을 생성합니다. 이 가스는 물 속에서 아황산과 아황산염을 만들어냅니다. 아황산염은 호기성 박테리아의 성장을 억제하는 항산화제이자 소량의 유용한 식품 첨가제입니다. 고농도에서 이러한 산은 폐, 눈 또는 기타 조직에 해를 끼칩니다.[132] 곤충과 같이 폐가 없는 생물체에서는 고농도의 아황산염이 호흡을 방해합니다.[133]
삼산화황(이산화황으로부터 촉매 작용에 의해 만들어지는 것)과 황산도 마찬가지로 산성이 강하며 물이 존재할 때 부식성이 있습니다. 농축 황산은 설탕과 유기 조직에서 사용 가능한 물 분자와 물 성분을 제거할 수 있는 강력한 탈수제입니다.[134]
산업 및 발전소에서 석탄 및/또는 석유를 연소하면 대기 중의 물 및 산소와 반응하여 황산(HSO23)을 생성하는 이산화황(SO2)이 발생합니다.[135] 이러한 산은 산성비의 성분으로 토양과 담수체의 pH를 낮추어 때때로 동상과 구조물의 환경과 화학적 풍화를 크게 손상시킵니다. 연료 표준은 점점 더 연료 생산자들이 산성비 형성을 방지하기 위해 화석 연료에서 황을 추출할 것을 요구하고 있습니다. 이렇게 추출되고 정제된 황은 황 생산의 많은 부분을 차지합니다. 석탄 화력 발전소에서는 연도 가스가 때때로 정화됩니다. 합성 가스를 사용하는 더 현대적인 발전소는 가스를 태우기 전에 황을 추출합니다.
황화수소는 시안화수소보다 약 1/2 정도 독성이 있고, 같은 메커니즘(호흡기 효소인 사이토크롬 산화효소 억제)에 의해 중독되지만,[136] 황화수소는 불쾌한 냄새 때문에 소량의 흡입량(허용 노출 한계(PEL) 근처)에서 갑작스러운 독극물을 유발할 가능성이 적습니다.[137] 그러나 100-150ppm 이상의 농도로 주변 공기 중에 존재하면 후각을 빠르게 사멸시키고,[138] 피해자는 심각한 증상이 사망에 이를 때까지 눈치채지 못한 채 점점 더 많은 양을 호흡할 수 있습니다. 용해된 황화물과 황화수소염은 동일한 메커니즘에 의해 독성이 있습니다.
참고 항목
참고문헌
- ^ "Standard Atomic Weights: Sulfur". CIAAW. 2009.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. (4 May 2022). "Standard atomic weights of the elements 2021 (IUPAC Technical Report)". Pure and Applied Chemistry. doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ a b Arblaster, John W. (2018). Selected Values of the Crystallographic Properties of Elements. Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ "Sulfur History". Georgiagulfsulfur.com. Retrieved 12 February 2022.
- ^ a b c Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Chisholm, Hugh, ed. (1911). . Encyclopædia Britannica. Vol. 4 (11th ed.). Cambridge University Press. p. 571.
- ^ a b c d Laurence Knight (19 July 2014). "Sulphur surplus: Up to our necks in a diabolical element". BBC.
- ^ a b "Sulfur". Elements. BBC. 11 October 2014."Sulfur". Elements. BBC. 11 October 2014.여기서 다운받으세요.
- ^ Rettig, S. J.; Trotter, J. (15 December 1987). "Refinement of the structure of orthorhombic sulfur, α-S8" (PDF). Acta Crystallographica Section C. 43 (12): 2260–2262. Bibcode:1987AcCrC..43.2260R. doi:10.1107/S0108270187088152.
- ^ "황의 냄새"라고 불리는 강한 냄새는 실제로 황화수소와 유기황 화합물과 같은 여러 황 화합물에 의해 발산됩니다.
- ^ Tucker, Roy P. (1 January 1929). "Notes on the Sublimation of Sulfur between 25° and 50°C". Industrial & Engineering Chemistry. 21 (1): 44–47. doi:10.1021/ie50229a014. ISSN 0019-7866.
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 645–665. ISBN 978-0-08-037941-8.
- ^ Maldonado-Zagal, S. B.; Boden, P. J. (1 January 1982). "Hydrolysis of Elemental Sulphur in Water and its Effect on the Corrosion of Mild Steel". British Corrosion Journal. 17 (3): 116–120. doi:10.1179/000705982798274336. ISSN 0007-0599. Retrieved 23 June 2022.
- ^ Munson, Ronald A. (February 1968). "The synthesis of iridium disulfide and nickel diarsenide having the pyrite structure" (PDF). Inorganic Chemistry. 7 (2): 389–390. doi:10.1021/ic50060a047.
- ^ Egon Wiberg; Nils Wiberg (2001). Inorganic Chemistry. Academic Press. pp. 513–. ISBN 978-0-12-352651-9.
- ^ Steudel, Ralf; Eckert, Bodo (2003). Solid Sulfur Allotropes Sulfur Allotropes. Topics in Current Chemistry. Vol. 230. pp. 1–80. doi:10.1007/b12110. ISBN 978-3-540-40191-9.
- ^ Steudel, R. (1982). "Homocyclic sulfur molecules". Inorganic Ring Systems. Topics in Current Chemistry. Vol. 102. pp. 149–176. doi:10.1007/3-540-11345-2_10. ISBN 978-3-540-11345-4.
- ^ Tebbe, Fred N.; Wasserman, E.; Peet, William G.; Vatvars, Arturs; Hayman, Alan C. (1982). "Composition of Elemental Sulfur in Solution: Equilibrium of S
6, S7, and S8 at Ambient Temperatures". Journal of the American Chemical Society. 104 (18): 4971–4972. doi:10.1021/ja00382a050. - ^ Meyer, Beat (1964). "Solid Allotropes of Sulfur". Chemical Reviews. 64 (4): 429–451. doi:10.1021/cr60230a004.
- ^ Meyer, Beat (1976). "Elemental sulfur". Chemical Reviews. 76 (3): 367–388. doi:10.1021/cr60301a003.
- ^ 유황. 동위원소 부존량 및 원자량 위원회
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 1.14. ISBN 1-4398-5511-0.
- ^ "Searching for the Origins of Presolar Grains". Energy.gov. Retrieved 4 February 2023.
- ^ Paytan, Adina; Yao, Weiqi; Faul, Kristina; Gray, E.T. (2020). "Sulfur Isotope Stratigraphy". Geologic Time Scale. pp. 259–278. doi:10.1016/B978-0-12-824360-2.00009-7. ISBN 9780128243602.
- ^ "NASA Astrobiology". astrobiology.nasa.gov. Retrieved 4 February 2023.
- ^ Goldhaber, M.B.; Kaplan, I.R. (April 1980). "Mechanisms of sulfur incorporation and isotope fractionation during early diagenesis in sediments of the gulf of California". Marine Chemistry. 9 (2): 95–143. Bibcode:1980MarCh...9...95G. doi:10.1016/0304-4203(80)90063-8.
- ^ Sim, Min Sub; Bosak, Tanja; Ono, Shuhei (July 2011). "Large Sulfur Isotope Fractionation Does Not Require Disproportionation". Science. 333 (6038): 74–77. Bibcode:2011Sci...333...74S. doi:10.1126/science.1205103. ISSN 0036-8075. PMID 21719675. S2CID 1248182.
- ^ Tsang, Man-Yin; Böttcher, Michael Ernst; Wortmann, Ulrich Georg (August 2023). "Estimating the effect of elemental sulfur disproportionation on the sulfur-isotope signatures in sediments". Chemical Geology. 632: 121533. doi:10.1016/j.chemgeo.2023.121533. S2CID 258600480.
- ^ Kim, Ik Soo; Kwak, Seung Im; Park, Ul Jae; Bang, Hong Sik; Han, Hyun Soo (1 July 2005). Production of Sulfur-35 by the Cation Exchange Process. 2005 autumn meeting of the KNS, Busan (Korea, Republic of), 27–28 Oct 2005.
- ^ "Sulfur-35 (35 S) safety information and specific handling precautions" (PDF). Yale Environmental Health & Safety.
- ^ Cameron, A. G. W. (1957). "Stellar Evolution, Nuclear Astrophysics, and Nucleogenesis" (PDF). CRL-41.
- ^ Mason, B. (1962). Meteorites. New York: John Wiley & Sons. p. 160. ISBN 978-0-908678-84-6.
- ^ Lopes, Rosaly M. C.; Williams, David A. (2005). "Io after Galileo". Reports on Progress in Physics. 68 (2): 303–340. Bibcode:2005RPPh...68..303L. doi:10.1088/0034-4885/68/2/R02. S2CID 44208045.
- ^ Rickwood, P. C. (1981). "The largest crystals" (PDF). American Mineralogist. 66: 885–907.
- ^ Kutney, Gerald (2007). Sulfur: history, technology, applications & industry. Toronto: ChemTec. p. 43. ISBN 978-1-895198-37-9. OCLC 79256100.
- ^ de Ronde, C. E. J.; Chadwick, W. W. Jr.; Ditchburn, R. G.; Embley, R. W.; Tunnicliffe, V.; Baker, E. T.; Walker, S. L.; Ferrini, V. L.; Merle, S. M. (2015). "Molten Sulfur Lakes of Intraoceanic Arc Volcanoes". Volcanic Lakes. Springer. pp. 261–288. Bibcode:2015vola.book.....R. doi:10.1007/978-3-642-36833-2. ISBN 978-3-642-36832-5. S2CID 199492543.
- ^ Klein, Cornelis; Hurlbut, Cornelius S. Jr. (1985). Manual of Mineralogy (20th ed.). Wiley. pp. 265–66. ISBN 0-471-80580-7.
- ^ "Sulphur: Mineral information, data and localities". www.mindat.org.
- ^ a b c d e Nehb, Wolfgang; Vydra, Karel (2006). "Sulfur". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag. doi:10.1002/14356007.a25_507.pub2. ISBN 978-3-527-30673-2.
- ^ 슈라이버, 앳킨스 무기화학, 제5판. W. H. Freeman and Company, 뉴욕, 2010; pp 416
- ^ Fujimori, Toshihiko; Morelos-Gómez, Aarón; Zhu, Zhen; Muramatsu, Hiroyuki; Futamura, Ryusuke; Urita, Koki; Terrones, Mauricio; Hayashi, Takuya; Endo, Morinobu; Young Hong, Sang; Chul Choi, Young; Tománek, David; Kaneko, Katsumi (2013). "Conducting linear chains of sulphur inside carbon nanotubes". Nature Communications. 4: 2162. Bibcode:2013NatCo...4.2162F. doi:10.1038/ncomms3162. PMC 3717502. PMID 23851903.
- ^ Brauer, G., ed. (1963). Handbook of Preparative Inorganic Chemistry. Vol. 1 (2nd ed.). New York: Academic Press. p. 421.
- ^ Hasek, W. R. (1961). "1,1,1-Trifluoroheptane". Organic Syntheses. 41: 104. doi:10.1002/0471264180.os041.28.
- ^ a b Lauss, H.-D.; Steffens, W. "Sulfur Halides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a25_623. ISBN 978-3527306732.
- ^ Vaughan, D. J.; Craig, J. R. (1978). Mineral Chemistry of Metal Sulfides. Cambridge: Cambridge University Press. ISBN 0-521-21489-0.
- ^ Tsang, Man-Yin; Inagaki, Fumio (29 May 2020). "Microbial Life Deep Under the Seafloor—A Story of Not Giving Up". Frontiers for Young Minds. 8: 70. doi:10.3389/frym.2020.00070. ISSN 2296-6846.
- ^ a b Cremlyn, R. J. (1996). An Introduction to Organosulfur Chemistry. Chichester: John Wiley and Sons. ISBN 0-471-95512-4.
- ^ Wilson, R. W.; Penzias, A. A.; Wannier, P. G.; Linke, R. A. (15 March 1976). "Isotopic abundances in interstellar carbon monosulfide". Astrophysical Journal. 204: L135–L137. Bibcode:1976ApJ...204L.135W. doi:10.1086/182072.
- ^ Banoub, Joseph (2011). Detection of Biological Agents for the Prevention of Bioterrorism. NATO Science for Peace and Security Series A: Chemistry and Biology. p. 183. Bibcode:2011dbap.book.....B. doi:10.1007/978-90-481-9815-3. ISBN 978-90-481-9815-3. OCLC 697506461.
- ^ "Sulfur in the Bible (14 instances)". bible.knowing-jesus.com. Retrieved 19 May 2022.
- ^ Rapp, George Robert (4 February 2009). Archaeomineralogy. Springer. p. 242. ISBN 978-3-540-78593-4.
- ^ 오디세이, 22권, 480-495행. www.perseus.tufts.edu 2012년 8월 16일에 검색되었습니다.
- ^ 과학과 기술에 관한 장로 플리니지, 존 F. 힐리, 옥스포드 대학 출판부, 1999, ISBN 0-19-814687-6, 페이지 247-249
- ^ a b c Zhang, Yunming (1986). "The History of Science Society: Ancient Chinese Sulfur Manufacturing Processes". Isis. 77 (3): 487. doi:10.1086/354207. S2CID 144187385.
- ^ Needham, Joseph; Yates, Robin (1994). Science and Civilisation in China, Volume 5: Chemistry and Chemical Technology, Part 6, Military Technology: Missiles and Sieges. Cambridge: Cambridge University Press. p. 120. ISBN 9780521327275. OCLC 489677531.
- ^ Koch, Rudolf (1955). The book of signs : which contains all manner of symbols used from the earliest times to the Middle Ages by primitive peoples and early Christians. New York: Dover Publications. ISBN 0-486-20162-7.
- ^ White, David Gordon (1996). The Alchemical Body — Siddha Traditions in Medieval India. Chicago: University of Chicago Press. pp. passim. ISBN 978-0-226-89499-7.
- ^ Lin, A. N.; Reimer, R. J.; Carter, D. M. (1988). "Sulfur revisited". Journal of the American Academy of Dermatology. 18 (3): 553–558. doi:10.1016/S0190-9622(88)70079-1. PMID 2450900.
- ^ Maibach, H. I.; Surber, C.; Orkin, M. (1990). "Sulfur revisited". Journal of the American Academy of Dermatology. 23 (1): 154–156. doi:10.1016/S0190-9622(08)81225-X. PMID 2365870.
- ^ Gupta, A. K.; Nicol, K. (2004). "The use of sulfur in dermatology". Journal of Drugs in Dermatology. 3 (4): 427–31. PMID 15303787.
- ^ Gupta, Aditya K; Nicol, Karyn (July–August 2004). "The Use of Sulfur in Dermatology". Journal of Drugs in Dermatology. 3 (4): 427–431. PMID 15303787.
- ^ Donovan, Arthur (1996). Antoine Lavoisier: Science, Administration and Revolution. Cambridge University Press. p. 66. ISBN 978-0-521-56672-8.
- ^ Poirier, Jean-Pierre (1998). Lavoisier: Chemist, Biologist, Economist. University of Pennsylvania Press. pp. 107–8. ISBN 978-0-8122-1649-3.
- ^ Riall, Lucy (1998). Sicily and the Unification of Italy: Liberal Policy and Local Power, 1859–1866. Oxford University Press. ISBN 9780191542619. Retrieved 7 February 2013.
- ^ Thomson, D. W. (April 1995). "Prelude to the Sulphur War of 1840: The Neapolitan Perspective". European History Quarterly. 25 (2): 163–180. doi:10.1177/026569149502500201. S2CID 145807900.
- ^ Botsch, Walter (2001). "Chemiker, Techniker, Unternehmer: Zum 150. Geburtstag von Hermann Frasch". Chemie in unserer Zeit (in German). 35 (5): 324–331. doi:10.1002/1521-3781(200110)35:5<324::AID-CIUZ324>3.0.CO;2-9.
- ^ Mass, Jennifer L; Anderson, Mark J (2003). "Pennsylvania German sulfur-inlaid furniture: characterization, reproduction, and ageing phenomena of the inlays". Measurement Science and Technology. 14 (9): 1598. doi:10.1088/0957-0233/14/9/311. ISSN 0957-0233. S2CID 250882259.
- ^ Kogel, Jessica (2006). Industrial minerals & rocks: commodities, markets, and uses (7th ed.). Colorado: Littleton. p. 935. ISBN 978-0-87335-233-8. OCLC 62805047.
- ^ "sulphur". Oxford English Dictionary (Online ed.). Oxford University Press. (가입 또는 참여기관 회원가입 필요)
- ^ "So long sulphur". Nature Chemistry. 1 (5): 333. 4 August 2009. Bibcode:2009NatCh...1Q.333.. doi:10.1038/nchem.301. PMID 21378874.
- ^ McNaught, Alan (1991). "Journal style update". The Analyst. 116 (11): 1094. Bibcode:1991Ana...116.1094M. doi:10.1039/AN9911601094.
- ^ "sulphur – definition of sulphur in English". Oxford Dictionaries. Archived from the original on 20 November 2016. Retrieved 19 November 2016.
- ^ Riegel, Emil; Kent, James (2007). Kent and Riegel's Handbook of Industrial Chemistry and Biotechnology. Vol. 1. Springer. p. 1171. Bibcode:2007karh.book....... ISBN 978-0-387-27842-1. OCLC 74650396.
- ^ Washington, Booker T. (1912). The Man Farthest Down: A Record of Observation and Study in Europe. Doubleday, Page. p. 214.
- ^ McElvaney, Kevin (25 February 2015). "The Men Who Mine Volcanos". The Atlantic. Retrieved 26 February 2015.
- ^ a b c Eow, John S. (2002). "Recovery of sulfur from sour acid gas: A review of the technology". Environmental Progress. 21 (3): 143–162. Bibcode:2002EnvPr..21..143E. doi:10.1002/ep.670210312.
- ^ a b c Schreiner, Bernhard (2008). "Der Claus-Prozess. Reich an Jahren und bedeutender denn je". Chemie in unserer Zeit. 42 (6): 378–392. doi:10.1002/ciuz.200800461.
- ^ Hyndman, A. W.; Liu, J. K.; Denney, D. W. (1982). "Sulfur Recovery from Oil Sands". Sulfur: New Sources and Uses. ACS Symposium Series. Vol. 183. pp. 69–82. doi:10.1021/bk-1982-0183.ch005. ISBN 978-0-8412-0713-4.
- ^ a b Mohamed, Abdel-Mohsen Onsy; El-Gamal, Maisa M. (2010). Sulfur concrete for the construction industry: a sustainable development approach. Fort Lauderdale: J. Ross. pp. 104–105, 109. ISBN 978-1-60427-005-1. OCLC 531718953.
- ^ 아포다카, 로리 E. (2012) "Sulfur" 광물 상품 요약. 미국 지질조사국.
- ^ a b Apodaca, Lori E. "Mineral Yearbook 2010: Sulfur" (PDF). United States Geological Survey.
- ^ a b "FAQ – The Sulphur Institute". sulphurinstitute.org. The Sulphur Institute. 2020. Retrieved 27 February 2020.
- ^ Zhao, F.; Hawkesford, M. J.; McGrath, S. P. (1999). "Sulphur Assimilation and Effects on Yield and Quality of Wheat". Journal of Cereal Science. 30 (1): 1–17. doi:10.1006/jcrs.1998.0241.
- ^ Blake-Kalff, M. M. A. (2000). "Diagnosing sulfur deficiency in field-grown oilseed rape (Brassica napus L.) and wheat (Triticum aestivum L.)". Plant and Soil. 225 (1/2): 95–107. doi:10.1023/A:1026503812267. S2CID 44208638.
- ^ Ceccotti, S. P. (1996). "Plant nutrient sulphur-a review of nutrient balance, environmental impact and fertilizers". Fertilizer Research. 43 (1–3): 117–125. doi:10.1007/BF00747690. S2CID 42207099.
- ^ Glossary, United States: NASA Earth Observatory, acid rain, archived from the original on 13 December 2011, retrieved 15 February 2013
- ^ Every, Richard L.; et al. (20 August 1968). "Method for Preparation of Wettable Sulfur" (PDF). Retrieved 20 May 2010.
- ^ Hagers Handbuch der Pharmazeutischen Praxis (in German). Vol. 6B (4th ed.). Berlin–Heidelberg–New York: Springer. 1978. pp. 672–9. ISBN 978-3-540-07738-1.
- ^ Arzneibuch-Kommentar. Wissenschaftliche Erläuterungen zum Europäischen Arzneibuch und zum Deutschen Arzneibuch [Pharmacopoeia Commentary. Scientific annotations to the European Pharmacopoeia and the German Pharmacopoeia] (in German) (23rd ed.). Stuttgart: Wissenschaftliche Verlagsgesellschaft. 2004. Monographie Schwefel zum äußerlichen Gebrauch [Monograph Sulfur for external use]. ISBN 978-3-8047-2575-1.
- ^ Scott, Kevin A.; Njardarson, Jon T. (2019), Jiang, Xuefeng (ed.), "Analysis of US FDA-Approved Drugs Containing Sulfur Atoms" (PDF), Sulfur Chemistry, Topics in Current Chemistry Collections, Springer International Publishing, pp. 1–34, doi:10.1007/978-3-030-25598-5_1, ISBN 978-3-030-25598-5, retrieved 8 March 2023
- ^ Pai, Rahul (10 February 2022). "Stabilization of gamma sulfur at room temperature to enable the use of carbonate electrolyte in Li–S batteries". Communications Chemistry. 5 (1): 17. doi:10.1038/s42004-022-00626-2. PMC 9814344. PMID 36697747. S2CID 246704531.
- ^ "Sulphur and the Human Body". The Sulfur Institute. Retrieved 3 April 2021.
- ^ "What is the body made of?". New Scientist. Archived from the original on 3 November 2021. Retrieved 9 November 2021.
- ^ Helmenstine, Anne (3 February 2019). "Elemental Composition of the Human Body by Mass". ThoughtCo. Archived from the original on 13 April 2021. Retrieved 21 November 2021.
- ^ Parcell, Stephen (February 2002). "Sulfur in human nutrition and applications in medicine". Alternative Medicine Review. 7 (1): 22–44. ISSN 1089-5159. PMID 11896744.
- ^ Ingenbleek, Yves; Kimura, Hideo (July 2013). "Nutritional essentiality of sulfur in health and disease". Nutrition Reviews. 71 (7): 413–432. doi:10.1111/nure.12050. ISSN 1753-4887. PMID 23815141.
- ^ Dworkin, Martin (March 2012). "Sergei Winogradsky: a founder of modern microbiology and the first microbial ecologist". FEMS Microbiology Reviews. 36 (2): 364–379. doi:10.1111/j.1574-6976.2011.00299.x. ISSN 1574-6976. PMID 22092289.
- ^ Waksman, S. A.; Starkey, R. L. (20 January 1923). "On the Growth and Respiration of Sulfur-Oxidizing Bacteria". The Journal of General Physiology. 5 (3): 285–310. doi:10.1085/jgp.5.3.285. ISSN 0022-1295. PMC 2140527. PMID 19871997.
- ^ Pronk JT; Meulenberg R; Hazeu W; Bos P; Kuenen JG (1990). "Oxidation of reduced inorganic sulphur compounds by acidophilic thiobacilli". FEMS Microbiology Letters. 75 (2–3): 293–306. doi:10.1111/j.1574-6968.1990.tb04103.x.
- ^ Frigaard, Niels-Ulrik; Dahl, Christiane (1 January 2008), Poole, Robert K. (ed.), Sulfur Metabolism in Phototrophic Sulfur Bacteria, Advances in Microbial Physiology, vol. 54, Academic Press, pp. 103–200, doi:10.1016/S0065-2911(08)00002-7, ISBN 9780123743237, PMID 18929068, retrieved 17 May 2022
- ^ Cavanaugh, Colleen M. (1994). "Microbial Symbiosis: Patterns of Diversity in the Marine Environment". American Zoologist. 34: 79–89. doi:10.1093/icb/34.1.79.
- ^ Jones, Galen E.; Starkey, Robert L.; Feely, Herbert W.; Kulp, J. Laurence (22 June 1956). "Biological Origin of Native Sulfur in Salt Domes of Texas and Louisiana". Science. 123 (3208): 1124–1125. Bibcode:1956Sci...123.1124J. doi:10.1126/science.123.3208.1124. ISSN 0036-8075. PMID 17793426.
- ^ Philip, G.; Wali, A. M. A.; Aref, M. A. M. (1 September 1994). "On the origin of native sulfur deposits in Gebel El Zeit, Gulf of Suez, Egypt". Carbonates and Evaporites. 9 (2): 223–232. Bibcode:1994CarEv...9..223P. doi:10.1007/BF03175232. ISSN 1878-5212. S2CID 128827551.
- ^ "Petrography and mineralogy of the crystalline limestone of Fatha Formation from Mishraq area, Iraq". ResearchGate. Retrieved 15 April 2022.
- ^ Heldt, Hans-Walter (1996). Pflanzenbiochemie (in German). Heidelberg: Spektrum Akademischer Verlag. pp. 321–333. ISBN 978-3-8274-0103-8.
- ^ Kuenen, J. G.; Beudeker, R. F. (13 September 1982). "Microbiology of thiobacilli and other sulphur-oxidizing autotrophs, mixotrophs and heterotrophs". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 298 (1093): 473–497. Bibcode:1982RSPTB.298..473K. doi:10.1098/rstb.1982.0093. ISSN 0962-8436. PMID 6127737.
- ^ Wasmund, Kenneth; Mußmann, Marc; Loy, Alexander (August 2017). "The life sulfuric: microbial ecology of sulfur cycling in marine sediments: Microbial sulfur cycling in marine sediments". Environmental Microbiology Reports. 9 (4): 323–344. doi:10.1111/1758-2229.12538. PMC 5573963. PMID 28419734.
- ^ Gutiérrez-Preciado, A.; Romero, H.; Peimbert, M. (2010). "An Evolutionary Perspective on Amino Acids". Nature Education. 3 (9): 29.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). Molecular Biology of the Cell. 4th edition. New York: Garland Science. ISBN 978-0-8153-3218-3.
- ^ Arnér, Elias S. J.; Holmgren, Arne (25 December 2001). "Physiological functions of thioredoxin and thioredoxin reductase: Thioredoxin and thioredoxin reductase". European Journal of Biochemistry. 267 (20): 6102–6109. doi:10.1046/j.1432-1327.2000.01701.x. PMID 11012661.
- ^ "Lysozyme". Drugs.com. Retrieved 19 May 2022.
- ^ Nelson, D. L.; Cox, M. M. (2000). Lehninger, Principles of Biochemistry (3rd ed.). New York: Worth Publishing. ISBN 978-1-57259-153-0.
- ^ Selhub, J. (1 July 1999). "Homocysteine metabolism". Annual Review of Nutrition. 19 (1): 217–246. doi:10.1146/annurev.nutr.19.1.217. ISSN 0199-9885. PMID 10448523.
- ^ Huxtable, R. J. (1 January 1992). "Physiological actions of taurine". Physiological Reviews. 72 (1): 101–163. doi:10.1152/physrev.1992.72.1.101. ISSN 0031-9333. PMID 1731369.
- ^ "The Function of Biotin". www.chem.uwec.edu. Retrieved 10 June 2022.
- ^ Edwards, Katie A. "Thiamine Biochemistry". thiamine.dnr.cornell.edu. Retrieved 10 June 2022.
- ^ Thauer, R. K. (1998). "Biochemistry of methanogenesis: a tribute to Marjory Stephenson:1998 Marjory Stephenson Prize Lecture". Microbiology. 144 (9): 2377–2406. doi:10.1099/00221287-144-9-2377. PMID 9782487.
- ^ Pace, Nicholas J.; Weerapana, Eranthie (17 April 2014). "Zinc-binding cysteines: diverse functions and structural motifs". Biomolecules. 4 (2): 419–434. doi:10.3390/biom4020419. ISSN 2218-273X. PMC 4101490. PMID 24970223.
- ^ Giles, Niroshini M; Watts, Aaron B; Giles, Gregory I; Fry, Fiona H; Littlechild, Jennifer A; Jacob, Claus (1 August 2003). "Metal and Redox Modulation of Cysteine Protein Function". Chemistry & Biology. 10 (8): 677–693. doi:10.1016/S1074-5521(03)00174-1. ISSN 1074-5521. PMID 12954327.
- ^ Lippard, S. J.; Berg, J. M. (1994). Principles of Bioinorganic Chemistry. University Science Books. ISBN 978-0-935702-73-6.
- ^ Schwarz, Günter; Mendel, Ralf R. (2006). "Molybdenum cofactor biosynthesis and molybdenum enzymes". Annual Review of Plant Biology. 57 (1): 623–647. doi:10.1146/annurev.arplant.57.032905.105437. ISSN 1543-5008.
- ^ Mladenović, Dušan; Radosavljević, Tatjana; Hrnčić, Dragan; Rasic-Markovic, Aleksandra; Stanojlović, Olivera (26 July 2019). "The effects of dietary methionine restriction on the function and metabolic reprogramming in the liver and brain – implications for longevity". Reviews in the Neurosciences. 30 (6): 581–593. doi:10.1515/revneuro-2018-0073. ISSN 2191-0200. PMID 30817309. S2CID 73470156.
- ^ Binz, Regina L.; Sadhukhan, Ratan; Miousse, Isabelle R.; Garg, Sarita; Koturbash, Igor; Zhou, Daohong; Hauer-Jensen, Martin; Pathak, Rupak (27 February 2021). "Dietary Methionine Deficiency Enhances Genetic Instability in Murine Immune Cells". International Journal of Molecular Sciences. 22 (5): 2378. doi:10.3390/ijms22052378. ISSN 1422-0067. PMC 7956689. PMID 33673497.
- ^ Karakas, Erkan; Kisker, Caroline (18 October 2005). "Structural analysis of missense mutations causing isolated sulfite oxidase deficiency". Dalton Transactions (21): 3459–3463. doi:10.1039/B505789M. ISSN 1477-9234. PMID 16234925.
- ^ "Sulfur 84683". S.
- ^ "Chemical Datasheet. SULFUR, MOLTEN".
- ^ "Sulfur General Fact Sheet". npic.orst.edu. Retrieved 2 September 2022.
- ^ Schwartz, Steven M.; Carroll, Hugh M.; Scharschmidt, Linda A. (1 July 1986). "Sublimed (Inorganic) Sulfur Ingestion: A Cause of Life-Threatening Metabolic Acidosis With a High Anion Gap". Archives of Internal Medicine. 146 (7): 1437–1438. doi:10.1001/archinte.1986.00360190229034. ISSN 0003-9926. PMID 3718141.
- ^ Blum, J. Eric; Coe, Fredric L. (13 January 2010). "Metabolic Acidosis after Sulfur Ingestion". New England Journal of Medicine. 297 (16): 869–870. doi:10.1056/nejm197710202971606. PMID 904661. Retrieved 2 September 2022.
- ^ "Sulfur Dioxide Toxicological Profile ATSDR". Centers for Disease Control and Prevention. 26 March 2014. Retrieved 24 October 2023.
- ^ "Sulfur General Fact Sheet". npic.orst.edu. Retrieved 20 January 2024.
- ^ Baker, Colin (1 March 2007). "The dehydration of sucrose". Education in Chemistry. Royal Society of Chemistry. Retrieved 14 June 2018.
- ^ "4.1: Fossil Fuels and Products of Combustion". Engineering LibreTexts. 28 February 2021. Retrieved 24 October 2023.
- ^ "Hydrogen Sulfide Toxicity: Practice Essentials, Pathophysiology, Etiology". Medscape. 30 March 2017 – via eMedicine.
- ^ Summers, Vincent (8 April 2017). "Hydrogen Sulfide or Hydrogen Cyanide: Which is More Dangerous?". Quirky Science. Retrieved 23 August 2022.
- ^ "Hydrogen Sulfide – Hazards Occupational Safety and Health Administration". www.osha.gov. Retrieved 23 August 2022.
추가읽기
Sigel, Astrid; Freisinger, Eva; Sigel, Roland K.O., eds. (2020). Transition Metals and Sulfur: A Strong Relationship for Life. Guest Editors Martha E Sosa Torres and Peter M.H.Kroneck. Berlin/Boston: de Gruyter. pp. xlv+455. ISBN 978-3-11-058889-7.
외부 링크
- 비디오 주기율표의 유황 (노팅엄 대학교)
- NIST 물리측정연구소 황 원자 데이터
- 2010년 2월 23일 Wayback Machine에서 보관된 황상도, 13-17세 화학 입문
- 이탈리아 불카노 섬의 유황 결정, 액체 및 중합
- 유황 및 살충제로서의 용도
- 유황연구소
- Nutrient Stewardship과 The Sulfur Institute