피릴리움 소금
Pyrylium salt| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 피릴리움[1] | |||
| 기타 이름 피라늄 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
펍켐 CID | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C5H5O+ | |||
| 어금질량 | 81.09 g/190 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
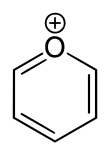
피릴리움(Pyrylium)은 공식을 가진 양이온(양이온)이다. CHO는55+ 각각 수소 원자 1개와 양전하 산소 원자 1개로 구성된 탄소 원자 5개로 구성된 6mb 링으로 구성되어 있다. 반지 속의 결합은 벤젠과 같이 결합되어 있어 향기로운 성격을 준다. 특히 양전하 때문에 산소원자가 3가치가 된다. 피릴륨(Pyrilium)은 옥소늄 이온의 하나인 단순환성 및 헤테로사이클릭성 화합물이다.
소금
피릴륨과 그 유도체는 다양한 음이온으로 안정적인 염분을 형성한다.[2][3][4][5][6][7]
파생상품
많은 중요한 양이온들은 공식적으로 링에 있는 일부 또는 모든 수력발전소에 대한 다양한 기능 그룹의 대체에 의해 피릴리움에서 파생된다. 카트리프츠키 소금으로 일컬어지는 2,4,6 트리페닐피릴륨(Alan R. Katritzky 이후)은 금속 촉매 교차 결합의 많은 현대적 예에서 사용되는 중요한 예다.[8]
화학적 특성
다른 옥소늄 이온과 마찬가지로 피릴리움은 중성 물에서 불안정하다. 그러나 피릴륨은 방향족 안정화 때문에 일반 옥소늄 이온에 비해 반응성이 훨씬 떨어진다. 2,4,6 트리페닐 소금은 일반적으로 1위치에 있는 알리파티 아민과 반응하여 피리디늄 염을 형성하고 금속 복합체, 특히 니켈이 함유된 아민과 산화제 첨가 작용을 한다.[9] 피릴리움 양이온도 2, 4, 6개 위치에서 핵포체와 반응해 다양한 반응을 유도할 수 있다. 산소의 높은 전기성은 6-엠베드 링에서 하나의 이질 원자에 의한 강한 단일 동요를 초래한다.
합성
화농염은 응축 반응을 통해 간단한 시동 물질에서 쉽게 생성된다.
2,4,6-트립페닐피릴리움 테트라플루오로보토스 같은 방향성 대체물을 함유한 피릴리움 염은 테트라플루오로보르산과 산화제(Dilthe composition)가 있는 아세토페논 두 몰과 벤츠알데히드 한 몰에서 얻을 수 있다. 2,4,6-trimethylpyrylium 소금 같은 알킬 substituents과 피릴륨 소금을 위해 최선의 방법, 과염소산의. 또는trifluoromethanesulfonictetrafluoroboric 산의 앞에서 삼차 부탄올과 무수 초산에서 Balaban-Nenitzescu-Praill 합성을 사용한다.[10][11]2,4,6-Triphenylpyrylium은 기지들로 안정된 1,5-enedion로 변환됩니다.e (pseudobase) 그러나 뜨거운 알칼리 수산화물로 처리한 2,4,6-trimethylpyrium salts는 3,5-dimethethylphenol을 생성하는 분자 내 응결 과정을 거치는 불안정한 가성비를 제공한다. 따뜻한 중수소 산화물에서 2,4,6-트리메틸피릴리움염은 2-메틸 그룹과 6-메틸 그룹보다 더 빨리 4-메틸 하이드로겐의 동위원소 교환을 거치게 되어 섭생성 중수소 화합물의 합성이 가능하다.
파생상품
핵물질에 대한 피릴리움 염의 반응성은 더 강한 방향성을 가진 다른 화합물을 생산하는 데 유용한 재료가 된다. 피릴리움염은 1차 아민이 함유된 암모니아,[12] 피리디늄염, 히드록실아민이 함유된 피리딘-N-산화물, 인산 유도체를 함유한 인산염, 황화수소를 함유한 티오피릴리움염, 아세토나이트릴 또는 니트로메탄 등을 함유한 벤젠 유도물을 제공한다.
파이로네스
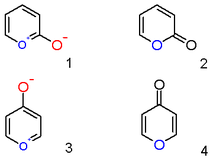
2-위치에 히드록실 음이온 대체물이 있는 피릴리움 계수는 zwitterionic 방향족 화합물(1)이 아니라 중성 불포화 락톤 또는 2-피론 또는 피란-2-1(2)이다. 이 반의 중요한 대표자는 쿠마린이다. 마찬가지로 4-히드록실 피릴리움 화합물은 γ-피론 또는 피란-4-1 (4)이며, 말톨과 같은 화합물에 속하는 그룹이다.
화학적 특성
2-Pyrones는 Diels-Alder 반응에서 알키네와 반응하여 이산화탄소 배출과 함께 아레네 화합물을 형성하는 것으로 알려져 있다.[13]
다순환화합물 이온
크로메닐리움 이온
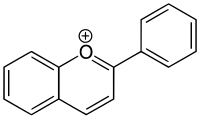
자전거용 피릴리움 이온 1개를 벤조피릴리움 이온(IUPAC: chromenylium ion)(공식: CHO97+, 어금질량: 131.15g/mol, 정확한 질량: 131.04968983)이라고 한다. 2H-1-벤조피란(IUPAC: 2H-크롬, CHO98)의 충전 파생상품이나 (충전) 나프탈렌(CH108)의 헤테로사이클릭 파생상품으로 볼 수 있다.
플라빌리움 이온
생물학에서 2-페닐벤조피릴리움(2-페닐크롬니룸) 이온을 플라빌리움이라고 한다. 향미유래 화합물의 종류는 안토시아니딘과 안토시아닌으로, 많은 꽃의 색을 담당하는 색소들이다.
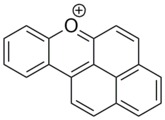
나프톡산테늄 양이온
고다중성계파생상품인 열량도 존재한다. 한 가지 좋은 예가 나프톡산테늄이다. 이 염료는 안정성이 높고 방향성이 있으며 평면적이다. UV와 블루 부위에서 흡수되며 뛰어난 광물리학적 특성을 나타낸다. 화학 반응이나 광화학 반응에 의해 합성될 수 있다.[14]
참고 항목
- 한 개의 탄소를 다른 그룹으로 대체한 6개 방향족 링: 보라벤젠, 실라벤젠, 게라벤젠, 스타나벤젠, 피리딘, 인광, 아르사벤젠, 스티바벤젠젠, 비스마벤젠젠젠, 피릴리움, 티오피릴리움, 셀레노피릴리움, 텔루프로필리움
- 피란, CHO56(케톤군이 부족한 피론)
| 무료 사전인 위키트리올에서 필리움을 찾아보자. |
참조
- ^ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 1097. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ Gilchrist, T. L. (1997). Heterocyclic Chemistry. ISBN 0-582-27843-0.
- ^ Balaban, A. T.; Schroth, W.; Fischer, G. (1969). Katritzky, A. R.; Boulton, A. J. (eds.). "Pyrylium Salts. I. Synthesis". Advances in Heterocyclic Chemistry. New York: Academic Press. 10: 241–326. doi:10.1016/S0065-2725(08)60499-7.
- ^ Balaban, A. T.; Dinculescu, A.; Dorofeenko, G. N.; Fischer, G. W.; Koblik, A. V.; Mezheritskii, V. V.; Schroth, W. (1982). Katritzky, A. R. (ed.). Pyrylium Salts. Syntheses, Reactions and Physical Properties. Advances in Heterocyclic Chemistry: Supplement. Vol. 2. New York: Academic Press. ISBN 978-0-12-020652-0.
- ^ Balaban, A. T. (1979). "The Pyrylium Cation as a Synthon in Organic Chemistry". In Mitra, R. B.; Ayyangar, N. R.; Gogte, V. N.; Acheson, R. M.; Cromwell, N. (eds.). New Trends in Heterocyclic Chemistry. Studies in Organic Chemistry. Vol. 3. Amsterdam: Elsevier. pp. 79–111. ISBN 978-0-444-41737-4.
- ^ Balaban, A. T. (1987). "Pyrylium Salts as Useful Synthons". In Chizov, O. (ed.). Organic Synthesis: Modern Trends. Oxford: Blackwell. pp. 263–274. ISBN 0-632-02014-8.
- ^ Balaban, T. S.; Balaban, A. T. (2003). "Pyrylium Salts". Hetarenes and Related Ring Systems, Six-membered Hetarenes with one Chalcogen. Science of Synthesis; Houben-Weyl Methods of Molecular Transformations. Vol. 14. Stuttgart: Georg Thieme Verlag. pp. 11–200. ISBN 978-3-13-118641-6.
- ^ Balaban, A. T.; Wray, V. (1977). "13C n.m.r. spectra of some pyrylium salts and related compounds". Organic Magnetic Resonance. 9 (1): 16–22. doi:10.1002/mrc.1270090105.
- ^ Pang, Yue; Moser, Daniel; Cornella, Josep (2020). "Pyrylium Salts: Selective Reagents for the Activation of Primary Amino Groups in Organic Synthesis". Synthesis. 52 (4): 489–503. doi:10.1055/s-0039-1690703. S2CID 208705148.
- ^ Balaban, A. T.; Boulton, A. J. (1973). "2,4,6-Trimethyl-Pyrylium Tetrafluoroborate" (PDF). Organic Syntheses.
{{cite journal}}: CS1 maint : 복수이름 : 저자목록(링크); - ^ Balaban, A. T.; Boulton, A. J. (1973). "2,4,6-Trimethyl-Pyrylium Trifluoromethanesulfonate" (PDF). Organic Syntheses.
{{cite journal}}: CS1 maint : 복수이름 : 저자목록(링크); - ^ Anderson, A. G.; Stang, P. J. (1981). "2,6-Di-tert-Butyl-4-Methylpyridine" (PDF). Organic Syntheses. 60: 34.
{{cite journal}}: CS1 maint : 복수이름 : 저자목록(링크); - ^ Delaney, P. M.; Moore, J. E.; Harrity, J. P. A. (2006). "An Alkynylboronic Ester Cycloaddition Route to Functionalised Aromatic Boronic Esters". Chemical Communications. 2006 (31): 3323–3325. doi:10.1039/b607322k. PMID 16883424.
- ^ Bucher, G.; Bresolí-Obach, R.; Brosa, C.; Flors, C.; Luis, J. L.; Grillo, T. A.; Nonell, S. (2014). "β-Phenyl quenching of 9-phenylphenalenones: a novel photocyclisation reaction with biological implications". Physical Chemistry Chemical Physics. 16 (35): 18813–18820. Bibcode:2014PCCP...1618813B. doi:10.1039/C4CP02783C. PMID 25079707.