사이클로부타디엔
Cyclobutadiene| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 사이클로부타-1,3-다이엔 | |||
| 기타 이름 1,3-사이클로부타디엔 사이클로부타디엔 [4]아눌렌 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C4H4 | |||
| 어금질량 | 52.076 g·192−1 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
사이클로부타디엔은 이 공식을 가진 유기 화합물이다. CH44. 약해지는 경향 때문에 매우 반응적이다. 모화합물이 분리되지는 않았지만 일부 대체 파생상품은 견고하고 사이클로부타디엔의 단일 분자는 상당히 안정적이다. 이 화합물은 2분자 공정에 의해 분해되기 때문에, 종은 35K 이하의 온도에서 행렬 격리 기법으로 관찰할 수 있다. 그것은 직사각형 구조를 채택하는 것으로 생각된다.[1][2]
구조 및 반응도
이 화합물은 4개의 elect전자를 가진 전형적인 반자성 탄화수소다. 그것은 가장 작은 [n]-안눌린[4] 직사각형 구조는 분자를 왜곡하고 대칭을 낮추어 3중주를 싱글렛 접지 상태로 바꾸는 얀-텔러 효과의 결과다.[3] 사이클로부타디엔의 전자 상태는 다양한 계산법으로 탐구되어 왔다.[4] 직사각형 구조는 두 개의 서로 다른 1,2-디데로-1,3-사이클로부타디엔 발랑스 이소머의 존재와 일치한다. 이 왜곡은 4개 전자의 π계통이 방향성이 없다고 예측하는 후켈의 법칙과 일치하여 파이 전자가 국부화되었음을 나타낸다.
원칙적으로는 또 다른 상황이 가능하다. 즉, 사이클로부타디엔은 3중 회전 상태를 채택할 경우 왜곡되지 않은 사각 지오메트리를 가정할 수 있다. 이론적 가능성은 있지만, 모체 사이클로부타디엔과 대체 파생상품의 트리플트 형태는 수십 년 동안 이해하기 어려웠다. 다만, 2017년에는 1,2,3,4-테트라키스(트리메틸실릴)-1,3-사이클로부타디엔의 사각 트리플트 흥분 상태가 분광학적으로 관찰되었으며, 이 화합물에 대해서는 EST = 13.9 kcal/mol(또는 분자당 0.6 eV)의 싱글트-트리플릿 간격이 측정되었다.[5]
합성
몇몇 사이클로부타디엔 파생상품들은 견고한 부피가 큰 대체물로 격리되었다. 오렌지색 테트라키스(테르트부틸)사이클로부타디엔은 이소체 테트라테르트부틸트라헤드란 열분해로 발생한다. 사이클로부타디엔 파생상품은 (조광에 관한) 안정적이지만, O와2 접촉하면 분해된다.[6][7]
트래핑
시클로부타디엔의 샘플은 디엘-알더 반응에 의해 화합물이 35K 이상의 온도에서 희미해지기 때문에 불안정하다.[8] 양분자 분해 경로를 억제함으로써 사이클로부타디엔은 품행이 단정하다. 그래서 그것은 헤미카스플렉스에서 생성되었다.[2] 포함 화합물은 바이클로피란-2-1의 광데카복시화에 의해 생성된다.[9] 숙주-게스트 콤플렉스에서 방출되면 사이클로부타디엔이 디머라이징한 후 사이클로옥타테트라엔으로 변환된다.
수많은 시도 끝에 사이클로부타디엔은 세륨(암모늄)을 가진 사이클로부타디엔아이론 트리카르보닐의 산화 분해에 의해 처음 생성되었다.IV) 질산염.[10][11] 철 복합체에서 해방되면 사이클로부타디엔은 전자 결핍 알키네스와 반응하여 드와르 벤젠을 형성한다.[12]
데와르 벤젠은 90°C에서 가열 시 디메틸 프탈레이트(dimethyl phalate)로 전환된다.
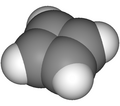
한 사이클로부타디엔 파생상품도 디알킨의 [2+2]사이클론 추가를 통해 이용할 수 있다. 이 특별한 반응에서 트래핑 시약은 2,3,4,5-테트라페닐사이클로펜타-2,4-다이엔타이며 최종 제품 중 하나(일산화탄소 배출 후)는 사이클로크타테트라엔이다.[13]
참고 항목
참조
- ^ Kollmar, H.; Staemmler, V. (1977). "A theoretical study of the structure of cyclobutadiene H. Kollmar, V. Staemmler; J. Am. Chem. Soc". Journal of the American Chemical Society. 99 (11): 3583–3587. doi:10.1021/ja00453a009.
- ^ a b Cram, Donald J.; Tanner, Martin E.; Thomas, Robert (1991). "The Taming of Cyclobutadiene Donald J. Cram, Martin E. Tanner, Robert Thomas". Angewandte Chemie International Edition in English. 30 (8): 1024–1027. doi:10.1002/anie.199110241.
- ^ Peter Senn (1992). "A Simple Quantum Mechanical Model that Illustrates the Jahn-Teller Effect". J. Chem. Educ. 69 (10): 819. Bibcode:1992JChEd..69..819S. doi:10.1021/ed069p819.
- ^ 발코바, 바틀렛, R. J. J. 화학. 1994, 101, 8972–8987.
- ^ Kostenko, Arseni; Tumanskii, Boris; Kobayashi, Yuzuru; Nakamoto, Masaaki; Sekiguchi, Akira; Apeloig, Yitzhak (2017-07-03). "Spectroscopic Observation of the Triplet Diradical State of a Cyclobutadiene". Angewandte Chemie International Edition. 56 (34): 10183–10187. doi:10.1002/anie.201705228. ISSN 1433-7851. PMID 28635054.
- ^ Günther Maier; Stephan Pfriem; Ulrich Schäfer; Rudolf Matusch (1978). "Tetra-tert-butyltetrahedrane". Angew. Chem. Int. Ed. Engl. 17 (7): 520. doi:10.1002/anie.197805201.
- ^ Hermann Irngartinger; Norbert Riegler; Klaus-Dieter Malsch; Klaus-Albert Schneider; Günther Maier (1980). "Structure of Tetra-tert-butylcyclobutadiene". Angewandte Chemie International Edition in English. 19 (3): 211–212. doi:10.1002/anie.198002111.
- ^ Carey, Francis A.; Sundberg, Richard J. (2007). Advanced Organic Chemistry: Part A: Structure and Mechanisms (5th ed.). Springer. p. 725. ISBN 978-0-387-44897-8.
- ^ E. J. Corey, Jacques Streith (1964). "Internal Photoaddtion Reactions of 2-Pyrone and N-Methyl-2-pyridone: A New Synthetic Approach to Cyclobutadiene". J. Am. Chem. Soc. 86 (5): 950–951. doi:10.1021/ja01059a059.
- ^ G. F. Emerson; L. Watts; R. Pettit (1965). "Cyclobutadiene- and Benzocyclobutadiene-Iron Tricarbonyl Complexes". J. Am. Chem. Soc. 87: 131–133. doi:10.1021/ja01079a032.
- ^ R. Pettit; J. Henery (1970). "Cyclobutadieneiron tricarbonyl". Organic Syntheses. 50: 21. doi:10.15227/orgsyn.050.0021.
- ^ L. Watts; J. D. Fitzpatrick; R. Pettit (1965). "Cyclobutadiene". J. Am. Chem. Soc. 87 (14): 3253–3254. doi:10.1021/ja01092a049.
- ^ Chung-Chieh Lee; Man-kit Leung; Gene-Hsiang Lee; Yi-Hung Liu; Shie-Ming Peng (2006). "Revisit of the Dessy-White Intramolecular Acetylene-Acetylene [2 + 2] Cycloadditions" (PDF). J. Org. Chem. 71 (22): 8417–8423. doi:10.1021/jo061334v. PMID 17064014.


![Acetylene-Acetylene [2 + 2] Cycloadditions Chung-Chieh Lee 2006](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c8/CyclobutadienSynthDessyWhite.png/400px-CyclobutadienSynthDessyWhite.png)