암모니아
Ammonia
 | |||
| |||
| 이름들 | |||
|---|---|---|---|
| IUPAC이름 암모니아[1] | |||
| 계통 IUPAC명 아자네 | |||
기타이름
| |||
| 식별자 | |||
3D 모델(JSMO) | |||
| 3D Met | |||
| 3587154 | |||
| ChEBI | |||
| 쳄블 | |||
| 켐스파이더 | |||
| ECHA 인포카드 | 100.028.760 | ||
| EC 번호 |
| ||
| 79 | |||
| 케그 | |||
| MeSH | 암모니아 | ||
펍켐 CID | |||
| RTECS 번호 |
| ||
| 유니아이 | |||
| UN번호 | 1005 | ||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| NH3 | |||
| 어금니 질량 | 17.031g·mol−1 | ||
| 외모 | 무색가스 | ||
| 냄새 | 강한 톡 쏘는 냄새 | ||
| 밀도 | |||
| 융점 | -77.73°C(-107.91°F, 195.42K) (6.060kPa, 195.4K에서 3중 지점) | ||
| 비등점 | -33.34°C(-28.01°F, 239.81K) | ||
| 임계점(T, P) | 132.4°C (405.5 K), 111.3 atm (11,280 kPa) | ||
| |||
| 용해도 | 클로로포름, 에테르, 에탄올, 메탄올에 용해됨 | ||
| 증기압 | 857.3 kPa | ||
| 산도(pKa) | 32.5 (-33 °C),[6] 9.24 (암모늄의 경우) | ||
| 베이직(pKb) | 4.75 | ||
| 공액산 | 암모늄 | ||
| 켤레염기 | 아미드 | ||
| -18.0·10cm−63/mol | |||
굴절률(nD) | 1.3327 | ||
| 점도 |
| ||
| 구조. | |||
| 다3v | |||
| 삼각뿔 | |||
| 1.42 D | |||
| 열화학 | |||
어금니 엔트로피 (S⦵298) | 193J/(mol·K)[8] | ||
스덴탈피 형성 (δ) | -46kJ/mol[8] | ||
| 유해성 | |||
| GHS 라벨링:[10] | |||
    | |||
| 위험 | |||
| H280, H314, H331, H410 | |||
| P260, P273, P280, P303+P361+P353, P304+P340+P311, P305+P351+P338+P310 | |||
| NFPA 704 (파이어다이아몬드) | |||
| 플래시 포인트 | 132°C (270°F; 405K) | ||
| 651°C (1,204°F; 924K) | |||
| 폭발한계 | 15,0–33,6% | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중앙선량) | 0.015 mL/kg (사람, 경구) | ||
LC50(중위농도) |
| ||
LCLo (최저 발행) | 5000ppm (mammal,5분) 5000ppm (사람, 5분)[9] | ||
| NIOSH(미국 건강 노출 한도):[11] | |||
PEL(허용) | 50 ppm (25 ppm ACGIH - TLV, 35 ppm STEL) | ||
REL (권장) | TWA 25ppm (18mg/m3) ST 35ppm (27mg/m3) | ||
IDLH(즉각 위험) | 300ppm | ||
| 안전자료(SDS) | ICSC 0414 (무수) | ||
| 관련화합물 | |||
관련 질소수소화물 | 히드라진 하이드라조산 | ||
관련화합물 | |||
| 부가자료페이지 | |||
| 암모니아 (자료페이지) | |||
별도의 언급이 없는 경우를 제외하고, 표준 상태(25 °C [77 °F], 100 kPa에서)의 재료에 대한 데이터가 제공됩니다. | |||
암모니아는 질소와 수소의 무기 화합물로 화학식은 NH입니다3. 안정적인 이항 수소화물, 그리고 가장 간단한 pnictogen 수소화물인 암모니아는 뚜렷한 톡 쏘는 냄새를 가진 무색의 기체입니다.생물학적으로는 특히 수생생물 중에서 흔한 질소성 폐기물이며, 전 세계 식량과[12] 비료의 45%를 차지하는 전조 역할을 하여 육상생물의 영양 수요에 크게 기여하고 있습니다.암모니아의 약 70%는 요소와 인산 디아모늄과 같은 다양한 형태와 조성의 비료를[13] 만드는 데 사용됩니다.순수한 형태의 암모니아 또한 토양에 직접적으로 적용됩니다.
암모니아는 또한 직간접적으로 많은 약학 제품의 합성을 위한 구성 요소이며 많은 상업적인 세척 제품에 사용됩니다.그것은 주로 공기와 물 모두의 아래쪽 변위에 의해 수집됩니다.
비록 지구와 태양계의 바깥 행성 모두에서 자연에서 흔하지만, 암모니아는 농축된 형태에서 인과적이고 위험합니다.많은 국가에서 이 물질은 매우 위험한 물질로 분류되며, 이 물질을 대량으로 생산, 저장 또는 사용하는 시설에서는 엄격한 보고 요건을 따릅니다.[14]
2021년 전 세계 암모니아 산업 생산량은 2억 3,500만 톤입니다.[15][16]산업용 암모니아는 암모니아 액체(일반적으로 물에서 암모니아의 28%)로 판매되거나 탱크차나 실린더에서 운반되는 가압 또는 냉장 무수 액체 암모니아로 판매됩니다.[17]
근본적인 이유로, 수소와 질소 원소로부터 암모니아를 생성하는 것은 어려우며, 이는 고압과 고온을 필요로 합니다.산업 생산을 가능하게 한 하버 공정은 20세기 초에 발명되어 농업에 혁명을 일으켰습니다.
NH는3 -33.34 °C(-28.012 °F)에서 한 대기의 압력으로 끓기 때문에 액체는 압력 또는 저온에서 보관해야 합니다.가정용 암모니아 또는 수산화암모늄은 물에 있는 NH의3 용액입니다.그러한 용액의 농도는 Baumé scale(밀도) 단위로 측정되며, 전형적인 고농도 상업 제품은 Baumé 26도(15.5 °C 또는 59.9 °F에서 암모니아 중량의 약 30%)입니다.[18]
어원
플리니는 그의 자연사 제XX권에서, 로마의 키레나이카 속주에 있는 주피터 아문 신전(그리스 ἄ μμ ων 암몬)과 가깝기 때문에 그렇게 불리는 함모니아쿰이라는 이름의 소금을 언급합니다.그러나 플리니가 말하는 소금의 설명은 염화암모늄의 성질에 부합하지 않습니다.Herbert Hoover가 Georgius Agricola의 Dere metallica를 그의 영어로 번역한 해설에 따르면, 그것은 흔한 바다 소금이었을 가능성이 있습니다.[20]어쨌든, 그 소금은 결국 암모니아와 암모늄 화합물의 이름을 지어주었습니다.시와 오아시스의 아문 신전을 찾은 로마인들은 천장과 벽에서 각종 오염물질로 인한 흰색 결정성 물질을 채취했습니다.이 하얀 결정질의 소금은 "암몬의 소금"(살암모니아)이라고 불립니다.조셉 프리스틀리는 이 소금이 석회와 반응할 때 증기가 방출되는 것을 알아차렸고, 그는 이것을 암모니아라고 이름 붙였습니다.[21]
자연발생
암모니아는 지구상에서 미량으로 발견되는 화학물질로, 질소가 함유된 동식물성 물질로부터 생성됩니다.암모니아와 암모늄염은 빗물에도 소량 존재하며, 염화암모늄(살암모니아)과 황산암모늄은 화산 지역에서 발견됩니다.중탄산 암모늄의 결정체는 파타고니아 구아노에서 발견되었습니다.[22]
암모니아는 또한 화성, 목성, 토성, 천왕성, 해왕성 그리고 명왕성의 태양계 전역에서 발견됩니다. 명왕성과 같은 더 작은 얼음 물체에서는 암모니아가 지질학적으로 중요한 부동액의 역할을 할 수 있습니다.물과 암모니아의 혼합물은 암모니아 농도가 충분히 높으면 녹는점이 -100 °C(-148 °F; 173 K)만큼 낮을 수 있으므로 물만으로 가능한 것보다 훨씬 낮은 온도에서 내부 해양과 활성 지질을 유지할 수 있습니다.[23][24]암모니아를 함유하고 있는 물질, 또는 그와 유사한 물질을 암모니아라고 합니다.
특성.
암모니아는 무색의 기체로 특유의 톡 쏘는 냄새가 납니다.밀도가 공기의 0.589배로 공기보다 가볍습니다.분자 간의 강한 수소 결합 때문에 쉽게 액화됩니다.기체 암모니아는 -33.1 °C(-27.58 °F)에서 끓는 무색 액체로 변하고 -77.7 °C(-107.86 °F)에서[22] 무색 결정으로 얼게 됩니다.초임계 상태와 같이 매우 높은 온도와 압력에서 사용할 수 있는 데이터는 거의 없습니다.[25]
단단한
결정 대칭은 입방정계, 피어슨 기호 cP16, 우주군 P231 No.198, 격자 상수 0.5125 nm.[26]
액체.
액체 암모니아는 22의 높은 ε을 반영하는 강력한 이온화 능력을 가지고 있습니다.액체 암모니아는 표준 엔탈피의 기화 변화가 매우 높습니다(23.35 kJ/mol, 비교수 40.65 kJ/mol, 메탄 8.19 kJ/mol, 포스핀 14.6 kJ/mol). 따라서 추가적인 냉동 없이 단열되지 않은 용기의 실험실에서 사용할 수 있습니다.액체 암모니아를 용매로 봅니다.
용매속성
암모니아는 물에 쉽게 녹습니다.수용액에서는 끓임으로써 배출할 수 있습니다.암모니아의 수용액은 기본입니다.물(포화 용액) 중 암모니아의 최대 농도는 0.880 g/cm이며3, 흔히 '.880 암모니아'로 알려져 있습니다.
분해
고온 및 적절한 촉매의 존재 하에서 또는 일정한 부피와 고온(예: 1,100 °C(2,010 °F))을 가진 가압 용기에서 암모니아는 그 구성 요소로 분해됩니다.[27]암모니아의 분해는 23 kJ/mol(5.5 kcal/mol)의 암모니아가 필요한 약간의 흡열 공정이며, 수소와 질소 가스를 생성합니다.미반응 암모니아를 제거할 수 있다면 암모니아는 산성 연료전지의 수소 공급원으로도 사용될 수 있습니다.루테늄과 백금 촉매가 가장 활성도가 높은 것으로 나타난 반면, 지지된 Ni 촉매는 활성도가 낮은 것으로 나타났습니다.'그린 암모니아'는 물의 전기분해와 같은 무탄소 공급원에서 수소로 생성되는 암모니아의 이름입니다.이 공급원에서 나오는 암모니아는 지구 기후 변화에 전혀 기여하지 않는 액체 연료로 사용될 수 있습니다.포화 액체 암모니아의 열 및 물리적 특성 표:[28][29]
| 온도(°C) | 밀도(kg/m3) | 비열(kJ/(kg·K)) | 운동학적 점도(m2/s) | 열전도율(W/(m·K)) | 열확산율(m2/s) | 프란틀 번호 | 벌크 계수(K−1) |
| -50 | 703.69 | 4.463 | 4.35x10−7 | 0.547 | 1.74x10−7 | 2.6 | |
| -40 | 691.68 | 4.467 | 4.06x10−7 | 0.547 | 1.78x10−7 | 2.28 | |
| -30 | 679.34 | 4.476 | 3.87x10−7 | 0.549 | 1.80x10−7 | 2.15 | |
| -20 | 666.69 | 4.509 | 3.81x10−7 | 0.547 | 1.82x10−7 | 2.09 | |
| -10 | 653.55 | 4.564 | 3.78x10−7 | 0.543 | 1.83x10−7 | 2.07 | |
| 0 | 640.1 | 4.635 | 3.73x10−7 | 0.54 | 1.82x10−7 | 2.05 | |
| 10 | 626.16 | 4.714 | 3.68x10−7 | 0.531 | 1.80x10−7 | 2.04 | |
| 20 | 611.75 | 4.798 | 3.59x10−7 | 0.521 | 1.78x10−7 | 2.02 | 2.45x10−3 |
| 30 | 596.37 | 4.89 | 3.49x10−7 | 0.507 | 1.74x10−7 | 2.01 | |
| 40 | 580.99 | 4.999 | 3.40x10−7 | 0.493 | 1.70x10−7 | 2 | |
| 50 | 564.33 | 5.116 | 3.30x10−7 | 0.476 | 1.65x10−7 | 1.99 |
대기압에서 암모니아(NH3)의 열 및 물리적 특성 표:[28][29]
| 온도(K) | 밀도(kg/m3) | 비열(kJ/(kg·K)) | 동적점도(kg/(m·s)) | 운동학적 점도(m2/s) | 열전도율(W/(m·K)) | 열확산율(m2/s) | 프란틀 번호 |
| 273 | 0.7929 | 2.177 | 9.35x10−6 | 1.18x10−5 | 0.022 | 1.31x10−5 | 0.9 |
| 323 | 0.6487 | 2.177 | 1.10x10−5 | 1.70x10−5 | 0.027 | 1.92x10−5 | 0.88 |
| 373 | 0.559 | 2.236 | 1.29x10−5 | 1.30x10−5 | 0.0327 | 2.62x10−5 | 0.87 |
| 423 | 0.4934 | 2.315 | 1.47x10−5 | 2.97x10−5 | 0.0391 | 3.43x10−5 | 0.87 |
| 473 | 0.4405 | 2.395 | 1.65x10−5 | 3.74x10−5 | 0.0467 | 4.42x10−5 | 0.84 |
| 480 | 0.4273 | 2.43 | 1.67x10−5 | 3.90x10−5 | 0.0492 | 4.74x10−5 | 0.822 |
| 500 | 0.4101 | 2.467 | 1.73x10−5 | 4.22x10−5 | 0.0525 | 5.19x10−5 | 0.813 |
| 520 | 0.3942 | 2.504 | 1.80x10−5 | 4.57x10−5 | 0.0545 | 5.52x10−5 | 0.827 |
| 540 | 0.3795 | 2.54 | 1.87x10−5 | 4.91x10−5 | 0.0575 | 5.97x10−5 | 0.824 |
| 560 | 0.3708 | 2.577 | 1.93x10−5 | 5.20x10−6 | 0.0606 | 6.34x10−5 | 0.827 |
| 580 | 0.3533 | 2.613 | 2.00x10−5 | 5.65x10−5 | 0.0638 | 6.91x10−5 | 0.817 |
구조.
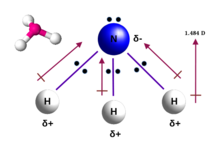

암모니아 분자는 실험적으로 결정된 결합각이 106.7°[30]인 원자가 껍질 전자쌍 반발 이론(VSEPR 이론)에 의해 예측된 삼각 피라미드 형상을 가지고 있습니다.중심 질소 원자는 각각의 수소 원자로부터 추가적인 전자를 가지고 있는 5개의 외부 전자를 가지고 있습니다.이것은 총 8개의 전자, 즉 4개의 전자쌍을 제공합니다.이 중 세 개의 전자쌍은 하나의 전자쌍을 남기는 결합쌍으로 사용됩니다.외쌍은 결합쌍보다 더 강하게 반발하므로 결합각은 정사면체 배열에서 예상되는 109.5°가 아니라 106.8°[30]입니다.이 모양은 분자에게 쌍극자 모멘트를 주고 극성을 만듭니다.분자의 극성, 특히 수소 결합을 형성하는 능력은 암모니아를 물과 매우 잘 섞이게 합니다.외쌍은 암모니아를 염기, 양성자 수용체로 만듭니다.암모니아는 적당한 염기성입니다. 1.0 M 수용액의 pH는 11.6이며, 용액이 중성(pH = 7)이 될 때까지 강산을 첨가하면 암모니아 분자의 99.4%가 양성자화됩니다.온도와 염도는 암모늄[NH4]의 비율에도 영향을 미칩니다.+후자는 정사면체 모양이고 메탄과 등전자성입니다.
암모니아 분자는 실온에서 쉽게 질소 반전을 겪습니다. 유용한 비유는 강한 바람에 그 자체를 뒤집어 놓는 우산입니다.이 반전에 대한 에너지 장벽은 24.7 kJ/mol이고, 공진 주파수는 23.79 GHz로 파장 1.260 cm의 마이크로파 방사에 해당합니다.이 주파수에서의 흡수는 관찰된 첫 번째 마이크로파 스펙트럼이었고 첫 번째 마스터에서 사용되었습니다.
양쪽성
암모니아의 가장 특징적인 특성 중 하나는 기본성입니다.암모니아는 약한 염기로 여겨집니다.산과 결합하여 암모늄염을 형성합니다. 따라서 염산과 결합하여 염화 암모늄(살 암모늄)을 형성하고 질산, 질산 암모늄 등을 생성합니다.완벽하게 건조된 암모니아 가스는 완벽하게 건조된 염화 수소 가스와 결합하지 않습니다. 수분은 반응을 일으키는 데 필요합니다.[32][33]
주변 수분과 함께 공기 중에서 실험한 것처럼, 농축된 암모니아와 염산 용액이 열린 병은 염화 암모늄 구름을 생성하는데, 이것은 확산하는 두 시약 구름이 두 병 사이에서 만나는 소금 에어로졸이 형성되기 때문에 "아무것도 아닌" 것처럼 보입니다.
- NH + HCl → [NH]Cl
암모니아가 산에 작용하여 생성되는 염은 암모늄 염으로 알려져 있으며 모두 암모늄 이온([NH4])+[32]을 포함합니다.
암모니아는 약한 염기로 잘 알려져 있지만, 매우 약한 산으로도 작용할 수 있습니다.양성자 물질이며, (NH-2 이온을 포함하는) 아미드를 형성할 수 있습니다.예를 들어, 리튬은 액체 암모니아에 용해되어 푸른색의 아미드 리튬 용액(용해된 전자)을 생성합니다.
- 2 Li + 2 NH → 2 LiNH + H
자기해체
물과 마찬가지로 액체 암모니아는 분자 자동 이온화 과정을 거쳐 산과 염기 결합체를 형성합니다.
- 2 NH3 ⇌ NH+4 + NH−2
암모니아는 종종 약한 염기로 작용하기 때문에 어느 정도 완충 능력이 있습니다.pH의 변화는 용액에 암모늄 양이온(NH+4)과 아미드 음이온(NH-2)이 더 많거나 더 적게 존재하게 합니다.표준 압력과 온도에서
- K = [NH+4] × [NH-2] = 10.
연소
암모니아는 공기의 부피 기준으로 15~25%의 좁은 연료 대 공기 혼합물을 제외하고는 쉽게 연소되거나 연소를 지속하지 못합니다.[34]산소와 섞이면 옅은 황록색의 불꽃과 함께 타오릅니다.점화는 염소가 암모니아로 유입되어 질소와 염화 수소를 형성할 때 발생합니다. 염소가 과다하게 존재할 경우 폭발성이 높은 삼염화 질소(NCL3)도 생성됩니다.
암모니아를 연소시켜 질소와 물을 형성하는 것은 발열성입니다.
암모니아 몰 당 표현되며 형성된 물의 응축에 따른 연소의 표준 엔탈피 변화인 δH°는 -382.81 kJ/mol입니다.다이니트로젠은 연소의 열역학적 생성물입니다. 모든 질소 산화물은 촉매변환기 뒤의 원리인 N과2 O에2 대해 불안정합니다.질소산화물은 적절한 촉매가 존재하는 경우 운동 생성물로 형성될 수 있으며, 이는 질산 생산에 있어 산업적으로 매우 중요한 반응입니다.
- 4 NH + 5 O → 4 NO + 6 HO
이후의 반응은 NO로2 이어집니다.
- 2 NO + O → 2 NO
비교적 낮은 연소열, 낮은 층류 연소 속도, 높은 자동 점화 온도, 높은 기화열 및 좁은 가연성 범위로 인해 공기 중 암모니아의 연소는 촉매(예: 백금 거즈 또는 따뜻한 크롬(III))가 없는 경우 매우 어렵습니다.그러나, 최근의 연구들은 스월 연소기를 이용하여 암모니아의 효율적이고 안정적인 연소를 달성할 수 있다는 것을 보여주고 있으며, 이에 따라 화력 생산을 위한 연료로서 암모니아에 대한 연구 관심을 다시 불러일으키고 있습니다.[35]건조한 공기에서 암모니아의 가연성 범위는 15.15-27.35%이고 상대습도 100%에서 15.95-26.55%[36][clarification needed]입니다.암모니아 연소의 역학을 연구하기 위해서는 신뢰할 수 있는 상세한 반응 메커니즘에 대한 지식이 필요하지만, 이를 얻기는 어려웠다.[37]
기타화합물의 생성
암모니아는 대부분의 제조된 질소 함유 화합물의 직접 또는 간접 전구체입니다.
유기화학에서 암모니아는 치환반응에서 친핵체로 작용할 수 있습니다.아민은 암모니아와 알킬할라이드 또는 알코올의 반응에 의해 형성될 수 있습니다.생성된 -NH2 그룹은 또한 친핵성이므로 종종 2차 및 3차 아민이 형성됩니다.이러한 다중 치환이 필요하지 않을 때 암모니아의 과다 사용은 이를 최소화하는 데 도움이 됩니다.예를 들어, 메틸아민은 암모니아와 클로로메탄 또는 메탄올의 반응에 의해 제조됩니다.두 경우 모두 디메틸아민과 트리메틸아민이 공동 생산됩니다.에탄올아민은 에틸렌 옥사이드와의 개환 반응에 의해 제조되고, 반응을 더 진행시키면 디에탄올아민과 트리에탄올아민이 생성됩니다.암모니아와 2-브로모프로판산의 반응은 라세믹 알라닌을 70% 수율로 제조하는 데 사용되었습니다.
아미드는 암모니아와 카르복실산 유도체의 반응에 의해 제조될 수 있습니다.예를 들어, 암모니아는 가열될 때 포름산(HCOOH)과 반응하여 포름아미드(HCONH2)를 생성합니다.염화 아실이 가장 반응성이 높지만, 형성된 염화 수소를 중화하기 위해서는 암모니아가 적어도 2배 이상 존재해야 합니다.에스테르와 무수물 또한 암모니아와 반응하여 아미드를 형성합니다.카르복실산의 암모늄염은 열에 민감한 그룹이 없는 한 150-200 °C로 가열하여 아미드로 탈수될 수 있습니다.
암모니아의 수소는 무수히 많은 치환기에 의해 대체되기 쉽습니다.건조한 암모니아 가스를 금속 나트륨으로 가열하면 나트륨, NaNH로2 바뀝니다.[32]염소와 함께 모노클로라민이 생성됩니다.
5가 암모니아는 λ-아민, 질소 펜타하이드라이드, 또는 일반적으로 [NH]H 암모늄으로 알려져 있습니다.이 결정성 고체는 고압에서만 안정적이고 정상 조건에서는 다시 3가 암모니아( λ-아민)와 수소 가스로 분해됩니다.이 물질은 1966년에 고체 로켓 연료일 가능성이 있다고 조사된 적이 있습니다.[38]
리간드로서의 암모니아


암모니아는 전이 금속 복합체에서 리간드 역할을 할 수 있습니다.분광 화학 계열의 중간에 있는 순수한 σ 공여체이며, 중간 정도의 경질-연질 거동을 보여줍니다(ECW 모델도 참조).다른 Lewis 염기와 비교하여 일련의 산에 대한 상대적인 공여 강도는 C-B 플롯으로 설명할 수 있습니다.[39][40]역사적인 이유로, 암모니아는 배위화합물의 명명법에서 암민으로 명명됩니다.몇몇 주목할 만한 암민 복합체는 구리()의 용액에 암모니아를 첨가함으로써 형성된 암청색 복합체인 테트라암미디아 콰구리(II)([Cu(NH3)(4HO2)])22+를 포함합니다.II) 소금테트라아민디아쿼구리()II) 수산화물은 슈와이저 시약으로 알려져 있으며, 셀룰로오스를 용해시키는 능력이 탁월합니다.디아민 은(I)([Ag(NH3))2+은 톨렌스 시약의 활성종입니다.이 복합체의 형성은 또한 다른 할로겐화은 침전물을 구별하는 데 도움이 됩니다. 염화은(AgCl)은 묽은(2M) 암모니아 용액에 용해되고 브롬화은(AgBr)은 농축 암모니아 용액에만 용해되는 반면 요오드화은(AgI)은 암모니아수에 용해되지 않습니다.
크롬(III)의 암민 복합체는 19세기 후반에 알려졌으며 배위화합물의 구조에 대한 알프레드 베르너의 혁명적인 이론의 기초를 형성했습니다.베르너는 복합체 [CrCl3(NH3)]3의 2개의 이성질체(fac- 및 mer-)만 형성될 수 있다고 지적하고, 리간드는 팔면체의 꼭지점에서 금속 이온 주위에 배열되어야 한다고 결론 내렸습니다.이 제안은 이후 X선 결정학으로 확인되었습니다.
금속 이온에 결합된 아민 리간드는 유리 암모니아 분자보다 현저하게 더 산성이지만, 수용액에서의 탈양성자화는 여전히 드물습니다.한 예로 수은의 반응이 있습니다.II) 암모니아가 첨가된 염화물(Calomel reaction)로 생성된 아미도클로라이드 수은이 불용성이 높은 경우.
- HgCl + 2 NH → HgCl(NH) + [NH]Cl
암모니아는 I2, 페놀 및 Al(CH3)과 같은 다양한 루이스 산과 1:1 부가물을 형성합니다.3암모니아는 강염기(HSAB 이론)이며 E&C 모수는 E = 2.31과 C = 2.04입니다.다른 Lewis 염기와 비교하여 일련의 산에 대한 상대적인 공여 강도는 C-B 플롯으로 설명할 수 있습니다.
탐지 및 결정
용액중 암모니아
암모니아와 암모늄염은 아주 미세한 흔적으로 쉽게 검출할 수 있는데, 암모니아나 암모늄염이 조금만 남아도 뚜렷한 노란색을 나타내는 네슬러 용액을 첨가하면 됩니다.암모늄염의 암모니아의 양은 나트륨(NaOH) 또는 수산화칼륨(KOH)과 함께 염류를 증류하여 정량적으로 추정할 수 있으며, 암모니아는 알려진 부피의 표준 황산에 흡수되고 산의 과잉량이 측정되며, 또는 암모니아는 염산과 탄약에 흡수될 수 있습니다.육염소산 암모늄으로 침전된 염화 니움, [NH4][2PtCl6].[41]
암모니아 가스
유황 스틱은 산업용 암모니아 냉동 시스템의 작은 누출을 감지하기 위해 연소됩니다.암모니아의 특징적인 냄새가 즉시 드러날 때, 가성 알칼리 또는 생석회로 소금을 데움으로써 더 많은 양을 검출할 수 있습니다.[41]암모니아는 자극제이며 농도에 따라 자극이 증가합니다. 허용 노출 한도는 25 ppm이며 500 ppm 이상으로 치명적입니다.[42][clarification needed]기존의 검출기에서는 더 높은 농도를 거의 검출하지 않으며, 검출기 유형은 필요한 감도(예: 반도체, 촉매, 전기화학)에 따라 선택됩니다.홀로그램 센서는 부피에서 최대 12.5%의 농도를 감지하기 위해 제안되었습니다.[43]
암모니아성 질소(NH-N3)
암모니아성 질소(NH-N3)는 물 또는 폐액에서 암모니아로부터 자연적으로 추출되어 유기 공정을 통해 암모니아로 환원되는 암모늄 이온의 양을 검사하는 데 일반적으로 사용되는 측정치입니다.주로 폐기물 처리 및 정수 시스템에서 값을 정량화하는 데 사용되는 척도이며, 천연 및 인공수분 매장량의 건강도를 측정하는 척도입니다.mg/L(리터당 밀리그램) 단위로 측정됩니다.
역사


고대 그리스 역사가 헤로도토스는 리비아의 한 지역에 "암모니아인"(현재 이집트 북서부의 시와 오아시스, 소금 호수가 여전히 존재함)이라고 불리는 사람들이 살고 있던 소금의 노두가 있었다고 언급했습니다.[44][45]그리스 지리학자 스트라보(Strabo)는 이 지역의 소금에 대해서도 언급했습니다.그러나, 고대 작가인 디오스코리데스, 아피키우스, 아리안, 시네시우스, 그리고 아미다의 아이 ë티우스는 이 소금이 요리에 사용될 수 있고 본질적으로 암염인 명확한 결정을 형성하는 것으로 묘사했습니다.하모니악살은 플리니의 글에 등장하지만,[47] 이 용어가 현대의 살 암모늄(염화암모늄)과 동일한지는 알 수 없습니다.[22][48][49]
박테리아에 의한 소변의 발효는 암모니아의 용액을 생산합니다. 따라서 발효된 소변은 고대에 천과 옷을 세탁하고, 태닝을 준비할 때 가죽에서 털을 제거하고, 죽어가는 천에서 매염제 역할을 하며, 철에서 녹을 제거하는 데 사용되었습니다.[50]이것은 고대 치과의사들이 이를 닦을 때 사용하기도 했습니다.[51][52][53]
نشادر, 누샤디르(Sal Amonomiac)의 형태로, 암모니아는 무슬림 연금술사들에게 중요했습니다.9세기에 쓰여진 것으로 보이며 야비르 이븐 하얀의 것으로 추정되는 돌의 서에 언급되어 있습니다.[54]알베르투스 마그누스가 언급한 13세기 유럽의 연금술사들에게도 중요했습니다.[22]그것은 또한 중세 시대의 염색업자들에 의해서 발효 소변의 형태로 식물성 염료의 색깔을 바꾸기 위해 사용되었습니다.15세기에 바실리우스 발렌티누스는 암모니아가 살 암모니아에 알칼리의 작용에 의해 얻어질 수 있다는 것을 보여주었습니다.[55]나중에 소의 발굽과 뿔을 증류하여 염산으로 탄산염을 중화시켜 살 암모니아를 얻었을 때, "하트쇼른의 정령"이라는 이름이 암모니아에 적용되었습니다.[22][56]
기체 암모니아는 1756년 Joseph Black에 의해 처음으로 살 암모늄(염화암모늄)과 하소된 마그네시아(산화마그네슘)를 반응시켜 분리되었습니다.[57][58]1767년 피터 울프에 [59][60]의해, 1770년[61] 칼 빌헬름 셸에 의해, 1773년 조셉 프리스틀리에 의해 다시 분리되었고, 그에 의해 "알칼리 공기"라고 명명되었습니다.[22][62]11년 후인 1785년, 클로드 루이스 베르톨레는 그 작곡을 확인했습니다.[63][22]
공기 중의 질소로부터 암모니아를 생성하는 하버-보쉬 공정은 1909년에 Fritz Haber와 Carl Bosch에 의해 개발되었고 1910년에 특허를 받았습니다.칠레로부터 질산염 공급을 차단한 연합군의 봉쇄 이후,[64] 제1차 세계 대전 중 독일에서 산업 규모로 처음 사용되었습니다.암모니아는 전쟁 노력을 지속시키기 위해 폭발물을 생산하는데 사용되었습니다.[65]
천연가스를 이용하기 전에, 물의 전기분해 또는 클로랄칼리 공정을 이용하여 암모니아 생성의 전구체로서 수소를 생산하였습니다.
20세기 철강 산업의 등장과 함께 암모니아는 코크스 석탄 생산의 부산물이 되었습니다.
적용들
용매
액체 암모니아는 가장 잘 알려져 있고 가장 널리 연구된 비수 이온화 용매입니다.가장 눈에 띄는 특성은 알칼리 금속을 용해하여 용매화된 전자를 포함하는 고색의 전기 전도성 용액을 형성하는 능력입니다.이러한 주목할 만한 용액 외에도, 액체 암모니아의 화학적인 많은 부분은 수용액의 관련 반응과 유추하여 분류할 수 있습니다.NH의3 물리적 특성을 물의 물리적 특성과 비교하면 NH는3 녹는점, 끓는점, 밀도, 점도, 유전율 및 전기 전도도가 더 낮습니다. 이는 적어도 부분적으로 NH의3 약한 수소 결합 때문이며 이러한 결합은 교차 결합된 네트워크를 형성할 수 없기 때문입니다.각각의 NH3 분자는 각각의 HO2 분자에 대해 2개의 전자에 비해 단지 하나의 외로운 쌍을 가지고 있기 때문입니다.-50 °C에서 액체3 NH의 이온성 자기분해 상수는 약 10−33.

염류 용해도
| 용해도(액체 NH3 100 g당 염분 g) | |
|---|---|
| 아세트산암모늄 | 253.2 |
| 질산암모늄 | 389.6 |
| 질산리튬 | 243.7 |
| 질산나트륨 | 97.6 |
| 질산칼륨 | 10.4 |
| 플루오르화나트륨 | 0.35 |
| 염화나트륨 | 157.0 |
| 브롬화나트륨 | 138.0 |
| 요오드화나트륨 | 161.9 |
| 티오시안산나트륨 | 205.5 |
액체 암모니아는 물보다는 덜하지만 이온화 용매이며, 많은 질산염, 질산염, 시안화물, 티오시아네이트, 금속 사이클로펜타디에닐 복합체 및 금속 비스(트리메틸실릴)아미드를 포함한 다양한 이온성 화합물을 용해합니다.[28]대부분의 암모늄염은 용해성이 있으며 액체 암모니아 용액에서 산으로 작용합니다.할로겐화물 염의 용해도는 불소에서 요오드화물로 증가합니다.질산암모늄의 포화 용액(다이버스 용액, Edward Divers의 이름을 따서 명명됨)은 암모니아 몰 당 0.83 몰의 용질을 함유하고 있으며, 25 °C(77 °F)에서도 증기압이 1 bar 미만입니다.
금속용액
액체 암모니아는 알칼리 금속과 Ca,[66] Sr, Ba, Eu 및 Yb와 같은 다른 전기 양성 금속을 모두 용해합니다(전해 공정을[29] 사용하는 Mg도 포함).낮은 농도(<0.06 mol/L)에서는 짙은 청색 용액이 형성됩니다. 금속 양이온과 용매 전자, 암모니아 분자 케이지로 둘러싸인 자유 전자를 포함합니다.
이 용액들은 강력한 환원제로서 매우 유용합니다.고농도의 경우, 용액은 외관상 금속성을 띠며 전기 전도성을 띠게 됩니다.낮은 온도에서는 두 가지 유형의 솔루션이 혼합 불가능한 단계로 공존할 수 있습니다.
암모니아 액체의 산화환원 특성
| E° (V, 암모니아) | E° (V, 물) | |
|---|---|---|
| Li+ + e− ⇌ Li | −2.24 | −3.04 |
| K+ + e− ⇌ K | −1.98 | −2.93 |
| Na+ + e− ⇌ Na | −1.85 | −2.71 |
| Zn + 2e ⇌ Zn | −0.53 | −0.76 |
| 2 [NH4]+ + 2 e− ⇌ H2 + 2 NH3 | 0.00 | — |
| Cu + 2e ⇌ Cu | +0.43 | +0.34 |
| Ag+ + e− ⇌ Ag | +0.83 | +0.80 |
액체 암모니아 용액의 열역학적 안정성의 범위는 매우 좁습니다. 질소로의 산화 전위인 E° (N + 6 [NH] + 6 e ⇌ 8 NH)가 +0.04 V에 불과하기 때문입니다.실제로는, 수소로의 산화와 수소로의 환원이 모두 느립니다.이것은 특히 환원 용액의 경우에 해당합니다. 위에서 언급한 알칼리 금속의 용액은 수일 동안 안정적이고 천천히 금속 아미드 및 디수소로 분해됩니다.액체 암모니아 용액과 관련된 대부분의 연구는 환원 조건에서 수행됩니다. 액체 암모니아의 산화가 일반적으로 느리지만, 특히 전이 금속 이온이 가능한 촉매로서 존재할 경우 폭발의 위험이 여전히 존재합니다.

비료
2019년 현재 미국에서는 암모니아의 약 88%가 소금, 용액 또는 무수물로 비료로 사용되고 있습니다.[67]토양에 적용하면 옥수수와 밀과 같은 작물의 수확량을 증가시키는 데 도움이 됩니다.[68]미국에서 적용되는 농업용 질소의 30%는 무수 암모니아 형태이며 전 세계적으로 매년 1억 1천만 톤이 적용되고 있습니다.[69]
질소화합물의 전구체
암모니아는 직간접적으로 대부분의 질소 함유 화합물의 전구체입니다.사실상 모든 합성 질소 화합물은 암모니아로부터 유래합니다.중요한 유도체는 질산입니다.이 핵심 물질은 ≈9 atm인 700–850 °C(1,292–1,562 °F)에서 공기와 함께 암모니아를 산화시켜 Ostwald 공정을 통해 생성됩니다.산화 질소는 이 전환의 중간생성물입니다.[70]
- NH + 2O → HNO + HO
질산은 비료, 폭발물 그리고 많은 유기 질소 화합물의 생산에 사용됩니다.
암모니아는 또한 다음과 같은 화합물을 만드는 데 사용됩니다.
- 히드라진, 올린 라쉬그 공정과 과산화물 공정에서
- 시안화수소, BMA 공정과 Andrussow 공정에서
- 라쉬그 공정에서 하이드록실아민과 탄산암모늄
- 페놀, 라쉬그에서-후커공정
- 요소, Bosch-Meiser 요소 공정 및 Wöhler 합성에서
- Strecker 아미노산 합성을 이용한 아미노산
- 소히오 공정에서 아크릴로니트릴
암모니아는 구체적으로 명명되지 않은 반응에서 화합물을 만드는 데 사용될 수도 있습니다.이러한 화합물의 예로는 과염소산암모늄, 질산암모늄, 포름아미드, 디니트로젠 사산화물, 알프라졸람, 에탄올아민, 에틸카바메이트, 헥사메틸렌테트라민, 중탄산암모늄 등이 있습니다.
클렌징제

가정용 '암모니아'는 물 속 NH3 용액으로, 여러 표면에 범용 세정제로 사용됩니다.암모니아는 비교적 줄무늬가 없는 광택을 내기 때문에 가장 일반적인 용도 중 하나는 유리, 자기 및 스테인리스 스틸을 세척하는 것입니다.또한 오븐을 청소하고 구운 때를 풀기 위해 물건을 담글 때도 자주 사용됩니다.가정용 암모니아의 농도는 중량 기준으로 5%에서 10% 사이입니다.[71]미국의 청소 제품 제조업체는 사용된 농도를 표시하는 제품의 재료 안전 데이터 시트를 제공해야 합니다.[72]
암모니아 용액(5~10 중량%)은 가정용 청소기, 특히 유리에 사용됩니다.이러한 해결책은 눈과 점막(호흡기 및 소화관)에 자극을 주며, 피부는 덜 자극적입니다.전문가들은 독성 염소 가스가 형성될 위험이 있기 때문에 화학물질이 표백제를 함유한 액체에 섞이지 않도록 주의해야 한다고 조언합니다.염소 함유 제품 또는 가정용 표백제와 같은 강력한 산화제와 혼합하면 유독한 클로라민 연기가 발생할 수 있습니다.[73]
전문가들은 또한 자동차 터치 스크린에 암모니아를 사용하는 클리너(예: 유리 또는 윈도우 클리너)를 사용하지 말라고 경고합니다. 스크린의 안티 글레어 및 안티 지문 코팅이 손상될 위험이 있기 때문입니다.[74]
발효
16%에서 25%에 이르는 암모니아 용액은 발효 산업에서 미생물의 질소 공급원으로 그리고 발효 동안 pH를 조절하기 위해 사용됩니다.[75]
식품용 항균제
일찍이 1895년에 암모니아가 "강력하게 방부제"였다는 것이 알려졌습니다.쇠고기 차(broth)를 보존하려면 리터당 1.4 그램이 필요합니다."한 연구에서 무수 암모니아는 3가지 종류의 동물 사료에서 99.999%의 동물원성 박테리아를 파괴했지만 사일리지는 않았습니다.[77][78]무수 암모니아는 현재 쇠고기의 미생물 오염을 줄이거나 제거하기 위해 상업적으로 사용되고 있습니다.[79][80]쇠고기 산업에서 기름기가 적은 미세한 질감의 쇠고기(일반적으로 '핑크 슬라임'이라 함)는 지방이 많은 쇠고기 손질(지방 50~70% 정도)을 열과 원심분리를 통해 지방을 제거한 후 암모니아로 처리하여 대장균을 죽입니다.미국 농무부는 이 치료법이 대장균을 검출 불가능한 수준으로 감소시킨다는 연구 결과를 바탕으로 이 과정이 효과적이고 안전하다고 판단했습니다.[81]암모니아 처리 쇠고기의 맛과 냄새에 대한 소비자 불만과 함께 공정에 대한 안전성에 대한 우려가 있어 왔습니다.[82]
연료


액체 암모니아의 원시 에너지 밀도는 11.5 MJ/L로 [83]디젤의 약 3분의 1 수준입니다.암모니아를 다시 수소로 변환할 수 있는 기회가 있으며, 여기서 그것은 수소 연료 전지에 전력을 공급하기 위해 사용될 수 있고, 또는 온실 가스를 배출하지 않는 효율적인 전력원을 제공하기 위해 고온의 고체 산화물 직접 암모니아 연료 전지 내에서 직접 사용될 수도 있습니다.[84][85]
연소를 위해 또는 양성자 교환 막 연료 전지의 연료로서,[86] 아마이드 나트륨 공정을 통해 암모니아를 수소로 전환하는 것이 [83]가능합니다.또 다른 방법은 고체 촉매를 이용한 암모니아의 촉매 분해입니다.[87]수소로 전환하면 압력을 받는 기체 수소의 경우 ≈5%에 비해 거의 18 wt%로 수소를 저장할 수 있습니다.
암모니아를 작동 유체로 사용하는 암모니아 엔진 또는 암모니아 모터가 제안되어 있고 때때로 사용되고 있습니다.[88]이 원리는 불이 없는 기관차에 사용되는 원리와 비슷하지만 증기나 압축 공기 대신 암모니아를 작동 유체로 사용합니다.암모니아 엔진은 19세기에 영국과 세인트루이스의 Goldsworthy Gurney에 의해 실험적으로 사용되었습니다. 1870년대와 1880년대에 뉴올리언스의 Charles Avenue Streetcar 라인,[89] 그리고 제2차 세계 대전 동안 벨기에에서 버스에 동력을 공급하는 데 암모니아가 사용되었습니다.[90]
암모니아는 때때로 내연기관용 화석 연료의 실용적인 대안으로 제안되기도 합니다.[90][91][92][93]
120의[94] 높은 옥탄가 등급과 낮은 화염[95] 온도로 인해 높은 NOx 생산이라는 단점 없이 높은 압축비를 사용할 수 있습니다.암모니아는 탄소를 포함하지 않기 때문에 연소를 통해 이산화탄소, 일산화탄소, 탄화수소 또는 그을음을 생성할 수 없습니다.
암모니아 생산은 현재 전 세계 이산화탄소2 배출량의 1.8%를 차지하고 있습니다.'그린 암모니아'는 그린 수소(전기 분해로 생성된 수소)를 이용해 생성되는 암모니아이고, '블루 암모니아'는 블루 수소(이산화탄소를 포집해 저장한 수증기 메탄 개질로 생성된 수소)를 이용해 생성되는 암모니아입니다.[96]
그러나 암모니아는 가연성 범위가 매우 좁기 때문에 기존 오토 사이클 엔진에서는 쉽게 사용할 수 없습니다.그럼에도 불구하고 몇 가지 테스트가 진행되었습니다.[97][98][99]
암모니아는 연료로서 수소와 비교하여 훨씬 에너지 효율이 높고, 압축된 상태로 유지되거나 극저온 액체로서 유지되어야 하는 수소보다 훨씬 적은 비용으로 생산, 저장 및 공급될 수 있습니다.[83][100]
로켓 엔진도 암모니아에 의해 연료가 공급되고 있습니다.X-15 극초음속 연구기에 동력을 공급한 리액티브 모터스 XLR99 로켓 엔진은 액체 암모니아를 사용했습니다.다른 연료만큼 강력하지는 않지만 재사용 가능한 로켓 엔진에 그을음이 남지 않았고, 그 밀도는 항공기의 설계를 단순화한 산화제, 액체 산소의 밀도와 거의 일치합니다.
2018년 8월 초, 호주 영연방 과학 산업 연구 기구(CSIRO)의 과학자들은 암모니아로부터 수소를 방출하고 자동차 연료로 초고순도로 수확하는 공정을 개발하는 데 성공했다고 발표했습니다.이것은 특수한 막을 사용합니다.현대 넥쏘와 도요타 미라이 두 대의 시연용 연료전지 차량이 이 기술을 가지고 있습니다.[101]
2020년, 사우디아라비아는 연료로 사용하기 위해 40톤의 액체 "블루 암모니아"를 일본으로 운송했습니다.[102]석유화학 업계에서 부산물로 생산한 것으로, 온실가스를 배출하지 않고 연소할 수 있습니다.부피에 따른 에너지 밀도는 액체 수소의 거의 두 배입니다.만약 그것을 만드는 과정이 순수하게 재생 가능한 자원을 통해, 녹색 암모니아를 생산함으로써 확장될 수 있다면, 그것은 기후 변화를 피하는 데 큰 변화를 만들 수 있을 것입니다.[103]ACWA 파워와 네옴 시는 2020년 그린 수소 및 암모니아 공장 건설을 발표했습니다.[104]
녹색 암모니아는 미래 컨테이너선의 잠재적 연료로 고려되고 있습니다.2020년, DSME와 MAN 에너지 솔루션은 암모니아 기반 선박의 건조를 발표했고, DSME는 2025년까지 상용화할 계획입니다.[105]암모니아를 항공기 제트 엔진의 잠재적인 대체 연료로 사용하는 것도 검토되고 있습니다.[106]
일본은 국내를 비롯한 아시아 전력회사들의 탄소중립 이행을 가속화하기 위한 노력의 일환으로 발전에서 암모니아 사용을 증대할 수 있는 암모니아 공동발화 기술 개발 계획을 추진할 계획입니다.[107]2021년 10월, 제1회 연료 암모니아 국제 회의(ICFA 2021)가 개최되었습니다.[108][109]
2022년 6월, IHI Corporation은 2,000 킬로와트급 가스터빈에서 액체 암모니아 연소 시 온실가스를 99% 이상 줄이는 데 성공하여 진정한 CO-free2 발전을 달성했습니다.[110]2022년 7월, 일본, 미국, 호주, 인도 4개국은 안보 그룹의 첫 번째 에너지 회의에서 수소와 암모니아를 연료로 청정 연소하는 기술 개발을 추진하기로 합의했습니다.[111]그러나 2022년[update] 현재 많은 양의 NO가x 생산되고 있습니다.[112]아산화질소도 문제가 될 수 있습니다.[113]
다른.
가스 배출물의 교정조치
암모니아는 화석 연료의 연소로부터 SO를2 세척하는 데 사용되며, 생성된 생성물은 비료로 사용하기 위해 황산암모늄으로 변환됩니다.암모니아는 디젤 엔진에서 배출되는 질소산화물(NOx) 오염물질을 중화합니다.SCR(선택적 촉매 환원)이라 불리는 이 기술은 바나디아 기반 촉매에 의존합니다.[114]
암모니아는 포스겐 가스 누출을 완화하는 데 사용될 수 있습니다.[115]
수소 운반선으로서
암모니아는 주변 온도에서 자체 증기 압력 하에서 액체 상태이고 부피 및 무게 에너지 밀도가 높다는 특성 때문에 수소에 적합한 운반체로 간주되며 액체 수소를 직접 운송하는 것보다 저렴할 수 있습니다.[116][117]
냉동 – R717
암모니아는 기화 특성 때문에 유용한 냉매입니다.[64]클로로플루오르카본(Freons)이 대중화되기 전에 일반적으로 사용되었습니다.무수 암모니아는 에너지 효율이 높고 비용이 저렴하기 때문에 산업용 냉동 응용 및 하키 링크에 널리 사용됩니다.독성의 단점이 있고 부식에 강한 성분을 필요로 하기 때문에 국산과 소규모 사용이 제한됩니다.현대 증기 압축 냉동에서 사용되는 것과 함께 흡수식 냉장고에서 수소 및 물과 함께 혼합물에 사용됩니다.지열 발전소에서 점점 더 중요해지고 있는 칼리나 사이클은 암모니아-물 혼합물의 넓은 비등 범위에 의존합니다.암모니아 냉각수는 또한 국제 우주 정거장에 탑재된 S1 라디에이터에 내부 온도를 조절하고 온도 의존적 실험을 가능하게 하는 두 개의 루프로 사용됩니다.[118][119]
환기된 CFC와 HFC가 매우 강력하고 안정적인 온실가스라는 사실이 밝혀지면서 냉매로서의 암모니아의 잠재적인 중요성이 증가했습니다.[120]
흥분제

암모니아는 소금 냄새를 맡으면서 배출되는 증기로서 호흡 촉진제로서의 중요한 용도를 발견했습니다.암모니아는 버치 환원을 통한 불법 필로폰 제조에 흔히 사용됩니다.[122]필로폰을 만드는 버치(Birch) 공법은 알칼리 금속과 액체 암모니아 모두 반응성이 매우 높고, 액체 암모니아의 온도는 반응물을 첨가할 때 폭발적인 비등에 취약하기 때문에 위험합니다.[123]
직물
액체 암모니아는 알칼리를 사용하여 머서라이제이션과 같은 특성을 부여하는 면 소재의 처리에 사용됩니다.특히 모직물을 미리 세탁할 때 사용합니다.[124]
리프팅 가스
표준 온도와 압력에서 암모니아는 대기보다 밀도가 낮으며 수소나 헬륨의 상승력이 약 45~48%에 이릅니다.암모니아는 풍선을 들어올리는 가스로 채우는 데 사용되기도 합니다.(헬륨과 수소에 비해)[125] 비등점이 상대적으로 높기 때문에, 암모니아는 잠재적으로 비행선에서 냉장 및 액화되어 양력을 감소시키고 양력을 증가시키고 양력을 감소시키기 위해 기체로 환원될 수 있습니다.
발끈
암모니아는 아트 앤 크래프트(Arts & Crafts)와 미션(Mission) 스타일의 가구에서 4분의 1의 흰 오크 나무를 검게 칠하는 데 사용되었습니다.암모니아 매연은 나무에 있는 천연 탄닌과 반응하여 색이 변합니다.[126]
안전.

미국 산업안전보건국(OSHA)은 환경 공기 중 기체 암모니아의 15분 노출 기준을 부피 기준 35ppm, 8시간 노출 기준을 부피 기준 25ppm으로 설정했습니다.[128]국립산업안전보건연구소(NIOSH)는 1943년의 독창적인 연구에 대한 최근의 보다 보수적인 해석을 바탕으로 IDLH(Indemeed Dangerous to Life and Health, 건강한 근로자가 돌이킬 수 없는 건강 영향을 받지 않고 30분 동안 노출될 수 있는 수준)를 500에서 300으로 최근 축소했습니다.다른 조직들은 노출 수준이 다양합니다.미국 해군 표준 [미국 선박국 1962] 최대 허용 농도(MAC): 연속 노출(60일)의 경우 25 ppm이고 1시간 노출의 경우 400 ppm입니다.[129]
암모니아 증기는 잠재적으로 위험한 노출을 경고하는 역할을 하는 날카롭고 자극적이며 톡 쏘는 냄새를 가지고 있습니다.평균 냄새 임계값은 5ppm으로 위험 또는 손상에 훨씬 못 미칩니다.매우 높은 농도의 가스 암모니아에 노출되면 폐 손상과 사망을 초래할 수 있습니다.[128]암모니아는 미국에서 불연성 가스로 규정되어 있지만, 흡입에 의해 유독한 물질의 정의를 충족하며 3,500US 갤런(13,000 L; 2,900 impgal) 이상의 양으로 운송될 경우 위험 안전 허가가 필요합니다.[130]
액체 암모니아는 흡습성이 있고 가성 화상을 일으킬 수 있기 때문에 위험합니다.자세한 내용은 가스 운반선 § 가스 운반선에 실려 있는 특정 화물의 건강 영향을 참조하십시오.
독성
암모니아 용액의 독성은 보통 인간과 다른 포유동물들에게 문제를 일으키지 않는데, 이는 혈류에서 암모니아가 축적되는 것을 방지하기 위한 특정한 메커니즘이 존재하기 때문입니다.암모니아는 효소인 카바모일 인산 합성효소에 의해 카바모일 인산으로 전환된 후 요소 회로에 들어가 아미노산으로 통합되거나 소변으로 배출됩니다.[131]물고기와 양서류는 이 메커니즘이 부족합니다. 왜냐하면 그들은 보통 몸에서 직접 배설함으로써 암모니아를 제거할 수 있기 때문입니다.암모니아는 묽은 농도에서도 수생동물에 강한 독성을 나타내므로 환경에 위험한 물질로 분류됩니다.대기 암모니아는 미세한 입자 물질의 형성에 중요한 역할을 합니다.[132]
코킹 폐수
암모니아는 석탄에서 코크스가 생성되는 액상 부산물로서 코크스 폐수 스트림에 존재합니다.[134]어떤 경우에는 암모니아가 오염물질로 작용하는 해양 환경으로 배출되기도 합니다.사우스오스트레일리아의 와얄라 제철소는 암모니아를 해양수역으로 배출하는 코크스 생산설비의 한 예입니다.[135]
양식업
암모니아 독성은 어류 부화장에서 설명할 수 없는 손실의 원인으로 여겨지고 있습니다.과다한 암모니아는 축적되어 대사의 변화를 일으키거나 노출된 유기체의 체내 pH를 증가시킬 수 있습니다.허용오차는 어종에 따라 다릅니다.[136]0.05 mg/L 정도의 낮은 농도에서 이온화되지 않은 암모니아는 어종에 해로우며 성장 및 사료 전환율 저하, 다산 및 생식력 저하, 스트레스 및 세균 감염 및 질병에 대한 민감성 증가를 초래할 수 있습니다.[137]과도한 암모니아에 노출되면 어류는 평형감각 상실, 극도의 흥분, 호흡활동 증가, 산소 흡수, 심장 박동수 증가 등을 겪을 수 있습니다.[136]암모니아는 2.0 mg/L를 초과하면 아가미와 조직 손상, 극도의 무기력증, 경련, 혼수상태, 사망 등을 유발합니다.[136][138]실험 결과, 다양한 어종의 치사 농도는 0.2에서 2.0 mg/L입니다.[138]
겨울철에는 양식 가축에 사료를 적게 투여하면 암모니아 농도가 높아질 수 있습니다.더 낮은 주변 온도는 조류 광합성의 속도를 감소시켜서 존재하는 조류에 의해 더 적은 암모니아가 제거됩니다.양식 환경, 특히 대규모 양식 환경에서는 암모니아 수치 상승에 대한 신속한 해결책이 없습니다.양식 어류와[138] 주변 환경인 오픈워터 시스템에 대한 피해를 줄이기 위해서는 교정보다는 예방이 권장됩니다.
보관정보
프로판과 유사하게 대기압에서 무수 암모니아는 실온 이하에서 끓게 됩니다.250psi(1.7 MPa)의 저장 용기는 액체를 담기에 적합합니다.[139]암모니아는 탄소 또는 스테인리스 스틸 저장 용기를 필요로 하는 다양한 산업 분야에 사용됩니다.수분 함량이 최소 0.2 중량%인 암모니아는 탄소강에 부식성이 없습니다.0.2 중량% 이상의 물을 사용하는 NH3 탄소강 건설 저장 탱크는 50년 이상 사용할 수 있습니다.[140]전문가들은 위험한 양의 암모니아 가스가 방출될 수 있기 때문에 암모늄 화합물이 염기와 접촉하는 것이 허용되지 않는다고 경고합니다.
실험실.

암모니아 용액의 위험은 농도에 따라 달라집니다. "희석" 암모니아 용액은 보통 5-10 중량%(< 5.62 mol/L)이고, "농축" 용액은 보통 25 중량% 이상으로 제조됩니다.25%(중량) 용액의 밀도는 0.907 g/cm이며3, 밀도가 낮은 용액은 더 농축됩니다.암모니아 용액의 유럽연합 분류는 표에 나와 있습니다.
| 집중 무게(w/w)로 | 몰래리티 | 집중 질량/부피(w/v) | GHS 픽토그램 | H구절 |
|---|---|---|---|---|
| 5–10% | 2.87–5.62 mol/L | 48.9~95.7g/L |  | H314 |
| 10–25% | 5.62–13.29 mol/L | 95.7~226.3g/L |   | H314, H335, H400 |
| >25% | >13.29 mol/L | >226.3g/L |    | H314, H335, H400, H411 |
농축된 암모니아 용액에서 나오는 암모니아 증기는 눈과 호흡기에 심한 자극을 주는데, 전문가들은 이 용액들이 흄후드에서만 취급될 수 있다고 경고합니다.포화 용액("0.880" – #속성 참조)은 따뜻한 날씨에 밀폐된 병 안에서 상당한 압력을 발생시킬 수 있으며, 전문가들은 병을 주의하여 열 것을 경고합니다.일반적으로 25%("0.900") 솔루션에서는 이 문제가 발생하지 않습니다.
전문가들은 암모니아 용액이 독성 및/또는 폭발성 제품이 생성되므로 할로겐과 혼합되지 않도록 경고합니다.전문가들은 또한 암모니아 용액이 은, 수은 또는 요오드화염과 장시간 접촉할 경우 폭발성 제품도 생성될 수 있다고 경고합니다. 이러한 혼합물은 질적 무기 분석에서 종종 형성되며, 테스트가 완료되면 폐기하기 전에 소량 산성화되지만 농축되지 않아야 합니다(<6% w/v).
실험실에서 무수 암모니아(가스 또는 액체) 사용
무수 암모니아는 독성(T)과 환경에 위험(N)으로 분류됩니다.가스는 가연성(자동 점화 온도: 651°C)이며 공기와 폭발성 혼합물(16~25%)을 형성할 수 있습니다.미국의 허용 노출 기준(PEL)은 50ppm(35mg/m3)인 반면 IDLH 농도는 300ppm으로 추정됩니다.암모니아에 반복적으로 노출되면 가스 냄새에 대한 민감도가 낮아집니다. 보통 냄새는 50 ppm 미만의 농도에서 감지할 수 있지만, 둔감한 사람은 100 ppm의 농도에서도 감지할 수 없습니다.무수 암모니아는 구리 및 아연 함유 합금을 부식시키기 때문에 황동 피팅이 가스를 처리하는 데 적합하지 않습니다.액체 암모니아는 또한 고무와 특정 플라스틱을 공격할 수 있습니다.
암모니아는 할로겐과 격렬하게 반응합니다.암모니아가 요오드와 접촉하면 1차 고폭약인 삼요오드화질소가 생성됩니다.암모니아는 에틸렌 옥사이드의 폭발적인 중합을 일으킵니다.그것은 또한 금, 은, 수은, 게르마늄 또는 텔루륨의 화합물과 스티빈과 함께 폭발적인 각성 화합물을 형성합니다.아세트알데히드, 차아염소산염 용액, 페릭야나이드 칼륨, 과산화물 등의 폭력적인 반응도 보고되었습니다.
생산.
기술적인 문제로 인해 그래프를 일시적으로 사용할 수 없습니다. |
암모니아는 어떤 무기 화학물질보다도 가장 높은 생산율을 가지고 있습니다.생산은 때때로 '고정 질소'로 표현됩니다.2020년 전 세계 생산량은 1억 6천만 톤(고정 질소 147톤)으로 추정되었습니다.[142]중국이 26.5%로 가장 많았고 러시아 11.0%, 미국 9.5%, 인도 8.3%[142] 순이었습니다.
제1차 세계 대전이 시작되기 전에, 대부분의 암모니아는 아질산과 아질산염을 수소로 환원하여 증류된 낙타똥을 포함한 질소성 식물성 및 동물성 폐기물을 건식[143] 증류함으로써 얻어졌습니다. 또한, 그것은 석탄의 증류로 생산되었습니다.또한 생석회와 같은 알칼리성 수산화물에[144] 의한 암모늄염의 분해에 의해서도:[22]
소규모 실험실 합성을 위해 요소와 수산화칼슘을 가열할 수 있습니다.
- (NH)CO + Ca(OH) → CaCO + 2 NH
하버보쉬

Haber 공정은 Haber-Bosch 공정이라고도 불리며,[145] 암모니아를 생산하는 주요 산업 공정입니다.[146][147]이것은 발명가인 독일 화학자들의 이름을 따서 지어졌습니다.20세기 첫 10년간 개발한 프리츠 하버와 칼 보쉬.고온, 압력 하에서 금속 촉매를 사용하여 수소(H2)와의 반응에 의해 대기 질소(N2)를 암모니아(NH3)로 변환합니다.이 반응은 약간 발열성이 있으며(즉, 에너지를 방출함), 이는 낮은 온도와[148] 높은 압력에서 반응이 선호된다는 것을 의미합니다.[149]그것은 엔트로피를 감소시켜서 과정을 복잡하게 만듭니다.수소는 증기 개질을 통해 생성되며, 수소와 질소를 반응시켜 암모니아를 생성하는 폐쇄 사이클이 반복됩니다.
주요 반응은 다음과 같습니다.
전기화학
암모니아는 전기화학적으로 합성될 수 있습니다.필요한 유일한 입력은 질소(잠재적 대기) 및 수소(물)의 공급원으로 사용 시점에서 발전이 가능합니다.재생 에너지의 가용성은 배출 제로의 가능성을 만들어 냅니다.[153][154]
또 다른 전기화학적 합성 모드는 양성자 공급원이 주어지면 암모니아로 양성자화될 수 있는 리튬 질화물의 환원 형성을 포함합니다.에탄올은 분해될 수도 있지만 그러한 공급원으로 사용되어 왔습니다.이 화학 물질의 첫 번째 사용은 1930년에 보고되었는데, 에탄올의 리튬 용액을 사용하여 암모니아를 최대 1000 bar의 압력으로 생산했습니다.[155]1994년, 츠네토 외.테트라하이드로퓨란에서 리튬 전착법을 사용하여 암모니아를 적당한 파라다익 효율로 보다 적당한 압력에서 합성하였습니다.[156]다른 연구에서는 에탄올-테트라하이드로퓨란 시스템을 전기화학적 암모니아 합성에 사용했습니다.[157][158]2019년, Lazouski et al. 은 관찰된 암모니아 형성 속도론을 설명하기 위한 메커니즘을 제안했습니다.[157]
2020년, Lazouski 등은 반응성 리튬으로의 질소 수송을 향상시키기 위해 용매에 의존하지 않는 가스 확산 전극을 개발하였습니다.이 연구에서는 주변 온도와 1bar 압력에서 최대 30 ± 5nmol/s/cm의2 NH3 생산 속도와 최대 47.5 ± 4%의 파라다익 효율성을 관찰했습니다.[159]
2021년, Suryanto 등은 에탄올을 테트라알킬 포스포늄염으로 대체하였습니다.이 양이온은 안정적으로 탈양성자화-복양성자화 사이클을 거칠 수 있으며, 매질의 이온전도도를 향상시킵니다.[160]이 연구는 주변 온도에서 0.5-bar 수소 및 19.5-bar 질소 분압 하에서 69 ± 1% 파라다익 효율 실험에서 53 ± 1nmol/s/cm의2 NH3 생산 속도를 관찰했습니다.[160]
생물학적 체계와 인간 질병에서의 역할

암모니아는 대사성 폐기물인 동시에 생물권 전체에 대사적으로 투입됩니다.그것은 생물계의 중요한 질소 공급원입니다.대기 질소가 75% 이상이지만, 대기 질소를 규조류 형태인 N2 가스로 사용할 수 있는 생물체는 거의 없습니다.따라서 단백질의 구성 요소인 아미노산의 합성을 위해서는 질소 고정이 필요합니다.어떤 식물들은 암모니아와 다른 질소성 폐기물들에 의존하며, 부패 물질에 의해 토양에 포함됩니다.질소 고정 콩류와 같은 다른 것들은 대기의 질소로부터 암모니아를 생성하는 근공포증 박테리아와의 공생 관계로부터 이익을 얻습니다.[162]
사람에게 암모니아를 고농도로 흡입하는 것은 치명적일 수 있습니다.암모니아에 노출되면 두통, 부종, 기억력 손상, 발작, 혼수상태를 유발할 수 있습니다.
생합성
특정 생물체에서 암모니아는 질소화효소라고 불리는 효소에 의해 대기 중의 질소로부터 생성됩니다.전체적인 과정을 질소 고정이라고 합니다.생물학적 질소 고정의 메커니즘을 이해하기 위한 집중적인 노력이 있어 왔습니다.이 문제에 대한 과학적 관심은 FeMoS79 앙상블로 구성된 효소의 활성 부위의 특이한 구조에 의해 동기부여됩니다.[164]
암모니아는 또한 글루타메이트 탈수소효소 1과 같은 효소에 의해 촉매되는 아미노산 탈아미노화의 대사 생성물입니다.암모니아 배설은 수생 동물에서 흔히 볼 수 있습니다.사람의 경우, 그것은 (간에 의해) 요소로 빠르게 전환되는데, 이것은 독성이 훨씬 덜하고, 특히 염기성이 덜합니다.이 요소는 소변의 건조한 무게를 구성하는 주요 요소입니다.대부분의 파충류, 조류, 곤충, 달팽이는 요산을 질소성 폐기물로만 배설합니다.
생리학
암모니아는 정상적인 동물생리학과 비정상적인 동물생리학에서 역할을 합니다.정상적인 아미노산 대사를 통해 생합성되며 고농도로 독성이 있습니다.간은 요소 순환이라고 알려진 일련의 반응을 통해 암모니아를 요소로 바꿉니다.간경변증에서 보이는 것과 같은 간 기능 장애는 혈중 암모니아의 양을 증가시킬 수 있습니다.마찬가지로, 오르니틴 트랜스카바밀라아제와 같은 요소 회로를 담당하는 효소의 결함은 고암모니아증을 유발합니다.고암모니아증은 간성뇌증의 혼란과 혼수, 그리고 요소주기결함과 유기산뇨증을 가진 사람들에게 흔한 신경질환의 원인이 됩니다.[165]
암모니아는 정상적인 동물 산/염기 균형에 중요합니다.글루타민으로부터 암모늄이 형성된 후, α-케토글루타르산은 분해되어 2개의 중탄산 이온을 생성할 수 있으며, 이후 식이 산의 완충제로 사용될 수 있습니다.암모늄은 소변으로 배출되어 순산 손실이 발생합니다.암모니아는 자체적으로 신장세관을 가로질러 확산되어 수소 이온과 결합하여 추가적인 산 배설을 허용할 수 있습니다.[166]
배설
암모늄 이온은 동물의 신진대사에서 나오는 독성 폐기물입니다.어류와 수생 무척추동물에서는 물 속으로 직접 배설됩니다.포유류, 상어, 양서류에서는 요소순환에서 요소로 전환되어 독성이 적고 효율적으로 저장할 수 있습니다.조류, 파충류, 그리고 육상 달팽이에서, 대사 암모늄은 고체인 요산으로 전환되고 따라서 최소한의 수분 손실과 함께 배설될 수 있습니다.[167]
비욘드 어스

암모니아는 메탄, 수소, 헬륨과 같은 다른 가스와 함께 목성, 토성, 천왕성, 해왕성의 대기에서 발견되었습니다.토성의 내부는 얼은 암모니아 결정을 포함할지도 모릅니다.[168]화성의 두 위성인 데이모스와 포보스에서 발견됩니다.
성간 공간
암모니아는 은하핵 방향에서 나오는 마이크로파 방출에 근거하여 1968년에 성간 공간에서 처음으로 발견되었습니다.[169]이것은 그렇게 발견된 최초의 다원자 분자였습니다.광범위한 여기에 대한 분자의 민감도와 여러 영역에서 관찰할 수 있는 용이성은 암모니아를 분자 구름 연구에 가장 중요한 분자 중 하나로 만들었습니다.[170]암모니아 라인의 상대적인 강도는 방출 매체의 온도를 측정하는 데 사용될 수 있습니다.
암모니아의3 동위원소 종류는3 NH2, NH, NHD, NHD2, ND3 등이 검출되었습니다.삼중중수소 암모니아의 검출은 중수소가 상대적으로 부족하기 때문에 놀라운 것으로 여겨졌습니다.저온 조건이 이 분자를 생존시키고 축적하게 해준다고 생각됩니다.[171]
성간 발견 이후, NH는3 성간매질의 연구에 있어서 매우 귀중한 분광 도구임이 증명되었습니다.광범위한 여기 조건에 민감한 많은 수의 전이로 NH는3 천문학적으로 광범위하게 감지되었으며, 수백 개의 저널 기사에 그 감지가 보고되었습니다.다음은 암모니아를 식별하는 데 사용된 검출기의 범위를 강조하는 저널 기사의 샘플입니다.
성간 암모니아에 대한 연구는 지난 수십 년간 많은 연구 분야에서 중요한 역할을 해왔습니다.이 중 일부는 아래에서 설명하며 주로 암모니아를 성간 온도계로 사용하는 것을 포함합니다.
성간 형성 메커니즘
암모니아의 성간부존량은 다양한 환경에서 측정되어 왔습니다.[NH3]/[H2] 비율은 작은 먹구름에서[172] 10에서−7 오리온 분자 구름 복합체의 밀도 높은 중심핵에서 10−5 사이로 추정됩니다.[173]총 18개의 총 생산 경로가 제안되었지만,[174] 성간 NH의3 주요 형성 메커니즘은 다음과 같습니다.
- [NH] + e → NH + H
이 반응의 속도 상수 k는 환경의 온도에 따라 달라지며, 10 K에서 5.2 x 10의−6 값을 갖습니다.[175]속도 상수는 식 = (T ) k = a (/ 로부터 계산하였으며 1차 생성 반응의 경우 a = 1.05 x 10, B = -0.47입니다.NH+4 함량이 3×10이고−7 전형적인 분자 구름의 전자 함량이 10이라고−7 가정하면, 형성은 총 밀도 105 cm의−3 분자 구름에서 1.6×10−9 cm의−3−1 속도로 진행될 것입니다.[176]
제안된 다른 모든 형성 반응은 2에서 13배 사이의 속도 상수를 가지고 있어 암모니아의 풍부함에 대한 기여가 상대적으로 미미합니다.[177]다른 형성 반응의 작은 기여의 예로, 반응은 다음과 같습니다.
- H + NH → NH + H
는 2.2×10의−15 속도 상수를 갖습니다.H2 밀도가 10이고5 [NH2]/[H2] 비율이 10이라고−7 가정하면, 이 반응은 위의 1차 반응보다 3배 이상 느린 2.2×10의−12 속도로 진행됩니다.
그 밖에 발생 가능한 형성 반응은 다음과 같습니다.
- H + [NH] → NH + H
- [PNH] + e → P + NH
성간 파괴 메커니즘
NH의3 파괴로 이어지는 총 113개의 제안된 반응들이 있습니다. 이 중 39개는 C, N, O 화합물들 사이의 화학에 대한 광범위한 표들로 표화되었습니다.[178]성간 암모니아에 대한 검토는 주요 해리 메커니즘으로 다음과 같은 반응을 언급합니다.[170]
- NH + [H] → [NH] + H
(1)
- NH + HCO → [NH] + CO
(2)
각각 [180]4.39×10−9[179] 및 2.2×10의−9 레이트 상수를 갖는.위의 식 (1, 2)는 각각 8.8×10−9 및 4.4×10의−13 속도로 실행됩니다.이러한 계산은 [NH]/[H] = 10, [[H]]/[H] = 2×10, [HCO]/[H] = 2×10의 주어진 속도 상수와 풍부함, 일반적으로 차갑고 밀도가 높은 분자 구름을 가정했습니다.분명히, 이 두 가지 1차 반응 사이에서 식 (1)이 지배적인 파괴 반응이며, 속도는 식 (2)보다 10,000배 더 빠릅니다.이것은 [H3]의 상대적으로 높은 풍부함 때문입니다.+
단일 안테나 검출
Effelsberg 100 m 전파 망원경에서 NH를3 관측한 결과 암모니아 라인은 배경 능선과 분해되지 않은 중심핵의 두 가지 구성 요소로 분리되어 있습니다.배경은 이전에 CO가 검출된 위치와 잘 일치합니다.[182]영국의 25m 칠볼턴 망원경은 HII 지역, HNHO2 마스터, H-H 물체 및 별 형성과 관련된 다른 물체에서 암모니아의 무선 신호를 감지했습니다.방출선 폭을 비교하면 분자 구름의 중심 코어에서 난류 또는 계통 속도가 증가하지 않음을 알 수 있습니다.[183]
암모니아로부터의 마이크로파 방사는 W3(OH), 오리온 A, W43, W51 및 은하 중심의 다섯 개의 소스를 포함한 여러 은하계 물체에서 관측되었습니다.높은 탐지율은 이것이 성간매질에서 흔한 분자이고 고밀도 영역이 은하에서 흔하다는 것을 나타냅니다.[184]
간섭계 연구
고속 가스 유출이 발생한 7개 지역의3 NH에 대한 VLA 관측 결과 L1551, S140, Cepheus A에서 0.1pc 미만의 응축이 확인되었습니다.세페우스 A에서 세 개의 개별 결로가 발견되었는데, 그 중 하나는 매우 길쭉한 모양을 하고 있습니다.그들은 그 지역에서 양극성 유출을 일으키는 데 중요한 역할을 할지도 모릅니다.[185]
은하계외 암모니아는 IC 342의 VLA를 이용하여 영상화하였습니다.뜨거운 가스는 70K 이상의 온도를 가지고 있는데, 이는 암모니아 라인 비율로부터 추론한 것이며 CO에서 볼 수 있는 핵막대의 가장 안쪽 부분과 밀접한 관련이 있는 것으로 보입니다.[186]NH는3 또한 VLA에 의해 G9.62+0.19, G10.47+0.03, G29.96-0.02, G31.41+0.31의 4개 은하 초소형 HII 영역 샘플을 향해 모니터링되었습니다.온도와 밀도 진단에 근거하여, 일반적으로 이러한 덩어리는 초소형 HII 영역이 발달하기 전 초기 진화 단계에서 거대한 별 형성의 장소일 것이라고 결론지었습니다.[187]
적외선 감지
Becklin-Neugebauer 천체와 NGC 2264-IR에서도 고체 암모니아에 의한 2.97 마이크로미터에서의 흡수가 기록되었습니다.이 감지는 이전에 잘 이해되지 않은 얼음 흡수선의 물리적인 형태와 관련된 얼음 흡수선을 설명하는 데 도움이 되었습니다.[188]
목성 원반의 스펙트럼은 카이퍼 공중천문대에서 얻었으며, 100에서 300 cm 스펙트럼−1 범위를 포함하고 있습니다.스펙트럼 분석은 암모니아 가스와 암모니아 얼음 연무의 지구 평균 특성에 대한 정보를 제공합니다.[189]
NH의 (J,K) = (1,1) 회전 반전선을 이용하여 총 149개의 암운 위치에서 "dense 코어"의 증거를 조사하였으며, 일반적으로 코어는 구형이 아니며, 종횡비는 1.1~4.4입니다.또한 별이 있는 코어는 별이 없는 코어보다 더 넓은 선을 가지고 있다는 것이 발견되었습니다.[190]
암모니아는 드레이코 성운과 고위도 은하 적외선 원과 관련된 하나 또는 두 개의 분자 구름에서 발견되었습니다.이 발견은 은하 원반에서 생성될 수 있었던 은하 헤일로에 있는 모집단 I 금속성 B형 별의 탄생지를 나타낼 수 있기 때문에 중요합니다.[191]
주변 먹구름 관측
자발 방출과 균형을 이루고 자극된 방출을 통해 여기 온도와 밀도 사이의 관계를 형성할 수 있습니다.또한 암모니아의 과도 수준은 저온에서 2-레벨 시스템에 의해 근사화될 수 있기 때문에 이 계산은 상당히 간단합니다.이 전제는 매우 낮은 온도를 가진 것으로 의심되는 지역과 미래의 별 형성을 위한 장소인 먹구름에 적용될 수 있습니다.암운에서 암모니아를 탐지한 결과 매우 좁은 선이 발견되었는데, 이는 낮은 온도뿐만 아니라 낮은 수준의 내부 구름 난류를 나타낸 것입니다.선비 계산은 이전의 CO 관측치와는 독립적인 구름 온도 측정을 제공합니다.암모니아 관측치는 ≈10 K의 회전 온도에 대한 CO 측정치와 일치했습니다.이를 통해 밀도를 측정할 수 있으며, 먹구름에서 10에서4 10cm5 사이의−3 범위로 계산되었습니다.NH의3 매핑은 0.1 pc의 일반적인 구름 크기와 1 태양 질량에 가까운 질량을 제공합니다.이 차갑고 밀도가 높은 중심핵들은 미래의 별 형성의 장소입니다.
UC HII 지역
초소형 HII 영역은 고질량 별 형성의 가장 좋은 추적자 중 하나입니다.UCHII 영역을 둘러싼 밀도 높은 물질은 주로 분자일 가능성이 높습니다.거대한 별의 형성에 대한 완전한 연구는 반드시 별이 형성된 구름을 포함하기 때문에 암모니아는 주변 분자 물질을 이해하는 데 매우 귀중한 도구입니다.이 분자 물질은 공간적으로 분해될 수 있기 때문에 가열/이온화 소스, 온도, 질량 및 영역의 크기를 제한할 수 있습니다.도플러 이동 속도 성분은 별을 형성하는 것에서 유래한 뜨거운 중심핵과 유출을 추적할 수 있는 분자 가스의 뚜렷한 영역을 분리할 수 있게 해줍니다.
은하계외탐지
외부 은하에서 암모니아가 검출됐고,[192][193] 여러 선을 동시에 측정하면 이들 은하의 가스 온도를 직접 측정할 수 있습니다.선비는 가스 온도가 따뜻하다는 것을 의미하며( ≈50K), 수십 pc 크기의 밀도 높은 구름에서 비롯됩니다.이 그림은 우리 은하 내의 그림과 일치합니다. 뜨거운 밀도의 분자 코어는 수백 pc 크기의 분자 물질의 더 큰 구름에 박혀 있는 새로 형성되는 별 주위에 형성됩니다.
참고 항목
- 암모니아 (자료페이지) – Chemical data 페이지
- 암모니아분수 – 화학시범 유형
- 암모니아 생산 – NH 생산3 이력 및 방법 개요
- 암모니아 용액 – 화학 화합물
- 발전원별 전기요금 – 발전원별 전기요금 비교
- 형성 가스 – 수소와 질소의 혼합물
- Haber process – 암모니아 생성의 주요 프로세스
- 하이드라진 – 암모니아와 같은 냄새가 나는 무색의 인화성 액체
- 정수 – 물속의 불순물을 제거하는 과정
메모들
참고문헌
- ^ "NOMENCLATURE OF INORGANIC CHEMISTRY IUPAC Recommendations 2005" (PDF). Archived (PDF) from the original on 9 October 2022.
- ^ "Gases – Densities". Retrieved 3 March 2016.
- ^ Yost, Don M. (2007). "Ammonia and Liquid Ammonia Solutions". Systematic Inorganic Chemistry. READ BOOKS. p. 132. ISBN 978-1-4067-7302-6.
- ^ Blum, Alexander (1975). "On crystalline character of transparent solid ammonia". Radiation Effects and Defects in Solids. 24 (4): 277. Bibcode:1975RadEf..24..277B. doi:10.1080/00337577508240819.
- ^ Budavari, Susan, ed. (1996). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (12th ed.). Merck. ISBN 978-0-911910-12-4.
- ^ Perrin, D. D., 수용액 중 무기산과 염기의 이온화 상수; 제2판, Pergamon Press: Oxford, 1982.
- ^ Iwasaki, Hiroji; Takahashi, Mitsuo (1968). "Studies on the transport properties of fluids at high pressure". The Review of Physical Chemistry of Japan. 38 (1).
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ a b "Ammonia". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ 시그마-알드리치 컴퍼니, 암모니아
- ^ NIOSH Pocket Guide to Chemical Hazards. "#0028". National Institute for Occupational Safety and Health (NIOSH).
- ^ Ritchie, Hannah. "How many people does synthetic fertilizer feed?". Our World in Data. Retrieved 4 September 2021.
- ^ "Ammonia Technology Roadmap – Analysis".
- ^ "40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities". Government Printing Office.
- ^ "Global ammonia annual production capacity".
- ^ "Mitsubishi Heavy Industries BrandVoice: Scaling Ammonia Production for the World's Food Supply". Forbes.
- ^ R. Norris Shreve; Joseph Brink (1977). Chemical Process Industries (4th ed.). McGraw-Hill. p. 276. ISBN 978-0-07-057145-7. 가스 운반선 및 병에 든 가스도 참조하십시오.
- ^ "Ammonium hydroxide physical properties" (PDF). Archived from the original (PDF) on 27 November 2007.
- ^ "Pliny the Elder, The Natural History, BOOK XXXI. REMEDIES DERIVED FROM THE AQUATIC PRODUCTION, CHAP. 39. (7.)—THE VARIOUS KINDS OF SALT; THE METHODS OF PREPARING IT, AND THE REMEDIES DERIVED FROM IT. TWO HUNDRED AND FOUR OBSERVATIONS THERE UPON". www.perseus.tufts.edu.
- ^ Hoover, Herbert (1950). Georgius Agricola De Re Metallica - Translated from the first Latin edition of 1556. New York: Dover Publications. p. 560. ISBN 978-0486600062.
- ^ "Siwa, Egypt".
- ^ a b c d e f g h Chisholm 1911, 페이지 861.
- ^ Shannon, Francis Patrick (1938) 아쿠아-암모니아 용액의 특성에 대한 표 흡수냉동의 열역학 제1부리하이 대학에서 공부합니다.과학기술 시리즈
- ^ 암모니아-물 슬러리가 명왕성의 얼음 표면 아래에서 빙빙 돌 수 있습니다.퍼듀 대학교 (2015년 11월 9일)
- ^ Pimputkar, Siddha; Nakamura, Shuji (January 2016). "Decomposition of supercritical ammonia and modeling of supercritical ammonia–nitrogen–hydrogen solutions with applicability toward ammonothermal conditions". The Journal of Supercritical Fluids. 107: 17–30. doi:10.1016/j.supflu.2015.07.032.
- ^ Hewat, A. W.; Riekel, C. (1979). "The crystal structure of deuteroammonia between 2 and 180 K by neutron powder profile refinement". Acta Crystallographica Section A. 35 (4): 569. Bibcode:1979AcCrA..35..569H. doi:10.1107/S0567739479001340.
- ^ White, Alfred H.; Melville, Wm. (April 1905). "The Decomposition of Ammonia at High Temperatures". Journal of the American Chemical Society. 27 (4): 373–386. doi:10.1021/ja01982a005. ISSN 0002-7863.
- ^ a b c Neufeld, R.; Michel, R.; Herbst-Irmer, R.; Schöne, R.; Stalke, D. (2016). "Introducing a Hydrogen-Bond Donor into a Weakly Nucleophilic Brønsted Base: Alkali Metal Hexamethyldisilazides (MHMDS, M = Li, Na, K, Rb and Cs) with Ammonia". Chem. Eur. J. 22 (35): 12340–12346. doi:10.1002/chem.201600833. PMID 27457218.
- ^ a b c Combellas, C; Kanoufi, F; Thiébault, A (2001). "Solutions of solvated electrons in liquid ammonia". Journal of Electroanalytical Chemistry. 499: 144–151. doi:10.1016/S0022-0728(00)00504-0.
- ^ a b Haynes, William M., ed. (2013). CRC Handbook of Chemistry and Physics (94th ed.). CRC Press. pp. 9–26. ISBN 9781466571143.
- ^ Cleeton, C. E.; Williams, N. H. (1934). "Electromagnetic Waves of 1.1 cm (0 in). Wave-Length and the Absorption Spectrum of Ammonia". Physical Review. 45 (4): 234. Bibcode:1934PhRv...45..234C. doi:10.1103/PhysRev.45.234.
- ^ a b c Chisholm 1911, 페이지 862.
- ^ Baker, H. B. (1894). "Influence of moisture on chemical change". J. Chem. Soc. 65: 611–624. doi:10.1039/CT8946500611.
- ^ "Ammonia". PubChem.
- ^ Kobayashi, Hideaki; Hayakawa, Akihiro; Somarathne, K.D. Kunkuma A.; Okafor, Ekenechukwu C. (2019). "Science and technology of ammonia combustion". Proceedings of the Combustion Institute. 37: 109–133. doi:10.1016/j.proci.2018.09.029.
- ^ Khan, A.S.; Kelley, R.D.; Chapman, K.S.; Fenton, D.L. (1995). Flammability limits of ammonia-air mixtures. U.S.: U.S. DOE Office of Scientific and Technical Information. OSTI 215703.
- ^ Shrestha, Krishna P.; Seidel, Lars; Zeuch, Thomas; Mauss, Fabian (7 July 2018). "Detailed kinetic mechanism for the oxidation of ammonia including the formation and reduction of nitrogen oxides" (PDF). Energy & Fuels. 32 (10): 10202–10217. doi:10.1021/acs.energyfuels.8b01056. ISSN 0887-0624. S2CID 103854263. Archived (PDF) from the original on 9 October 2022.
- ^ Sterrett, K. F.; Caron, A. P. (1966). "High pressure chemistry of hydrogenous fuels". Northrop Space Labs. Archived from the original on 23 August 2011. Retrieved 24 December 2009.
- ^ 로렌스, C. 그리고 갈, J-F.Lewis Basicity and Affinity Scales, Data and Measurement, (Wiley 2010) pp 50-51 ISBN 978-0-470-74957-9
- ^ Cramer, R. E.; Bopp, T. T. (1977). "Graphical display of the enthalpies of adduct formation for Lewis acids and bases". Journal of Chemical Education. 54: 612–613. doi:10.1021/ed054p612. 이 문서에 표시된 그림은 오래된 모수를 사용했습니다.ECW 모델에는 개선된 E&C 파라미터가 나열되어 있습니다.
- ^ a b Chisholm 1911, 페이지 863.
- ^ (OSHA) 출처: Sax, N. Irving (1984) 산업 재료의 위험 특성6판반 노스트랜드 라인홀드.ISBN 0-442-28304-0.
- ^ Hurtado, J. L. Martinez; Lowe, C. R. (2014). "Ammonia-Sensitive Photonic Structures Fabricated in Nafion Membranes by Laser Ablation". ACS Applied Materials & Interfaces. 6 (11): 8903–8908. doi:10.1021/am5016588. ISSN 1944-8244. PMID 24803236.
- ^ 헤로도토스와 조지 롤린슨, 트랜스,헤로도토스의 역사(New York, New York: Tandy-Thomas Co., 1909), vol.2, 4권, § 181, pp. 304-305
- ^ 헤로도토스의 역사와 파우사니아스의 그리스 묘사에서 암몬인의 땅이 언급되고 있습니다.
- 헤로도토스와 조지 롤린슨, 트랜스,헤로도토스의 역사(뉴욕, 뉴욕: 탠디-토마스 주식회사, 1909), vol. 1, book 2, § 42, p. 245, vol. 2, book 3, § 25, p. 73, vol. 2, book 3, § 26, p. 74
- Pausanias with W.H.S. Jones, trans., 그리스 설명(런던, 영국:William Heinemann Ltd., 1979), vol. 2, book 3, Ch. 18, § 3, pp. 109 및 111 및 vol. 4, book 9, Ch. 16, § 1, p. 239.
- ^ Kopp, Hermann, Geschichte der Chemie [화학의 역사] (Braunschweig, (독일):Friedrich Viewegund Son, 1845), Part 3, p. 237. [독일어]
- ^ Chisholm 1911은 Pliny Nat을 인용합니다. 히스토리 xxxxi 39.참조: Pliny the Elder with John Bostock and H. T. Riley, ed.s, 자연사 (영국 런던: H. G. Bonh, 1857), vol. 5, 31권, § 39, p. 502.
- ^ "Sal-ammoniac". Webmineral. Retrieved 7 July 2009.
- ^ 플리니는 또한 나트론으로 알려진 것의 일부 샘플(라틴어: 니트룸, 불순한 탄산나트륨)을 석회(탄산칼슘)와 물로 처리했을 때 나트론이 자극적인 냄새를 내뿜을 것이라고 언급했는데, 일부 저자들은 나트론이 염화암모늄이거나 그것에 오염되었다는 것을 의미한다고 해석했습니다.참조:
- W.H.S. 존스와 함께하는 플리니, 자연사(런던, 영국:William Heinemann Ltd., 1963), vol. 8, 31권, § 46, pp. 448-449448-449쪽: "애굽에서 칼세, 디펜디투르 구스투르. sincerum enim statim resolvitur, adultatum calce pungit et asperum [또는 aspersum] dreddit odorem diever." (이집트에서는 맛으로 감지되는 석회와 혼입됩니다. 순수한 나트론은 단번에 녹지만, 혼입된 나트론은 석회 때문에 따가워지고, 강한 냄새를 내뿜기 때문입니다.쓴 냄새[또는: 물을 뿌리면 격렬한 냄새가 납니다].]
- 키드, 존, 광물학의 개요 (영국 옥스포드: N. 블리스, 1809), vol. 2, p. 6.
- 무어, 나다니엘 피쉬, 고대 광물학: 또는, 고대인들이 언급한 광물 물질에 대한 탐구: ... (뉴욕, 뉴욕: G. & C. Carvill & Co., 1834), 96-97쪽.
- ^ 참조:
- Forbes, R.J., 고대 기술에 관한 연구, vol. 5, 2ed. (Leiden, 네덜란드: E.J. Brill, 1966), pp. 19, 48, 65.
- 몰러, 월터 O., 고대 폼페이 양모 무역 (네덜란드 레이덴: E.J. Brill, 1976), p. 20.
- Faber, G.A. (가명: Goldschmidt, Günder) (1938년 5월) "고대 고대의 염색과 태닝", Ciba Review, 9:277–312.제공처: 엘리자베스 코스튬
- 스미스, 윌리엄, 그리스 로마 유물 사전(영국 런던: John Murray, 1875), 기사: "Fullo" (즉, 풀러 또는 세탁기), pp. 551-553.
- 루셋, 앙리 (1917년 3월 31일) "고대인들의 빨래", 사이언티픽 아메리칸 보충제, 83 (2152): 197
- 본드, 사라 E., 무역과 금기: 로마 지중해에서 평판이 좋지 않은 직업들 (미시간주 앤아버:미시간 대학교 출판부, 2016), p. 112.
- Binz, Arthur (1936) "Altes und Neues über die technologyche Verwendung des Harnes" (소변의 기술적 사용에 관한 고대 및 현대의 [정보]), Zeitschrift für Angewandte Chemie, 49 (23): 355-360[독일어로]
- 위트, Michael (2016년 12월) "고대 로마 소변 화학", Acta Archoologica, 87 (1) : 179–191위트는 로마인들이 몇 시간 동안 발효시킨 소변에 나무회분(불순탄산칼륨)을 넣어 농축된 형태의 암모니아를 얻었다고 추측했습니다.따라서 스트루바이트(인산 마그네슘 암모늄)가 침전되고, 바닷물에서 소금을 만드는 부산물인 마그네슘이 풍부한 용액인 쓴맛을 용액으로 처리함으로써 스트루바이트의 산출량이 증가할 수 있습니다.스트루바이트를 구우면 암모니아 증기가 방출됩니다.
- ^ Lenkeit, Roberta Edwards (23 October 2018). High Heels and Bound Feet: And Other Essays on Everyday Anthropology, Second Edition. Waveland Press. p. 72. ISBN 978-1-4786-3841-4.
- ^ Perdigão, Jorge (3 August 2016). Tooth Whitening: An Evidence-Based Perspective. Springer. p. 170. ISBN 978-3-319-38849-6.
- ^ Bonitz, Michael; Lopez, Jose; Becker, Kurt; Thomsen, Hauke (9 April 2014). Complex Plasmas: Scientific Challenges and Technological Opportunities. Springer Science & Business Media. p. 465. ISBN 978-3-319-05437-7.
- ^ Haq, Syed Nomanul (1995). Names, Natures and Things: The Alchemist Jabir Ibn Hayyan and His Kitab Al-Ahjar (Book of Stones). Springer. ISBN 978-0-7923-3254-1.
- ^ 스피리투스 살리수린 æ(소변의 염정, 즉 탄산암모늄)은 발렌티누스 이전에 만들어진 것으로 보이지만, 그는 그의 책에서 그것을 준비하기 위한 새롭고 간단한 방법을 제시했습니다.발렌티누스, 바실리우스, Vier Tractätlein Fr. 바실리 발렌티니...[바질 발렌타인 형제의 에세이 4편 ... ] (프랑크푸르트암 마인, (독일):Luca Jennis, 1625), "Supplementum moder Zugabe"(보충 또는 부록), pp. 80-81: "Der Wegzum Universal, damit die drei Stein zusammen kommen"(우주로 가는 길, 세 개의 돌이 모이도록).p.81:"Der Spiritus Salis Urin æ nimbt langes wesen zubereiten / dieser process ß ß 수베르스트 wa leichter und näher au ß dem Salz von Armenia, ... Nun nimb sauberen schönen Armenischen Salzarmoniac ohnalles sublimiren / thueihnin ein Kolben / giesein Olum Tartari drauff / da ß es wiein Mu ß oder Breywerde / vermachs baldt / dafür thucheing grosen vorlag / solege schichals balder Spiritus Salis Urin æ Helman Crystallisch ..." (소변의 염 정신[탄산암모늄]은 준비하는 데 긴 방법[절차]을 필요로 하지만, 아르메니아의 염[염화암모늄]으로부터 시작하는 [발렌타인] 과정은 다소 쉽고 짧습니다...이제 깨끗한 아르메니아 소금을 채취하고, 그 모든 것을 승화시키지 않고, 그것을 [증류] 플라스크에 넣습니다. 그 위에 타르타르 기름을 붓습니다 [즉, 공기에서 흡수한 물에만 용해된 탄산 칼륨]. 그것을 [즉, 혼합물]이 머쉬나 페이스트처럼 되도록 합니다. 조립합니다 [즉, 증류 장치 (알렘빅)] quiickly; 이를 위해 [목적] 큰 수용 플라스크를 연결하고, 곧 소변 염분이 "helmet"에 결정체로 침전되는[즉, 증류 플라스크 상단에 있는 증기의 배출구]...)
참고 항목: Kopp, Hermann, Geschichte der Chemie [화학의 역사] (Braunschweig, (독일)):Friedrich Viewegund Son, 1845), Part 3, p. 243. [독일어] - ^ Maurice P. Crosland (2004). Historical Studies in the Language of Chemistry. Courier Dover Publications. p. 72. ISBN 978-0-486-43802-3.
- ^ Black, Joseph (1893) [1755]. Experiments upon magnesia alba, quick-lime, and other alcaline substances. Edinburgh: W.F. Clay.
- ^ Jacobson, Mark Z. (23 April 2012). Air Pollution and Global Warming: History, Science, and Solutions. Cambridge University Press. ISBN 9781107691155.
- ^ "Woulfe's bottle". Chemistry World. Retrieved 1 July 2017.
- ^ Woulfe, Peter (1 January 1767). "Experiments on the Distillation of Acids, Volatile Alkalies, &c. Shewing How They May be Condensed without Loss, and How Thereby We May Avoid Disagreeable and Noxious Fumes: In a Letter from Mr. Peter Woulfe, F. R. S. to John Ellis, Esq; F. R. S." Philosophical Transactions. 57: 517–536. Bibcode:1767RSPT...57..517W. doi:10.1098/rstl.1767.0052. ISSN 0261-0523.
- ^ Pictorial life history of the apothecary chemist Carl Wilhelm Scheele. American Institute of the History of Pharmacy. 1942. hdl:1811/28946/Pictorial%20Life%20History_Scheele.pdf.
- ^ 참조:
- 프리스틀리, 조셉(1773) "Extrait dune llette de M. Priestley, endate du 1773"(프리스틀리 씨가 보낸 편지 발췌, 1773년 10월 14일자), 관찰 sur la 피지크..., 2:389.
- Priestley, Joseph, 다양한 공기 종류에 대한 실험과 관찰, vol. 1, 2d. (영국 런던: 1775), 2부, § 1: 알칼라인 공기에 대한 관찰, pp. 163-177.
- 스코필드, 로버트 E., 계몽된 조셉 프리스틀리: 1773년부터 1804년까지 그의 삶과 일에 관한 연구 (펜실베니아 유니버시티 파크:펜실베니아 주립대학 출판부, 2004), 93-94쪽.
- 1775년까지 프리스틀리는 전기가 암모니아를 분해하여 인화성 가스(수소)를 생성할 수 있다는 것을 발견했습니다.참고: Priestley, Joseph, 다양한 종류의 공기에 대한 실험과 관찰, vol. 2 (영국 런던: J. Johnson, 1775), 239-240쪽.
- ^ 베르톨레 (1785) "알칼리 휘발유 분석" (휘발성 알칼리 분석), Memoires de l'Académie Royale des Sciences, 316–326.
- ^ a b Max Appl (2006). "Ammonia". Ammonia, in Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_143.pub2. ISBN 978-3527306732.
- ^ Smith, Roland (2001). Conquering Chemistry. Sydney: McGraw-Hill. ISBN 978-0-07-470146-1.
- ^ Edwin M. Kaiser (2001). "Calcium–Ammonia". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rc003. ISBN 978-0471936237.
- ^ "Mineral Commodity Summaries 2020, p. 117 – Nitrogen" (PDF). USGS. 2020. Archived (PDF) from the original on 9 October 2022. Retrieved 12 February 2020.
- ^ Lassaletta, Luis; Billen, Gilles; Grizzetti, Bruna; Anglade, Juliette; Garnier, Josette (2014). "50-year trends in nitrogen use efficiency of world cropping systems: the relationship between yield and nitrogen input to cropland". Environmental Research Letters. 9 (10): 105011. Bibcode:2014ERL.....9j5011L. doi:10.1088/1748-9326/9/10/105011. ISSN 1748-9326.
- ^ David Brown (18 April 2013). "Anhydrous ammonia fertilizer: abundant, important, hazardous". Washington Post. Retrieved 23 April 2013.
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ "The Facts About Ammonia". www.health.ny.gov. Retrieved 6 April 2018.
- ^ "OSHA Hazard Communication Standard: Safety Data Sheets" (PDF). OSHA. Archived (PDF) from the original on 9 October 2022.
- ^ Rizk-Ouaini, Rosette; Ferriol, Michel; Gazet, Josette; Saugier-Cohen Adad; Marie Therese (2006). Oxidation reaction of ammonia with sodium hypochlorite. Production and degradation reactions of chloramines. p. 512. doi:10.1002/14356007.a02_143.pub2. ISBN 978-3527306732.
{{cite book}}:journal=무시됨(도움말) - ^ Barry, Keith. "How To Clean Your Car's Interior". Consumer Reports. Retrieved 31 January 2021.
- ^ "Applications of Anhydrous Ammonia and Aqueous Ammonia". www.mysoreammonia.com. Retrieved 2 February 2022.
- ^ Samuel Rideal (1895). Disinfection and Disinfectants: An Introduction to the Study of. London: Charles Griffin and Company. p. 109.
- ^ Tajkarimi, Mehrdad; Riemann, H. P.; Hajmeer, M. N.; Gomez, E. L.; Razavilar, V.; Cliver, D. O.; et al. (2008). "Ammonia disinfection of animal feeds – Laboratory study". International Journal of Food Microbiology. 122 (1–2): 23–28. doi:10.1016/j.ijfoodmicro.2007.11.040. PMID 18155794.
- ^ Kim, J. S.; Lee, Y. Y.; Kim, T. H. (January 2016). "A review on alkaline pretreatment technology for bioconversion of lignocellulosic biomass". Bioresource Technology. 199: 42–48. doi:10.1016/j.biortech.2015.08.085. PMID 26341010.
- ^ "질감쇠고기의 박테리아 감소를 위한 처리방법 평가", Jensen, Jean L et al., 미국농생물공학회 2009년 연례회의
- ^ 참조 문서: 쇠고기, 돈나 윙클러와 케리 B를 위한 항균제 개입.Harris, 식품안전센터, Texas A&M University 동물과학부, 2009년 5월
- ^ Moss, Michael (3 October 2009). "The Burger That Shattered Her Life". The New York Times.
- ^ Moss, Michael (31 December 2009). "Safety of Beef Processing Method Is Questioned". The New York Times.
- ^ a b c Lan, Rong; Tao, Shanwen (28 August 2014). "Ammonia as a suitable fuel for fuel cells". Frontiers in Energy Research. 2: 35. doi:10.3389/fenrg.2014.00035.
- ^ Giddey, S.; Badwal, S. P. S.; Munnings, C.; Dolan, M. (10 October 2017). "Ammonia as a Renewable Energy Transportation Media". ACS Sustainable Chemistry & Engineering. 5 (11): 10231–10239. doi:10.1021/acssuschemeng.7b02219.
- ^ Afif, Ahmed; Radenahmad, Nikdilila; Cheok, Quentin; Shams, Shahriar; Hyun Kim, Jung; Azad, Abul (12 February 2016). "Ammonia-fed fuel cells: a comprehensive review". Renewable and Sustainable Energy Reviews. 60: 822–835. doi:10.1016/j.rser.2016.01.120. Retrieved 1 January 2021.
- ^ David, William I. F.; Makepeace, Joshua W.; Callear, Samantha K.; Hunter, Hazel M. A.; Taylor, James D.; Wood, Thomas J.; Jones, Martin O. (24 September 2014). "Hydrogen Production from Ammonia Using Sodium Amide". Journal of the American Chemical Society. 136 (38): 13082–13085. doi:10.1021/ja5042836. ISSN 0002-7863. PMID 24972299.
- ^ Lucentini, Ilaria; García Colli, Germán; Luzi, Carlos D.; Serrano, Isabel; Martínez, Osvaldo M.; Llorca, Jordi (5 June 2021). "Catalytic ammonia decomposition over Ni-Ru supported on CeO2 for hydrogen production: Effect of metal loading and kinetic analysis". Applied Catalysis B: Environmental. 286: 119896. doi:10.1016/j.apcatb.2021.119896. ISSN 0926-3373. S2CID 233540470.
- ^ Douglas Self (1 October 2007). "Ammonia Motors". Retrieved 28 November 2010.
- ^ Louis C. Hennick; Elbridge Harper Charlton (1965). The Streetcars of New Orleans. Pelican Publishing. pp. 14–16. ISBN 9781455612598.
- ^ a b "Ammonia as a Transportation Fuel IV" (PDF). Norm Olson – Iowa Energy Center. 15–16 October 2007. Archived from the original (PDF) on 7 February 2012.
- ^ Lee, Dongeun; Min, Hyungeun; Park, Hyunho; Song, Han Ho (1 November 2017). "Development of new combustion strategy for internal combustion engine fueled by pure ammonia" (PDF). Seoul National University, Department of Mechanical Engineering. Archived (PDF) from the original on 9 October 2022. Retrieved 29 January 2019.
- ^ Brohi, Emtiaz Ali (2014). "Ammonia as fuel for internal combustion engines?" (PDF). Chalmers University of Technology. Archived (PDF) from the original on 9 October 2022. Retrieved 29 January 2019.
- ^ Elucidare (2 February 2008). "Ammonia: New possibilities for hydrogen storage and transportation" (PDF). Elucidare Limited. Archived (PDF) from the original on 8 October 2010.
- ^ "Ammonia". chm.bris.ac.uk. Retrieved 3 March 2016.
- ^ Zacharakis-Jutz, George; Kong, Song-Charng (2013). "Characteristics of an SI Engine Using Direct Ammonia Injection" (PDF). Department of Mechanical Engineering, Iowa State University. Archived (PDF) from the original on 9 October 2022. Retrieved 29 January 2019.
- ^ "Green ammonia Royal Society". royalsociety.org.
- ^ 유투브에 올라온 암모니아 동력 자동차
- ^ "Watch 'Ammonia Fuel'". Greg Vezina. Retrieved 7 July 2009.
- ^ "Welcome to NH3 Car". NH3Car.com.
- ^ Lindzon, Jared (27 February 2019). "He's Creating a New Fuel Out of Thin Air – for 85 Cents per Gallon". OZY. Retrieved 26 April 2019.
- ^ '무탄소 연료': 호주 수소차 돌파구, 렉시 해밀턴-스미스, ABC 뉴스 온라인, 2018-08-08
- ^ "Saudi Arabia Sends Blue Ammonia to Japan in World-First Shipment". Bloomberg.com. 27 September 2020. Retrieved 28 September 2020.
- ^ Service, Robert F. (12 July 2018). "Ammonia—a renewable fuel made from sun, air, and water—could power the globe without carbon". Science AAAS. Retrieved 28 September 2020.
- ^ "Will Saudi Arabia build the world's largest green hydrogen and ammonia plant?". energypost.eu. 17 September 2020. Retrieved 9 October 2020.
- ^ "DSME gets LR AIP for ammonia-fueled 23,000 TEU boxship". Offshore Energy. 6 October 2020. Retrieved 9 October 2020.
- ^ "What will power aircraft in the future?". Aviafuture. 30 March 2022. Retrieved 24 May 2022.
- ^ "Japan to advance ammonia co-firing technology". Argus Media. 24 June 2021. Retrieved 8 November 2021.
- ^ "First International Conference on Fuel Ammonia 2021". ICFA. 6 October 2021. Archived from the original on 7 November 2021. Retrieved 7 November 2021.
- ^ "First International Conference on Fuel Ammonia Held". METI, Japan. 12 October 2021. Retrieved 7 November 2021.
- ^ "CO2-free power generation achieved with the world's first gas turbine using 100% liquid ammonia" (Press release). IHI Corporation. 16 June 2022. Retrieved 1 July 2022.
- ^ Masaya Kato (14 July 2022). "Quad members agree to promote hydrogen, ammonia fuel tech". The Nikkei. Retrieved 14 July 2022.
- ^ "On the use of ammonia as a fuel – A perspective" (PDF).
- ^ "Nitrogen Oxides as a By-product of Ammonia/Hydrogen Combustion Regimes" (PDF).
- ^ "Diesel: Greener Than You Think". Archived from the original on 10 May 2008. Retrieved 7 July 2009.
- ^ "Phosgene: Health and Safety Guide". International Programme on Chemical Safety. 1998.
- ^ "MOL studies ammonia FSRU concept". Offshore Energy. 3 February 2022. Retrieved 3 February 2022.
- ^ Collins (l_collins), Leigh (27 January 2022). "SPECIAL REPORT Why shipping pure hydrogen around the world might already be dead in the water Recharge". Recharge Latest renewable energy news. Retrieved 3 February 2022.
- ^ Wright, Jerry (13 April 2015). "Cooling System Keeps Space Station Safe, Productive". NASA. Retrieved 1 July 2017.
- ^ "International Space Station's Cooling System: How It Works (Infographic)". Space.com. Retrieved 1 July 2017.
- ^ "Reducing Hydrofluorocarbon (HFC) Use and Emissions in the Federal Sector through SNAP" (PDF). Archived (PDF) from the original on 9 October 2022. Retrieved 2 December 2018.
- ^ "Anhydrous ammonia tank locks have flaws". Cedar Rapids Gazette. 6 October 2009.
- ^ "Illinois Attorney General Basic Understanding of Meth". Illinoisattorneygeneral.gov. Archived from the original on 10 September 2010. Retrieved 21 May 2011.
- ^ Greenberg, Michael I. (1 January 2003). Occupational, Industrial, and Environmental Toxicology. Elsevier Health Sciences. ISBN 978-0323013406.
- ^ Włochowicz, A.; Stelmasiak, E. (1983). "Change in thermal properties of wool after treatment with liquid ammonia". Journal of Thermal Analysis and Calorimetry. 26 (1): 17. doi:10.1007/BF01914084. S2CID 96930751.
- ^ Horkheimer, Donald (2005). "Ammonia - A Solution for Airships Demanding Rapid Changes in Net Buoyancy". AIAA 5th ATIO and16th Lighter-Than-Air Sys Tech. And Balloon Systems Conferences. doi:10.2514/6.2005-7393. ISBN 978-1-62410-067-3. Retrieved 27 October 2022.
{{cite book}}:website=무시됨(도움말) - ^ 발끈하는 흰 오크 나무. woodweb.com
- ^ 광물연감, vol.3
- ^ a b "Toxic FAQ Sheet for Ammonia" (PDF). Agency for Toxic Substances and Disease Registry (ATSDR). September 2004. Archived (PDF) from the original on 9 October 2022.
- ^ 암모니아, IDLH 설명서
- ^ 무수 암모니아는 유해 물질 안전 허가 프로그램에 따라 적용됩니까?미국 교통부(DOT)의 웹사이트에서
- ^ Berg, J. M.; Tymoczko, J. L.; Stryer, L. (2002). "23.4: Ammonium Ion is Converted into Urea in Most Terrestrial Vertebrates". Biochemistry (5th ed.).
- ^ Wang, Mingyi; Kong, Weimeng; Marten, Ruby; He, Xu-Cheng; Chen, Dexian; Pfeifer, Joschka; Heitto, Arto; Kontkanen, Jenni; Dada, Lubna; Kürten, Andreas; Yli-Juuti, Taina (13 May 2020). "Rapid growth of new atmospheric particles by nitric acid and ammonia condensation". Nature. 581 (7807): 184–189. Bibcode:2020Natur.581..184W. doi:10.1038/s41586-020-2270-4. ISSN 1476-4687. PMC 7334196. PMID 32405020.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). "Hazardous Compounds in Tobacco Smoke". International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ "Cutting-Edge Solutions For Coking Wastewater Reuse To Meet The Standard of Circulation Cooling Systems". www.wateronline.com. Retrieved 16 January 2016.
- ^ Vasudevan Rajaram; Subijoy Dutta; Krishna Parameswaran (30 June 2005). Sustainable Mining Practices: A Global Perspective. CRC Press. p. 113. ISBN 978-1-4398-3423-7.
- ^ a b c Oram, Brian. "Ammonia in Groundwater, Runoff, and Streams". The Water Centre. Retrieved 3 December 2014.
- ^ Hargreaves, J.A.; Tucker, C.S. (2004). Managing ammonia in fish ponds. Southern Regional Aquaculture Center.
- ^ a b c Sergeant, Chris (5 February 2014). "The Management of Ammonia Levels in an Aquaculture Environment". Water/Wastewater. Retrieved 3 December 2014.
- ^ 전자연방규정집:2011년 11월 4일 웨이백 머신에서 보관.Ecfr.gpoaccess.gov .2011년 12월 22일 회수.
- ^ "Ammonia Tanks - Carbon and Stainless Steel Construction". ammoniatanks.com. Retrieved 28 June 2021.
- ^ "Nitrogen Statistics and Information U.S. Geological Survey". www.usgs.gov. Retrieved 24 January 2023.
- ^ a b "Nitrogen (Fixed)--Ammonia (2022)" (PDF). U.S. National Minerals Information Center. Retrieved 24 January 2023.
- ^ "Nobel Prize in Chemistry (1918) – Haber–Bosch process". Retrieved 7 July 2009.
- ^ "Chemistry of the Group 2 Elements – Be, Mg, Ca, Sr, Ba, Ra". BBC.co.uk. Retrieved 7 July 2009.
- ^ Habers process chemistry. India: Arihant publications. 2018. p. 264. ISBN 978-93-131-6303-9.
- ^ Appl, M. (1982). "The Haber–Bosch Process and the Development of Chemical Engineering". A Century of Chemical Engineering. New York: Plenum Press. pp. 29–54. ISBN 978-0-306-40895-3.
- ^ Appl, Max (2006). "Ammonia". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_143.pub2.
- ^ Clark 2013, "순방향 반응(암모니아 생성)은 발열성입니다.르 샤틀리에의 원칙에 따르면, 이것은 더 낮은 온도에서 선호될 것입니다.시스템은 평형 위치를 이동하여 이에 대응합니다. 즉, 더 많은 열을 생성함으로써 이에 대응합니다.평형 혼합물에서 가능한 한 많은 암모니아를 얻기 위해서는 가능한 한 낮은 온도가 필요합니다."
- ^ Clark 2013, "방정식의 왼쪽에는 4개의 분자가 있지만 오른쪽에는 2개의 분자만 있습니다.르 샤틀리에의 원리에 따르면, 압력을 증가시킴으로써 계는 더 적은 분자를 생성하는 반응을 선호함으로써 반응할 것입니다.그러면 압력이 다시 떨어지게 됩니다.평형 혼합물에서 가능한 한 많은 암모니아를 얻기 위해서는 가능한 높은 압력이 필요합니다.200기압은 고기압이지만 놀라울 정도로 높지는 않습니다."
- ^ Smil, Vaclav (2004). Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production (1st ed.). Cambridge, MA: MIT. ISBN 978-0-262-69313-4.
- ^ Hager, Thomas (2008). The Alchemy of Air: A Jewish genius, a doomed tycoon, and the scientific discovery that fed the world but fueled the rise of Hitler (1st ed.). New York, New York: Harmony Books. ISBN 978-0-307-35178-4.
- ^ Sittig, Marshall (1979). Fertilizer Industry: Processes, Pollution Control, and Energy Conservation. Park Ridge, New Jersey: Noyes Data Corp. ISBN 978-0-8155-0734-5.
- ^ Lavars, Nick (30 November 2021). "Green ammonia electrolysis breakthrough could finally kill Haber-Bosch". New Atlas. Archived from the original on 30 November 2021. Retrieved 3 December 2021.
- ^ Blaine, Loz (19 November 2021). "FuelPositive promises green ammonia at 60% the cost of today's gray". New Atlas. Archived from the original on 19 November 2021. Retrieved 3 December 2021.
- ^ Fichter, Fr.; Girard, Pierre; Erlenmeyer, Hans (1 December 1930). "Elektrolytische Bindung von komprimiertem Stickstoff bei gewöhnlicher Temperatur". Helvetica Chimica Acta. 13 (6): 1228–1236. doi:10.1002/hlca.19300130604.
- ^ Tsuneto, Akira; Kudo, Akihiko; Sakata, Tadayoshi (4 March 1994). "Lithium-mediated electrochemical reduction of high pressure N2 to NH3". Journal of Electroanalytical Chemistry. 367 (1): 183–188. doi:10.1016/0022-0728(93)03025-K. ISSN 1572-6657.
- ^ a b Lazouski, Nikifar; Schiffer, Zachary J.; Williams, Kindle; Manthiram, Karthish (17 April 2019). "Understanding Continuous Lithium-Mediated Electrochemical Nitrogen Reduction". Joule. 3 (4): 1127–1139. doi:10.1016/j.joule.2019.02.003. ISSN 2542-4351. S2CID 107985507.
- ^ Andersen, Suzanne Z.; Čolić, Viktor; Yang, Sungeun; Schwalbe, Jay A.; Nielander, Adam C.; McEnaney, Joshua M.; Enemark-Rasmussen, Kasper; Baker, Jon G.; Singh, Aayush R.; Rohr, Brian A.; Statt, Michael J. (June 2019). "A rigorous electrochemical ammonia synthesis protocol with quantitative isotope measurements". Nature. 570 (7762): 504–508. Bibcode:2019Natur.570..504A. doi:10.1038/s41586-019-1260-x. hdl:10044/1/72812. ISSN 1476-4687. PMID 31117118. S2CID 162182383.
- ^ Lazouski, Nikifar; Chung, Minju; Williams, Kindle; Gala, Michal L.; Manthiram, Karthish (1 May 2020). "Non-aqueous gas diffusion electrodes for rapid ammonia synthesis from nitrogen and water-splitting-derived hydrogen". Nature Catalysis. 3 (5): 463–469. doi:10.1038/s41929-020-0455-8. ISSN 2520-1158. S2CID 218495730.
- ^ a b Suryanto, Bryan H. R.; Matuszek, Karolina; Choi, Jaecheol; Hodgetts, Rebecca Y.; Du, Hoang-Long; Bakker, Jacinta M.; Kang, Colin S. M.; Cherepanov, Pavel V.; Simonov, Alexandr N.; MacFarlane, Douglas R. (11 June 2021). "Nitrogen reduction to ammonia at high efficiency and rates based on a phosphonium proton shuttle". Science. 372 (6547): 1187–1191. Bibcode:2021Sci...372.1187S. doi:10.1126/science.abg2371. ISSN 0036-8075. PMID 34112690. S2CID 235396282.
- ^ Roth, Karl S. "eMedicine Specialties > Metabolic Diseases > Hyperammonemia". Retrieved 7 July 2009.
- ^ Adjei, M. B.; Quesenberry, K. H.; Chamblis, C. G. (June 2002). "Nitrogen Fixation and Inoculation of Forage Legumes". University of Florida IFAS Extension. Archived from the original on 20 May 2007.
- ^ 암모니아가 뇌에 미치는 직접적인 영향 파악 - PubMed
- ^ Igarashi, Robert Y.; Laryukhin, Mikhail; Dos Santos, Patricia C.; Lee, Hong-In; Dean, Dennis R.; Seefeldt, Lance C.; Hoffman, Brian M. (May 2005). "Trapping H- Bound to the Nitrogenase FeMo-Cofactor Active Site during H2 Evolution: Characterization by ENDOR Spectroscopy". Journal of the American Chemical Society. 127 (17): 6231–6241. doi:10.1021/ja043596p. PMID 15853328.
- ^ Zschocke, Johannes; Hoffman, Georg (2004). Vademecum Metabolism. Schattauer Verlag. ISBN 978-3794523856.
- ^ Rose, Burton; Helmut Rennke (1994). Renal Pathophysiology. Baltimore: Williams & Wilkins. ISBN 978-0-683-07354-6.
- ^ Campbell, Neil A.; Jane B. Reece (2002). "44". Biology (6th ed.). San Francisco: Pearson Education, Inc. pp. 937–938. ISBN 978-0-8053-6624-2.
- ^ 커크 먼셀 편집.이미지 페이지 크레딧 달과 행성 연구소.NASA "NASA 태양 탐사: 멀티미디어: 갤러리: 가스 자이언트 인테리어 2006년 2월 20일 웨이백 머신에서 보관"2006년 4월 26일 회수.
- ^ Cheung, A. C.; Rank, D. M.; Townes, C. H.; Thornton, D. D.; Welch, W. J. (1968). "Detection of NH3 molecules in the interstellar medium by their microwave emission". Phys. Rev. Lett. 21 (25): 1701. Bibcode:1968PhRvL..21.1701C. doi:10.1103/PhysRevLett.21.1701.
- ^ a b Ho, P. T. P.; Townes, C. H. (1983). "Interstellar ammonia". Annu. Rev. Astron. Astrophys. 21 (1): 239–70. Bibcode:1983ARA&A..21..239H. doi:10.1146/annurev.aa.21.090183.001323.
- ^ Millar, T. J. (2003). "Deuterium Fractionation in Interstellar Clouds". Space Science Reviews. 106 (1): 73–86. Bibcode:2003SSRv..106...73M. doi:10.1023/A:1024677318645. S2CID 189793190.
- ^ Ungerechts, H.; Walmsley, C. M.; Winnewisser, G. (1980). "Ammonia and cyanoacetylene observations of the high-density core of L-183 (L-134-N)". Astron. Astrophys. 88: 259. Bibcode:1980A&A....88..259U.
- ^ Genzel, R.; Downes, D.; Ho, P. T. P. (1982). "NH3 in Orion-KL – A new interpretation". Astrophysical Journal. 259: L103. Bibcode:1982ApJ...259L.103G. doi:10.1086/183856.
- ^ "The UMIST data for Astrochemistry". Retrieved 7 July 2009.
- ^ Vikor, L.; Al-Khalili, A.; Danared, H.; Djuric, N.; Dunn, G. H.; Larsson, M.; Le Padellec, A.; Rosen, S.; Af Ugglas, M. (1999). "Branching fractions of dissociative recombination of NH4+ and NH2+ molecular ions". Astronomy and Astrophysics. 344: 1027. Bibcode:1999A&A...344.1027V.
- ^ van Dishoeck, E. F.; Black, J. H. (1986). "Comprehensive models of diffuse interstellar clouds – Physical conditions and molecular abundances" (PDF). Astrophys. J. Suppl. Ser. 62: 109–145. Bibcode:1986ApJS...62..109V. doi:10.1086/191135. hdl:1887/1980.
- ^ "astrochemistry.net". astrochemistry.net. Retrieved 21 May 2011.
- ^ Prasad, S. S.; Huntress, W. T. (1980). "A model for gas phase chemistry in interstellar clouds". The Astrophysical Journal Supplement Series. 43: 1. Bibcode:1980ApJS...43....1P. doi:10.1086/190665.
- ^ Lininger, W.; Albritton, D. L.; Fehsenfeld, F. C.; Schmeltekopf, A. L.; Ferguson, E. E. (1975). "Flow–drift tube measurements of kinetic energy dependences of some exothermic proton transfer rate constants". J. Chem. Phys. 62 (9): 3549. Bibcode:1975JChPh..62.3549L. doi:10.1063/1.430946.
- ^ Smith, D.; Adams, N. G. (1977). "Reactions of CH+n IONS with ammonia at 300 K". Chemical Physics Letters. 47 (1): 145. Bibcode:1977CPL....47..145S. doi:10.1016/0009-2614(77)85326-8.
- ^ Wooten, A.; Bozyan, E. P.; Garrett, D. B. (1980). "Detection of C2H in cold dark clouds". Astrophysical Journal. 239: 844. Bibcode:1980ApJ...239..844W. doi:10.1086/158168.
- ^ Wilson, T. L.; Downes, D.; Bieging, J. (1979). "Ammonia in Orion". Astronomy and Astrophysics. 71 (3): 275. Bibcode:1979A&A....71..275W.
- ^ MacDonald, G. H.; Little, L. T.; Brown, A. T.; Riley, P. W.; Matheson, D. N.; Felli, M. (1981). "Detection of new ammonia sources". MNRAS. 195 (2): 387. Bibcode:1981MNRAS.195..387M. doi:10.1093/mnras/195.2.387.
- ^ Morris, M.; Zuckerman, B.; Palmer, P.; Turner, B. E. (1973). "Interstellar ammonia". Astrophysical Journal. 186: 501. Bibcode:1973ApJ...186..501M. doi:10.1086/152515.
- ^ Torrelles, J. M.; Ho, P. T. P.; Rodriguez, L. F.; Canto, J. (1985). "VLA observations of ammonia and continuum in regions with high-velocity gaseous outflows". Astrophysical Journal. 288: 595. Bibcode:1985ApJ...288..595T. doi:10.1086/162825. S2CID 123014355.
- ^ Ho, P. T. P.; Martin, R. N.; Turner, J. L.; Jackson, J. M. (1990). "VLA imaging of extragalactic ammonia – Hot gas in the nucleus of IC 342". Astrophysical Journal Letters. 355: L19. Bibcode:1990ApJ...355L..19H. doi:10.1086/185728.
- ^ Cesaroni, R.; Churchwell, E.; Hofner, P.; Walmsley, C. M.; Kurtz, S. (1994). "Hot ammonia toward compact HII regions". Astronomy and Astrophysics. 288: 903. Bibcode:1994A&A...288..903C.
- ^ Knacke, R. F.; McCorkle, S.; Puetter, R. C.; Erickson, E. F.; Kraetschmer, W. (1982). "Observation of interstellar ammonia ice". Astrophysical Journal. 260: 141. Bibcode:1982ApJ...260..141K. doi:10.1086/160241.
- ^ Orton, G. S.; Aumann, H. H.; Martonchik, J. V.; Appleby, J. F. (1982). "Airborne spectroscopy of Jupiter in the 100- to 300-cm−1 region: Global properties of ammonia gas and ice haze". Icarus. 52 (1): 81. Bibcode:1982Icar...52...81O. doi:10.1016/0019-1035(82)90170-1.
- ^ Benson, P. J.; Myers, P. (1989). "A survey for dense cores in dark clouds". Astrophysical Journal Supplement Series. 71: 89. Bibcode:1989ApJS...71...89B. doi:10.1086/191365.
- ^ Mebold, U.; Heithausen, A.; Reif, K. (1987). "Ammonia in the galactic halo and the infrared cirrus". Astronomy and Astrophysics. 180: 213. Bibcode:1987A&A...180..213M.
- ^ Martin, R. N.; Ho, P. T. P. (1979). "Detection of extragalactic ammonia". Astronomy and Astrophysics. 74 (1): L7. Bibcode:1979A&A....74L...7M.
- ^ Takano, S.; Nakai, N.; Kawaguchi, K. (1 April 2002). "Observations of Ammonia in External Galaxies I. NGC 253 and M 82". Publications of the Astronomical Society of Japan. 54 (2): 195–207. Bibcode:2002PASJ...54..195T. doi:10.1093/pasj/54.2.195.
인용작품
- "Aqua Ammonia". airgasspecialtyproducts.com. Archived from the original on 19 November 2010. Retrieved 28 November 2010.
- 이 기사는 현재 퍼블릭 도메인에 있는 출판물의 텍스트를 통합합니다.
- Clark, Jim (April 2013) [2002]. "The Haber Process". Retrieved 15 December 2018.
추가열람
- Bretherick, L., ed. (1986). Hazards in the Chemical Laboratory (4th ed.). London: Royal Society of Chemistry. ISBN 978-0-85186-489-1. OCLC 16985764.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Housecroft, C. E.; Sharpe, A. G. (2000). Inorganic Chemistry (1st ed.). New York: Prentice Hall. ISBN 978-0-582-31080-3.
- Weast, R. C., ed. (1972). Handbook of Chemistry and Physics (53rd ed.). Cleveland, OH: Chemical Rubber Co.
외부 링크
- 국제 화학 안전 카드 0414 (암모니아 anhydr), ilo.org
- 국제 화학 안전 카드 0215 (수액), ilo.org
- PubChem의 CID 222
- "Ammoniac et solutions aqueuses" (in French). Institut National de Recherche et de Sécurité. Archived from the original on 11 December 2010.
- 미네소타 주 Agriculture.ammoniaspills.org 의 암모니아 비료 방출(유출)에 대한 긴급 대응
- 국립산업안전보건연구소 – 암모니아 페이지, cdc.gov
- 화학적 위험에 대한 NIOSH 포켓 가이드 – 암모니아, cdc.gov
- 암모니아, 비디오










