셀레놀
Selenol셀레놀은 C-Se-H 연결성을 가진 기능군을 포함하는 유기 화합물이다. 셀레놀은 셀레노머캡탄과 셀레노티올이라고도 불린다. 셀레놀은 오르가노셀레늄 화합물의 주요 등급 중 하나이다. 그 그룹에서 가장 잘 알려진 구성원은 아미노산 셀레노시스테인이다.
구조, 본딩, 특성
셀레놀은 구조적으로 티올과 비슷하지만 C-Se 본드는 196pm으로 약 8% 길다. C-Se-H 각도는 90°에 근접한다. 접합은 거의 순수한 P-orbital을 포함하며, 따라서 거의 90 각도가 된다. Se-H 본드 에너지는 S-H 본드보다 약하기 때문에 셀레놀은 쉽게 산화되어 H-원자 기증자의 역할을 한다. Se-H 채권은 각각의 채권 분리에너지(BDE)에 반영된 S-H 채권에 비해 훨씬 약하다. CHSe-H의65 경우 BDE는 326 kJ/mol이고 CHS-H의65 경우 BDE는 368 kJ/mol이다.[1]
셀레놀산은 티올보다 약 1000배 더 강하다: CHSeH의33 pK는a 5.2 대 8.3이다. 디프로토톤은 셀레놀레이트 음이온, RSe를− 제공한다. 그 중 대부분은 핵포화성이 높고 공기에 의해 빠르게 산화된다.[2]
셀레놀의 비등점은 티올보다 약간 더 큰 경향이 있다. 이는 더 큰 원자에 대해 더 강한 반데르 발스 결합의 중요성이 증가했기 때문이라고 볼 수 있다. 휘발성 셀레놀은 악취가 심하다.
신청 및 발생
셀레놀은 셀레늄의 높은 독성뿐만 아니라 Se-H 결합의 민감도에 의해 제한되어 상업적 용도가 거의 없다. 그들의 결합 기반인 셀레놀레이트들은 유기 합성에 제한적인 응용을 가지고 있다.

생화학적 역할
셀레놀은 어떤 생물학적 과정에서 중요하다. 포유류에서 발견되는 세 가지 효소는 활성 부위에 셀레놀을 함유하고 있다: 글루타티온 페록시다아제, 요오드타티로닌 디오디나제, 티오레독신 환원효소. 이 단백질들의 셀레놀은 필수적인 아미노산 셀레노시스테인의 일부분이다.[2] 셀레놀은 셀렌산 유도체(RSE-OH)를 주는 환원제로 기능하며, 이는 티올 함유 효소에 의해 다시 감소된다. 는 시험관에서 배양되는 세균성 메티오닌 gamma-lyase(METase)효소로, 셀렌화 이온의 생물학적 메틸화 또는 vivo에methaneseleninic 산성(CH3SeO2H)의 감소로 인해 selenomethionine을 육성하기에 의해 생산될 수 있는 Methaneselenol(일반적으로 명명된"methylselenol")(CH3SeH)은 특정한 organos의 항암 효과를 설명하기 위해 호출되고 있다.엘레늄 [3][4][5]화합물 메탄젤레놀의 전구체들은 암 예방과 치료에 있어 활발한 조사를 받고 있다. 이 연구들에서 메탄젤레놀은 에탄젤레놀이나 2프로판젤레놀보다 생물학적으로 더 활동적인 것으로 밝혀졌다.[6]
준비
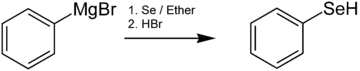
셀레놀은 보통 소자 SE와 함께 유기석소 시약이나 그리그나드 시약의 반응에 의해 준비된다. 예를 들어 벤제네셀레놀은 셀레늄과 함께 페닐마그네슘 브로미이드의 반응에 의해 생성되며, 산성화가 뒤따른다.[7]
셀레놀로 가는 또 다른 준비 경로는 셀레누아 알키화, 그 다음에 가수분해와 관련이 있다. 셀레놀은 종종 이질화물의 감소에 따른 셀레노산염의 양성화에 의해 생성된다.
- 22 RSeSeR + 2 LiHB(CH25)3 → 2 RSeLi + 2 B(CH25)3 + H
- RSeLi + HCl → RSeH + LiCl
디메틸 이델레니드는 세포 내에서 메탄젤레놀로 쉽게 감소할 수 있다.[8]
반응
셀레놀은 세세 결합을 함유한 화합물인 이산화물로 쉽게 산화된다. 예를 들어 브롬으로 벤제네셀레놀을 치료하면 디페닐 이델레니드가 생긴다.
- 2 CHSeH65 + Br2 → (CHSe65)2 + 2 HBr
베이스가 있는 곳에서 셀레놀은 셀레니드를 주기 위해 쉽게 알킬화된다. 이 관계는 디메틸셀렌화물을 주기 위한 메타네셀레놀의 메틸화에 의해 설명된다.
안전
오르가노셀레늄 화합물(또는 셀레늄 화합물)은 건강에 미량의 SE가 필요함에도 불구하고 누적 독물질이다.
참고 항목
참조
- ^ Lide, David R., ed. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ^ a b Wessjohann L, Schneider A, Abbas M, Brandt W (2007). "Selenium in Chemistry and Biochemistry in Comparison to Sulfur". Biological Chemistry. 388 (10): 997–1006. doi:10.1515/BC.2007.138. PMID 17937613. S2CID 34918691.
- ^ Zeng H, Briske-Anderson M, Wu M, Moyer MP (2012). "Methylselenol, a Selenium Metabolite, Plays Common and Different Roles in Cancerous Colon HCT116 Cell and Noncancerous NCM460 Colon Cell Proliferation". Nutrition and Cancer. 64 (1): 128–135. doi:10.1080/01635581.2012.630555. PMID 22171558. S2CID 21968566.
- ^ Fernandes AP, Wallenberg M, Gandin V, Misra S, Marzano C, Rigobello MP, et al. (2012). "Methylselenol Formed by Spontaneous Methylation of Selenide Is a Superior Selenium Substrate to the Thioredoxin and Glutaredoxin Systems". PLOS ONE. 7 (11): e50727. Bibcode:2012PLoSO...750727F. doi:10.1371/journal.pone.0050727. PMC 3511371. PMID 23226364.
- ^ Ip C, Dong Y, Ganther HE (2002). "New Concepts in Selenium Chemoprevention". Cancer and Metastasis Reviews. 21 (3–4): 281–289. doi:10.1023/a:1021263027659. PMID 12549766. S2CID 7636317.
- ^ Zuazo A, Plano D, Ansó E, Lizarraga E, Font M, Irujo JJ (2012). "Cytotoxic and Proapototic Activities of Imidoselenocarbamate Derivatives Are Dependent on the Release of Methylselenol". Chemical Research in Toxicology. 25 (11): 2479–2489. doi:10.1021/tx300306t. PMID 23043559.
- ^ Foster DG (1944). "Selenophenol". Organic Syntheses. 24: 89. doi:10.15227/orgsyn.024.0089.
- ^ Gabel-Jensen C, Lunøe K, Gammelgaard B (2010). "Formation of methylselenol, dimethylselenide and dimethyldiselenide in in vitro metabolism models determined by headspace GC-MS". Metallomics. 2 (2): 167–173. doi:10.1039/b914255j. PMID 21069149.