에탄올
Ethanol
 | |||
| | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 발음 | /nnnl/ | ||
| 우선 IUPAC 이름 에탄올[1] | |||
| 기타 이름 절대 알코올 알코올 향수주 음주 에틸알코올 EtOH 에틸알코올 에틸 수화물 수산화 에틸 에틸롤 곡물 알코올 히드록시에탄 메틸카르비놀 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 3 DMet | |||
| 1718733 | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| 드러그뱅크 | |||
| ECHA 정보 카드 | 100.000.526 | ||
| 787 | |||
| 케그 | |||
PubChem CID | |||
| 유니 | |||
| UN 번호 | UN 1170 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C2H6O | |||
| 몰 질량 | 46.069 g/120−1 | ||
| 외모 | 무색 액체 | ||
| 냄새 | 메탄올[2] 유사 | ||
| 밀도 | 0.78945 g/cm3 (20 °[3]C에서) | ||
| 녹는점 | -114.14 ± 0.03[3] °C(-173.45 ± 0.05 °F, 159.01 ± 0.03 K) | ||
| 비등점 | 78.23 ± 0.09[3] °C (172.81 ± 0.16 °F, 351.38 ± 0.09 K) | ||
| 혼재 | |||
| 로그 P | −0.18 | ||
| 증기압 | 5.95kPa(20°C에서) | ||
| 산도(pKa) | 15.9(HO2), 29.8(DSO)[4][5] | ||
자화율(δ) | - 33.60·10cm−63/수직선 | ||
굴절률(nD) | 1.3611[3] | ||
| 점성 | 1.2mPa·s(20°C에서), 1.074mPa·s(25°[6]C에서) | ||
| 1.69 D[7] | |||
| 위험 요소 | |||
| GHS 라벨링: | |||
  | |||
| 위험. | |||
| H225, H319 | |||
| P210, P280, P305+P351+P338 | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | 14 °C (절대)[9] | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중간선량) | 7340 mg/kg (구강, 쥐) 7300 mg/kg (표준) | ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 1000ppm(1900mg/m3)[10] | ||
REL(권장) | TWA 1000ppm(1900mg/m3)[10] | ||
IDLH(즉시 위험) | N.D.[10] | ||
| 안전 데이터 시트(SDS) | [8] | ||
| 관련 화합물 | |||
관련 화합물 | 에탄 메탄올 | ||
| 보충 데이터 페이지 | |||
| 에탄올(데이터 페이지) | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
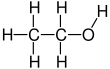
에탄올(에틸알코올, 곡물알코올, 음용알코올 또는 단순알코올이라고도 함)은 유기화합물입니다.화학식이26 CHO인 단순한 알코올입니다.그 공식은 CH-CH-OH
3
2 또는
2
5 CHOH(히드록실기와 연결된 에틸기)로도 표기될 수 있으며 종종 EtOH로 약칭된다.에탄올은 휘발성, 인화성, 무색 액체이며 와인 같은 특유의 냄새와 톡 쏘는 [11][12]맛이 있습니다.알코올 음료의 유효성분인 정신작용 약물, 레크리에이션 약물입니다.
에탄올은 효모나 에틸렌 수화 등의 석유화학적 과정을 통해 당을 발효시킴으로써 자연적으로 생산된다.방부제 및 소독제로 의학적 용도가 있습니다.화학용매, 유기화합물 합성, 연료원으로 사용된다.에탄올은 또한 중요한 화학 원료인 에틸렌을 만들기 위해 탈수될 수 있다.
어원학
에탄올은 국제순수응용화학연합(IUPAC)에 의해 정의된 체계적 명칭으로, 탄소 원자 2개( 접두사 "eth-")와 탄소 원자 2개(infix "an-") 사이에 단일 결합을 가진 알킬기(suffix "-ol")[13]로 구성되어 있다.
"에틸 알코올"에서 "eth-" 접두사와 한정자 "ethyl"은 원래 1834년에 Justus Liebig에 의해 그룹
2
5 CH-에 할당된 이름 "ethyl"에서 유래했습니다.그는 CH-O-CH
2
5
2
5 화합물의 독일어 이름인 에테르(일반적으로 영어로 "에테르"로 불리고 더 구체적으로 "디에틸 [14]에테르"로 불림)에서 이 단어를 만들었습니다.옥스포드 영어사전에 따르면 에틸은 고대 그리스어 αααααα(aithḗr, "위쪽 공기")와 그리스어 αααα(hēlē, "substance")[15]의 합성어이다.
에탄올이라는 이름은 1892년 4월 스위스 [16]제네바에서 열린 국제화학명칭회의에서 채택된 결의안의 결과로 만들어졌다.
"알코올"이라는 용어는 현재 화학 용어에서 더 넓은 종류의 물질을 가리키지만, 일반적으로는 에탄올의 이름으로 남아 있습니다.그것은 고대부터 화장품으로 사용된 안티몬 가루 광석인 아랍어 알-쿠엘에서 중세 [17]라틴어로 그 의미를 유지했다.에탄올에 "알코올"을 사용하는 것은 현대적이고 1753년에 처음 기록되었습니다.18세기 후반 이전에 "알코올"이라는 용어는 일반적으로 승화된 [18]물질을 가리켰다.
사용하다
의료의
방부제
에탄올은 의료용 물티슈에 사용되며 살균 및 곰팡이 방지 효과를 [19]위한 방부제로 항균 손 소독 젤에 가장 일반적으로 사용됩니다.에탄올은 막지질 이중층을 분해하고 단백질을 변성시켜 미생물을 죽이며 대부분의 박테리아, 곰팡이, 바이러스에 효과가 있다.그러나 세균성 포자에 대해서는 효과가 없지만 [20]과산화수소를 사용하면 완화할 수 있다.에탄올은 최적의 항균 활동을 위해 물 분자에 의존하기 때문에 70% 에탄올 용액이 순수한 에탄올보다 더 효과적입니다.절대 에탄올은 알코올이 미생물의 [21][22]막에 완전히 침투할 수 없기 때문에 미생물을 파괴하지 않고 비활성화할 수 있습니다.에탄올은 세포막을 가로지르는 삼투압 균형을 깨뜨려 세포 탈수를 유발하기 때문에 살균제와 방부제로도 사용될 수 있다. 그래서 물이 세포를 떠나 세포 [23]사멸로 이어진다.
해독제
에틸렌글리콜 중독[24] 및 메탄올 [25]중독에 대한 해독제로서 에탄올을 투여할 수 있다.에탄올은 알코올 탈수소효소에 [26]대한 메탄올 및 에틸렌 글리콜에 대한 경쟁 억제제 역할을 함으로써 이러한 과정을 지원합니다.에탄올은 더 많은 부작용이 있지만 메탄올과 에틸렌 글리콜 [27]중독의 해독제로도 사용되는 포메피졸보다 저렴하고 쉽게 구할 수 있다.
약용제
에탄올은 종종 고농도로 많은 불용성 약물과 관련 화합물을 녹이는 데 사용됩니다.예를 들어 진통제, 기침 및 감기약, 구강 세척제의 액체 제제는 최대 25%의[28] 에탄올을 함유할 수 있으며 알코올로 인한 [29]호흡 반응과 같은 에탄올에 대한 부작용을 가진 개인은 피해야 할 수 있습니다.에탄올은 아세트아미노펜, 철 보충제, 라니티딘, 푸로세미드, 만니톨, 페노바르비탈, 트리메토프림/술파메톡사졸 및 시판되는 [30]기침약을 포함한 700개 이상의 액체 제제에 주로 항균 방부제로 존재한다.
약리학
포유동물에서 에탄올은 주로 알코올탈수소효소([31]ADH)에 의해 간과 위에서 대사된다.이러한 효소는 에탄올의 아세트알데히드(에탄올)[32] 산화를 촉매합니다.
- CHCHOH32 + NAD+ → CHCHO3 + NADH + H+
상당한 농도로 존재할 때, 에탄올의 이러한 대사는 인간에서 시토크롬 P450 효소 CYP2E1에 의해 추가적으로 도움을 받는 반면, 미량 또한 [33]카탈라아제에 의해 대사된다.
생성된 중간물질인 아세트알데히드는 알려진 발암물질로 에탄올 자체보다 인간에게 훨씬 더 큰 독성을 일으킨다.알코올 중독과 관련된 증상들 중 많은 것들과 에탄올의 장기 소비와 관련된 건강상의 위험들은 인간의 [34]아세트알데히드 독성에 기인할 수 있다.
아세트알데히드의 아세트산으로의 후속 산화는 알데히드탈수소효소(ALDH) 효소에 의해 수행됩니다.ALDH2 유전자의 돌연변이가 이 효소의 비활동적 또는 기능적 형태를 암호화하는 것은 동아시아 인구의 약 50%에 영향을 미치며, 아세트알데히드 [35]독성의 많은 관련 증상 및 종종 불쾌한 증상을 유발할 수 있는 특징적인 알코올 홍조 반응에 기여합니다.이러한 돌연변이는 동아시아인의 약 80%에서 알코올 탈수소효소 ADH1B의 또 다른 돌연변이를 동반하며, 이는 에탄올을 [35]아세트알데히드로 변환하는 촉매 효율을 향상시킨다.
오락의
중추신경계 억제제로서, 에탄올은 가장 일반적으로 소비되는 정신작용 [36]약물 중 하나이다.
알코올의 정신 작용 및 발암 특성에도 불구하고, 대부분의 국가에서 알코올을 쉽게 구입할 수 있고 합법적으로 판매할 수 있습니다.그러나 알코올 음료의 판매, 수출/수입, 과세, 제조, 소비 및 소지를 규제하는 법이 있습니다.가장 일반적인 규제는 미성년자에 대한 금지이다.
연료
엔진 연료
| 연료 종류 | MJ/L | MJ/kg | 조사. 옥탄 번호 |
|---|---|---|---|
| 건조목재(수분 20%) | ~19.5 | ||
| 메탄올 | 17.9 | 19.9 | 108.7[37] |
| 에탄올 | 21.2[38] | 26.8[38] | 108.6[37] |
| E85 (85% 에탄올, 15% 가솔린) | 25.2 | 33.2 | 105 |
| 액화천연가스 | 25.3 | ~55 | |
| 자동 가스(LPG) (프로판 60 % + 부탄 40 % ) | 26.8 | 50 | |
| 항공 가솔린 (고옥탄 가솔린, 제트 연료 아님) | 33.5 | 46.8 | 100/130 (표준/농후) |
| 가스홀 (90% 가솔린 + 10% 에탄올) | 33.7 | 47.1 | 93/94 |
| 일반 가솔린/휘발유 | 34.8 | 44.4[39] | 최소 91 |
| 프리미엄 가솔린/휘발유 | 최대 104 | ||
| 디젤 | 38.6 | 45.4 | 25 |
| 숯, 압출 | 50 | 23 |
에탄올의 단일 사용이 가장 많은 것은 엔진 연료 및 연료 첨가제입니다.브라질은 특히 에탄올의 [40][41]세계 주요 생산국 중 하나로서의 역할 때문에 엔진 연료로서의 에탄올 사용에 크게 의존하고 있습니다.브라질에서 판매되는 휘발유는 최소 25%의 무수 에탄올을 함유하고 있습니다.국내에서 판매되는 가솔린 연료 신차의 90% 이상에서 함수 에탄올(에탄올 약 95%, 물 5%)을 연료로 사용할 수 있다.브라질의 에탄올은 사탕수수로 생산되는데, 사탕수수는 다른 에너지 [42]작물에 비해 상대적으로 높은 생산량을 가지고 있다.미국과 다른 많은 국가들은 주로 E10(10% 에탄올, 때로는 가스홀로 알려져 있음)과 E85(85% 에탄올) 에탄올/가솔린 혼합물을 사용합니다.
호주 법은 사탕수수 폐기물에서 나오는 순수한 에탄올의 사용을 자동차에서 10%로 제한하고 있습니다.구형차(및 연소가 느린 연료를 사용하도록 설계된 구형차)는 엔진 밸브를 업그레이드하거나 [43]교체해야 합니다.
업계 옹호 단체에 따르면 연료로서의 에탄올은 일산화탄소, 입자상 물질, 질소산화물 및 기타 오존을 형성하는 오염물질의 [44]유해한 테일파이프 배출을 감소시킨다.Argonne National Laboratory에서 다양한 엔진과 연료 조합의 온실가스 배출량을 분석한 결과, 순수 [45]휘발유에 비해 바이오디젤/휘발유 혼합(B20)은 8%, 기존 E85 에탄올 혼합은 17%, 셀룰로오스 에탄올은 64% 감소했습니다.에탄올은 가솔린보다 연구용 옥탄가(RON)가 훨씬 더 높기 때문에 사전 점화 가능성이 낮으며, 더 낮은 탄소 [46]배출량과 더불어 더 많은 토크를 의미하는 더 나은 점화 진보를 가능하게 합니다.
내연기관에서 에탄올 연소는 가솔린과 상당히 많은 양의 포름알데히드 [47]및 아세트알데히드와 같은 관련 종에 의해 생성된 불완전 연소의 많은 산물을 산출합니다.이로 인해 광화학 반응성이 현저하게 커지고 지면 수준의 [48]오존이 증가하게 됩니다.이 데이터는 The Clean Fuels Report에 수록된 연료[49] 배출량 비교 결과, 에탄올 배기가스가 가솔린 [50]배기가스보다 2.14배 많은 오존을 발생시키는 것으로 나타났습니다.이를 청정 연료 보고서의 LPI(Custom Localization Tollution Index)에 추가하면 에탄올(스모그의 원인이 되는 오염)의 지역 오염은 1.7로 평가되며, 여기서 휘발유는 1.0이고 수치가 높을수록 오염이 [51]심함을 나타냅니다.캘리포니아 항공 자원 위원회는 2008년에 기존의 NOx 및 반응성 유기 가스(ROG)[52]와 마찬가지로 포름알데히드에 대한 제어 표준을 배출 관리 그룹으로 인정함으로써 이 문제를 공식화했습니다.
2006년 세계 에탄올 생산량은 51기가리터(1.3×1010 US gal)였으며, 세계 공급량의 69%가 브라질과 [53]미국에서 생산되었습니다.브라질 자동차의 20% 이상이 에탄올 전용 엔진과 플렉스 연료 [54]엔진을 포함한 100% 에탄올을 연료로 사용할 수 있습니다.브라질의 플렉스 연료 엔진은 모든 에탄올, 모든 가솔린 또는 두 가지 혼합물을 사용할 수 있습니다.미국에서는 높은 에탄올 혼합이 아직 허용되지 않거나 효율적이기 때문에 플렉스 연료 차량은 0% ~ 85%의 에탄올(15%)로 주행할 수 있습니다.브라질은 국내에서 재배된 사탕수수에서 에탄올을 생산하는 대규모 국가 기반시설을 갖춘 에탄올 연소 자동차를 지원하고 있다.사탕수수는 옥수수보다 수크로스 농도가 더 높을 뿐만 아니라 추출하기도 훨씬 쉽습니다.이 공정에서 발생하는 바가스는 낭비되지 않고 발전소에서 전기를 [citation needed]생산하기 위해 사용된다.
미국에서 에탄올 연료 산업은 주로 옥수수(옥수수라고도 함)에 기반을 두고 있다.재생 연료 협회에 따르면, 2007년 10월 30일 현재 미국의 131개 곡물 에탄올 바이오 정제소에서 연간 70억 미국 갤런(2600만 m3)의 에탄올을 생산할 수 있다.(미국에서) 진행 중인 72개의 추가 건설 프로젝트는 향후 18개월 내에 64억 US 갤런(2400,000m3)의 새로운 용량을 추가할 수 있습니다.시간이 지남에 따라 연간 1500억 미국 갤런(5억7000만 m3)의 휘발유 시장 중 일부분이 연료 [55]에탄올로 대체될 것으로 예상된다.
달콤한 수수도 에탄올의 또 다른 잠재적 공급원이며 건조한 땅에서 자라는 데 적합합니다.국제 반건조 열대 작물 연구소(ICRISAT)는 아시아와 [56]아프리카의 건조한 지역에서 연료, 식량, 동물 사료로서 수수 재배 가능성을 조사하고 있다.사탕수수는 같은 기간 동안 사탕수수의 3분의 1을 필요로 한다.옥수수보다 물도 약 22% 적게 필요합니다.세계 최초의 사탕수수 에탄올 증류소는 2007년 인도 [57]안드라 프라데시 주에서 상업 생산을 시작했다.
에탄올은 물과 혼합성이 높기 때문에 액체 [58]탄화수소와 같은 최신 파이프라인을 통한 수송에는 적합하지 않습니다.정비사들은 소형 엔진(특히 카뷰레터)의 손상 사례가 증가하는 것을 목격했으며,[59] 이러한 손상으로 인해 연료 내 에탄올에 의한 수분 보유량이 증가했다고 보고 있습니다.
로켓 연료
에탄올은 액체 산소와 같은 산화제와 함께 초기 이원추진제 로켓(액체 추진식) 차량에서 연료로 일반적으로 사용되었습니다.선전명 V-2로 [60]더 잘 알려진 제2차 세계 대전의 독일 A-4 탄도 로켓은 에탄올을 B-Stoff의 주성분으로 사용했다.이러한 명명법 하에서 에탄올을 25%의 물과 혼합하여 연소실 온도를 [61][62]낮춥니다.V-2의 설계팀은 미국 최초의 인공위성을 [63]발사한 에탄올 연료의 레드스톤 로켓을 포함하여 2차 세계대전 이후 미국의 로켓 개발을 도왔다.에탄올은 현재 경량 로켓으로 움직이는 경주용 [64]항공기에 사용되고 있지만, 보다 에너지 밀도가 높은 로켓 연료가 [62]개발됨에 따라 알코올은 일반적으로 사용되지 않게 되었다.
연료 전지
상업용 연료전지는 개질된 천연가스, 수소 또는 메탄올로 작동한다.에탄올은 광범위한 가용성, 낮은 비용, 높은 순도 및 낮은 독성으로 인해 매력적인 대안입니다.직접 에탄올 연료 전지, 자동 열 개질 시스템 및 열 집적 시스템 등 광범위한 연료 전지 개념이 시행되고 있습니다.에탄올 연료 [65]전지의 상용화를 개시한 시점에는 많은 조직이 있지만, 대부분의 작업은 연구 수준에서 진행되고 있다.
가정용 난방 및 조리
에탄올 벽난로는 가정 난방이나 장식에 사용할 수 있습니다.에탄올은 [66][67]요리용 스토브 연료로도 사용될 수 있다.
공급원료
에탄올은 중요한 산업 성분이다.할로겐화 에틸, 에틸에스테르, 디에틸에테르, 아세트산 및 에틸아민과 같은 다른 유기 화합물의 전구체로 널리 사용되고 있습니다.
용제
에탄올은 분자 구조가 극성, 친수성, 비극성, 소수성 화합물의 용해를 허용하기 때문에 보편적인 용매로 여겨진다.에탄올은 끓는점도 낮기 때문에 다른 화합물을 녹일 때 사용한 용액에서 쉽게 제거되기 때문에 식물성 기름의 추출제로 인기가 있다.대마 오일 추출 방법은 종종 추출 [68]용매로 에탄올을 사용하고, 겨울화라고 알려진 프로세스에서 용액에서 기름, 왁스 및 엽록소를 제거하기 위한 후처리 용매로도 사용합니다.
에탄올은 페인트, 팅크제, 마커, 그리고 구강 세척제, 향수, 탈취제와 같은 개인 관리 제품에서 발견됩니다.단, 알코올의 존재 하에서 다당류가 수용액에서 침전되며, 이 때문에 DNA 및 RNA의 정제에는 에탄올 침전이 사용된다.
저온 액체
낮은 어는점 -173.20°F(-114.14°C)와 낮은 독성 때문에, 에탄올은 때때로 실험실(드라이 아이스 또는 기타 냉각제와 함께)에서 용기를 어는점 이하의 온도로 유지하기 위한 냉각 용기로 사용됩니다.같은 이유로 알코올 온도계의 활성액으로도 사용됩니다.
화학
화학식
에탄올은 2탄소 알코올입니다.그 분자식은32 CHCHOH이다. 대체 표기법은 CH-CH-OH로32 메틸기(CH-3)의 탄소가 메틸렌기2(-CH-)의 탄소에 부착되어 있고, 메틸기(-CH-)의 탄소는 수산기(-OH)의 산소에 부착되어 있음을 나타낸다.그것은 디메틸에테르 구성 이성질체이다.에탄올은 Et와 함께 에틸기25(CH-)를 나타내는 일반적인 유기 화학 표기법을 사용하여 EtOH로 약칭되기도 한다.
물리 속성
에탄올은 휘발성이 있고 냄새가 약간 나는 무색의 액체입니다.그것은 보통 빛에서는 항상 보이지 않는 무연 파란색 불꽃과 함께 타오릅니다.에탄올의 물리적 특성은 주로 수산화기의 존재와 탄소 사슬의 짧음에서 비롯됩니다.에탄올의 하이드록실기는 수소 결합에 참여할 수 있으며, 프로판과 같은 분자량이 비슷한 극성 유기 화합물보다 더 점성이 높고 휘발성이 덜하도록 만듭니다.
에탄올의 공기 중 연소를 위한 단열 화염 온도는 섭씨 2082도 또는 [69]화씨 3779도입니다.
에탄올은 굴절률이 1.36242(θ=589.3nm, 18.35°C 또는 65.03°F)[70]로 물보다 약간 더 굴절된다.에탄올의 삼중점은 4.3 × 10−4 [71]Pa의 압력에서 150 K이다.
용매 특성
에탄올은 아세트산, 아세톤, 벤젠, 사염화탄소, 클로로포름, 디에틸에테르, 에틸렌글리콜, 글리세롤, 니트로메탄, 피리딘 및 톨루엔을 포함한 많은 유기 용제와 혼합 가능한 다용제입니다.주로 요오드, 기침 시럽 [70][72]등의 팅크제를 만드는 용매로 사용됩니다.또한 펜탄 및 헥산과 같은 가벼운 지방족 탄화수소와 트리클로로에탄 및 테트라클로로에틸렌과 [72]같은 지방족 염화물과 혼합할 수 있다.
물과 에탄올의 혼화성은 탄소 [73]수가 증가함에 따라 물의 혼화성이 급격히 감소하는 긴 사슬 알코올(탄소 원자 5개 이상)의 비혼화성과 대조됩니다.에탄올과 알케인의 혼합 가능성은 최대 알케인으로 제한됩니다. 도데칸과 더 높은 알케인과 혼합하면 특정 온도(도데칸의[74] 경우 약 13°C) 미만의 혼합성 갭을 보입니다.혼합성 간격은 알칸이 높을수록 넓어지는 경향이 있으며, 완전한 혼합성을 위한 온도는 높아진다.
에탄올-물 혼합물은 주어진 분수에 있는 개별 성분들의 합보다 부피가 작습니다.동일한 양의 에탄올과 물을 혼합하면 [70][75]1.92 부피의 혼합물만 생성됩니다.에탄올과 물을 혼합하는 것은 발열성이며 298K에서 최대 777J/mol이[76] 방출됩니다.
에탄올과 물의 혼합물은 약 89몰 에탄올과 11몰 물 또는 351K[77](78°C)에서 끓는 정상 압력에서 95.6%(또는 부피 기준 약 97%)의 에탄올 혼합물을 형성한다.이 공생성 조성물은 온도와 압력에 크게 의존하며 303K [78]미만의 온도에서 사라집니다.
수소 결합은 순수 에탄올이 공기 중의 물을 쉽게 흡수할 정도로 흡습성을 일으킨다.히드록실기의 극성은 에탄올이 많은 이온 화합물, 특히 나트륨과 수산화칼륨, 염화마그네슘, 염화칼슘, 염화암모늄, 브롬화암모늄, [72]브롬화나트륨을 용해시킵니다.염화나트륨과 염화칼륨은 [72]에탄올에 약간 용해된다.에탄올 분자는 또한 무극성 끝을 가지고 있기 때문에, 대부분의 에센셜[79] 오일과 수많은 향미료, 착색제, 그리고 약재를 포함한 무극성 물질도 녹일 것입니다.
물에 에탄올을 몇 퍼센트만 첨가해도 물의 표면 장력이 급격히 감소합니다.이 성질은 "와인의 눈물" 현상을 부분적으로 설명한다.와인이 유리잔에 소용돌이칠 때, 에탄올은 유리잔 벽에 있는 와인의 얇은 막에서 빠르게 증발합니다.와인의 에탄올 함량이 감소함에 따라 와인의 표면 장력이 증가하고 얇은 막이 "거품"을 일으키며 부드러운 시트가 아닌 채널을 통해 글라스를 따라 흘러내립니다.
가연성
에탄올-수 용액은 섬광점이라고 불리는 온도 이상으로 가열되면 불이 붙고 점화원은 에탄올-수용액에 [80]도포됩니다.질량 기준 알코올 20%(용적 기준 약 25%)의 경우 약 25°C(77°F)에서 발생합니다.순수 에탄올의 섬광점은 13°C(55°F)[81]이지만 압력 및 습도와 같은 대기 조성에 의해 매우 약간 영향을 받을 수 있습니다.에탄올 혼합물은 평균 실온 이하에서 발화할 수 있습니다.에탄올은 질량 기준 농도 2.35% 이상(부피 기준 3.0%, 6 프루프)[82][83][84]의 가연성 액체(Class 3 유해 물질)로 간주됩니다.
에탄올-물[85][83][86] 혼합물의 섬광점
에탄올
질량분율, %온도 °C 화씨 1 84.5 184.1[83] 2 64 147[83] 2.35 60 140[83][82] 3 51.5 124.7[83] 5 43 109[85] 6 39.5 103.1[83] 10 31 88[85] 20 25 77[83] 30 24 칠십오[85] 40 21.9 71.4[citation needed][85] 50 20 68[85][83] 60 17.9 64.2[citation needed][85] 70 16 61[85] 80 15.8 60.4[83] 90 14 57[85] 100 12.5 54.5[85][83][81]
요리 효과를 위해 알코올을 태운 요리를 플램베라고 합니다.
자연발생
에탄올은 효모의 대사 과정의 부산물이다.따라서, 에탄올은 효모 서식지에 존재할 것이다.에탄올은 과숙된 [87]과일에서 흔히 발견됩니다.공생 효모에 의해 생성된 에탄올은 버탐 야자수 꽃에서 발견될 수 있다.비록 펜타일 나무새와 같은 몇몇 동물 종들은 에탄올을 찾는 행동을 보이지만, 대부분은 [88]에탄올을 함유한 음식 자원에 대한 관심이나 거부감을 보이지 않는다.에탄올은 또한 자연 혐기성 [89]생식의 결과로 많은 식물의 발아 중에 생산된다.에탄올이 우주 공간에서 검출되어 성간 [90]구름에 있는 먼지 알갱이 주위에 얼음 코팅이 형성되었습니다.건강한 [91]지원자의 호흡에서 미량(평균 196ppb)의 내인성 에탄올과 아세트알데히드가 검출되었습니다.자가 양조 증후군은 또한 내장 발효 증후군으로 알려져 있는데, 소화 시스템 [92]내에서 내인성 발효를 통해 알코올 중독량이 생성되는 드문 의학적 질환이다.
생산.
에탄올은 에틸렌의 수화작용을 통해, 그리고 생물학적 과정을 통해 당을 [93]효모로 발효시킴으로써 석유화학으로 생산된다.어떤 과정이 더 경제적인지는 석유와 곡물 사료의 현재 가격에 달려있다.1970년대에 미국의 대부분의 산업용 에탄올은 석유화학제품으로 만들어졌지만, 1980년대에 미국은 옥수수를 기반으로 한 에탄올에 보조금을 도입했고, 오늘날에는 거의 모든 것이 [94]석유화학제품으로 만들어진다.인도에서 에탄올은 [95]사탕수수로 만들어진다.
에틸렌 수화
산업용 공급 원료 또는 용매로 사용되는 에탄올(때로는 합성 에탄올이라고도 함)은 주로 에틸렌의 산 촉매 수화 작용에 의해 석유화학적 공급 원료로 만들어집니다.
- CH
2
4
2 + HO → CHCHOH
3
2
촉매는 가장 일반적으로 실리카 겔 또는 규조토와 같은 다공질 서포트에 흡착되는 [96][97]인산입니다.이 촉매는 1947년 [98]Shell Oil Company에 의해 대규모 에탄올 생산에 처음 사용되었습니다.이 반응은 에틸렌 대 증기비가 5:3으로 [99][100]유지되는 300°C(572°F)에서 고압 증기가 있는 상태에서 수행됩니다.이 과정은 미국에서 Union Carbide Corporation과 다른 회사들에 의해 산업 규모로 사용되었지만, 현재는 LyondellBasell만이 상업적으로 사용합니다.
1930년 유니언 카바이드(Union Carbide)[101]에 의해 산업 규모로 처음 실행되었지만, 현재는 거의 사용되지 않는 에틸렌을 농축 황산과 반응시켜 에탄올을 생성하고 황산을 [102]재생하기 위해 에틸렌을 가수분해함으로써 간접적으로 수화시켰다.
- CH
2
4 + HSO
2
4 → CHCHSOH
3
2
4 - CHCHSOH
3
2
4 + HO
2 → CHCHOH
3
2 + HSO
2
4
CO에서2
에탄올은 생물학적,[103][104] 전기화학적 반응을 통해 이산화탄소를 변환함으로써 실험실에서 생산되었다.
- CO2 + HO
2 → CHCHOH
3
2 + 사이드 제품
발효
알코올 음료와 연료의 에탄올은 발효에 의해 생산된다.특정 종의 효모(예: 사카로미세스 세레비시아)는 당을 대사하여 에탄올과 이산화탄소를 생성한다.다음 화학식은 변환을 요약한 것입니다.
발효는 알코올을 생산하기 위해 적절한 열 조건에서 효모를 배양하는 과정입니다.이 프로세스는 약 35~40°C(95~104°F)에서 수행됩니다.효모에 대한 에탄올의 독성은 양조에 의해 얻을 수 있는 에탄올 농도를 제한하므로, 높은 농도는 강화 또는 증류에 의해 얻어진다.에탄올 내성 효모 균주는 부피 기준 약 18%의 에탄올까지 생존할 수 있습니다.
시리얼과 같은 녹말성 물질로부터 에탄올을 생산하기 위해, 녹말은 먼저 당으로 전환되어야 한다.맥주를 양조할 때, 이것은 전통적으로 곡물이 아밀라아제 효소를 생성하는 발아 또는 맥아를 허용함으로써 달성되었습니다.맥아 알갱이가 으깨질 때, 아밀라아제는 남은 녹말을 설탕으로 변환합니다.
셀룰로오스
에탄올 발효용 당은 셀룰로오스로부터 얻을 수 있다.이 기술을 도입하면 옥수수 굴, 짚, 톱밥과 같은 셀룰로오스 함유 농업 부산물이 재생 에너지 자원으로 바뀔 수 있다.사탕수수 바가스 같은 다른 농업 잔류물과 스위치그래스 같은 에너지 작물도 발효성 [105]당원일 수 있다.
테스트
양조장과 바이오 연료 공장에서는 에탄올 농도를 측정하기 위해 두 가지 방법을 사용합니다.적외선 에탄올 센서는 2900cm의−1 C-H 대역을 사용하여 용해된 에탄올의 진동 주파수를 측정합니다.이 방법은 C-H 밴드를 기준 밴드와 비교하여 에탄올 함량을 계산하는 비교적 저렴한 고체 센서를 사용합니다.이 계산에는 맥주-람버트 법칙이 사용됩니다.또는 비중계를 이용하여 원료의 밀도 및 제품의 밀도를 측정함으로써 발효 중의 비중 변화를 알콜 도수를 나타낸다.이 저렴하고 간접적인 방법은 맥주 양조 업계에서 오랜 역사를 가지고 있습니다.
정화
증류
에틸렌 수화 또는 양조 시 에탄올-물 혼합물이 생성됩니다.대부분의 산업용 및 연료 용도의 경우 에탄올을 정제해야 합니다.대기압에서의 부분 증류는 에탄올을 중량 기준 95.6%(89.5몰%)로 농축할 수 있습니다.이 혼합물은 끓는점이 78.1 °C(172.6 °F)인 공생 로프이며 증류로는 정제할 수 없다.벤젠, 시클로헥산, 헵탄 등의 혼입제를 첨가함으로써 에탄올, 물 및 혼입제를 포함한 새로운 삼원 아제트로프를 형성할 수 있다.이 낮은 끓는 3원짜리 아제트로프는 우선적으로 제거되어 물이 없는 [97]에탄올이 됩니다.
분자 체 및 건조제
증류와는 별도로, 에탄올은 분자 체, 셀룰로오스 또는 옥수수 가루와 같은 건조제를 첨가하여 건조될 수 있다.건조제는 건조하여 [97]재사용할 수 있습니다.분자 체를 사용하여 95.6% 에탄올 [106]용액에서 물을 선택적으로 흡수할 수 있습니다.제올라이트의 일종인 모공 크기 3옹스트롬의 분자 체는 에탄올 분자를 제외한 물 분자를 효과적으로 분리한다.젖은 체를 가열하면 물이 밖으로 배출되어 건조 [107]능력이 재생됩니다.
막과 역삼투
막은 에탄올과 물을 분리하는 데도 사용할 수 있습니다.멤브레인 기반 분리는 기액 평형에 기초하지 않기 때문에 물-에탄올 공조로프의 한계를 따르지 않는다.막은 흔히 하이브리드 막 증류 과정에서 사용됩니다.이 공정은 첫 번째 분리 공정으로 사전 농축 증류 컬럼을 사용합니다.그런 다음 증기 투과 모드 또는 퍼베퍼레이션 모드 중 하나로 작동하는 막으로 추가 분리가 이루어집니다.증기 투과에는 증기막 사료를 사용하고, 침투에는 액체막 사료를 사용합니다.
기타 기술
다음과 [97]같은 다양한 기술이 논의되었습니다.
- 불용성을 이용해 탄산칼륨을 소금에 절이면 에탄올과 물로 상분리가 발생합니다.이는 알코올에 매우 작은 탄산칼륨 불순물을 제공하여 증류를 통해 제거할 수 있습니다.이 방법은 에탄올이 물과 공기로프를 형성하기 때문에 증류에 의한 에탄올의 정화에 매우 유용합니다.
- 카본 나노스피크 필름 위의 구리 나노 입자를 [108]촉매로 사용하여 주변 조건에서 이산화탄소를 에탄올로 직접 전기화학적 환원
- 초임계 이산화탄소에 의한 곡물 매쉬로부터의 에탄올 추출
- 퍼베이포레이션
- 프랙셔널 프리즈(fractional frozing)는 발효 알코올 용액을 농축하는 데도 사용됩니다(예: Applejack(음료수)).
- 압력 스윙 [109]흡착
에탄올 등급
변성 알코올
순수한 에탄올과 알코올 음료는 정신작용성 의약품으로 세금이 많이 부과되지만, 에탄올은 소비를 수반하지 않는 많은 용도를 가지고 있다.이러한 사용에 대한 세금 부담을 완화하기 위해 대부분의 국가에서는 에탄올을 마시기에 부적합한 물질로 만들기 위해 에탄올에 첨가했을 때 세금을 면제합니다.여기에는 벤조산 데나토늄과 같은 역청제와 메탄올, 나프타, 피리딘과 같은 독소가 포함된다.이런 종류의 제품을 변성 [110][111]알코올이라고 합니다.
절대 알코올
절대 알코올 또는 무수 알코올은 수분 함량이 낮은 에탄올을 말합니다.최대 수분 함량이 1%에서 몇ppm(ppm)에 이르는 다양한 등급이 있습니다.물을 제거하기 위해 공생 증류를 사용할 경우, 미량의 물질 분리제(예: 벤젠)[112]가 함유됩니다.절대 알코올은 사람이 마시기 위한 것이 아닙니다.절대 에탄올은 물이 다른 화학물질과 반응하는 실험실 및 산업용 용매 및 연료 알코올로 사용됩니다.분광 에탄올은 자외선 및 가시광선의 흡수율이 낮은 절대 에탄올로서 자외선 가시 분광법에서 [113]용매로 사용하기에 적합합니다.
순수한 에탄올은 미국에서 200프로프로프로프로프로프로프로, 영국 시스템에서는 [114]175도프로프로프로프로프로프로프로프로프로프로프로프로프로프로프로에 해당합니다.
정류주
무수 에탄올 대신 물 4% 함유 에탄올 96%의 공생성 조성물인 정류주류를 다양한 용도로 사용한다.와인 증류주는 약 94%의 에탄올(188프루프)입니다.불순물은 95%(190 프루프) 실험실 [115]에탄올과 다릅니다.
반응
에탄올은 1차 알코올로 분류되는데, 이는 에탄올의 하이드록실기가 부착하는 탄소가 적어도 두 개의 수소 원자를 가지고 있다는 것을 의미한다.많은 에탄올 반응은 수산화기에서 일어난다.
에스테르 형성
산 촉매가 있을 때 에탄올은 카르본산과 반응하여 에틸에스테르와 물을 생성합니다.
산업적으로 대규모로 이루어지는 이 반응은 반응 혼합물이 형성될 때 물을 제거해야 한다.에스테르들은 산이나 염기의 존재 하에서 반응하여 알코올과 소금을 되돌려 줍니다.이 반응은 비누의 준비에 사용되기 때문에 비누화라고 알려져 있다.에탄올은 무기산과 에스테르를 형성할 수도 있다.에탄올을 삼산화황으로 처리하여 황산디에틸과 인산트리에틸을 각각 제조한다.황산디에틸은 유기 합성에 유용한 에틸화제이다.에탄올과 아질산나트륨 및 황산의 반응으로 제조된 아질산 에틸은 이전에는 이뇨제로 사용되었습니다.
탈수
산촉매의 존재 하에서 알코올은 에탄올과 같은 알케인으로 전환될 수 있다.일반적으로 알루미나와 같은 고체산이 사용됩니다.[116]
- CHHOH32 → HC2= CH2 + HO2
물은 같은 분자로부터 제거되기 때문에, 그 반응은 분자내 탈수라고 알려져 있다.알코올의 분자 내 탈수에는 고온과 황산 [117]등의 산성 촉매가 필요합니다.
설탕 유래 에탄올(주로 브라질)에서 생산되는 에틸렌은 나프타 및 에탄과 같은 석유화학 원료에서 생산되는 에틸렌과 경쟁합니다.
분자내 탈수보다 낮은 온도에서 분자간 알코올 탈수가 일어나 대칭 에테르를 생성해도 된다.이것은 응축 반응입니다.다음 예제에서는 에탄올에서 디에틸에테르를 생성합니다.
- 232 CHCHOH → CHCHOCH3223 + HO2[118]
연소
- CHOH25 (l) + 32 O (g) → 2 CO2 (g) + 3 HO2 (l); -δHc = 1371 kJ/mol[119] = 29.8 kJ/g = 327 kcal/g = 7.1 kcal/g
- CHOH25 (l) + 3 O2 (g) → 2 CO2 (g) + 32 HO (g); -δHc = 1236 kJ/mol = 26.8 kJ/g = 295.4 kcal/g = 6.41 kcal/g[120]
비열 = 2.44 kJ/(kg·K)
산염기화학
에탄올은 중성 분자이며 물 속의 에탄올 용액의 pH는 거의 7.00입니다.에탄올은 [73]나트륨과 같은 알칼리 금속과 반응하여 결합염기인 에톡시드 이온(CHCHO32−)으로 정량적으로 변환할 수 있습니다.
- 2CHOH32 + 2Na → 2CHOCNA32 + H2
또는 수소화 나트륨과 같은 매우 강한 염기:
- CHCHOH32 + NaH → CHCHONA322 + H
물과 에탄올의 산성도는 각각 15.7과 16의 pKa에서 알 수 있듯이 거의 동일합니다.따라서 에톡시드나트륨과 수산화나트륨은 밀접하게 균형 잡힌 평형으로 존재합니다.
- CHCHOH32 + NaOH ch32 CHCHONA + HO2
할로겐화
에탄올은 할로겐화 에틸의 전구체로 산업적으로 사용되지 않지만, 그 반응은 예시적이다.에탄올은 할로겐화 수소와 반응하여 S2N 반응을 통해 염화 에틸 및 브롬화 에틸과 같은 할로겐화 에틸을 생성합니다.
- CHCHOH32 + HCl → CHCHCl32 + HO2
이러한 반응에는 [102]염화아연과 같은 촉매가 필요합니다.HBr은 황산 [102]촉매로 환류해야 합니다.할로겐화 에틸은 원칙적으로 염화티오닐 또는 삼염화 [73][102]인과 같은 보다 전문적인 할로겐화제로 에탄올을 처리함으로써 생산될 수 있다.
- CHCHOH32 + SOCl2 → CHCHCl32 + SO2 + HCl
염기가 있는 상태에서 할로겐으로 처리하면, 에탄올은 상응하는 할로폼(CHX, 여기서 X = Cl, Br, I)을3 생성한다.이 변환은 할로포름 [121]반응이라고 불립니다.염소와 반응하는 중간체는 클로로알이라고 불리는 알데히드로 [122]물과 반응할 때 클로로알 하이드레이트를 형성합니다.
- 4 Cl2 + CHCHOH32 → CCLCHO3 + 5 HCl
- CCLCHO3 + HO2 → CCLC3(OH)2h
산화
에탄올은 시약 및 [102]조건에 따라 아세트알데히드로 산화되거나 아세트산으로 산화될 수 있습니다.이 산화는 산업적으로는 중요하지 않지만, 인체에서는 이러한 산화 반응이 간 알코올 탈수소 효소에 의해 촉매된다.에탄올의 산화 생성물인 아세트산은 아세틸 CoA의 전구체이며, 아세틸기는 에너지로 소비되거나 생합성에 사용될 수 있다.
대사
에탄올은 칼로리를 제공한다는 점에서 단백질, 지방, 탄수화물과 같은 대영양소와 유사하다.섭취 및 대사 시 에탄올 [123]대사를 통해 g당 7cal의 열량을 기여합니다.
안전.
순수한 에탄올은 피부와 [124]눈을 자극할 것이다.메스꺼움, 구토, 중독은 섭취의 증상이다.장기간 섭취하면 심각한 간 [125]손상을 초래할 수 있다.1000분의 1 이상의 대기 농도는 유럽연합(EU)의 직업상 피폭 [125]한계치를 초과한다.
역사
설탕을 에탄올에 발효시키는 것은 인간이 사용한 최초의 생명공학 중 하나이다.에탄올은 역사적으로 와인이나 열렬한 영혼,[126] 그리고 아쿠아 비테 또는 아쿠아 비타로 다양하게 식별되어 왔습니다.그것의 중독 효과는 고대부터 알려져 왔다.에탄올은 선사시대부터 알코올 음료의 중독 성분으로 인간에 의해 사용되어 왔다.중국에서 발견된 9000년 된 도자기의 건조 잔여물은 신석기시대 사람들이 [127]술을 마셨음을 시사한다.
포도주의 내뱉는 불타는 성질은 아리스토텔레스 (기원전 384–322), 테오프라스토스 (c.기원전 371–287), 그리고 대 플리니우스 (기원전 23/24–79)[128]와 같은 고대 자연 철학자들에게 이미 알려져 있었다.하지만, 2, 3세기 로마 [129]이집트에서 보다 발전된 증류 기술이 개발되었음에도 불구하고, 이것이 바로 에탄올의 분리로 이어지지는 않았다.자비르 이븐 에이얀(9세기 CE)의 글 중 하나에서 처음 발견된 중요한 인식은 끓는 와인에 소금을 첨가함으로써 와인의 상대적인 휘발성을 증가시킴으로써 결과 증기의 가연성을 높일 [130]수 있다는 것이다.와인의 증류는 알-킨드(c.c.801–873 CE)와 알-파라브(872–950)에 기인하는 아랍어 작품과 알-자흐라위(라틴어: Abulcasis, 936–1013)의 제28권(라틴어: Abulcasis, 936–1013) 키타프(라틴어: Latinfr ()에서 증명된다.12세기에는 와인을 소금으로 증류하여 아쿠아 아렌스(즉, 에탄올)를 만드는 레시피가 라틴어 작품에 등장하기 시작했고, 13세기 말에는 서유럽 [132]화학자들 사이에서 널리 알려진 물질이 되었다.
Taddeo Alderotti (1223–1296)의 연구는 수냉식 스틸을 통해 반복적인 부분 증류를 수반하는 에탄올 농축 방법을 설명하고 있으며, 이를 통해 90%의 에탄올 순도를 [133]얻을 수 있습니다.에탄올의 약효는 빌라노바의 아르날드(1240–c.1311 CE)와 루페시사의 존(1310–1366)에 의해 연구되었으며, 후자는 에탄올을 모든 질병을 예방할 수 있는 생명을 유지하는 물질로 간주했다.[134]
중국에서, 고고학적 증거는 알코올의 진정한 증류가 진 (1115–1234) 또는 남송 (1127–1279) [135]왕조 때 시작되었다는 것을 보여준다.허베이(河北)시 칭룽(靑龍)의 고고학 유적지에서 [135]12세기 것으로 추정되는 유물이 아직도 발견됐다.인도에서는 진정한 알코올 증류가 중동에서 도입되어 [136]14세기까지 델리 술탄국에서 널리 사용되었습니다.
1796년 독일-러시아 화학자 요한 토바이어스 로위츠는 부분적으로 정제된 에탄올(알코올-물 아제트로프)과 과도한 무수 알칼리를 혼합한 다음 혼합물을 약한 열로 [137]증류하여 순수한 에탄올을 얻었습니다.프랑스의 화학자 앙투안 라부아지에가 에탄올을 탄소, 수소, 산소의 화합물로 묘사했고 1807년 니콜라-테오도르 드 소쇠르는 에탄올의 화학식을 [138][139]알아냈다.50년 후, 아치볼드 스콧 쿠퍼는 에탄올의 구조식을 발표했다.그것은 최초로 [140]밝혀진 구조식 중 하나였다.
에탄올은 1825년 마이클 패러데이에 의해 처음으로 합성되었다.그는 황산이 많은 양의 [141]석탄 가스를 흡수할 수 있다는 것을 발견했다.그는 1826년 영국의 화학자 헨리 헤넬에게 그 결과 얻은 용액을 주었는데, 헤넬은 그것이 "술포빈산"[142]을 함유하고 있다는 것을 발견했다.1828년, Hennell과 프랑스의 화학자 Georges-Simon Serullas는 독립적으로 술포빈산이 [143][144]에탄올로 분해될 수 있다는 것을 발견했습니다.따라서, 1825년 패러데이는 현재의 산업 에탄올 [145]합성과 유사한 과정인 산 촉매 수화 작용에 의해 에틸렌(석탄 가스의 성분)에서 에탄올이 생산될 수 있다는 것을 자신도 모르게 발견했다.
에탄올은 1840년 초에 미국에서 램프 연료로 사용되었지만 남북전쟁 동안 산업용 알코올에 부과된 세금으로 인해 사용이 비경제적이었습니다.그 세금은 [146]1906년에 폐지되었다.Ford 모델 T는 가솔린(가솔린) 또는 [147]에탄올로 주행할 수 있으며, 1908년부터 자동차 연료로 사용되었습니다.그것은 몇 개의 램프를 연료로 한다.
산업용으로 의도된 에탄올은 종종 [148]에틸렌에서 생산됩니다.에탄올은 냄새, 향료, 착색료 및 의약품을 포함하여 사람의 접촉이나 소비를 위한 물질의 용매로 널리 사용되고 있습니다.화학에서는 다른 제품의 합성을 위한 용매이자 공급 원료이다.열과 빛의 연료로 오랜 역사를 가지고 있으며 최근에는 내연기관의 연료로도 사용되고 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge, UK: The Royal Society of Chemistry. 2014. p. 30. doi:10.1039/9781849733069-00001. ISBN 978-0-85404-182-4.
- ^ "Methanol". PubChem. PubChem. Retrieved 2 September 2020.
- ^ a b c d Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 3.246. ISBN 1-4398-5511-0.
- ^ Ballinger P, Long FA (1960). "Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds1,2". Journal of the American Chemical Society. 82 (4): 795–798. doi:10.1021/ja01489a008.
- ^ Arnett EM, Venkatasubramaniam KG (1983). "Thermochemical acidities in three superbase systems". J. Org. Chem. 48 (10): 1569–1578. doi:10.1021/jo00158a001.
- ^ Lide DR, ed. (2012). CRC Handbook of Chemistry and Physics (92 ed.). Boca Raton, FL: CRC Press/Taylor and Francis. pp. 6–232.
- ^ Lide DR, ed. (2008). CRC Handbook of Chemistry and Physics (89 ed.). Boca Raton, FL: CRC Press. pp. 9–55.
- ^ "MSDS Ethanol" (PDF). Archived from the original (PDF) on 25 March 2012. Retrieved 8 July 2018.
- ^ "Ethanol". webwiser.nlm.nih.gov. Retrieved 25 June 2021.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0262". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Ethanol". PubChem. National Library of Medicine. Retrieved 28 September 2021.
{{cite web}}: CS1 maint :url-status (링크) - ^ "Ethyl Alcohol" (PDF). Hazardous Substance Fact Sheet. New Jersey Department of Health. Retrieved 28 September 2021.
{{cite web}}: CS1 maint :url-status (링크) - ^ "Ethanol – Compound Summary". The PubChem Project. Bethesda, MD: National Center for Biotechnology Information.
- ^ Liebig J (1834). "Ueber die Constitution des Aethers und seiner Verbindungen" [On the constitution of ether and its compounds]. Annalen der Pharmacie (in German). 9 (22): 1–39. Bibcode:1834AnP...107..337L. doi:10.1002/andp.18341072202.
From page 18: "Bezeichnen wir die Kohlenwasserstoffverbindung 4C + 10H als das Radikal des Aethers mit E2 und nennen es Ethyl, ..." (Let us designate the hydrocarbon compound 4C + 10H as the radical of ether with E2 and name it ethyl ...).
- ^ Harper, Douglas. "ethyl". Online Etymology Dictionary.
- ^ 1892년 국제화학명칭회의에 대한 보고서는 다음을 참조하십시오.
- Armstrong H (1892). "The International Conference on Chemical Nomenclature". Nature. 46 (1177): 56–59. Bibcode:1892Natur..46...56A. doi:10.1038/046056c0.
- 암스트롱의 보고서 영어의 해상도로 암스트롱은 H(1892년):으로 발간된다."국제 회의 화학 품목 분류 표에".이어 해석적·응용 화학. 6(1177년):390–400(398).Bibcode:1892Natur..46...56A.doi:10.1038/046056c0.그 알코올과 페놀은 파생된 탄화 수소, 그 접미사 올(전처예요 pentanol, pentynol 등)로 끝나의 이름으로 불릴 것이다.
- ^ Multhauf, Robert P. (1966). The Origins of Chemistry. London: Oldbourne. ISBN 9782881245947. 페이지 205; OED; etymonline.com
- ^ Berthelot, Marcellin; Houdas, Octave V. (1893). La Chimie au Moyen Âge. Vol. I. Paris: Imprimerie nationale. p. 136.
- ^ Pohorecky, Larissa A.; Brick, John (January 1988). "Pharmacology of ethanol". Pharmacology & Therapeutics. 36 (2–3): 335–427. doi:10.1016/0163-7258(88)90109-X. PMID 3279433.
- ^ McDonnell G, Russell AD (January 1999). "Antiseptics and disinfectants: activity, action, and resistance". Clinical Microbiology Reviews. 12 (1): 147–179. doi:10.1128/CMR.12.1.147. PMC 88911. PMID 9880479.
- ^ "Chemical Disinfectants Disinfection & Sterilization Guidelines Guidelines Library Infection Control CDC". www.cdc.gov. Retrieved 29 January 2018.
- ^ "Why is 70% ethanol used for wiping microbiological working areas?". ResearchGate. Retrieved 29 January 2018.
- ^ "Ethanol". www.drugbank.ca. Retrieved 28 January 2019.
- ^ Scalley R (September 2002). "Treatment of Ethylene Glycol Poisoning". American Family Physician. 66 (5): 807–813. PMID 12322772. Retrieved 15 January 2018.
- ^ Beauchamp, GA; Valento, M (September 2016). "Toxic Alcohol Ingestion: Prompt Recognition And Management In The Emergency Department". Emergency Medicine Practice. 18 (9): 1–20. PMID 27538060.
- ^ Sasanami, Misa; Yamada, Taihei; Obara, Takafumi; Nakao, Atsunori; Naito, Hiromichi (2020). "Oral Ethanol Treatment for Ethylene Glycol Intoxication". Cureus. 12 (12): e12268. doi:10.7759/cureus.12268. ISSN 2168-8184. PMC 7827791. PMID 33510981.
- ^ Anseeuw, Kurt; Sabbe, Marc B.; Legrand, Annemie (April 2008). "Methanol poisoning: the duality between 'fast and cheap' and 'slow and expensive'". European Journal of Emergency Medicine. 15 (2): 107–109. doi:10.1097/MEJ.0b013e3282f3c13b. ISSN 0969-9546. PMID 18446077. S2CID 23861841.
- ^ "Alcohol Content in Common Preparations" (PDF). Medical Society of the State of New York. Retrieved 8 October 2019.
- ^ Adams KE, Rans TS (December 2013). "Adverse reactions to alcohol and alcoholic beverages". Annals of Allergy, Asthma & Immunology. 111 (6): 439–445. doi:10.1016/j.anai.2013.09.016. PMID 24267355.
- ^ Zuccotti GV, Fabiano V (July 2011). "Safety issues with ethanol as an excipient in drugs intended for pediatric use". Expert Opinion on Drug Safety. 10 (4): 499–502. doi:10.1517/14740338.2011.565328. PMID 21417862. S2CID 41876817.
- ^ Farrés J, Moreno A, Crosas B, Peralba JM, Allali-Hassani A, Hjelmqvist L, et al. (September 1994). "Alcohol dehydrogenase of class IV (sigma sigma-ADH) from human stomach. cDNA sequence and structure/function relationships". European Journal of Biochemistry. 224 (2): 549–557. doi:10.1111/j.1432-1033.1994.00549.x. PMID 7925371.
- ^ Edenberg HJ, McClintick JN (December 2018). "Alcohol Dehydrogenases, Aldehyde Dehydrogenases, and Alcohol Use Disorders: A Critical Review". Alcoholism, Clinical and Experimental Research. 42 (12): 2281–2297. doi:10.1111/acer.13904. PMC 6286250. PMID 30320893.
- ^ Heit, C.; Dong, H.; Chen, Y.; Thompson, D.C.; Dietrich, R.A.; Vasiliou, V.K. (2013). "The Role of CYP2E1 in Alcohol Metabolism and Sensitivity in the Central Nervous System". Sub-cellular Biochemistry. 67: 235–237. doi:10.1007/978-94-007-5881-0_8. ISBN 978-94-007-5880-3. PMC 4314297. PMID 23400924.
- ^ "Alcohol Metabolism: An Update". NIAA Publications. National Institute of Health. Retrieved 10 March 2021.
- ^ a b Eng MY, Luczak SE, Wall TL (2007). "ALDH2, ADH1B, and ADH1C genotypes in Asians: a literature review". Alcohol Research & Health. 30 (1): 22–27. PMC 3860439. PMID 17718397.
- ^ 알코올 사용 및 안전한 음주.미국 국립 보건원
- ^ a b Eyidogan M, Ozsezen AN, Canakci M, Turkcan A (2010). "Impact of alcohol–gasoline fuel blends on the performance and combustion characteristics of an SI engine". Fuel. 89 (10): 2713–2720. doi:10.1016/j.fuel.2010.01.032.
- ^ a b Thomas, George: (99.6KB).리버모어, 캘리포니아샌디아 국립 연구소.2000.
- ^ Thomas G (2000). "Overview of Storage Development DOE Hydrogen Program" (PDF). Sandia National Laboratories. Retrieved 1 August 2009.
- ^ "Availability of Sources of E85". Clean Air Trust. Retrieved 27 July 2015.
- ^ "Fuel ethanol production worldwide". Statista. Retrieved 2 June 2021.
- ^ Reel M (19 August 2006). "Brazil's Road to Energy Independence". The Washington Post.
- ^ Green R. "Model T Ford Club Australia (Inc.)". Archived from the original on 14 January 2014. Retrieved 24 June 2011.
- ^ "Ethanol 101". American Coalition for Ethanol.
- ^ Energy Future Coalition. "The Biofuels FAQs". The Biofuels Source Book. United Nations Foundation. Archived from the original on 19 February 2011.
- ^ Malaquias, Augusto César Teixeira; Netto, Nilton Antonio Diniz; Filho, Fernando Antonio Rodrigues; da Costa, Roberto Berlini Rodrigues; Langeani, Marcos; Baêta, José Guilherme Coelho (18 November 2019). "The misleading total replacement of internal combustion engines by electric motors and a study of the Brazilian ethanol importance for the sustainable future of mobility: a review". Journal of the Brazilian Society of Mechanical Sciences and Engineering. 41 (12): 567. doi:10.1007/s40430-019-2076-1. ISSN 1806-3691.
- ^ California Air Resources Board (October 1989). "Definition of a Low Emission Motor Vehicle in Compliance with the Mandates of Health and Safety Code Section 39037.05, second release". Archived from the original on 18 February 2018. Retrieved 18 February 2018.
- ^ Lowi A, Carter WP (March 1990). A Method for Evaluating the Atmospheric Ozone Impact of Actual Vehicle emissions. S.A.E. Technical Paper. Warrendale, PA.
- ^ Jones TT (2008). "The Clean Fuels Report: A Quantitative Comparison Of Motor (engine) Fuels, Related Pollution and Technologies". researchandmarkets.com. Archived from the original on 9 September 2012.
- ^ Tao R (16–20 August 2010). Electro-rheological Fluids and Magneto-rheological Suspensions. Proceedings of the 12th International Conference. Philadelphia: World Scientific. ISBN 9789814340229.
- ^ Biello D. "Want to Reduce Air Pollution? Don't Rely on Ethanol Necessarily". Scientific American. Retrieved 11 July 2017.
- ^ "Adoption of the Airborne Toxic Control Measure to Reduce Formaldehyde Emissions from Composite Wood Products". Chicago & Washington, DC: Window and Door Manufacturers Association. 30 July 2008. Archived from the original on 9 March 2010.
- ^ "2008 World Fuel Ethanol Production". Ellisville, MO: Renewable Fuels Association. Archived from the original on 24 September 2015. Retrieved 21 February 2011.
- ^ "Tecnologia flex atrai estrangeiros". Agência Estado.
- ^ "First Commercial U.S. Cellulosic Ethanol Biorefinery Announced". Renewable Fuels Association. 20 November 2006. Retrieved 31 May 2011.
- ^ 음식, 사료, 연료용 달콤한 수수 2008년 1월 New Agriculturalist.
- ^ 사탕수수 에탄올 가치사슬 ICRISAT 개발, 2013
- ^ Horn M, Krupp F (16 March 2009). Earth: The Sequel: The Race to Reinvent Energy and Stop Global Warming. Physics Today. Vol. 62. pp. 63–65. Bibcode:2009PhT....62d..63K. doi:10.1063/1.3120901. ISBN 978-0-393-06810-8.
- ^ 정비사들은 소형 엔진을 손상시키는 에탄올을 보았다, NBC 뉴스, 2008년 1월 8일
- ^ Clark, John D. (2017). Ingnition! An Informal History of Liquid Rocket Propellants. New Brunswick, NJ: Rutgers University Press. p. 9. ISBN 978-0-8135-9583-2.
- ^ Darling D. "The Internet Encyclopedia of Science: V-2".
- ^ a b 브레이니그, 로버트 A. "로켓 추진제" (웹사이트)Rocket & Space Technology, 2006.2007년 8월 23일 취득.
- ^ "로켓의 역사"2006년 8월 5일, science.ksc.nasa.gov 경유로 Wayback Machine NASA 이력 아카이브에 아카이브.
- ^ Chow D (26 April 2010). "Rocket Racing League Unveils New Flying Hot Rod". Space.com. Retrieved 27 April 2010.
- ^ Badwal SP, Giddey S, Kulkarni A, Goel J, Basu S (May 2015). "Direct ethanol fuel cells for transport and stationary applications – A comprehensive review". Applied Energy. 145: 80–103. doi:10.1016/j.apenergy.2015.02.002.
- ^ "Can Ethanol Fireplaces Be Cozy?". Wall Street Journal. Retrieved 2 March 2016.
- ^ "Low-concentration ethanol stove for rural areas in India, Energy for Sustainable Development, March 2007". CiteSeerX 10.1.1.142.5846.
- ^ "Your Guide to Ethanol Extraction". Cannabis Business Times. Retrieved 9 April 2019.
- ^ "Flame Temperature Analysis and NOx Emissions for Different Fuels". Mississippi State Department of Chemical Engineering.
- ^ a b c Lide DR, ed. (2000). CRC Handbook of Chemistry and Physics 81st edition. CRC press. ISBN 978-0-8493-0481-1.
- ^ "What is the triple point of alcohol?". Webanswers.com. 31 December 2010. Archived from the original on 14 May 2013.[과학적 인용 필요]
- ^ a b c d Windholz M (1976). The Merck index: an encyclopedia of chemicals and drugs (9th ed.). Rahway, NJ: Merck. ISBN 978-0-911910-26-1.[페이지 필요]
- ^ a b c Morrison RT, Boyd RN (1972). Organic Chemistry (2nd ed.). Allyn and Bacon, inc. ISBN 978-0-205-08452-4.[페이지 필요]
- ^ Dahlmann U, Schneider GM (1989). "(Liquid + liquid) phase equilibria and critical curves of (ethanol + dodecane or tetradecane or hexadecane or 2,2,4,4,6,8,8-heptamethylnonane) from 0.1 MPa to 120.0 MPa". J Chem Thermodyn. 21 (9): 997–1004. doi:10.1016/0021-9614(89)90160-2.
- ^ "Ethanol". Encyclopedia of chemical technology. Vol. 9. 1991. p. 813.
- ^ Costigan MJ, Hodges LJ, Marsh KN, Stokes RH, Tuxford CW (1980). "The Isothermal Displacement Calorimeter: Design Modifications for Measuring Exothermic Enthalpies of Mixing". Aust. J. Chem. 33 (10): 2103. Bibcode:1982AuJCh..35.1971I. doi:10.1071/CH9802103.
- ^ Lei Z, Wang H, Zhou R, Duan Z (2002). "Influence of salt added to solvent on extractive distillation". Chem. Eng. J. 87 (2): 149–156. doi:10.1016/S1385-8947(01)00211-X.
- ^ Pemberton RC, Mash CJ (1978). "Thermodynamic properties of aqueous non-electrolyte mixtures II. Vapour pressures and excess Gibbs energies for water + ethanol at 303.15 to 363.15 K determined by an accurate static method". J Chem Thermodyn. 10 (9): 867–888. doi:10.1016/0021-9614(78)90160-X.
- ^ 머크 화학 및 의약품 지수, 제9판; 논문 6575~6669
- ^ "Flash Point and Fire Point". Nttworldwide.com. Archived from the original on 14 December 2010.
- ^ a b NFPA 325: Guide to Fire Hazard Properties of Flammable Liquids, Gases, and Volatile Solids. Quincy, MA: National Fire Protection Association (NFPA). 1 January 1994.
- ^ a b "49 CFR § 173.120 - Class 3 – Definitions". Legal Information Institute.
a flammable liquid (Class 3) means a liquid having a flash point of not more than 60 °C (140 °F)
- ^ a b c d e f g h i j k Martínez, P.J.; Rus, E.; Compaña, J.M. "Flash Point Determination of Binary Mixtures of Alcohols, Ketones and Water". Departamento de Ingeniería Química. Facultad de Ciencias.: 3.
Page 3, Table 4
- ^ "49 CFR § 172.101 – Purpose and use of hazardous materials table". Legal Information Institute.
Hazardous materials descriptions and proper shipping names: Ethanol or Ethyl alcohol or Ethanol solutions or Ethyl alcohol solutions; Hazard class or Division: 3; Identification Numbers: UN1170; PG: II; Label Codes: 3;
- ^ a b c d e f g h i j Ha, Dong-Myeong; Park, Sang Hun; Lee, Sungjin (April 2015). "The Measurement of Flash Point of Water-Methanol and Water-Ethanol Systems Using Seta Flash Closed Cup Tester". Fire Science and Engineering. 29 (2): 39–43. doi:10.7731/KIFSE.2015.29.2.039.
Page 4, Table 3
- ^ "Flash points of ethanol-based water solutions". Engineeringtoolbox.com. Retrieved 23 June 2011.
- ^ Dudley R (August 2004). "Ethanol, fruit ripening, and the historical origins of human alcoholism in primate frugivory". Integrative and Comparative Biology. 44 (4): 315–323. doi:10.1093/icb/44.4.315. PMID 21676715.
- ^ Graber C (2008). "Fact or Fiction?: Animals Like to Get Drunk". Scientific American. Retrieved 23 July 2010.
- ^ Leblová S, Sinecká E, Vaníčková V (1974). "Pyruvate metabolism in germinating seeds during natural anaerobiosis". Biologia Plantarum. 16 (6): 406–411. doi:10.1007/BF02922229. S2CID 34605254.
- ^ Schriver A, Schriver-Mazzuoli L, Ehrenfreund P, d'Hendecourt L (2007). "One possible origin of ethanol in interstellar medium: Photochemistry of mixed CO2–C2H6 films at 11 K. A FTIR study". Chemical Physics. 334 (1–3): 128–137. Bibcode:2007CP....334..128S. doi:10.1016/j.chemphys.2007.02.018.
- ^ Turner C, Spanel P, Smith D (2006). "A longitudinal study of ethanol and acetaldehyde in the exhaled breath of healthy volunteers using selected-ion flow-tube mass spectrometry". Rapid Communications in Mass Spectrometry. 20 (1): 61–68. Bibcode:2006RCMS...20...61T. doi:10.1002/rcm.2275. PMID 16312013.
- ^ Doucleff M (17 September 2013). "Auto-Brewery Syndrome: Apparently, You Can Make Beer In Your Gut". NPR.
- ^ Mills GA, Ecklund EE (1987). "Alcohols as Components of Transportation Fuels". Annual Review of Energy. 12: 47–80. doi:10.1146/annurev.eg.12.110187.000403.
- ^ Wittcoff HA, Reuben BG, Plotkin JS (2004). Industrial Organic Chemicals. John Wiley & Sons. pp. 136–. ISBN 978-0-471-44385-8.
- ^ Swami, V.N. (2020). विद्याभराती जिल्हा मध्यवर्ती सहकारी बँक भारती परीक्षा मार्गदर्शक [Vidyabharti District Co-operative Bank recruitment examination guide (Bank clerk grade examination)] (in Marathi). Latur, Maharashtra, India: Vidyabharti Publication. p. 119.
- ^ Roberts JD, Caserio MC (1977). Basic Principles of Organic Chemistry. W. A. Benjamin, Inc. ISBN 978-0-8053-8329-4.[페이지 필요]
- ^ a b c d Kosaric N, Duvnjak Z, Farkas A, Sahm H, Bringer-Meyer S, Goebel O, Mayer D (2011). "Ethanol". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 1–72. doi:10.1002/14356007.a09_587.pub2. ISBN 9783527306732.(설명 필요)
- ^ "Ethanol". Encyclopedia of chemical technology. Vol. 9. 1991. p. 82.
- ^ 에탄올.essentialchemicalindustry.org
- ^ Harrison, Tim (2014년 5월) 대학생을 위한 촉매 웹 페이지 V1_0.Bristol ChemLabS, Bristol 대학교 화학대학원
- ^ Lodgsdon JE (1991). "Ethanol". In Howe-Grant, Mary, Kirk, Raymond E., Othmer, Donald F., Kroschwitz, Jacqueline I. (eds.). Encyclopedia of chemical technology. Vol. 9 (4th ed.). New York: Wiley. p. 817. ISBN 978-0-471-52669-8.
- ^ a b c d e Streitwieser A, Heathcock CH (1976). Introduction to Organic Chemistry. MacMillan. ISBN 978-0-02-418010-0.
- ^ Liew F, Henstra AM, Köpke M, Winzer K, Simpson SD, Minton NP (March 2017). "Metabolic engineering of Clostridium autoethanogenum for selective alcohol production". Metabolic Engineering. 40: 104–114. doi:10.1016/j.ymben.2017.01.007. PMC 5367853. PMID 28111249.
- ^ "Solar-to-Fuel System Recycles CO2 for Ethanol and Ethylene". News Center. 18 September 2017. Retrieved 19 September 2017.
- ^ Clines T (July 2006). "Brew Better Ethanol". Popular Science Online. Archived from the original on 3 November 2007.
- ^ Chemists, American Association of Cereal (1986). Advances in Cereal Science and Technology. American Association of Cereal Chemists, Incorporated. ISBN 9780913250457.
- ^ Dale Callaham, Molecular Sieve Information
- ^ Song Y, Peng R, Hensley DK, Bonnesen PV, Liang L, Wu Z, Meyer HM, Chi M, Ma C, Sumpter BG, Rondinone AJ (2016). "High-Selectivity Electrochemical Conversion of CO2 to Ethanol using a Copper Nanoparticle/N-Doped Graphene Electrode". ChemistrySelect. 1 (Preprint): 6055–6061. doi:10.1002/slct.201601169.
- ^ Jeong J, Jeon H, Ko K, Chung B, Choi G (2012). "Production of anhydrous ethanol using various PSA (Pressure Swing Adsorption) processes in pilot plant". Renewable Energy. 42: 41–45. doi:10.1016/j.renene.2011.09.027.
- ^ "U-M Program to Reduce the Consumption of Tax-free Alcohol; Denatured Alcohol a Safer, Less Expensive Alternative" (PDF). University of Michigan. Archived from the original (PDF) on 27 November 2007. Retrieved 29 September 2007.
- ^ 영국(2005년).변성 알코올 규제 2005.법정계정 2005년 제1524호
- ^ Bansal RK, Bernthsen A (2003). A Textbook of Organic Chemistry. New Age International Limited. pp. 402–. ISBN 978-81-224-1459-2.
- ^ Christian GD (2004). "Solvents for Spectrometry". Analytical chemistry. Vol. 1 (6th ed.). Hoboken, NJ: John Wiley & Sons. p. 473. ISBN 978-0471214724.
- ^ Andrews S (1 August 2007). Textbook Of Food & Bevrge Mgmt. Tata McGraw-Hill Education. pp. 268–. ISBN 978-0-07-065573-7.
- ^ Kunkee RE, Amerine MA (July 1968). "Sugar and alcohol stabilization of yeast in sweet wine". Applied Microbiology. 16 (7): 1067–1075. doi:10.1128/AEM.16.7.1067-1075.1968. PMC 547590. PMID 5664123.
- ^ Zimmermann, Heinz; Walz, Roland (2008). "Ethylene". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a10_045.pub3. ISBN 978-3527306732.
- ^ "14.4: Dehydration Reactions of Alcohols". Chemistry LibreTexts. 9 February 2016. Retrieved 9 May 2022.
- ^ "Alkenes from Dehydration of Alcohols". Chemistry LibreTexts. 2 October 2013. Retrieved 9 May 2022.
- ^ Rossini FD (1937). "Heats of Formation of Simple Organic Molecules". Ind. Eng. Chem. 29 (12): 1424–1430. doi:10.1021/ie50336a024.
- ^ CRC Handbook of Chemistry and Physics, 제49판, 1968-1969년의 생성 열로부터 계산된다.
- ^ Chakrabartty SK (1978). Trahanovsky WS (ed.). Oxidation in Organic Chemistry. New York: Academic Press. pp. 343–370.
- ^ Reinhard J, Kopp E, McKusick BC, Röderer G, Bosch A, Fleischmann G (2007). "Chloroacetaldehydes". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a06_527.pub2. ISBN 978-3527306732.
- ^ Cederbaum, Arthur I (16 November 2012). "Alcohol Metabolism". Clinics in Liver Disease. 16 (4): 667–685. doi:10.1016/j.cld.2012.08.002. ISSN 1089-3261. PMC 3484320. PMID 23101976.
- ^ 회의록유해화학물질 데이터의 분류 및 특성에 관한 기술위원회(2010년 1월 12일-13일).
- ^ a b "Safety data for ethyl alcohol". University of Oxford. 9 May 2008. Retrieved 3 January 2011.
- ^ 윌리엄 캠벨 오틀리, 화학 및 광물학 사전(1826) "알코올" 항목 참조
- ^ Roach J (18 July 2005). "9,000-Year-Old Beer Re-Created From Chinese Recipe". National Geographic News. Retrieved 3 September 2007.
- ^ Berthelot & Houdas 1893, vol.I, 137페이지
- ^ Berthelot & Houdas 1893, vol.I, 페이지 138-139.
- ^ al-Hassan, Ahmad Y. (2009). "Alcohol and the Distillation of Wine in Arabic Sources from the 8th Century". Studies in al-Kimya': Critical Issues in Latin and Arabic Alchemy and Chemistry. Hildesheim: Georg Olms Verlag. pp. 283–298. (저작자 웹사이트에서도 같은 내용을 볼 수 있습니다).
- ^ al-Hassan 2009 (저자 웹사이트에서도 같은 내용을 이용할 수 있습니다); cf.Berthelot & Houdas 1893, vol.I, 페이지 141, 143때때로, 유황도 와인에 첨가되었다(Berthelot & Houdas 1893, vol. 참조).I, 페이지 143).
- ^ 물타우프 1966, 페이지 204-206.
- ^ Holmyard, Eric John (1957). Alchemy. Harmondsworth: Penguin Books. ISBN 978-0-486-26298-7. 페이지 51~52.
- ^ Principe, Lawrence M. (2013). The Secrets of Alchemy. Chicago: The University of Chicago Press. ISBN 978-0226103792. 페이지 69-71.
- ^ a b Haw SG (2006). "Wine, women and poison". Marco Polo in China. Routledge. pp. 147–148. ISBN 978-1-134-27542-7. Retrieved 10 July 2016.
The earliest possible period seems to be the Eastern Han dynasty... the most likely period for the beginning of true distillation of spirits for drinking in China is during the Jin and Southern Song dynasties
- ^ Habib, Irfan (2011). Economic History of Medieval India, 1200-1500. Pearson Education India. pp. 55–. ISBN 978-81-317-2791-1.
- ^ Lowitz T (1796). "Anzeige eines, zur volkommen Entwasserung des Weingeistes nothwendig zu beobachtenden, Handgriffs" [Report of a task that must be done for the complete dehydration of wine spirits [i.e., alcohol-water azeotrope])]. Chemische Annalen für die Freunde der Naturlehre, Aerznengelartheit, Haushaltungskunde und Manufakturen (in German). 1: 195–204.
See pp. 197–198: Lowitz dehydrated the azeotrope by mixing it with a 2:1 excess of anhydrous alkali and then distilling the mixture over low heat.
- ^ Chisholm, Hugh, ed. (1911). . Encyclopædia Britannica. Vol. 1 (11th ed.). Cambridge University Press. pp. 525–527.
- ^ 드 소쉬르 T(1807년)."Mémoire 데 라 작문 드 l'alcohol 것은 드 l'éther sulfurique sur".저널 드 Physique, 드 Chimie,d'Histoire사 박물관 에 예술. 64:316–354.그의 1807년 논문에서, 초심만 대략, 에탄올 더 정확한 분석 그의 1814년 종이의 페이지 300에 드 소쉬르, 테오도르(1814년) 나타나는 에탄올의 구성을 결정했습니다."Nouvelles 관찰 불구하고la 작문 드 l'alcool 것은 드 l'éther sulfurique".Annales 드 Chimie 에 드 Physique.89:273–305.
- ^ Couper AS (1858). "On a new chemical theory" (online reprint). Philosophical Magazine. 16 (104–116). Retrieved 3 September 2007.
- ^ 패러데이 M(1825년)."탄소와 수소의 새로운 혼합물, 그리고 정확한 다른 제품에 석유의 분해 과정 동안 열에 의해 입수".왕립 협회 런던. 115의 철학적 거래는 반드시:440–466. doi:10.1098/rstl.1825.0022.페이지 448에 대한 각주에서, 패러데이의 산성 용액 석탄 가스와 coal-gas에서 액션;특히,"[황산]산성 직접 탄소와 수소와 결합하여 유분,[결과 화합물은]기지와 결합되어 난[그것]은 sulphovinates,[즉, 에틸 sulfates]를 닮은 염류의 특이한 수업을 형성하다고 지적했습니다.아직 그들과 다르지 않다.
- ^ Hennell H(1826년)."황산과 술의 상호 작용, 구성에 관한 결과 화합물의 관찰 및 속성으로".왕립 협회 런던. 116의 철학적 거래는 반드시:240–249. doi:10.1098/rstl.1826.0021.S2CID 98278290.페이지 248일, Hennell 언급은 페러데이는 그와 그가 그 제품에"sulphovinic 산성"(ethyl 황산 수소염.)을 포함한 것을 발견(Hennell)는 석탄의 용존 기체의 황산을 주었다.
- ^ Hennell H (1828). "On the mutual action of sulfuric acid and alcohol, and on the nature of the process by which ether is formed". Philosophical Transactions of the Royal Society of London. 118: 365–371. doi:10.1098/rstl.1828.0021. S2CID 98483646. 368페이지에서 Hennell은 "술포빈산"(황산 에틸)에서 에탄올을 생산합니다.
- ^ Sérullas G(1828년).가이 드 Morveau L, 게이뤼삭 JL, 프랑스의 물리학자 F, 미셸 외젠 Chevreul, Marcellin 베르 틀로,Éleuthère Élie 니콜라스 Mascart,. 헬러(eds.)."것은 데 produitsrésultent enqui 드 l'action 드 l'acidesulfurique 제공하는 l'alcool,".Annales 드 Chimie 에 드 Physique.39:152–186.158페이지에, Sérullas을 호명해 술의"황산 산성d'hydrogène carboné"(탄화 수소 산성 황산)에서 생산.
- ^ 1855년, 프랑스 화학자 마르셀린 베르텔로는 순수한 에틸렌으로부터 에탄올을 준비함으로써 패러데이의 발견을 확인했습니다.Berthelot M (1855). Arago F, Gay-Lussac JL (eds.). "Sur la formation de l'alcool au moyen du bicarbure d'hydrogène (On the formation of alcohol by means of ethylene)". Annales de Chimie et de Physique. 43: 385–405. (주의:Berthelot의 논문의 화학식은 그 당시 화학자들이 원소에 대해 잘못된 원자 질량을 사용했기 때문에 틀렸다. 예를 들어 탄소 (12개 대신 6개), 산소 (16개 대신 8개) 등이다.
- ^ Siegel R (15 February 2007). "Ethanol, Once Bypassed, Now Surging Ahead". NPR. Retrieved 22 September 2007.
- ^ DiPardo J. "Outlook for Biomass Ethanol Production and Demand" (PDF). United States Department of Energy. Archived from the original (PDF) on 24 September 2015. Retrieved 22 September 2007.
- ^ Myers RL, Myers RL (2007). The 100 most important chemical compounds: a reference guide. Westport, CN: Greenwood Press. p. 122. ISBN 978-0-313-33758-1.
추가 정보
- 를 클릭합니다Boyce JM, Pittet D (2003). "Hand Hygiene in Healthcare Settings". Atlanta, GA: Centers for Disease Control..
- Onuki S, Koziel JA, van Leeuwen J, Jenks WS, Grewell D, Cai L (June 2008). Ethanol production, purification, and analysis techniques: a review. 2008 ASABE Annual International Meeting. Providence, RI. Retrieved 16 February 2013.
- "Explanation of US denatured alcohol designations". Sci-toys.
- Lange, Norbert Adolph (1967). John Aurie Dean (ed.). Lange's Handbook of Chemistry (10th ed.). McGraw-Hill.
외부 링크
- 주기적 비디오 표(노팅엄 대학교)의 알코올(에탄올)
- 국제 노동 기구 에탄올 안전 정보
- 국가 오염 물질 목록 – 에탄올 팩트 시트
- CDC – NIOSH 화학적 위험에 대한 포켓 가이드 – 에틸 알코올
- 에탄올에 관한 미국 국립표준기술연구소
- 시카고 상품거래소(Board of Trade)의 에탄올 선물 관련 뉴스 및 시장 데이터
- 에탄올의 증기압, 액체밀도, 동적 액체점도, 표면장력 계산
- 에탄올의 역사 에탄올의 역사를 살펴봅니다.
- ChemSub 온라인:에틸알코올
- 에틸렌과 황산을 이용한 산업용 에탄올 생산 공정 흐름도