폴리인
Polyyne화학에서 폴리인(/folyyne)은 단일 결합과 삼중 결합이 교대로 이루어지는 모든 유기 화합물이다. 즉, n이 1보다 큰 일련의 연속 알키인(-CcC-)
n이다. 이러한 화합물을 폴리아세틸렌이라고도 부르는데,[1] 특히 천연물과 화학생태학 문헌에서는 이러한 명칭이 단일 결합과 이중 결합(-CR=CR--)으로 이루어진 아세틸렌 중합체를 보다 적절하게 언급하고 있다. 그것들은 또한 때때로 시리즈의 궁극적인 구성원이 될 탄소의 가상적인 할당로프인 "
∞카빈" (-C-C-) 뒤에 올리고이,[2][needs IPA] 또는 카르비노이드라고 불리기도 한다.[3][4] 이 물질의 합성은 1960년대 이후 여러 차례 주장되어 왔지만, 그러한 보도는 논란이 되어왔다.[5] 사실, 많은 초기 유기 합성 시도에서[6] "카빈"의 짧은 사슬로 확인된 물질들은 오늘날 폴리인이라고 불릴 것이다.
가장 간단한 폴리인은 디아세틸렌 또는 부타디엔, H-C≡C-C≡C-H이다. 큐뮬렌과 함께 폴리인은 경직성과 높은 전도도로 다른 유기체 사슬과 구별되는데, 이 둘 다 분자 나노기술 분야에서 유망하게 만든다. 수소가 부족한 성간 분자구름에서 다연체가 검출됐다.
합성
폴리인의 최초 보고된 합성은 1869년 칼 안드레아스 글레이저에 의해 수행되었는데, 그는 구리 페닐아세틸라이드(CuCCH265)가 공기 존재에서 산화성 조광화를 거쳐 디페닐부타디니(CHCCH65465)를 생성하는 것을 관찰했다.[4]
이러한 화합물에 대한 관심은 몇 가지 일반적인 경로에 의한 유기적 합성에 의한 준비 연구를 자극했다. 주요 합성 도구로서 일반적으로 글레이저 커플링이나 그와 관련된 엘린튼 및 헤이 프로토콜과 같은 아세틸렌 호모커플링 반응이 사용된다.[7][4] 또한 그러한 절차의 많은 부분은 두 개의 분리된 알키네 빌딩 블록을 결합하거나 미리 형성된 폴리이네 유닛의 알키화를 통해 카디오트-초키에비치 결합 또는 유사한 반응을 수반한다.[8] 게다가 프리츠-부텐베르그-도요.위셸 재배치는 가장 오래 알려진 폴리네(C44)를 합성하는 과정에서 중요한 단계로 사용되었다.[9] 클로로비닐실레인 제거는 가장 긴 것으로 알려진 페닐 엔드-캡 폴리아인 합성의 최종 단계로 사용되었다.[10]
유기농 및 유기농 폴리네시아
다양한 기법을 사용하여 1950년대에는 n이 4 또는 5인 폴리네시아 H(-C≡C-)
nH가 합성되었다.[11] 1971년경 T. R. Johnson과 D. R. M. Walton은 Hay의 촉매(동(I)-–)를 이용한 연쇄붕괴 반응 중 폴리인 체인을 보호하기 위해 보통 R이 에틸 그룹이었던 -SiR
3 형식의 엔드캡을 사용하게 되었다.TMEDA 복합체).[11][12] 그러한 기법으로 그들은 순수 상태에서 n까지 최대 8까지 그리고 용액에서 최대 16까지 EtSi-
3(C≡C)-
nSiet과
3 같은 폴리네를 얻을 수 있었다. 후에 Tykwinski와 동료들은 최대 C까지20 체인 길이를 가진 iPrSi-
3(C≡C)-
nSiiPr
3 폴리네스를 얻을 수 있었다.[13]
프레셰트형 방향족 폴리에테르 덴드리머로 끝부분을 덮은 10개의 아세틸렌 단위(20개의 원자)의 폴리인 화합물이 2002년에 분리되어 특징지어졌다.[2] 또한, 최대 8개의 아세틸렌 단위를 가진 다이샤노폴리네스의 합성이 보고되었다.[14] 가장 긴 페닐 엔드-캡슐 폴리네시아는 2007년에 콕스와 동료들에 의해 보고되었다.[10] 2010년 현재 가장 긴 체인이지만 격리된 폴리인은 22개의 아세틸렌 단위(44개의 원자)를 가지고 있으며 트리스(3,5-di-t-butyl-phenyl) 메틸 그룹과 끝부분을 이루고 있다.[9]
부분적으로 산화된 구리(I) 아세틸라이드(
nCu+
)
2C2−
2(Cu)C (1856년 이전부터 알려진 아세틸렌 유도체)의 염산 분해물에서 2 ~ 6의 공식 H(-C andC-)H와 n을 가진 알키네스를 검출할 수 있다. 분해에 의해 남은 "탄소성" 잔류물도 (-C (-C-)
n 체인의 스펙트럼 시그니처를 가지고 있다.[15]

유기측정학
금속 콤플렉스로 덮인 유기농 폴리네시아가 잘 특징이다. As of the mid-2010s, the most intense research has concerned rhenium (ReCnRe, n=6-20),[16] ruthenium (RuRuCnRuRu, n = 8–20),[17] iron (FeC12CFe),[18] platinum (PtCnPt, n = 16–28),[19] palladium (ArCnPd, n = 6–10),[20] and cobalt (Co3CnCo3, n = 14–26)[21] complexes.

안정성
긴 폴리인 체인은 외생적으로 서로 교차 연계가 가능하기 때문에 본질적으로 부피가 불안정하다고 한다.[5] 폭발은 이 연구 분야에서 실질적인 위험이다.[22] 최종 수소 원자를 테르트-부틸 또는 트라이플루오로메틸과 같은 적절한 불활성 최종 그룹으로 대체하면 수분과 산소에도 불구하고 상당히 안정적일 수 있다.[23] 체인을 분리할 수 있는 부피가 큰 최종 집단은 특히 폴리네시아 안정화에 효과가 있다.[2] 1995년에 300개 이상의 탄소를 가진 카르바인 체인의 준비는 이 기술을 사용하여 보고되었다.[23] 그러나 이 보고서는 검출된 분자가 긴 폴리네시아가 아닌 풀레렌과 같은 구조라는 주장에 의해 논란이 되고 있다.[5]
폴리인 체인도 은 나노입자와 공동 결합하고 [24]수은이 함유된 트라이던트레이트 루이스산을 복합화하여 층층적 인덕트를 형성함으로써 가열로 안정화되었다.[25] 이중벽 탄소나노튜브로 캡슐화된 긴 폴리인 체인도 안정적인 것으로 나타났다.[26] 다소 낮은 안정성에도 불구하고 긴 폴리네시아의 경우 유기체 및 유기체 합성에서 합성 전구체로서 사용하는 몇 가지 예가 있다.[27]
구조
R-(-C≡C--R)
n 형식의 합성 폴리네시아는 n개 정도가 약 8개 이상인 경우 결정체 고형 상태에서 완만하게 곡선 또는 나선형 백본을 갖는 경우가 많으며, 아마도 결정 패킹 효과 때문일 것이다.[28] 예를 들어 캡 R이 3이소프로필릴이고 n이 8이 되면 물질의 X선 결정학(결정 오렌지/노란색 고체)은 넓은 아치에서 약 25~30도 구부러진 등뼈를 보여 각 C-C≡C 각도가 직선으로부터 3.1도씩 벗어나게 된다. 이 기하학적 구조는 인접한 분자의 부피가 큰 캡이 등뼈의 오목한 면에 중첩되어 더 촘촘한 패킹을 제공한다. 그 결과 주변 분자의 등뼈 사이의 거리는 약 0.35~0.5nm로 줄어들어 자발적인 교차 연동을 기대하는 범위에 근접하게 된다. 이 화합물은 낮은 온도에서 무한정 안정적이지만 녹기 전에 분해된다. 이와는 대조적으로 n = 4 또는 n = 5의 동음이의 분자는 0.5 ~ 0.7 nm의 간격을 유지하며 분해하지 않고 녹는 거의 직선적인 등뼈를 가지고 있다.[13]
자연발생
생물학적 기원
광범위한 유기체는 폴리네시아를 합성한다.[1][29] 이 화학물질들은 향료와 색소, 화학적 퇴치제와 독소, 그리고 생물 의학 연구와 제약에 대한 잠재적 응용을 포함하여 다양한 생물학적 활동을 가지고 있다. 식물에서는 주로 캄파눌리드 쇄골에서 폴리인이 발견되며, 특히 해바라기, 당근, 인삼, 도라지과에 속한다. 하지만, 그것들은 토마토, 올락스, 그리고 샌달우드 과의 일부 구성원들에서도 발견될 수 있다.[30] 가장 먼저 격리된 폴리인은 1826년 탈수증식성피부종 에스테르(DME)였으나, 이후까지 완전한 특징이 나타나지 않았다.[1][31]
단순지방산 8,10 옥타데카디노산은 세살피니과 계열의 레구메 파라마크로비움 카루울의 뿌리 껍질로부터 격리되어 합성인광체에서 광폴리머릴 수 있는 단위로 조사되어 왔다.[8]
티아루브린 B는 한약재에 쓰이는 식물인 자이언트 래그위드(암브로시아 트리피다)로부터 격리된 몇몇 관련 빛 민감성 색소 가운데 가장 널리 퍼져 있다. 티아루브린은 항생제, 항바이러스제, 신마멸성 활성을 가지고 있으며, 빛에 노출되어 매개되는 HIV-1에 대한 활성을 가지고 있다.[32]
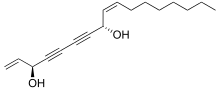
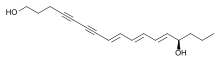
팔카린디올과 같은 폴리네시아는 당근, 셀러리,[33] 페넬, 파슬리, 파스닙과 같은 아피아과 야채에서 발견될 수 있으며 세포독성 활동을 보여준다. 팔카리놀 타입의 알리파틱 C폴리네스는17 신진대사 조절기[34][35] 역할을 하며 잠재적인 건강증진 영양제로 연구되었다.[36] 팔카린디올은 당근의 쓴맛을 일으키는 주성분으로 데빌의 클럽(오플로파낙스 호리두스)에서 발견되는 잠재적인 항암 활동을 가진 여러 폴리네시아 중 가장 활발하다. 식물에서 나온 다른 폴리네시아로는 물방울(Oenanthotoxin)과 물방울(Oenanthe spp.)에서 발견되는 독극물인 oenantotoxin과 cicutoxin이 있다.
Ichtheyother는 활성 성분이 Ichtheotherol이라고 불리는 폴리인 식물의 속이다. 이 화합물은 물고기와 포유류에게 매우 독성이 강하다.[37] Ichtheyother terminalis는 전통적으로 아마존 하류 유역의 원주민들에 의해 독이 든 미끼를 만드는데 사용되어 왔다.[37]
디히드로마트리카리아산은 병정벌레에 의해 생산되고 화학적 방어로 분비되는 폴리염이다.[38]
우주에서
수소가 희박한 우주에서 이온과 함께 옥타트레이닐산소, 헥사트리닐산소 등이 검출된다.[39] 더욱이 광물 차오아이트의 일부로서 지구의 천문학적 충격현장에서 폴리인이 발견되었다는 주장이[40] 제기되어 왔지만, 이러한 해석은 논쟁의 대상이 되어 왔다.[41] 아스트로케미칼을 보라.
참고 항목
참조
- ^ Jump up to: a b c Minto RE; Blacklock BJ (July 2008). "Biosynthesis and function of polyacetylenes and allied natural products". Prog Lipid Res. 47 (4): 233–306. doi:10.1016/j.plipres.2008.02.002. PMC 2515280. PMID 18387369.
- ^ Jump up to: a b c Gibtner, Thomas; Hampel, Frank; Gisselbrecht, Jean-Paul; Hirsch, Andreas (2002). "End-cap stabilized oligoynes: Model compounds for the linear sp carbon allotrope carbyne". Chemistry: A European Journal. 8 (2): 408–432. doi:10.1002/1521-3765(20020118)8:2<408::AID-CHEM408>3.0.CO;2-L. PMID 11843154.
- ^ Heimann, R.B.; Evsyukov, S.E.; Kavan, L., eds. (1999). Carbyne and carbynoid structures. Physics and Chemistry of Materials with Low-Dimensional Structures. 21. p. 452. ISBN 978-0-7923-5323-2.
- ^ Jump up to: a b c Chalifoux, Wesley A.; Tykwinski, Rik R. (2009). "Synthesis of extended polyynes: Toward carbyne". Comptes Rendus Chimie. 12 (3–4): 341–358. doi:10.1016/j.crci.2008.10.004. Avancés en chimie des acétylenes – 아세틸렌 화학의 최근 발전
- ^ Jump up to: a b c Kroto, H. (November 2010). "Carbyne and other myths about carbon". RSC Chemistry World.
- ^ Akagi, K.; Nishiguchi, M.; Shirakawa, H.; Furukawa, Y.; et al. (1987). "One-dimensional conjugated carbyne — synthesis and properties". Synthetic Metals. 17 (1–3): 557–562. doi:10.1016/0379-6779(87)90798-3.
- ^ Jevric, Martyn; Nielsen, Mogens Brøndsted (April 2015). "Synthetic Strategies for Oligoynes". Asian Journal of Organic Chemistry. 4 (4): 286–295. doi:10.1002/ajoc.201402261.
- ^ Jump up to: a b Xu, Zhenchun; Byun, Hoe Sup; Bittman, Robert (1991). "Synthesis of photopolymerizable long-chain conjugated diacetylenic acids and alcohols from butadiyne synthons". J. Org. Chem. 56 (25): 7183–7186. doi:10.1021/jo00025a045.
- ^ Jump up to: a b Chalifoux, Wesley A.; Tykwinski, Rik R. (2010). "Synthesis of polyynes to model the sp-carbon allotrope carbyne". Nature Chemistry. 2 (11): 967–971. Bibcode:2010NatCh...2..967C. doi:10.1038/nchem.828. PMID 20966954. S2CID 24123099.
- ^ Jump up to: a b Simpkins, Simon M. E.; Weller, Michael D.; Cox, Liam R. (2007). "β-Chlorovinylsilanes as masked alkynes in oligoyne assembly: synthesis of the first aryl-end-capped dodecayne". Chemical Communications (39): 4035–7. doi:10.1039/B707681A. PMID 17912407.
- ^ Jump up to: a b Eastmond, R.; Johnson, T.R.; Walton, D.R.M. (1972). "Silylation as a protective method for terminal alkynes in oxidative couplings: A general synthesis of the parent polyynes H(C≡C)
nH (n = 4–10, 12)". Tetrahedron. 28 (17): 4601–16. doi:10.1016/0040-4020(72)80041-3. - ^ Johnson, T.R.; Walton, D.R.M. (1972). "Silylation as a protective method in acetylene chemistry: Polyyne chain extensions using the reagents, Et
3Si(C≡C)
mH (m = 1, 2, 4) in mixed oxidative couplings". Tetrahedron. 28 (20): 5221–36. doi:10.1016/S0040-4020(01)88941-9. - ^ Jump up to: a b Eisler, Sara; Slepkov, Aaron D.; Elliott, Erin; Thanh Luu; et al. (2005). "Polyynes as a model for carbyne: Synthesis, physical properties, and nonlinear optical response". Journal of the American Chemical Society. 127 (8): 2666–76. doi:10.1021/ja044526l. PMID 15725024.
- ^ Schermann, Günther; Grösser, Thomas; Hampel, Frank; Hirsch, Andreas (1997). "Dicyanopolyynes: A Homologous Series of End-Capped Linear sp Carbon". Chemistry – A European Journal. 3 (7): 1105–1112. doi:10.1002/chem.19970030718. ISSN 1521-3765.
- ^ Cataldo, Franco (1999). "From dicopper acetylide to carbyne". Polymer International. 48 (1): 15–22. doi:10.1002/(SICI)1097-0126(199901)48:1<15::AID-PI85>3.0.CO;2-#.
- ^ Dembinski, Roman; Bartik, Tamás; Bartik, Berit; Jaeger, Monika; Gladysz, J. A. (2000-02-01). "Toward Metal-Capped One-Dimensional Carbon Allotropes: Wirelike C6−C20 Polyynediyl Chains That Span Two Redox-Active (η5-C5Me5)Re(NO)(PPh3) Endgroups". Journal of the American Chemical Society. 122 (5): 810–822. doi:10.1021/ja992747z. ISSN 0002-7863.
- ^ Cao, Zhi; Xi, Bin; Jodoin, Diane S.; Zhang, Lei; Cummings, Steven P.; Gao, Yang; Tyler, Sarah F.; Fanwick, Phillip E.; Crutchley, Robert J. (2014-08-27). "Diruthenium–Polyyn-diyl–Diruthenium Wires: Electronic Coupling in the Long Distance Regime". Journal of the American Chemical Society. 136 (34): 12174–12183. doi:10.1021/ja507107t. ISSN 0002-7863. PMID 25116468.
- ^ Sakurai, Aizoh; Akita, Munetaka; Moro-oka, Yoshihiko (1999-08-01). "Synthesis and Characterization of the Dodecahexaynediyldiiron Complex, Fp*−(C≡C)6−Fp* [Fp*= Fe(η5-C5Me5)(CO)2], the Longest Structurally Characterized Polyynediyl Complex". Organometallics. 18 (16): 3241–3244. doi:10.1021/om990266i. ISSN 0276-7333.
- ^ Zheng, Qinglin; Gladysz, J. A. (2005-08-01). "A Synthetic Breakthrough into an Unanticipated Stability Regime: Readily Isolable Complexes in which C16−C28 Polyynediyl Chains Span Two Platinum Atoms". Journal of the American Chemical Society. 127 (30): 10508–10509. doi:10.1021/ja0534598. ISSN 0002-7863. PMID 16045336.
- ^ Pigulski, Bartłomiej; Gulia, Nurbey; Szafert, Sławomir (2015-10-22). "Synthesis of Long, Palladium End-Capped Polyynes through the Use of Asymmetric 1-Iodopolyynes". Chemistry: A European Journal. 21 (49): 17769–17778. doi:10.1002/chem.201502737. ISSN 1521-3765. PMID 26490174.
- ^ Bruce, Michael I.; Zaitseva, Natasha N.; Nicholson, Brian K.; Skelton, Brian W.; White, Allan H. (2008-08-15). "Syntheses and molecular structures of some compounds containing many-atom chains end-capped by tricobalt carbonyl clusters". Journal of Organometallic Chemistry. 693 (17): 2887–2897. doi:10.1016/j.jorganchem.2008.06.007.
- ^ Baughman, R.H. (2006). "Dangerously Seeking Linear Carbon". Science. 312 (5776): 1009–1110. doi:10.1126/science.1125999. PMID 16709775. S2CID 93868586.
- ^ Jump up to: a b Lagow, R.J.; Kampa, J.J.; Han-Chao Wei; Battle, Scott L.; et al. (1995). "Synthesis of linear acetylenic carbon: The "sp" carbon allotrope". Science. 267 (5196): 362–7. Bibcode:1995Sci...267..362L. doi:10.1126/science.267.5196.362. PMID 17837484. S2CID 12939062.
- ^ Casari, C. S.; Cataldo, F.; et al. (2007). "Stabilization of linear carbon structures in a solid Ag nanoparticle assembly". Applied Physics Letters. 90 (1): 013111. arXiv:cond-mat/0610073. Bibcode:2007ApPhL..90a3111C. doi:10.1063/1.2430676. S2CID 119095451.
- ^ Gabbai, F. P.; Taylor, T. J. (March 24, 2006). "Supramolecular Stabilization of α,ω-Diphenylpolyynes by Complexation to the Tridentate Lewis Acid [o-C6F4Hg]3". Organometallics. 25 (9): 2143–2147. doi:10.1021/om060186w.
- ^ Zhao, C.; Shinohara, H. (2011). "Growth of Linear Carbon Chains inside Thin Double-Wall Carbon Nanotubes". Journal of Physical Chemistry C. 115 (27): 13166–13170. doi:10.1021/jp201647m.
- ^ Pigulski, Bartłomiej; Gulia, Nurbey; Szafert, Sławomir (2019). "Reactivity of Polyynes: Complex Molecules from Simple Carbon Rods". European Journal of Organic Chemistry. 2019 (7): 1420–1445. doi:10.1002/ejoc.201801350. ISSN 1099-0690.
- ^ Szafert, Slawomir; Gladysz, J. A. (2006-11-01). "Update 1 of: Carbon in One Dimension: Structural Analysis of the Higher Conjugated Polyynes". Chemical Reviews. 106 (11): PR1–PR33. doi:10.1021/cr068016g. ISSN 0009-2665. PMID 17100401.
- ^ Annabelle, L.K.; Shi Shun; Tykwinski, Rik R. (2006). "Synthesis of Naturally Occurring Polyynes". Angewandte Chemie International Edition. 45 (7): 1034–57. doi:10.1002/anie.200502071. PMID 16447152.
- ^ Konovalov, D. A. (December 2014). "Polyacetylene Compounds of Plants of the Asteraceae Family (Review)". Pharmaceutical Chemistry Journal. 48 (9): 613–631. doi:10.1007/s11094-014-1159-7. ISSN 0091-150X. S2CID 41555718. Retrieved 2020-01-07.
- ^ Stavholt, K, N. A. Sornsen. 1950. 자연발생 아세틸렌 화합물 관련 연구: V. 아르테미시아의 에센셜 오일의 데이드로 마트리카리아 에스테르(메틸 n-decene-triynoate) L. 액타 케미카 스칸디나비아 4.
- ^ Block, Eric; Guo, Chuangxing; Thiruvazhi, Mohan; Toscano, Paul J. (1994). "Total Synthesis of Thiarubrine B [3-(3-Buten-1-ynyl)-6-(1,3-pentadiynyl)-1,2-dithiin], the Antibiotic Principle of Giant Ragweed (Ambrosia trifida)". J. Am. Chem. Soc. 116 (20): 9403–9404. doi:10.1021/ja00099a097.
- ^ Zidorn, C.; Jöhrer, K.; Ganzera, M.; Schubert, B.; et al. (2005). "Polyacetylenes from the Apiaceae Vegetables Carrot, Celery, Fennel, Parsley, and Parsnip and Their Cytotoxic Activities". J. Agric. Food Chem. 53 (7): 2518–23. doi:10.1021/jf048041s. PMID 15796588.
- ^ Atanasov, AG; Blunder, M; Fakhrudin, N; Liu, X; Noha, SM; Malainer, C; Kramer, MP; Cocic, A; Kunert, O; Schinkovitz, A; Heiss, EH; Schuster, D; Dirsch, VM; Bauer, R (Apr 2013). "Polyacetylenes from Notopterygium incisum–new selective partial agonists of peroxisome proliferator-activated receptor-gamma". PLOS ONE. 8 (4): e61755. Bibcode:2013PLoSO...861755A. doi:10.1371/journal.pone.0061755. PMC 3632601. PMID 23630612.
- ^ Ohnuma, T; Anan, E; Hoashi, R; Takeda, Y; Nishiyama, T; Ogura, K; Hiratsuka, A (2011). "Dietary diacetylene falcarindiol induces phase 2 drug-metabolizing enzymes andblocks carbon tetrachloride-induced hepatotoxicity in mice through suppression of lipid peroxidation". Biol Pharm Bull. 34 (3): 371–8. doi:10.1248/bpb.34.371. PMID 21372387.
- ^ Christensen, LP (Jan 2011). "Aliphatic C17-polyacetylenes of the falcarinol type as potential health promoting compounds in food plants of the Apiaceae family". Recent Pat Food Nutr Agric. 3 (1): 64–77. doi:10.2174/2212798411103010064. PMID 21114468.
- ^ Jump up to: a b Cascon, Seiva C.; Mors, Walter B.; Tursch, Bernard M.; Aplin, Robin T.; Durham, Lois J. (1965). "Ichthyothereol and Its Acetate, the Active Polyacetylene Constituents of Ichthyothere terminalis (Spreng.) Malme, a Fish Poison from the Lower Amazon". Journal of the American Chemical Society. 87 (22): 5237–5241. doi:10.1021/ja00950a044. ISSN 0002-7863. PMID 5844817.
- ^ Eisner, Thomas; Eisner, Maria; Siegler, Melody (2005). "40. Chauliognathus lecontei (a soldier beetle)". Secret Weapons: Defenses of Insects, Spiders, Scorpions, and Other Many-legged Creatures. Harvard University Press. pp. 185–188. ISBN 9780674018822.
- ^ Duley, W. W.; Hu, A. (2009). "Polyynes and interstellar carbon nanoparticles". Astrophys. J. 698 (1): 808–811. Bibcode:2009ApJ...698..808D. doi:10.1088/0004-637X/698/1/808.
- ^ El Goresy, A.; Donnay, G. (1968). "A New Allotropic Form of Carbon from the Ries Crater". Science. 151 (3839): 363–364. Bibcode:1968Sci...161..363E. doi:10.1126/science.161.3839.363. PMID 17776738. S2CID 43744113.
- ^ Smith, P. P. K.; Busek, P. R. (1982). "Carbyne Forms of Carbon: Do They Exist?". Science. 216 (4549): 984–986. Bibcode:1982Sci...216..984S. doi:10.1126/science.216.4549.984. PMID 17809068. S2CID 13290442.