크산타이트
Xanthate크산테는 보통 ROCSM−
2+
(R = 알킬; M+ = Na+, K+)[1]이라는 공식을 가진 소금을 말하므로 디티오카르본산염의 금속 치오테/O-에스테르를 말한다. 크산타이트스라는 이름은 고대 그리스어 ααόςς x x x x 크산토스에서 유래되었는데, '노란색, 황금색'이라는 뜻이며, 실제로 대부분의 크산타이트 염은 노란색이다. 그것들은 1823년 덴마크의 화학자 윌리엄 크리스토퍼 자이즈에 의해 발견되어 이름 지어졌다. 이 유기황 화합물은 셀로판과 셀룰로오스의 관련 폴리머의 생산과 특정 광석을 추출하기 위한 (광업에서) 두 가지 영역에서 중요하다.[2] 그들은 또한 유기적 합성에 있어서 다재다능한 매개체들이다. 크산틴은 크산틴의 O,S-ester를 나타낼 수도 있다. 이 에스테르에는 ROC(=S)SR′ 구조물이 있다.
형성과 구조
크산산염은 알코올, 알칼리, 이황화탄소의 처리로 생성된다. 그 과정을 크산트화라고 한다.[2] 화학 용어로 알칼리는 알콜과 반응하여 알카산화물을 생성하는데, 이 알카리는 CS에서2 전기영동 탄소중심에 첨가되는 핵소포체다.[3] 알카산화물은 알코올을 나트륨이나 수산화칼륨으로 처리하여 상황에 따라 생성되는 경우가 많다.
- ROH + CS2 + KOH → ROCS2K + H2O
예를 들어, 이산화 나트륨은 에틸 크산테이트 나트륨을 준다. 이 반응에는 많은 알코올이 사용될 수 있다. 기술 등급 크산트염은 보통 순도가 90~95%이다. 불순물로는 알칼리메탈황화물, 황산염, 트리티오카르본산염, 티오황산염, 황산염, 탄산염 등이 있으며 알코올, 알칼리수산화물 등 잔류 원자재가 있다. 이 소금들은 분말, 과립, 박리, 막대기, 용액으로 시중에서 구입할 수 있다.
상업적으로 중요한 크산산염에는 다음이 포함된다.
- 에틸 크산틴산나트륨 CHCOCSNA322
- 에틸 크산트산칼륨, CHCOCSK322
- 이소프로필 크산트나트륨, (CH3)2CHOCSNA2
- 이소부틸 크산트나트륨, (CH3)2CHCHOCSNA22
- 아밀 크산틴산칼륨, CH3(CH2)4OCS2K
유기탄산염과 에스테르와 같은 크산틴염의 OCS2 코어는 특징적으로 평면적이다. 중심 탄소는 sp-hybridized이다2.
반응
크산틴산염은 산에서 특성적으로 분해된다.
- ROCSK2 + HCl → ROH + CS2 + KCl
이 반응은 크산산염의 조제법과는 정반대다. 분해의 중간은 크산틴(Xantic acid, ROC(S)SH)로, 특정 경우 격리할 수 있다.
크산산염 음이온은 또한 크산산염 에스테르를 주기 위해 알킬화를 겪는데, 이는 일반적으로 안정적이다.[4]
- ROCS2K + R′X → ROC(S)SR′ + KX
이들 화합물에서 C-O 결합은 바톤-맥콤비 디옥시겐화에 의해 갈라지기 쉬우며, 이는 알코올의 산소를 제거하는 수단을 제공한다.
그것들은 딕산토르균으로 산화될 수 있다.
- 2 ROCSNA2 + Cl2 → ROC(S)SC2(S)OR + 2 NaCl
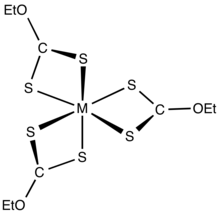
크산타테스는 전이 금속 양이온과 결합하여 biddate 리간드로 묶는다. 충전중립 복합체는 유기 용매에 용해된다.[5]
산업용 응용 프로그램

셀룰로오스는 수산화나트륨(NaOH)이 있는 이황화탄소(CS2)와 반응해 셀룰로오스 크산트나트륨을 생산하는데, 황산(HSO24)으로 중화하면 비스코오스 레이온이나 셀로판지(Sellotape 또는 Scotch Tape)가 나온다.
특정 크산틴염과 비스산틴(예: 딕산틴겐)은 광물 처리에서 플로팅제로 사용된다. 이들은 추가예프 제거 과정의 매개체로서 RAFT 공정에서 급진적인 중합성을 제어하는 데 사용되며, MADIX(xantate의 교환을 통한 고분자 설계)라고도 한다.
관련 화합물
티오산틴은 드물게2 CS와 티올레이트 염의 반응에 의해 발생한다. 예를 들어 에틸티오산산트나트륨은 CHSCNa라는252 공식을 가지고 있다. 디티오카르바메이트도 관련 화합물이다. 그것들은 CS에2 대한 2차 아민의 반응에서 발생한다. 예를 들어, 디에틸디티시오카르바메이트 나트륨에는 (CH25)2NCSNA라는2 공식이 있다.
환경 영향
생분해가 가능한 동안, 이 종류의 화학물질은 1 mg/L 미만의 농도로 물 속 생명에 독성이 있을 수 있다.[8] 광업 하류의 물은 종종 크산틴으로 오염된다.[9]
참조
- ^ IUPAC는 과학 문헌에서 현재 사용되고 있지만 크산틴이라는 용어의 사용을 권장하지 않는다. IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "잔타이트". doi:10.1351/골드북.X06696
- ^ a b Roy, Kathrin-Maria. "Xanthates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a28_423.
- ^ 이 보고서에는 에틸 크산테이트 칼륨에 대한 자세한 절차가 수록되어 있다.
- ^ Gagosz, Fabien; Zard, Samir Z. (1948). "A Xanthate-Transfer Approach to α-Trifluoromethylamines". Organic Syntheses. 84: 32.; Collective Volume, vol. 11, p. 212
- ^ Haiduc, I. (2004). "1,1-Dithiolato ligands". In McClevert, J. A.; Meyer, T. J. (eds.). Comprehensive Coordination Chemistry II. Vol. 1. p. 349–376.
- ^ Galsbøl, F.; Schäffer, C. E. (1967). Tris (O-Ethyl Dithiocarbonato) Complexes of Tripositive Chromium, Indium, and Cobalt. Inorganic Syntheses. Vol. 10. pp. 42–49. doi:10.1002/9780470132418.ch6. ISBN 9780470132418.
- ^ 지그프리드 하우프트만: Organicche Chemie, 2. Durchesene Auflage, VEB Deutscher Verlag Für Grundstoff산업계, 라이프치히, 1985년, S. 652년, ISBN 3-342-00280-8.
- ^ Besser, J.; Brumbaugh, W.; Allert, A.; Poulton, B.; Schmitt, C.; Ingersoll, C. (2009). "Ecological impacts of lead mining on Ozark streams: toxicity of sediment and pore water". Ecotoxicology and Environmental Safety. 72 (2): 516–526. doi:10.1016/j.ecoenv.2008.05.013. PMID 18603298.
- ^ Xu, Y.; Lay, J. P.; Korte, F. (1988). "Fate and effects of xanthates in laboratory freshwater systems". Bulletin of Environmental Contamination and Toxicology. 41 (5): 683–689. doi:10.1007/BF02021019. PMID 3233367. S2CID 2696850.





