중수소
Deuterium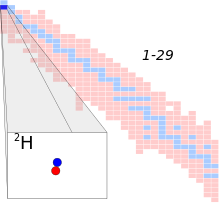 | |
| 일반 | |
|---|---|
| 기호. | 2H |
| 이름 | 중수소, 수소-2, H-2, 수소-2, D |
| 양성자 (Z) | 1 |
| 중성자 (N) | 1 |
| 핵종 데이터 | |
| 자연 풍족도 | 0.0156%(지구)[1] |
| 동위원소 질량 | 2.01410177811[2] Da |
| 스핀 | 1개+ |
| 과잉 에너지 | 13135.165±0.001 keV |
| 결합 에너지 | 2224.52±0.20keV |
| 수소 동위 원소 핵종 전체 표 | |
중수소(또는 수소-2, 기호
H 또는 중수소라고도 함)는 수소의 안정적인 두 동위원소 중 하나이다.중수소라고 불리는 중수소 원자의 핵은 한 개의 양성자와 한 개의 중성자를 포함하고 있는 반면, 훨씬 더 일반적인 프로튬은 핵에 중성자가 없다.중수소는 지구의 바다에 6420개의 수소 중 약 1개의 원자가 자연적으로 풍부하게 된다.따라서 중수소는 바다에서 자연적으로 발생하는 모든 수소의 약 0.0156%(질량 기준 0.0312%)를 차지하는 반면 프로튬은 99.98% 이상을 차지한다.중수소의 풍부함은 한 종류의 천연수에서 다른 종류의 천연수로 약간 변화합니다(빈 표준 평균 해양수 참조).
중수소라는 이름은 두 번째라는 뜻의 그리스어 중수소에서 유래한 것으로,[3] 두 개의 입자가 핵을 이루고 있다는 것을 의미한다.중수소는 1931년 해롤드 유리에 의해 발견되고 명명되었다.1932년에 중성자가 발견되었을 때, 이것은 중수소의 핵구조를 분명히 했고, 유리는 1934년에 "중수소의 발견"으로 노벨상을 수상했다.중수소의 발견 직후, 유레이와 다른 사람들은 중수소의 함량이 매우 농축된 "중수" 샘플을 생산했다.
중수소는 별의 내부에서 생성되는 것보다 더 빨리 파괴된다.다른 자연적 과정들은 아주 적은 양의 중수소만을 생산하는 것으로 생각된다.자연에서 발견되는 거의 모든 중수소는 138억 년 전 빅뱅에서 생성되었는데, 수소-1 대 중수소(수소 원자 백만 개당 중수소 원자 약 26개)의 기본 또는 초기 비율이 그 때부터 유래했기 때문이다.이것은 목성과 같은 거대 가스 행성에서 발견되는 비율이다.혜성의 중수소-원자의 비율 분석은 지구 해양의 평균 비율과 매우 유사한 결과를 발견했다.이것은 지구의 바닷물 대부분이 혜성으로부터 [4][5]유래했다는 이론을 강화한다.로제타 우주 탐사선으로 측정한 혜성 67P/추류모프-게라시멘코의 중수소-프로튬 비율은 지구 물의 약 3배이다.이 수치는 [6]혜성에서 측정된 수치 중 가장 높다.
따라서 중수소와 원자의 비율은 천문학과 기후학 모두에서 활발한 연구 주제이다.
일반 수소(프로튬)와의 차이
화학 기호
중수소는 종종 화학 기호 D로 나타난다.질량이 2인 수소의 동위원소이기 때문에 H로 표시되기도
한다. IUPAC는 D와
H를 모두 허용하지만 H가
[7]바람직하다.다양한 과학적 과정에서 동위원소가 일반적으로 사용되기 때문에 편의를 위해 구별되는 화학 기호가 사용된다.또한 프로튬(1H)과의 큰 질량 차이(중수소는 평균 수소 원자량 1.007947u, 프로튬의 질량 1.007825u에 비해 2.014102u의 질량을 가진다)는 프로튬 함유 화합물과의 불요불급한 화학적 차이를 나타내지만 다른 원소 내 동위원소 중량비는 대체로 미미하다.이 점에 있어서는 개미.
분광학
양자역학에서 원자에 있는 전자의 에너지 수준은 전자와 핵 시스템의 감소된 질량에 의존한다.수소 원자의 경우, 감소 질량의 역할은 원자의 Bohr 모델에서 가장 단순하게 볼 수 있는데, 여기서 감소 질량은 Rydberg 상수와 Rydberg 방정식의 단순한 계산에서 나타나지만, 감소 질량은 Schredinger 방정식과 원자 에너지 수준을 계산하기 위한 Dirac 방정식에서도 나타난다.
이러한 방정식에서 시스템의 감소된 질량은 단일 전자의 질량에 가깝지만, 원자핵에 대한 전자의 질량의 비율과 거의 같은 작은 양만큼 다릅니다.수소의 경우, 이 양은 약 1837/1836 즉 1.000545이며, 중수소의 경우 3671/3670 또는 1.0002725로 더 작습니다.따라서 중수소와 경수소(수소-1)에 대한 스펙트럼 분석 라인의 에너지는 이 두 숫자의 비율인 1.000272에 따라 다르다.모든 중수소 스펙트럼 분석 라인의 파장은 해당하는 경수소 라인보다 1.000272배 더 짧다.천체 관측에서는, 이것은 빛의 0.000272배 즉, 81.6 km/[8]s의 파란색 도플러 이동에 해당합니다.
적외선 분광학이나 라만 분광학 같은 진동 분광학이나 마이크로파 분광학 [9]같은 회전 분광학에서는 중수소의 감소 질량이 프로튬보다 훨씬 높기 때문에 차이가 더 뚜렷하다.핵자기공명분광학에서 중수소는 매우 다른 NMR 주파수(예: 프로튬이 400MHz일 때 61MHz)를 가지며 훨씬 덜 민감하다.중수소화 용제는 일반적으로 프로튬 NMR에서 용제가 신호와 중복되는 것을 방지하기 위해 사용되지만, 중수소 NMR 자체도 가능합니다.
빅뱅 핵합성
중수소는 빅뱅에서 형성된 원소의 수와 비율을 정하는 데 중요한 역할을 한 것으로 생각된다.열역학과 우주 팽창으로 인한 변화를 결합하면, 우주가 핵을 형성할 수 있을 만큼 충분히 차가워진 지점의 온도에 기초하여 양성자와 중성자의 비율을 계산할 수 있다.이 계산은 핵생성이 시작될 때 모든 중성자에 대해 7개의 양성자를 나타내며, 이 비율은 핵생성이 끝난 후에도 안정적으로 유지될 것이다.이 분율은 처음에는 양성자를 선호했는데, 주로 양성자의 낮은 질량이 양성자의 생산을 선호했기 때문이다.우주가 팽창하면서 차가워졌다.자유 중성자와 양성자는 헬륨 원자핵보다 안정성이 떨어지고 양성자와 중성자는 헬륨-4를 형성해야 하는 강력한 에너지 이유가 있었다.그러나 헬륨-4를 형성하기 위해서는 중수소를 형성하는 중간 단계가 필요하다.
핵합성이 일어날 수 있었던 빅뱅 이후 몇 분 동안, 온도는 입자당 평균 에너지가 약하게 결합된 중수소의 결합 에너지보다 클 정도로 높았다. 따라서 생성된 중수소는 즉시 파괴되었다.이 상황은 중수소 병목현상으로 알려져 있습니다.이 병목 현상으로 인해 우주가 중수소를 형성하기에 충분할 정도로 차가워질 때까지 헬륨-4의 형성이 지연되었다.이 시점에서, 갑작스런 원소 형성 폭발이 있었다(첫 번째 중수소는 즉시 헬륨으로 융합되었다).하지만, 그 직후, 빅뱅 후 20분 후에, 우주는 너무 차가워져서 더 이상의 핵융합과 핵합성이 일어날 수 없었다.이 시점에서, 원소 풍부성은 거의 고정되었고, 유일한 변화는 빅뱅 핵합성(예: 삼중수소)의 방사성 생성물 [10]중 일부가 붕괴함에 따라 이루어졌다.헬륨의 형성에 있어서의 중수소의 병목 현상은 헬륨이 수소나 그 자체와 결합할 수 있는 안정적인 방법의 부족과 함께 (질량 수가 5 또는 8인 안정적인 핵은 없다) 빅뱅에서 미미한 양의 탄소 또는 탄소보다 무거운 원소가 형성되었다는 것을 의미했다.따라서 이러한 원소들은 별에서 형성되어야 했다.동시에, 빅뱅 동안 많은 핵생성의 실패는 우리의 태양과 같은 장수하는 별들을 형성하기 위해 사용 가능한 수소가 후기 우주에 충분히 있을 것이라는 것을 보장했다.
풍부
중수소는 H 또는2 D로 쓰여진
2 중수소 가스처럼 자연적으로 발생하지만, 우주에서 자연적으로 발생하는 대부분의 원자는 전형적인
H 원자, 즉 중수소라고
2
불리는 [11]기체와 결합되어 있다.
지구, 태양계 다른 곳(행성 탐사선에 의해 확인됨), 그리고 별의 스펙트럼에 중수소가 존재하는 것 또한 우주론에서 중요한 기준이다.일반적인 핵융합에서 나오는 감마선은 중수소를 양성자와 중성자로 분해하며, 빅뱅 핵합성 외에 관측된 자연적 풍부함에 가까운 어떤 것으로도 중수소를 생성했을 수 있는 알려진 자연 과정은 없다.중수소는 희귀한 클러스터 붕괴와 자연발생 중성자의 가벼운 수소에 의한 흡수로부터 생성되지만, 이것들은 사소한 원천이다.태양과 다른 별들의 내부에는 중수소가 거의 없는 것으로 생각되는데, 이러한 온도에서 중수소를 소비하는 핵융합 반응이 중수소를 생성하는 양성자-양성자 반응보다 훨씬 더 빠르게 일어나기 때문이다.하지만, 중수소는 목성과 거의 같은 농도로 태양 대기에 머물러 있으며, 이것은 아마도 태양계의 기원 이후 변하지 않았을 것이다.중수소의 자연적 풍부함은 수소를 농축하는 명확한 과정이 없는 한 수소가 발견되는 곳마다 수소의 매우 유사한 분율인 것처럼 보인다.
모든 수소에서 낮지만 일정한 원시 분율에서의 중수소의 존재는 우주의 정상 상태 이론에 대한 빅뱅 이론을 지지하는 또 다른 주장 중 하나이다.우주에서 관측된 수소 대 헬륨 대 중수소의 비율은 빅뱅 모델을 제외하고는 설명하기 어렵다.중수소의 풍부함은 약 138억 년 [12]전 생성 이후 크게 진화하지 않은 것으로 추정된다.자외선 스펙트럼 분석으로 은하 중수소를 측정한 결과, 방해받지 않은 가스 구름의 수소 원자 100만 개당 중수소 원자의 비율은 23개이며, 이는 빅뱅의 WMAP 추정 원시 비율인 약 27개 원자보다 15% 낮은 것입니다.이것은 우리 은하에서 예상보다 적은 수의 중수소가 별의 형성에 파괴되었거나,[13] 아마도 은하계 외부에서 유입된 원초 수소로 인해 중수소가 보충되었다는 것을 의미하는 것으로 해석되어 왔다.태양으로부터 수백 광년 떨어진 우주에서는 중수소의 풍부도는 백만 개당 15개의 원자밖에 되지 않지만, 이 값은 아마도 중수소가 성간 공간에 [14]있는 탄소 먼지 입자에 서로 다른 흡착에 의해 영향을 받는 것으로 추정됩니다.
목성 대기의 중수소는 갈릴레오 우주 탐사선에 의해 수소 원자 100만 개당 26개의 원자로 직접 측정되었다.ISO-SWS 관측 결과 [15]목성에서 수소 원자 백만 개당 22개가 발견되었습니다.그리고 이 풍부함은 원시 태양계 [5]비율에 가까운 것으로 생각됩니다.이는 수소 원자 백만 개당 중수소 원자 156개의 지상 중수소 대 비율의 약 17%에 해당한다.
Hale-Bopp 혜성과 Halley 혜성과 같은 혜성체들은 추정된 원형성운 비율에 대해 농축된 비율(아마도 가열에 의한 비율이며 지구 바닷물에서 발견되는 비율과 비슷한 비율)을 상대적으로 더 많이 포함하는 것으로 측정되었다.최근 혜성 103P/하틀리(이전의 카이퍼 벨트 물체)에서 161개의 원자 D/100만 개의 수소 중수소를 측정한 것은 지구의 표면수가 주로 혜성에서 [4][5]파생된 것일 수 있다는 이론을 강조하고 있다.가장 최근에 로제타가 측정한 67P/추류모프-게라시멘코의 중수소-프로튬(D-H) 비율은 지구 물의 약 3배이며,[6] 이는 높은 수치이다.이것은 지구의 물이 소행성의 일부일 수도 있다는 제안에 대한 새로운 관심을 불러일으켰다.
중수소는 또한 다른 지구 행성들, 특히 화성과 [16]금성에서 평균 태양풍족도에 집중되어 있는 것으로 관측되었다.
생산.
중수소는 산업, 과학 및 군사 목적으로 생산되는데, 그 중 극히 일부만 자연적으로 발생하는 중수인 일반 물로 시작하여 중수를 황화 거들러 프로세스, 증류 또는 다른 방법으로 분리한다.
이론적으로는 중수용 중수소가 원자로에서 생성될 수 있지만 일반 물과의 분리가 가장 저렴한 대량 생산 공정이다.
중수소를 공급하는 세계 최고의 업체는 1997년 마지막 중수소가 폐쇄될 때까지 캐나다 원자력유한공사였다.캐나다는 CANDU 원자로 설계 운영을 위해 중성자 감속재로 중수를 사용한다.
중수의 또 다른 주요 생산국은 인도이다.인도의 원자력 발전소 중 하나를 제외한 모든 원자력 발전소는 가압 중수 발전소로 천연 우라늄(즉, 농축되지 않은)을 사용한다.인도에는 8개의 중수 발전소가 있으며, 그 중 7개가 가동 중이다.6개의 발전소가 가동 중이며, 그 중 5개는 암모니아 가스의 D-H 교환에 기초하고 있다.다른 두 식물은 황화수소를 고압으로 사용하는 과정에서 천연수에서 중수소를 추출한다.
인도는 중수로 자급자족하는 반면, 인도는 현재 원자로급 중수를 수출하고 있다.
특성.
물리 속성
지구상의 수소에 비해 순수 중수소(D2)는 높은 녹는점(18.72K 대 13.99K), 높은 끓는점(23.64K 대 20.27K), 높은 임계 온도(38.3K 대 32.94K), 높은 임계 압력(1.64MPa 대 58a)[17]을 가지고 있다.
중수소 화합물의 물리적 특성은 상당한 운동 동위원소 효과와 프로튬 유사 물질과의 다른 물리적, 화학적 특성을 나타낼 수 있다.예를2 들어 DO는 [18]HO보다2 점성이 높습니다.화학적으로, 프로튬에 비해 무거운 수소 동위원소 화합물의 결합 에너지와 길이는 차이가 있으며, 이는 다른 원소의 동위원소 차이보다 크다.중수소와 삼중수소를 포함한 결합은 프로튬의 해당 결합보다 다소 강하며, 이러한 차이는 생물학적 반응에 상당한 변화를 일으키기에 충분하다.제약회사들은 중수소가 [19]프로튬보다 탄소로부터 제거되기 어렵다는 사실에 관심이 있다.
중수소는 물 분자의 프로튬을 대체하여 일반 물보다 약 10.6% 더 밀도가 높은 중수(DO)를2 형성할 수 있다.중수는 진핵생물에서 약간 독성이 있어 체수 치환으로 세포분열 문제 및 불임, 50% 치환으로 세포독성증후군(골수부전 및 위장내막부전)에 의한 사망이 발생한다.그러나 원핵 생물들은 비록 천천히 [20]발달하지만 순수한 중수에서 생존하고 성장할 수 있다.이러한 독성에도 불구하고, 정상적인 상황에서 중수를 섭취하는 것은 인간에게 건강을 위협하지 않는다.70kg(154lb)의 사람은 [21]심각한 결과 없이 4.8L(1.3US gal)의 중수를 마실 수 있는 것으로 추정됩니다.소량의 중수(인간의 경우 몇 그램, 보통 체내에 존재하는 중수소와 비슷한 양의 중수소를 포함한다)는 인간과 동물의 무해한 대사 추적기로 일상적으로 사용된다.
양자 속성
중수소는 스핀 +1("트리플트 상태")을 가지며 따라서 보손이다.중수소의 NMR 주파수는 일반적인 경수소와 상당히 다르다.적외선 분광법은 또한 중수소를 포함한 화학 결합의 진동에서 볼 수 있는 IR 흡수 주파수와 경수소의 진동의 차이가 크기 때문에 많은 중수소화 화합물을 쉽게 구별할 수 있다.두 개의 안정적인 수소 동위원소는 질량 분석법을 사용하여 구별할 수 있다.
삼중수소 핵자는 E = 2.23 MeV에서 거의B 결합되지 않으며, 더 높은 에너지 상태는 결합되지 않는다.싱글트 듀테론은 음의 결합 에너지가 60 keV 이하인 가상 상태입니다.이렇게 안정된 입자는 없지만, 이 가상 입자는 중성자-양성자 비탄성 산란 중에 일시적으로 존재하며,[22] 양성자의 중성자 산란 단면이 비정상적으로 크다.
핵특성(중수소)
중수소의 질량과 반지름
중수소의 핵은 중수소라고 불린다.질량은 2.013553212745(40)Da(1.875GeV를 [23][24]약간 초과)입니다.
듀테론의 전하 반경은 2.12799(74) [25]fm입니다.
양성자 반지름과 마찬가지로 뮤오닉 중수소를 사용하여 측정하면 2.12562(78)[26] fm의 더 작은 결과를 얻을 수 있습니다.
스핀과 에너지
중수소는 홀수 양성자와 홀수 중성자를 가진 5개의 안정핵종 중 하나이다.2
(H
, Li
, B
, N
, Ta
; 또한 장수명 방사성핵종
K, V
, La
, Lu는
자연적으로 발생한다.붕괴 생성물은 짝수이고, 따라서 핵 쌍성 효과로 인해 더 강하게 결합되기 때문에 대부분의 홀수 핵은 베타 붕괴와 관련하여 불안정하다.그러나 중수소는 양성자와 중성자가 스핀-1 상태에 결합되어 더 강한 핵 흡인력을 얻을 수 있는 혜택을 누린다. 해당하는 스핀-1 상태는 동일한 스핀을 가진 동일한 입자가 어느 정도 Oth를 가지도록 요구하는 파울리 배타 원리로 인해 2중성자 또는 2중성자 시스템에 존재하지 않는다.er 궤도 각운동량과 같은 서로 다른 양자수.그러나 두 입자의 궤도 각운동량은 주로 원자력의 가파른 경사도에서 입자의 거리가 증가하기 때문에 시스템에 낮은 결합 에너지를 제공합니다.두 경우 모두, 이것은 다이프로톤과 디뉴트론 핵을 불안정하게 만든다.
중수소를 구성하는 양성자와 중성자는 중성미자와의 중성 전류 상호작용을 통해 분리될 수 있다.이 상호작용에 대한 단면은 비교적 크고, 중수소는 서드베리 중성미자 관측소 실험에서 중성미자 표적으로 성공적으로 사용되었다.
2원자 중수소(D2)는 2원자 수소와 같은 오르토 및 파라 핵 스핀 이성체를 가지고 있지만, 중수소가 [27]1과 같은 핵 스핀을 가진 보손이기 때문에 발생하는 스핀 상태 및 회전 수준의 수와 모집단의 차이가 있다.
중수소의 이소스핀 싱글릿 상태
양성자와 중성자 사이의 질량과 핵 특성이 유사하기 때문에, 그들은 종종 같은 물체의 두 가지 대칭 유형인 핵자로 간주된다.양성자만이 전하를 가지고 있지만, 이것은 종종 강한 핵 상호작용에 대한 전자기 상호작용의 약점 때문에 무시할 수 있다.양성자와 중성자와 관련된 대칭은 아이소스핀으로 알려져 있으며 I(때로는 T)로 표시된다.
이소스핀은 일반 스핀과 마찬가지로 SU(2) 대칭이므로 완전히 유사합니다.각각 isospin-122를 갖는 양성자와 중성자는 아이소스핀 이중(spin doublet)을 형성하며, "down" 상태(↓)는 중성자이고 "up" 상태(↑)는 [citation needed]양성자이다.한 쌍의 핵자는 싱글트라고 불리는 아이소스핀의 반대칭 상태이거나 트리플트라고 불리는 대칭 상태에 있을 수 있다.'다운' 상태와 '업' 상태의 관점에서 싱글릿은
- , which can also be written :
이것은 하나의 양성자와 하나의 중성자, 즉 중수소 핵을 가진 핵이다.세쌍둥이는
따라서 대칭이 되어야 하는 세 가지 종류의 핵으로 구성되어 있다: 중수소 핵(실제로 그것의 매우 흥분된 상태), 두 개의 양성자를 가진 핵, 그리고 두 개의 중성자를 가진 핵.이러한 상태는 안정적이지 않습니다.
중수소의 근사파 함수
중수소파 함수는 아이소스핀 표현을 사용하는 경우 반대대칭이어야 한다(양자와 중성자는 동일한 입자가 아니기 때문에 일반적으로 반대대칭일 필요는 없다).그들의 이소스핀과는 별도로, 두 핵자는 또한 그들의 파동 기능의 스핀과 공간 분포를 가지고 있다.중수소가 패리티 하에서는 대칭(즉, "짝수" 또는 "양" 패리티 하에서는 대칭), 중수소가 반대칭(즉, "홀수" 또는 "음" 패리티 하에서는 반대칭)인 경우에는 반대칭이다.패리티는 두 핵자의 총 궤도 각 운동량에 의해 완전히 결정됩니다. 짝수이면 짝수(양수), 홀수이면 홀수(음수)입니다.
이소스핀 단일인 중수소는 이소스핀에 의해 핵 교환에서 반대칭이며, 따라서 그들의 스핀과 위치의 이중 교환에서는 대칭이어야 한다.따라서 다음 두 가지 상태 중 하나가 될 수 있습니다.
- 대칭 스핀과 패리티 아래의 대칭.이 경우, 두 핵자의 교환은 반대칭성에 필요한 총(-1)에 대해 이소스핀 교환에서 (-1), 스핀 교환에서 (+1) 및 패리티(위치 교환)에서 (+1) 중수소 파동 함수를 곱한다.
- 반대칭 스핀 및 반대칭 패리티 미달이 경우, 두 핵자의 교환은 중수소파 함수에 아이소스핀 교환의 (-1), 스핀 교환의 (-1), 패리티(위치 교환)의 (-1)을 곱하여 다시 반대칭성에 필요한 총 (-1)을 구한다.
첫 번째 경우 중수소는 스핀 트리플렛이므로 총 스핀 s는 1입니다.또한 짝수 패리티를 가지며 따라서 궤도 각 운동량 l; 궤도 각 운동량이 낮을수록 에너지가 감소합니다.따라서 가장 낮은 에너지 상태는 s = 1, l = 0입니다.
두 번째 경우 중수소는 스핀 싱글렛이므로 총 스핀 s는 0입니다.또한 홀수 패리티를 가지며, 따라서 홀수 궤도 각 운동량 l을 가진다.따라서 가장 낮은 에너지 상태는 s = 0, l = 1입니다.
s = 1은 더 강한 핵 흡인력을 제공하므로 중수소 지표 상태는 s = 1, l = 0 상태에 있다.
동일한 고려 사항으로 인해 s = 0, l = 짝수 또는 s = 1, l = 홀수인 아이소스핀 삼중항이 발생할 수 있다.따라서 가장 낮은 에너지의 상태는 이소스핀 싱글렛보다 높은 s = 1, l = 1이다.
방금 제공된 분석은 사실 근사치일 뿐인데, 이는 아이소스핀이 정확한 대칭이 아니기 때문이고, 더 중요한 것은 두 핵자 사이의 강한 핵 상호작용이 다른 s와 l 상태를 혼합하는 스핀-오빗 상호작용의 각 운동량과 관련이 있기 때문이다.즉, s와 l은 시간이 일정하지 않으며(해밀턴과 함께 이동하지 않음), 시간이 지남에 따라 s = 1, l = 0과 같은 상태가 s = 1, l = 2의 상태가 될 수 있습니다. 패리티는 여전히 일정하므로 홀수 l 상태(예: s = 0, l = 1)와 혼합되지 않습니다.따라서 중수소의 양자 상태는 첫 번째 성분이 훨씬 크더라도 s = 1, l = 0 상태와 s = 1, l = 2 상태의 중첩(선형 조합)이다.총 각운동량 j는 좋은 양자수이기 때문에(시간상수이다), 두 성분은 반드시 같은 j를 가져야 하며, 따라서 j = 1이다.이것은 중수소핵의 총 회전이다.
요약하자면, 중수소핵은 아이소스핀의 측면에서 반대칭이며 스핀 1과 짝수(+1) 패리티를 가지고 있다.핵자 l의 상대적인 각운동량은 잘 정의되어 있지 않으며, 중수소는 대부분 l = 0이고, 일부는 l = 2이다.
자기 및 전기 멀티폴
이론적으로 중수소 자기 쌍극자 모멘트 μ를 구하려면 핵자기 모멘트 공식을 사용한다.
와 함께
g와(l)(s) g는 핵자의 g-치환이다.
양성자와 중성자는 g와(s) g의 값이(l) 다르기 때문에 이들의 기여도를 분리해야 한다.각각 중수소 궤도 l {\ 및 스핀 {\{\의 절반을 얻습니다. 1은 다음과 같습니다.
여기서 첨자 p와 n은 양성자와 중성자를 나타내며(l)n g = 0이다.
여기서와 같은 동일성을 사용하고 g = 1 값을 사용하면(l)p 핵자기장N μ 단위로 다음과 같은 결과를 얻을 수 있다.
s = 1, l = 0 상태(j = 1)의 경우 다음과 같이 구한다.
s = 1, l = 2 상태(j = 1)의 경우 다음과 같이 구한다.
중수소 자기 쌍극자 모멘트의 측정값은 0.857μ로N 양성자와 중성자의 모멘트를 단순히 더한 값 0.879μ의N 97.5%이다.이는 중수소의 상태가 실제로 좋은 근사치 s = 1, l = 0 상태이며, 두 핵자는 같은 방향으로 회전하지만 중성자의 음의 모멘트로 인해 자기 모멘트가 차감되는 상태에서 발생한다.
그러나 양성자와 (음) 중성자 모멘트의 단순 추가에 따른 실험 수치보다 약간 낮은 실험 수치는 중수소가 실제로는 대부분 s = 1, l = 0 상태의 선형 조합이며 s = 1, l = 2 상태의 약간의 혼합물이 있음을 보여준다.
측정된 중수소의 전기 4극은 0.2859 e·fm이다2.크기 순서는 합리적이지만 중수소 반지름은 1펨토미터(아래 참조)이고 전하가 e이기 때문에 위의 모델은 그 계산에 충분하지 않다.보다 구체적으로 전기 4중극 연산자는 각운동량으로 이동하지 않기 때문에 전기 4중극은 l =0 상태(우세한 상태)에서 기여하지 않고 l =0 상태와 l =2 상태를 혼합한 항에서 기여한다.
후자의 기여는 순수한 l = 0 기여가 없을 때 우세하지만, 중수소 내부의 핵자 파동 함수의 정확한 공간 형태를 알지 못하면 계산할 수 없다.
더 높은 자기 및 전기 다중극 모멘트는 유사한 이유로 위의 모델로는 계산할 수 없습니다.
적용들
중수소는 많은 상업적, 과학적 용도를 가지고 있다.여기에는 다음이 포함됩니다.
원자로
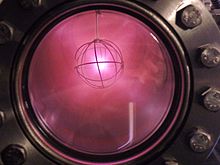
중수소는 보통 [28]수소의 높은 중성자 흡수 없이 중성자를 느리게 하기 위해 보통 액체2 DO로 중수 감속 핵분열 원자로에 사용된다.이것은 더 많은 양의 중수소에 대한 일반적인 상업적 사용이다.
연구용 원자로에서 액체2 D는 차가운 선원에서 사용되어 중성자를 매우 낮은 에너지와 산란 실험에 적합한 파장으로 조절한다.
실험적으로, 중수소는 D-T 반응의 큰 반응 속도(또는 핵 단면적)와 높은 에너지 수율 때문에 특히 삼중수소와 함께 핵융합로 설계에 사용되는 가장 일반적인 핵종이다.D-He
핵융합 반응은 다른 대부분의 핵융합 반응보다 더 높지만,3
3
적어도
상업적인 규모로 D-T 및 D-D 핵융합 반응이 수행되기 전까지는 실질적인 동력원으로서 믿을 수 없다.상업적인 핵융합은 아직 완성된 기술이 아니다.
NMR 분광법
중수소는 수소핵자기공명분광학(양성자 NMR)에서 다음과 같은 방법으로 가장 일반적으로 사용된다.NMR은 일반적으로 용액에 용해된 것으로 분석해야 한다.일반적으로 유기 분자에 존재하는 가벼운 수소와 다른 중수소의 핵 스핀 특성 때문에 수소/프로튬의 NMR 스펙트럼은 중수소의 NMR 스펙트럼과 높은 차이를 보이며, 실제로 중수소는 광수소에 맞게 조정된 NMR 기기에 의해 "보이지" 않는다.따라서 NMR 분광학에서는 용제 신호 간섭 없이 해당 화합물의 광수소 스펙트럼만 측정할 수 있도록 중수(중수3 포함)를 일상적으로 사용한다.
또한 핵자기공명분광학을 사용하여 동위원소 라벨 샘플(중수소 NMR)에서 중수소의 환경에 대한 정보를 얻을 수 있다.예를 들어 중수소 라벨 지질 분자의 긴 탄화수소 사슬인 꼬리 부분의 유연성을 고체 중수소 [29]NMR을 사용하여 정량화할 수 있다.
중수소 NMR 스펙트럼은 예를 들어 염소-35와 같은 더 큰 4극 핵에 비해 상대적으로 작은 4극 모멘트 때문에 고체 상태에서 특히 유용하다.
★★★★★
예를 들어 화학, 생화학 및 환경과학에서 중수소는 비방사능적이고 안정적인 동위원소 추적자로 사용된다.화학 반응과 대사 경로에서 중수소는 일반 수소와 다소 비슷하게 작용한다(예: 몇 가지 화학적 차이가 있음).질량을 통해 일반 수소와 가장 쉽게 구별할 수 있으며 질량 분석 또는 적외선 분석법을 사용합니다.중수소는 질량 차이가 분자 진동의 주파수에 크게 영향을 미치기 때문에 펨토초 적외선 분광법에 의해 검출될 수 있다. 중수소와 탄소 결합 진동은 다른 신호가 없는 스펙트럼 영역에서 발견된다.
안정적인 중산소 동위원소 O와 O와 함께 중수소의 자연적 함량에서 작은 변화를 측정하는 것은 지구 물의 지리적 기원을 추적하기 위해 수문학에서 중요하다.빗물에 있는 수소와 산소의 무거운 동위원소(일명 유성수)는 강수량이 떨어지는 지역의 환경 온도의 함수로 농축된다(따라서 농축은 평균 위도와 관련이 있다).온도에 대해 그림으로 표시할 때 빗물(평균 바닷물)에 있는 중동위원소의 상대적 농축은 지구 운석수선(GMWL)이라고 불리는 선을 따라 예측 가능하다.이 그래프를 통해 강수 발생 원인에 대한 일반적인 정보와 함께 강수 발생 원수의 샘플을 확인할 수 있다.수역의 증발 및 기타 과정과 지하수 과정 또한 담수와 염수의 중수소 및 산소 동위원소 비율을 특징적으로 그리고 종종 지역적으로 구별되는 [30]방식으로 다르게 변화시킨다.H 대 H의 농도 비율은 보통 δH로2 델타 표시되며, 이러한 값의 지리적 패턴은 Isoscape라고 불리는 지도에 표시된다.안정적인 동위원소는 식물과 동물에 통합되며, 이동성 조류나 곤충의 비율을 분석하면 그 [31][32]기원에 대한 대략적인 지침을 제시할 수 있다.
중성자 산란 기법은 특히 중수소화 샘플의 이용으로부터 이익을 얻는다.H와 D 단면은 매우 뚜렷하고 부호가 다르기 때문에 이러한 실험에서 대조도 변화가 가능하다.또, 일반 수소의 귀찮은 문제는, D에 대해서는 제로인 큰 불연속 중성자 단면이다.수소 원자에 중수소 원자를 치환하면 산란 소음이 감소한다.
수소는 유기화학과 생명과학의 모든 물질에서 중요하고 중요한 성분이지만 X선과 거의 상호작용하지 않는다.수소(및 중수소)가 중성자와 강하게 상호작용하기 때문에, 중성자 산란 기술은 현대적인 중수소화 [33]시설과 함께 생물학 및 다른 많은 영역의 고분자에 대한 많은 연구에서 틈새를 메운다.
이것에 대해서는, 이하에 설명하겠습니다.태양을 포함한 대부분의 별들이 수소를 더 무거운 원소로 융합함으로써 그들의 삶의 대부분을 통해 에너지를 발생시키지만, 이러한 가벼운 수소(프로튬)의 융합은 지구에서 달성할 수 있는 조건에서 성공한 적이 없다.따라서, 소위 수소 폭탄에서 발생하는 수소 융합을 포함한 모든 인공 융합은 과정이 작동하기 위해 중수소(삼중수소, 중수소 또는 둘 다)를 필요로 한다.
★★★
중수소화약물은 약제분자에 포함된 수소원자 중 하나 이상이 중수소로 치환된 소분자 의약품이다.운동 동위원소 효과 때문에 중수소 함유 약물은 대사 속도가 현저히 낮아 반감기가 [34][35][36]길어질 수 있다.2017년, 도이테트라베나진은 FDA [37]승인을 받은 최초의 중수소화 약물이 되었다.
강화
중수소는 특정 아미노산 또는 다불포화지방산(PUFA)과 같은 필수 또는 조건상 필수 [38]영양소 내의 특정 산화-취약성 C-H 결합을 강화하여 산화적 손상에 더욱 내성을 갖도록 하기 위해 사용될 수 있다.리놀산과 같은 중수소화 다불포화 지방산은 살아있는 [39][40]세포를 손상시키는 지질 과산화 연쇄 반응을 늦춥니다.레트로토프에 의해 개발된 리놀레산의 중수소화 에틸에스테르(RT001)는 유아 신경축 디스트로피에서 동정적 사용 시험 중이며 프리드라이히의 운동실조에서의 [41][37]I/II 시험을 성공적으로 완료했다.
(Thermosabilization)
경구 폴리오바이러스 백신과 같은 살아있는 백신은 단독으로 또는 MgCl과2 [42]같은 다른 안정제와 함께 중수소에 의해 안정화될 수 있다.
의 을 늦추다
중수소는 랫드, 햄스터,[43][44][45][46] 곤야울락스 디노플라겔라테에 투여했을 때 일주기 시계의 진동 주기를 연장하는 것으로 나타났다.쥐의 경우, DO의 만성2 섭취는 뇌의 [45]시상하부에서 핵의존성 리듬의 일주 기간을 연장함으로써 일주기 리듬을 방해한다.햄스터에 대한 실험은 또한 중수소가 자유자재로 움직이는 일주기를 [47]연장하기 위해 초경질 핵에 직접 작용한다는 이론을 뒷받침한다.
★★★
원소
1913년부터 네온에 대한 연구에서 가벼운 원소의 비방사성 동위원소의 존재가 의심되었고 1920년 가벼운 원소의 질량 분석으로 증명되었다.당시 지배적인 이론은 원소의 동위원소가 같은 수의 핵 전자를 동반한 핵의 추가 양성자의 존재에 따라 다르다는 것이었다.이 이론에서 질량이 2이고 전하 1인 중수소 핵은 두 개의 양성자와 한 개의 핵 전자를 포함할 것이다.그러나 측정된 평균 원자 질량이 양성자의 알려진 질량인 1Da에 매우 가까운 원소 수소는 항상 단일 양성자(알려진 입자)로 구성된 핵을 가지고 있으며 두 번째 양성자를 포함할 수 없을 것으로 예상되었다.따라서, 수소는 무거운 동위원소가 없는 것으로 생각되었다.
그것은 1931년 말 콜롬비아 대학의 화학자 해롤드 유리에 의해 분광학적으로 처음 발견되었다.우레이의 공동 연구자인 페르디난드 브릭웨드는 최근 워싱턴 D.C.의 국립표준연구소(현 국립표준기술연구소)에 설립된 저온물리학 실험실을 이용해 5리터의 액체 수소를 1mL로 증류했다.이 기술은 이전에 네온의 무거운 동위원소를 분리하는 데 사용되었었다.극저온 비오프 기술은 수소 질량 2 동위원소의 분율을 스펙트럼 식별이 [48][49]모호하지 않을 정도로 집중시켰다.
Urey는 1934년에 발표된 기사에서 프로튬, 중수소, 삼중수소라는 이름을 만들었다.그 이름은 부분적으로 "듀튬"이라는 이름을 제안한 G. N. 루이스의 조언에 바탕을 두고 있다.이 이름은 그리스어 듀테로스("second")와 핵을 듀테론(deuteron) 또는 듀테론(deuton)으로 부르는데서 유래했다.동위원소와 새로운 원소들은 전통적으로 그들의 발견자가 결정한 이름이 붙여졌다.어니스트 러더포드와 같은 일부 영국 과학자들은 동위원소를 그리스 디플로(diploos)에서 "디플로겐"으로, 핵을 "디플로겐"[3][50]으로 부르기를 원했다.
이 무거운 수소 동위원소의 정상적인 풍부성에 대해 추론된 양은 너무 작아서(해수에서 6400개의 수소 원자 중 1개의 원자만) 이전의 (평균) 수소 원자 질량의 측정에 눈에 띄게 영향을 미치지 않았다.이것은 왜 그것이 이전에 실험적으로 의심되지 않았는지를 설명해 주었다.유리는 물을 농축하여 중수소의 부분적인 농도를 나타낼 수 있었다.루이스는 1933년에 최초의 순수 중수 표본을 준비했다.1932년 중성자가 발견되기 전에 나온 중수소의 발견은 이론적으로는 실험적인 충격이었지만, 중성자가 보고되면서 중수소의 존재가 더욱 설명 가능하게 되자, 1934년 중수소는 유레이에게 노벨 화학상을 수여했다.루이스는 이전 [3]제자에게 주어졌던 이 공로를 인정받지 못해 화가 났다.
제2차 중
전쟁 직전, Hans von Halban과 Lew Kowarski는 중성자 조절에 대한 연구를 프랑스에서 영국으로 옮겼고, 26개의 강철 [51][52]드럼통으로 전 세계 중수 공급량을 밀수했다.
나치 독일은 제2차 세계대전 당시 중수를 원자로 설계 감속재로 사용해 실험을 해 온 것으로 알려졌다.그러한 실험은 원자폭탄용 플루토늄을 생산할 수 있게 해줄 수도 있기 때문에 우려의 대상이었다.결국 연합군의 "노르웨이 중수 사보타주"라고 불리는 작전으로 이어졌는데, 그 목적은 노르웨이의 베모르크 중수소 생산/농축 시설을 파괴하는 것이었다.그 당시 이것은 전쟁의 잠재적 진전에 중요한 것으로 여겨졌다.
제2차 세계대전이 끝난 후, 연합군은 독일이 이전에 생각했던 것만큼 이 프로그램에 많은 노력을 기울이지 않고 있다는 것을 알게 되었다.독일군은 (숨겨져 있던) 실험용 소형 원자로를 완성했을 뿐 연쇄반응을 지속할 수 없었다.전쟁이 끝날 때까지 독일은 부분적으로 노르웨이의 중수 파괴 작전 때문에 [clarification needed]원자로를 가동하는 데 필요한 중수량의 5분의 1도 확보하지 못했다.하지만 독일이 원자로를 가동시키는 데 성공했더라도 (미국이 1942년 말 시카고 파일 1호에서 했던 것처럼) 그들은 여전히 원자폭탄 개발로부터 적어도 몇 년은 멀었을 것이다.예를 들어, 최대 노력과 자금을 지원하더라도, 공학적 과정은 (첫 번째 임계 원자로에서 폭탄까지) 미국과 러시아 양국에서 약 2년 반의 시간이 필요했다.
미국이 만들고 1952년 11월 1일 폭발한 62톤급 아이비 마이크 장치는 완전히 성공한 최초의 "수소 폭탄"이었다.이런 맥락에서, 그것은 방출된 에너지의 대부분이 원자폭탄의 1차 핵분열 단계에 이은 핵반응 단계에서 나온 첫 번째 폭탄이었다.아이비 마이크 폭탄은 생산 가능한 무기라기보다는 공장 같은 건물이었다.그 중심에는 매우 큰 원통형 단열 진공 플라스크 또는 크라이오스탯이 약 1000리터의 부피로 극저온 액체 중수소를 담고 있었다.그리고 나서, 폭탄의 한쪽 끝에 있는 재래식 원자 폭탄('1차')이 열핵 반응을 일으키기 위해 필요한 극한 온도와 압력 조건을 만들기 위해 사용되었다.
몇 년 안에, 극저온 수소를 필요로 하지 않는 소위 "건식" 수소 폭탄이 개발되었습니다.공개된 정보에 따르면 그 이후 만들어진 모든 열핵 무기는 2차 단계에서 중수소와 리튬의 화합물을 포함하고 있다.중수소를 포함하는 물질은 대부분 중수소화리튬이며 리튬은 리튬-6 동위원소로 구성되어 있다.리튬-6에 원자 폭탄의 빠른 중성자가 폭격되면, 삼중수소(수소-3)가 생성되고, 중수소와 삼중수소는 열핵융합에 빠르게 관여하여 풍부한 에너지, 헬륨-4, 그리고 더 많은 자유 중성자를 방출한다.차르 봄바와 같은 "순수한" 핵융합 무기는 구식인 것으로 여겨진다.대부분의 현대식 "부상된" 열핵 무기에서, 핵융합은 직접적으로 전체 에너지의 극히 일부만을 제공합니다.D-T 핵융합에서 생성된 고속 중성자에 의한 자연 우라늄 U-238 변조 핵분열은 핵융합 반응 자체보다 훨씬 더 큰(즉, 증가한) 에너지 방출을 설명한다.
현대 연구
2018년 8월, 과학자들은 중수소가 액체 금속 형태로 변화한다고 발표했다.목성, 토성, 그리고 이와 관련된 외계행성과 같은 거대한 가스 행성에 대해 연구자들이 더 잘 이해하는데 도움을 줄 수 있는데, 이러한 행성은 관측된 강력한 [53][54]자기장의 원인이 될 수 있는 다량의 액체 금속 수소를 포함하고 있는 것으로 생각되기 때문이다.
원소 중수소 데이터
공식: D2 또는
2 H
- 밀도: STP에서 0.180kg/m(0°C3, 101.325kPa)
- 원자량: 2.0141017926Da.
- (VSMOW의) 바닷물 평균 풍부도 155.76 ± 0.1ppm(약 6420개 부분당 1개 부분의 비율), 즉 표본 내 원자의 약 0.015%(중량이 아닌 수치 기준)
- 밀도:
- 액체: 162.4 kg/m3
- 가스: 0.452 kg/m3
- 점도: 300K에서 12.6μPa·s (기상)
- 정압p c에서의 비열 용량:
- 솔리드: 2950 J/(kg·K)
- 가스: 5200 J/(kg·K)
반중수소
반중수소는 중수소핵의 반물질로, 반양성자와 반중성자로 구성되어 있다.반중수소는 1965년 CERN의 프로톤[55] 싱크로트론과 브룩헤이븐 [56]국립연구소의 교대 경사 싱크로트론에서 처음 생산되었다.핵 주위를 도는 양전자를 가진 완전한 원자는 반중수소라고 불리지만, 2019년[update] 현재 반중수소는 아직 생성되지 않았다.제안된 반중수소 기호는 D
, 즉 오버바가 [57]있는 D이다.
「 」를 참조해 주세요.
레퍼런스
- ^ Hagemann, R; Nief, G; Roth, E (1970). "Absolute isotopic scale for deuterium analysis of natural waters. Absolute D/H ratio for SMOW 1". Tellus. 22 (6): 712–715. doi:10.1111/j.2153-3490.1970.tb00540.x.
- ^ Wang, M.; Audi, G.; Kondev, F. G.; Huang, W. J.; Naimi, S.; Xu, X. (2017). "The AME2016 atomic mass evaluation (II). Tables, graphs, and references" (PDF). Chinese Physics C. 41 (3): 030003-1–030003-442. doi:10.1088/1674-1137/41/3/030003.
- ^ a b c O'Leary D (February 2012). "The deeds to deuterium". Nature Chemistry. 4 (3): 236. Bibcode:2012NatCh...4..236O. doi:10.1038/nchem.1273. PMID 22354440.
- ^ a b Hartogh P, Lis DC, Bockelée-Morvan D, de Val-Borro M, Biver N, Küppers M, et al. (October 2011). "Ocean-like water in the Jupiter-family comet 103P/Hartley 2". Nature. 478 (7368): 218–20. Bibcode:2011Natur.478..218H. doi:10.1038/nature10519. PMID 21976024. S2CID 3139621.
- ^ a b c Hersant F, Gautier D, Hure J (2001). "A Two-dimensional Model for the Primordial Nebula Constrained by D/H Measurements in the Solar System: Implications for the Formation of Giant Planets". The Astrophysical Journal. 554 (1): 391–407. Bibcode:2001ApJ...554..391H. doi:10.1086/321355.
see fig. 7. for a review of D/H ratios in various astronomical objects
- ^ a b Altwegg K, Balsiger H, Bar-Nun A, Berthelier JJ, Bieler A, Bochsler P, et al. (January 2015). "Cometary science. 67P/Churyumov-Gerasimenko, a Jupiter family comet with a high D/H ratio" (PDF). Science. 347 (6220): 1261952. Bibcode:2015Sci...347A.387A. doi:10.1126/science.1261952. PMID 25501976. S2CID 206563296.
- ^ "§ IR-3.3.2 Provisional Recommendations". Nomenclature of Inorganic Chemistry. Chemical Nomenclature and Structure Representation Division, IUPAC. Archived from the original on 27 October 2006. Retrieved 3 October 2007.
- ^ Hébrard G, Péquignot D, Vidal-Madjar A, Walsh JR, Ferlet R (7 February 2000). "Detection of deuterium Balmer lines in the Orion Nebula". Astronomy and Astrophysics. 354: L79. arXiv:astro-ph/0002141. Bibcode:2000A&A...354L..79H.
- ^ Water Absorback Spectrum 2017년 7월 27일 웨이백 머신에 보관.lsbu.ac.uk
- ^ Weiss A. "Equilibrium and change: The physics behind Big Bang Nucleosynthesis". Einstein Online. Archived from the original on 8 February 2007. Retrieved 24 February 2007.
- ^ IUPAC Commission on Nomenclature of Inorganic Chemistry (2001). "Names for Muonium and Hydrogen Atoms and their Ions" (PDF). Pure and Applied Chemistry. 73 (2): 377–380. doi:10.1351/pac200173020377. S2CID 97138983.
- ^ "Cosmic Detectives". The European Space Agency (ESA). 2 April 2013. Retrieved 15 April 2013.
- ^ NASA 퓨즈 위성이 듀테륨 실종 사건을 해결합니다.NASA
- ^ 거리와 중수소의 우리 은하 근처에 그래프 512월 2013년은 승객을 머신 참조하십시오에 또한 Linsky JL, Draine BT, Moos HW, 젠킨스 EB, 우드 BE, 올리베이라 C,(알 Archived.(2006년)."무엇이 토탈 ArrayAbundance 지방 갤럭틱 디스크에 있는 건가요?".그 AstrophysicalJournal.647(2):1106–1124. arXiv:astro-ph/0608308.Bibcode:2006ApJ...647.1106L. doi:10.1086/505556.S2CID 14461382.
- ^ Lellouch E, Bézard B, Fouchet T, Feuchtgruber H, Encrenaz T, de Graauw T (2001). "The deuterium abundance in Jupiter and Saturn from ISO-SWS observations" (PDF). Astronomy & Astrophysics. 670 (2): 610–622. Bibcode:2001A&A...370..610L. doi:10.1051/0004-6361:20010259.
- ^ Hunten, Donald M. (1993). "Atmospheric Evolution of the Terrestrial Planets". Science. 259 (5097): 915–920. Bibcode:1993Sci...259..915H. doi:10.1126/science.259.5097.915. ISSN 0036-8075. JSTOR 2880608. S2CID 178360068.
- ^ "Deuterium H2 - PubChem".
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Halford B (4 July 2016). "The deuterium switcheroo". Chemical & Engineering News. American Chemical Society. pp. 32–36.
- ^ Kushner DJ, Baker A, Dunstall TG (February 1999). "Pharmacological uses and perspectives of heavy water and deuterated compounds". Canadian Journal of Physiology and Pharmacology. 77 (2): 79–88. doi:10.1139/cjpp-77-2-79. PMID 10535697.
- ^ Vertes, Attila, ed. (2003). "Physiological effect of heavy water". Elements and isotopes: formation, transformation, distribution. Dordrecht: Kluwer. pp. 111–112. ISBN 978-1-4020-1314-0.
- ^ 중성자-프로톤 산란(PDF). mit.edu2011-11-23에 취득.
- ^ u의 중수소 질량Physics.nist.gov 를 참조해 주세요.2020-09-18에 회수.
- ^ MeV에 상당하는 중수소 질량 에너지Physics.nist.gov 를 참조해 주세요.2020-09-18에 회수.
- ^ 듀테론 RMS 충전 반지름Physics.nist.gov 를 참조해 주세요.2020-09-18에 회수.
- ^ Pohl R, Nez F, Fernandes LM, Amaro FD, Biraben F, Cardoso JM, et al. (The CREMA Collaboration) (August 2016). "Laser spectroscopy of muonic deuterium". Science. 353 (6300): 669–73. Bibcode:2016Sci...353..669P. doi:10.1126/science.aaf2468. hdl:10316/80061. PMID 27516595. S2CID 206647315.
- ^ Hollas JM (1996). Modern Spectroscopy (3rd ed.). John Wiley and Sons. p. 115. ISBN 0-471-96523-5.
- ^ 중성자 단면 참조#일반적인 단면
- ^ Seelig J (October 1971). "On the flexibility of hydrocarbon chains in lipid bilayers". Journal of the American Chemical Society. 93 (20): 5017–22. doi:10.1021/ja00749a006. PMID 4332660.
- ^ "Oxygen – Isotopes and Hydrology". SAHRA. Archived from the original on 2 January 2007. Retrieved 10 September 2007.
- ^ West JB (2009). Isoscapes: Understanding movement, pattern, and process on Earth through isotope mapping. Springer.
- ^ Hobson KA, Van Wilgenburg SL, Wassenaar LI, Larson K (2012). "Linking hydrogen (δ2H) isotopes in feathers and precipitation: sources of variance and consequences for assignment to isoscapes". PLOS ONE. 7 (4): e35137. Bibcode:2012PLoSO...735137H. doi:10.1371/journal.pone.0035137. PMC 3324428. PMID 22509393.
- ^ "NMI3 – Deuteration". NMI3. NMI3. Archived from the original on 3 February 2019. Retrieved 23 January 2012.
- ^ Sanderson K (March 2009). "Big interest in heavy drugs". Nature. 458 (7236): 269. doi:10.1038/458269a. PMID 19295573. S2CID 4343676.
- ^ Katsnelson A (June 2013). "Heavy drugs draw heavy interest from pharma backers". Nature Medicine. 19 (6): 656. doi:10.1038/nm0613-656. PMID 23744136. S2CID 29789127.
- ^ Gant TG (May 2014). "Using deuterium in drug discovery: leaving the label in the drug". Journal of Medicinal Chemistry. 57 (9): 3595–611. doi:10.1021/jm4007998. PMID 24294889.
- ^ a b Schmidt C (June 2017). "First deuterated drug approved". Nature Biotechnology. 35 (6): 493–494. doi:10.1038/nbt0617-493. PMID 28591114. S2CID 205269152.
- ^ Demidov VV (September 2007). "Heavy isotopes to avert ageing?". Trends in Biotechnology. 25 (9): 371–5. doi:10.1016/j.tibtech.2007.07.007. PMID 17681625.
- ^ 할리웰, 배리; 거터리지, 존 M.C. (2015년)프리래디컬 생물 및 의학 (제5판)옥스포드: 클라렌던 프레스.ISBN 9780198717485.
- ^ Hill S, Lamberson CR, Xu L, To R, Tsui HS, Shmanai VV, et al. (August 2012). "Small amounts of isotope-reinforced polyunsaturated fatty acids suppress lipid autoxidation". Free Radical Biology & Medicine. 53 (4): 893–906. doi:10.1016/j.freeradbiomed.2012.06.004. PMC 3437768. PMID 22705367.
- ^ "A Randomized, Double-blind, Controlled Study to Assess the Safety, Tolerability, and Pharmacokinetics of RT001 in Patients with Friedreich's Ataxia". 24 November 2020.
- ^ Wu R, Georgescu MM, Delpeyroux F, Guillot S, Balanant J, Simpson K, Crainic R (August 1995). "Thermostabilization of live virus vaccines by heavy water (D2O)". Vaccine. 13 (12): 1058–63. doi:10.1016/0264-410X(95)00068-C. PMID 7491812.
- ^ Lesauter J, Silver R (September 1993). "Heavy water lengthens the period of free-running rhythms in lesioned hamsters bearing SCN grafts". Physiology & Behavior. 54 (3): 599–604. doi:10.1016/0031-9384(93)90255-E. ISSN 0031-9384. PMID 8415956. S2CID 32466816.
- ^ McDaniel M, Sulzman FM, Hastings JW (November 1974). "Heavy water slows the Gonyaulax clock: a test of the hypothesis that D2O affects circadian oscillations by diminishing the apparent temperature". Proceedings of the National Academy of Sciences of the United States of America. 71 (11): 4389–91. Bibcode:1974PNAS...71.4389M. doi:10.1073/pnas.71.11.4389. PMC 433889. PMID 4530989.
- ^ a b Petersen CC, Mistlberger RE (August 2017). "Interval Timing Is Preserved Despite Circadian Desynchrony in Rats: Constant Light and Heavy Water Studies". Journal of Biological Rhythms. 32 (4): 295–308. doi:10.1177/0748730417716231. PMID 28651478. S2CID 4633617.
- ^ Richter CP (March 1977). "Heavy water as a tool for study of the forces that control length of period of the 24-hour clock of the hamster". Proceedings of the National Academy of Sciences of the United States of America. 74 (3): 1295–9. Bibcode:1977PNAS...74.1295R. doi:10.1073/pnas.74.3.1295. PMC 430671. PMID 265574.
- ^ Lesauter J, Silver R (September 1993). "Heavy water lengthens the period of free-running rhythms in lesioned hamsters bearing SCN grafts". Physiology & Behavior. 54 (3): 599–604. doi:10.1016/0031-9384(93)90255-E. PMID 8415956. S2CID 32466816.
- ^ Brickwedde FG (1982). "Harold Urey and the discovery of deuterium". Physics Today. 35 (9): 34. Bibcode:1982PhT....35i..34B. doi:10.1063/1.2915259.
- ^ Urey H, Brickwedde F, Murphy G (1932). "A Hydrogen Isotope of Mass 2". Physical Review. 39 (1): 164–165. Bibcode:1932PhRv...39..164U. doi:10.1103/PhysRev.39.164.
- ^ "Science: Deuterium v. Diplogen". Time. 19 February 1934. Archived from the original on 15 September 2009.
- ^ Sherriff L (1 June 2007). "Royal Society unearths top secret nuclear research". The Register. Situation Publishing Ltd. Retrieved 3 June 2007.
- ^ "The Battle for Heavy Water Three physicists' heroic exploits". CERN Bulletin. European Organization for Nuclear Research. 25 March 2002. Retrieved 2 November 2015.
- ^ Chang K (16 August 2018). "Settling Arguments About Hydrogen With 168 Giant Lasers". The New York Times. Archived from the original on 1 January 2022. Retrieved 18 August 2018.
- ^ "Under pressure, hydrogen offers a reflection of giant planet interiors". Carnegie Institution for Science. 15 August 2018. Retrieved 19 August 2018.
- ^ Massam T, Muller T, Righini B, Schneegans M, Zichichi A (1965). "Experimental observation of antideuteron production". Il Nuovo Cimento. 39 (1): 10–14. Bibcode:1965NCimS..39...10M. doi:10.1007/BF02814251. S2CID 122952224.
- ^ Dorfan DE, Eades J, Lederman LM, Lee W, Ting CC (June 1965). "Observation of Antideuterons". Phys. Rev. Lett. 14 (24): 1003–1006. Bibcode:1965PhRvL..14.1003D. doi:10.1103/PhysRevLett.14.1003.
- ^ Chardonnet P, Orloff J, Salati P (1997). "The production of anti-matter in our galaxy". Physics Letters B. 409 (1–4): 313–320. arXiv:astro-ph/9705110. Bibcode:1997PhLB..409..313C. doi:10.1016/S0370-2693(97)00870-8. S2CID 118919611.
외부 링크
- KAERI 원자력 데이터 센터
- "Annotated bibliography for deuterium". ALSOS: The Digital Library for Nuclear Issues. Archived from the original on 5 May 2010. Retrieved 26 November 2019.
- Mullins, Justin (27 April 2005). "Desktop nuclear fusion demonstrated". New Scientist.
- Lloyd, Robin (21 August 2006). "Missing Gas Found in Milky Way". Space.com.









![{\displaystyle \mu ={\frac {1}{4(j+1)}}\left[({g^{(s)}}_{p}+{g^{(s)}}_{n}){\big (}j(j+1)-l(l+1)+s(s+1){\big )}+{\big (}j(j+1)+l(l+1)-s(s+1){\big )}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a3c23357e4baf596b679ef024306fab09a5396a8)