질산염
Nitrate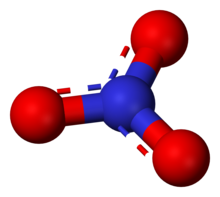 | |
| 이름 | |
|---|---|
| 시스템 IUPAC 이름 질산염 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
PubChem CID | |
| 유니 | |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| 아니요− 3 | |
| 몰 질량 | 62.004 g/120−1 |
| 켤레산 | 질산 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
질산염은 화학식이−
3 NO인 다원자 이온이다. 이 이온을 포함하는 소금은 질산염이라고 불린다.질산염은 비료와 [1]폭발물의 일반적인 성분이다.거의 모든 무기질산염은 물에 녹는다.불용성 질산염의 예로는 산화질산 비스무트를 들 수 있다.
구조.
이온은 질산의 켤레 염기로, 삼각 평면 배열로 세 개의 동일한 결합 산소 원자에 둘러싸인 하나의 중심 질소 원자로 구성됩니다.질산 이온은 공식적으로는 -1의 전하를 띤다.이 전하는 3개의 산소가 각각 -를 운반하는 결합 공식 전하에서 발생합니다. 질소는 +1 전하를 띠는 반면, 2⁄3 전하를 띠며, 이 모든 것은 다원자 질산 이온의 공식 전하를 합한다.이 배열은 일반적으로 공명의 예로 사용됩니다.아이소일렉트로카보네이트 이온과 마찬가지로 질산 이온은 다음과 같은 공명 구조로 나타낼 수 있습니다.
식이 질산염
인간의 식단에 있는 무기질산염의 풍부한 공급원은 시금치와 아루굴라와 같은 잎이 많은 녹색 음식에서 나옵니다.NO−
3(유기질산염)는 비트루트 주스와 다른 야채에서 생존 가능한 활성 성분이다.물을 마시는 것도 식생활의 [2]원천이다.
식이요법 질산염 보충제는 지구력 운동 [3]성과를 테스트할 때 양성 결과를 제공합니다.
젊은 건강한 개인에서 순수한 질산나트륨 또는 비트루트 주스의 형태로 많은 양의 질산염을 섭취하면 혈장 질산염 농도가 2~3배 빠르게 증가하며, 이 높은 질산염 농도는 최소 2주 동안 유지될 수 있다.혈장 질산염의 증가는 일산화질소의 생성을 자극합니다. 일산화질소는 근육 혈류 조절과 미토콘드리아 [4]호흡에 사용되는 중요한 생리 신호 분자입니다.
경화육
아질산염 소비는 주로 가공육의 섭취량과 이들 고기의 질산염 농도에 의해 결정된다.아질산염은 주로 육류 양생에 사용되는 질소 화합물이지만 질산염도 사용된다.질산염은 니트로사민의 [5]형성을 일으킨다.항산화제 비타민 C와 비타민 E의 알파-토코페롤 형태의 사용에 [6]의해 발암성 니트로사민의 생산을 억제할 수 있다.
DASH 식단과 같은 항고혈압 식단은 [2]일반적으로 산화질소를 형성하기 전에 침 테스트에서 검출된 것처럼 침에서 아질산염으로 환원되는 높은 수준의 질산염이 포함되어 있습니다.
발생 및 생산
질산염은 건조한 환경에서 많은 양의 퇴적물, 특히 질산나트륨의 주요 공급원으로서 지구상에서 자연적으로 발견됩니다.
질산염은 암모니아나 요소를 질소와 자유 에너지원으로 사용하여 자연 환경에서 많은 종류의 질화 박테리아에 의해 생산됩니다.화약용 질산염 화합물은 미네랄 질산염 공급원이 없을 때 소변과 똥을 이용한 다양한 발효 과정을 통해 역사적으로 생산되었다.
지구의 질소와 산소가 풍부한 대기에서 번개가 치면 질소 이온과 질산 이온을 형성하는 질소 산화물이 혼합되어 생성되며, 질산 이온은 비나 잠재 퇴적 과정에서 대기에서 씻겨 나옵니다.
사용하다
농업
질산염은 높은 용해성과 생분해성 때문에 농업에서 비료로 사용된다.주요 질산 비료는 암모늄, 나트륨, 칼륨, 칼슘, 마그네슘 소금이다.이 목적을 [1]위해 매년 수백만 킬로그램이 생산된다.
총기류
질산염은 산화제로 사용되며, 특히 폭발물에서 탄소 화합물의 빠른 산화가 대량의 가스를 방출합니다(예: 화약 참조).질산나트륨은 녹은 유리 및 일부 세라믹에서 기포를 제거하는 데 사용됩니다.녹은 소금의 혼합물은 일부 [1]금속을 굳히는 데 사용된다.
영화
질산염은 니트로셀룰로오스를 통해 필름 스톡으로도 사용되었다.높은 가연성 때문에 1950년에 스튜디오는 아세테이트 안전 필름으로 바꿨다.
약
의료 분야에서 질산염은 급성 관상동맥증후군/MI/심장 발작의 예방 및 관리에 사용됩니다.이러한 종류의 약물은 니트로혈관확장제로도 알려져 있다.
검출
질산염의 검출을 위한 거의 모든 방법은 아질산염으로의 변환에 의존하며 그 후 아질산염 특이적 테스트를 실시합니다.질산염에서 아질산염으로의 환원은 구리-카드뮴 물질에 의해 영향을 받는다.시료를 플로우 인젝션 분석기와 함께 도입하고, 그 결과 아질산염이 함유된 유출액을 비색 또는 전기화학적 검출을 위한 시약과 결합한다.이러한 분석 중 가장 인기 있는 것은 Griess 테스트로, 아질산염은 UV-vis 분광 분석에 적합한 짙은 색상의 아조 염료로 변환됩니다.이 방법은 아질산염의 산성화로부터 유도되는 아질산의 반응성을 이용한다.아질산은 방향족과 선택적으로 반응하여 디아조늄염을 생성하고, 디아조늄염은 제2의 시약과 결합하여 아조염료를 만든다.검출한계는 0.02 ~2μM [7]입니다.이러한 방법은 생물학적 [8]샘플에 매우 적합하다.
안전.
질산염의 급성 독성은 낮다.질산염 노출의 장기적 위험에 대해 "실질적 불일치"가 존재한다.우려되는 두 가지 영역은 (i) 질산염은 하장의 아질산염의 전구체일 수 있고, 아질산염은 발암에 관여하는 아질산염의 전구체이며, (ii) 적혈구의 [9][10]헤모글로빈 질환인 메트헤모글로빈혈증에 관여하는 것이다.
메트헤모글로빈혈증
질산염은 유아와 [11][12]임산부에게 영향을 주지 않는다.블루 베이비 증후군은 설사감염, 단백질 과민증, 중금속 독성 등과 같은 많은 다른 요인에 의해 발생하며 질산염은 경미한 [13]역할을 한다.
음용수 기준
미국 환경보호청은 안전한 식수법을 통해 [14]식수의 최대 오염물질 수치를 10mg/L 또는 10ppm의 질산염으로 설정했습니다.
질산 이온에 대한 일일 허용 섭취량(ADI)은 FAO/WHO 식품첨가물 합동전문가위원회(JEFCA)[15]에 의해 0-3.7mg(kg 체중−1)−1 일 범위에서 확립되었다.
수생 독성

육지에 가까운 담수나 하구에서는 질산염이 어류에 치명적인 농도에 도달할 수 있습니다.질산염은 [16]암모니아보다 독성이 훨씬 덜하지만, 30ppm 이상의 질산염은 성장을 방해하고, 면역 체계를 손상시키고, 일부 [17]수생 생물에서 스트레스를 일으킬 수 있습니다.질산염 독성은 여전히 [18]논란의 대상이다.
수계에서의 과도한 질산염 농도의 대부분의 경우, 주요 공급원은 폐수 방출이며, 과도한 질산염 비료를 공급받은 농업 또는 조경 지역의 표면 유출이다.그 결과 부영양화와 조류의 꽃은 산소 부족과 데드존을 초래한다.그 결과 질산염은 전체 용해 고형물의 성분을 형성하기 때문에 수질 지표로서 널리 이용되고 있다.
가축 사료
가축의 질산염 중독 증상은 심박수와 호흡의 증가를 포함한다; 고도의 경우에는 혈액과 조직이 파란색이나 갈색으로 변할 수 있다.사료에 질산염이 있는지 테스트할 수 있습니다.처리는 기존 공급물을 저질산염 물질로 보충하거나 대체하는 것으로 구성됩니다.다양한 종류의 가축에 대한 질산염의 안전 수준은 다음과 같다.[19]
| 카테고리 | %NO3 | %NO3–N | %KNO3 | 영향들 |
|---|---|---|---|---|
| 1 | 0.5 미만 | < 0.12 | 0.81 미만 | 육우 및 양에게 일반적으로 안전함 |
| 2 | 0.5–1.0 | 0.12–0.23 | 0.81–1.63 | 주의: 임신한 말, 양, 육우에서 일부 증상이 나타날 수 있습니다 |
| 3 | 1.0 | 0.23 | 1.63 | 고질산염 문제: 육우와 양에서 사망과 낙태가 발생할 수 있습니다. |
| 4 | 1.23 미만 | 0.28 미만 | 2.00 미만 | 말의 최대 안전 수준입니다.임신한 암말에게 높은 질산염 사료를 먹이지 마십시오. |
위의 값은 건조(습기 없음) 기준입니다.
염류 및 공유 유도체
주기율표의 원소를 사용한 질산염 생성:
| HNO3 | 그 | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 | 로노2 | 아니요− 3 NH4NO3 | 훈오2 | FNO3 | 네 | ||||||||||
| NaNO3 | Mg(NO3)2 | 알(NO3)3 | 시 | P | S | 클로노2 | 아르 | ||||||||||
| 키보드3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 | Co(NO3)2 Co(NO3)3 | Ni(NO3)2 | CuNO3 Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | ge | ~하듯이 | 세 | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | 모 | Tc | Ru(NO3)3 | Rh(NO3)3 | PD(NO3)2 PD(NO3)4 | 아그노3 Ag(NO3)2 | CD(NO3)2 | 입력3(NO)3 | Sn(NO3)4 | Sb(NO3)3 | 테 | 이노3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | 타 | W | 레 | OS | Ir | Pt(NO3)2 Pt(NO3)4 | AU(NO3)3 | Hg2(NO3)2 Hg(NO3)2 | TLNO3 TL(NO3)3 | Pb(NO3)2 | Bi(NO3)3 BiO(NO3) | Po(NO3)4 | 앳 | Rn | |
| 프루노3 | Ra(NO3)2 | Rf | 데이터베이스 | Sg | Bh | Hs | 산 | Ds | Rg | Cn | Nh | 플 | 맥 | Lv | Ts | 오그 | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 | Pr(NO3)3 | Nd(NO3)3 | PM(NO3)3 | SM(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | 호(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | 루(NO3)3 | |||
| AC(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | AM(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | 아니요. | Lr | |||
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d Laue W, Thiemann M, Scheibler E, Wiegand KW (2006). "Nitrates and Nitrites". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_265.
- ^ a b Hord NG, Tang Y, Bryan NS (July 2009). "Food sources of nitrates and nitrites: the physiologic context for potential health benefits". The American Journal of Clinical Nutrition. 90 (1): 1–10. doi:10.3945/ajcn.2008.27131. PMID 19439460.
- ^ McMahon NF, Leveritt MD, Pavey TG (April 2017). "The Effect of Dietary Nitrate Supplementation on Endurance Exercise Performance in Healthy Adults: A Systematic Review and Meta-Analysis" (PDF). Sports Medicine (Auckland, N.Z.). 47 (4): 735–756. doi:10.1007/s40279-016-0617-7. PMID 27600147. S2CID 207494150.
- ^ Maughan, Ronald J (2013). Food, Nutrition and Sports Performance III. New York: Taylor & Francis. p. 63. ISBN 978-0-415-62792-4.
- ^ Bingham SA, Hughes R, Cross AJ (November 2002). "Effect of white versus red meat on endogenous N-nitrosation in the human colon and further evidence of a dose response". The Journal of Nutrition. 132 (11 Suppl): 3522S–3525S. doi:10.1093/jn/132.11.3522S. PMID 12421881.
- ^ Parthasarathy DK, Bryan NS (November 2012). "Sodium nitrite: the "cure" for nitric oxide insufficiency". Meat Science. 92 (3): 274–9. doi:10.1016/j.meatsci.2012.03.001. PMID 22464105.
- ^ Moorcroft, M.; Davis, J.; Compton, R. G. (2001). "Detection and determination of nitrate and nitrite: A review". Talanta. 54 (5): 785–803. doi:10.1016/S0039-9140(01)00323-X. PMID 18968301.
- ^ Ellis, Graham; Adatia, Ian; Yazdanpanah, Mehrdad; Makela, Sinikka K. (1998). "Nitrite and Nitrate Analyses: A Clinical Biochemistry Perspective". Clinical Biochemistry. 31 (4): 195–220. doi:10.1016/S0009-9120(98)00015-0. PMID 9646943.
- ^ Powlson, David S.; Addiscott, Tom M.; Benjamin, Nigel; Cassman, Ken G.; De Kok, Theo M.; Van Grinsven, Hans; l'Hirondel, Jean-Louis; Avery, Alex A.; Van Kessel, Chris (2008). "When Does Nitrate Become a Risk for Humans?". Journal of Environmental Quality. 37 (2): 291–5. doi:10.2134/jeq2007.0177. PMID 18268290.
- ^ "Nitrate and Nitrite Poisoning: Introduction". The Merck Veterinary Manual. Retrieved 2008-12-27.
- ^ Addiscott, T.M.; Benjamin, N. (2006). "Nitrate and human health". Soil Use and Management. 20 (2): 98–104. doi:10.1111/j.1475-2743.2004.tb00344.x. S2CID 96297102.
- ^ A. A. Avery: 유아용 메트헤모글로빈혈증 - 먹는물 질산염의 역할 재검토, 환경보건 관점, 제107권, No.7, 1999년 7월
- ^ Manassaram DM, Backer LC, Messing R, Fleming LE, Luke B, Monteilh CP (October 2010). "Nitrates in drinking water and methemoglobin levels in pregnancy: a longitudinal study". Environmental Health. 9 (1): 60. doi:10.1186/1476-069x-9-60. PMC 2967503. PMID 20946657.
- ^ "4. What are EPA's drinking water regulations for nitrate?". Ground Water & Drinking Water. Retrieved 2018-11-13.
- ^ Bagheri, H.; Hajian, A.; Rezaei, M.; Shirzadmehr, A. (2017). "Composite of Cu metal nanoparticles-multiwall carbon nanotubes-reduced graphene oxide as a novel and high performance platform of the electrochemical sensor for simultaneous determination of nitrite and nitrate". Journal of Hazardous Materials. 324 (Pt B): 762–772. doi:10.1016/j.jhazmat.2016.11.055. PMID 27894754.
- ^ Romano N, Zeng C (September 2007). "Acute toxicity of sodium nitrate, potassium nitrate, and potassium chloride and their effects on the hemolymph composition and gill structure of early juvenile blue swimmer crabs(Portunus pelagicus Linnaeus, 1758) (Decapoda, Brachyura, Portunidae)". Environmental Toxicology and Chemistry. 26 (9): 1955–62. doi:10.1897/07-144r.1. PMID 17705664. S2CID 19854591.
- ^ Sharpe, Shirlie. "Nitrates in the Aquarium". About.com. Retrieved October 30, 2013.
- ^ Romano N, Zeng C (December 2007). "Effects of potassium on nitrate mediated alterations of osmoregulation in marine crabs". Aquatic Toxicology. 85 (3): 202–8. doi:10.1016/j.aquatox.2007.09.004. PMID 17942166.
- ^ "Nitrate Risk in Forage Crops - Frequently Asked Questions". Agriculture and Rural Development. Government of Alberta. Retrieved October 30, 2013.
외부 링크
- ATSDR - 환경 의학 사례 연구 - 질산염/질산염 독성(아카이브)
| HNO3 | 그 | ||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO 3)− 4 | 로노2 | 아니요− 3 NH4NO3 | 훈오2 | FNO3 | 네 | ||||||||||
| NaNO3 | Mg(NO3)2 | 알(NO3)3 | 시 | P | S | 클로노2 | 아르 | ||||||||||
| 키보드3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)2 Fe(NO3)3 | Co(NO3)2 Co(NO3)3 | Ni(NO3)2 | CuNO3 Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | ge | ~하듯이 | 세 | BrNO3 | Kr |
| RbNO3 | Sr(NO3)2 | Y(NO3)3 | Zr(NO3)4 | Nb | 모 | Tc | Ru(NO3)3 | Rh(NO3)3 | PD(NO3)2 PD(NO3)4 | 아그노3 Ag(NO3)2 | CD(NO3)2 | 입력3(NO)3 | Sn(NO3)4 | Sb(NO3)3 | 테 | 이노3 | Xe(NO3)2 |
| CsNO3 | Ba(NO3)2 | Hf(NO3)4 | 타 | W | 레 | OS | Ir | Pt(NO3)2 Pt(NO3)4 | AU(NO3)3 | Hg2(NO3)2 Hg(NO3)2 | TLNO3 TL(NO3)3 | Pb(NO3)2 | Bi(NO3)3 BiO(NO3) | Po(NO3)4 | 앳 | Rn | |
| 프루노3 | Ra(NO3)2 | Rf | 데이터베이스 | Sg | Bh | Hs | 산 | Ds | Rg | Cn | Nh | 플 | 맥 | Lv | Ts | 오그 | |
| ↓ | |||||||||||||||||
| La(NO3)3 | Ce(NO3)3 Ce(NO3)4 | Pr(NO3)3 | Nd(NO3)3 | PM(NO3)3 | SM(NO3)3 | Eu(NO3)3 | Gd(NO3)3 | Tb(NO3)3 | Dy(NO3)3 | 호(NO3)3 | Er(NO3)3 | Tm(NO3)3 | Yb(NO3)3 | 루(NO3)3 | |||
| AC(NO3)3 | Th(NO3)4 | PaO2(NO3)3 | UO2(NO3)2 | Np(NO3)4 | Pu(NO3)4 | AM(NO3)3 | Cm(NO3)3 | Bk(NO3)3 | Cf | Es | Fm | Md | 아니요. | Lr | |||




