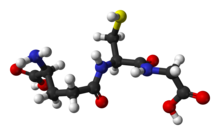
글루타티온
Glutathione
 | |
 | |
| 이름들 | |
|---|---|
| IUPAC이름 γ-글루타밀시스테닐글리신 | |
| 계통 IUPAC명 (2S)-2-아미노-5-({(2R)-1-[(카복시메틸)아미노]-1-옥소-3-설파닐프로판-2-일}아미노)-5-옥소펜타논산 | |
| 기타이름 γ-L-글루타밀-L-시스테닐글리신 (2S)-2-아미노-4-({(1R)-1-[(카르복시메틸)카르바모일]-2-설파닐에틸}카르바모일)부타논산 | |
| 식별자 | |
3D 모델(JSMO) | |
| 약어 | GSH |
| ChEBI | |
| 쳄블 | |
| 켐스파이더 | |
| 드럭뱅크 | |
| ECHA 인포카드 | 100.000.660 |
| 케그 | |
| MeSH | 글루타티온 |
펍켐 CID | |
| 유니아이 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C10H17N3O6S | |
| 어금니 질량 | 307.32g·mol−1 |
| 융점 | 195°C (383°F, 468K)[1] |
| 자유용해성[1] | |
| 메탄올, 디에틸에테르에 대한 용해도 | 불용성[1] |
| 약리학 | |
| V03AB32(WHO) | |
별도의 언급이 없는 경우를 제외하고, 표준 상태(25 °C [77 °F], 100 kPa에서)의 재료에 대한 데이터가 제공됩니다. | |
글루타티온(GSH, /ˌɡ루 ː트 əˈθ라 ɪ오 ʊn/)은 식물, 동물, 곰팡이 및 일부 박테리아 및 고균에서 항산화 물질입니다.글루타티온은 활성산소, 활성산소, 과산화물, 지질 과산화물, 중금속 등의 공급원에 의해 유발되는 중요한 세포 성분의 손상을 방지할 수 있습니다.[2]글루타메이트 측쇄의 카르복실기와 시스테인 사이의 감마 펩타이드 연결을 갖는 트리펩티드입니다.시스테인 잔기의 카르복실기는 글리신에 정상적인 펩티드 연결에 의해 부착됩니다.
생합성 및 발생
글루타티온 생합성은 두 가지 아데노신 삼인산 의존적 단계를 포함합니다.
- 첫째, γ-글루타밀 시스테인은 L-글루타메이트와 시스테인으로부터 합성됩니다.이러한 전환에는 글루타메이트-시스테인 연결효소(GCL, 글루타메이트 시스테인 합성효소)가 필요합니다.이 반응은 글루타티온 합성에서 속도 제한 단계입니다.[3]
- 둘째, 글리신은 γ-글루타밀 시스테인의 C-말단에 첨가됩니다.이 축합은 글루타티온 합성효소에 의해 촉매됩니다.
모든 동물 세포는 글루타티온을 합성할 수 있지만 간에서 글루타티온 합성은 필수적인 것으로 나타났습니다.GCLC 녹아웃 마우스는 간 GSH 합성의 부재로 생후 한 달 이내에 사망합니다.[4][5]
글루타티온의 특이한 감마아미드 연결은 펩티다아제에 의한 가수분해로부터 글루타티온을 보호합니다.[6]
발생
글루타티온은 0.5mmol/L에서 10mmol/L 사이의 동물 세포에서 가장 풍부한 티올입니다.그것은 세포질과 소기관에 존재합니다.[6]
인간은 글루타티온을 합성하지만, 파바과, 엔타메바, 지아르디아의 일부 구성원을 포함한 몇몇 진핵생물들은 그렇지 않습니다.글루타티온을 만드는 유일한 고균은 할로박테리아입니다."시아노박테리아"와 슈도모나도타와 같은 일부 박테리아는 글루타티온을 생합성할 수 있습니다.[7][8]
경구로 섭취된 글루타티온의 전신 가용성은 트리펩티드가 소화관의 단백질 분해효소(펩타이드)의 기질이고, 세포막 수준에서 글루타티온의 특정 전달체가 없기 때문에 생체이용률이 떨어집니다.[9][10]시스테인 프로약인 N-아세틸시스테인(NAC)의 투여는 세포 내 GSH 수치를 증가시키는데 도움을 줍니다.[11]특허를 받은 화합물 리보세인은 고혈당 완화에 도움을 주는 글루타티온의 생성을 향상시키는 보충제로 연구되어 왔습니다.[12][13]
생화학적 기능
글루타티온은 환원(GSH) 및 산화(GSSG) 상태에 존재합니다.[14]세포 내에서 감소된 글루타티온 대 산화된 글루타티온의 비율은 GSSG 대 GSH 비율의 증가가 더 큰 산화 스트레스를 나타내는 세포 산화 스트레스의[15][16] 척도입니다.건강한 세포와 조직에서, 전체 글루타티온 풀의 90% 이상은 환원된 형태(GSH)이고, 나머지는 이황화된 형태(GSSG)입니다.[17]
환원된 상태에서, 시스테닐 잔기의 티올기는 하나의 환원 당량의 공급원입니다.이황화 글루타티온(Glutathione disulfide, GSSG)이 생성됩니다.산화된 상태는 NADPH에 의해 환원된 상태로 전환됩니다.[18]이러한 전환은 글루타티온 환원효소에 의해 촉매됩니다.
- NADPH + GSSG + HO → 2 GSH + NADP + OH
역할
항산화제
GSH는 활성 산소종을 중화(감소)시킴으로써 세포를 보호합니다.[19][6]이러한 전환은 과산화물의 감소로 설명됩니다.
- 2 GSH + RO → GSSG + 2 ROH (R = H, 알킬)
그리고 자유 라디칼과 함께:
- GSH + R →1/2 GSSG + RH
규정
라디칼 및 반응성 산화제를 비활성화시키는 것 외에도, 글루타티온은 레독스-조절된 번역 후 티올 변형인 단백질 S-글루타티오닐화에 의한 산화 스트레스 하에서 세포 티올 단백질의 티올 보호 및 레독스 조절에 참여합니다.일반적인 반응은 보호 가능한 단백질(RSH)과 GSH로부터 비대칭적인 이황화물을 형성하는 것을 포함합니다.[20]
- RSH + GSH + [O] → GSSR + HO
글루타티온은 또한 산화 스트레스 하에서 생성되는 독성 대사 물질인 메틸글리옥살과 포름알데히드의 해독에 사용됩니다.이 해독 반응은 글리옥살라아제 시스템에 의해 수행됩니다.글리옥살라아제 I (EC 4.4.1.5)은 메틸글리옥살 및 환원된 글루타티온의 S-D-락토일글루타티온으로의 전환을 촉매합니다.글리옥살라아제 II (EC 3.1.2.6)는 S-D-락토일글루타티온을 글루타티온 및 D-락트산으로 가수분해하는 것을 촉매합니다.
그것은 비타민 C와 E와 같은 외인성 산화 방지제를 그들의 감소된 (활성) 상태로 유지합니다.[21][22][23]
신진대사
글루타티온은 류코트리엔과 프로스타글란딘의 생합성을 위해 참여하는 많은 대사 과정 중에서 필요합니다.시스테인의 저장에 역할을 합니다.글루타티온은 산화 질소 순환의 일부로서 시트룰린의 기능을 향상시킵니다.[24]이것은 보조 인자이며 글루타티온 과산화효소에 작용합니다.[25]글루타티온은 황화수소 대사의 일부인 S-설파닐글루타티온을 생산하는 데 사용됩니다.[26]
컨쥬게이션
글루타티온은 이종 생물의 대사를 촉진합니다.글루타티온 S-트랜스퍼라제 효소는 친유성 외국인 생물체로의 결합을 촉매하여 배설을 촉진하거나 대사를 더 촉진합니다.[27]컨쥬게이션 과정은 N-아세틸-p-벤조퀴논 이민(NAPQI)의 대사에 의해 설명됩니다.NAPQI는 파라세타몰(아세트아미노펜)에 시토크롬 P450이 작용하여 형성되는 반응성 대사산물입니다.글루타티온은 NAPQI에 결합하고, 생성된 앙상블은 배설됩니다.
식물에서
식물에서 글루타티온은 스트레스 관리에 관여합니다.이것은 독성이 있는 과산화수소를 줄이는 시스템인 글루타티온-아스코르베이트 사이클의 구성 요소입니다.[28]그것은 카드뮴과 같은 중금속을 킬레이트하는 글루타티온 올리고머인 피토켈라틴의 전구체입니다.[29]글루타티온은 녹농균과 피토토라 브라시케아와 같은 식물 병원균에 대한 효율적인 방어를 위해 필요합니다.[30]황 동화 경로의 효소인 아데닐릴-설페이트 환원효소는 글루타티온을 전자 공여체로 사용합니다.글루타티온을 기질로 사용하는 다른 효소들은 글루타레독신입니다.이러한 작은 산화환원효소는 꽃의 발달, 살리실산, 식물 방어 신호 전달에 관여합니다.[31]
사용하다
와인만들기
화이트 와인의 제조 시, 포도 반응 생성물로서 효소적 산화에 의해 생성된 카페오일타르산 퀴논을 트래핑함으로써, 와인의 최초의 원료 형태인 머스트(must)에 있는 글루타티온의 함량이 브라우닝 또는 카라멜화 효과를 결정합니다.[32]포도주의 농도는 UPLC-MRM 질량분석법으로 측정할 수 있습니다.[33]
참고 항목
- 감소응력
- 글루타티온 합성효소 결핍증
- 안산
- 세포 글루타티온 산화환원 전위를 측정하는 도구인 roGFP
- 글루타티온-아스코르브산 회로
- 세균글루타티온전이효소
- 환원제와 매우 유사한 기능을 갖는 시스테인 함유 작은 단백질인 티오레독신
- 환원된 글루타티온을 보조인자로 사용하고 이에 의해 비효율적으로 환원되는 항산화 단백질인 글루타레독신
- 바실리티올
- 마이코티올
- γ-L-글루타밀-L-시스테인
참고문헌
- ^ a b c d Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. p. 3.284. ISBN 9781498754293.
- ^ Pompella A, Visvikis A, Paolicchi A, De Tata V, Casini AF (October 2003). "The changing faces of glutathione, a cellular protagonist". Biochemical Pharmacology. 66 (8): 1499–1503. doi:10.1016/S0006-2952(03)00504-5. PMID 14555227.
- ^ White CC, Viernes H, Krejsa CM, Botta D, Kavanagh TJ (July 2003). "Fluorescence-based microtiter plate assay for glutamate-cysteine ligase activity". Analytical Biochemistry. 318 (2): 175–180. doi:10.1016/S0003-2697(03)00143-X. PMID 12814619.
- ^ Chen Y, Yang Y, Miller ML, Shen D, Shertzer HG, Stringer KF, Wang B, Schneider SN, Nebert DW, Dalton TP (May 2007). "Hepatocyte-specific Gclc deletion leads to rapid onset of steatosis with mitochondrial injury and liver failure". Hepatology. 45 (5): 1118–1128. doi:10.1002/hep.21635. PMID 17464988. S2CID 25000753.
- ^ Sies H (1999). "Glutathione and its role in cellular functions". Free Radical Biology & Medicine. 27 (9–10): 916–921. doi:10.1016/S0891-5849(99)00177-X. PMID 10569624.
- ^ a b c Guoyao Wu; Yun-Zhong Fang; Sheng Yang; Joanne R. Lupton; Nancy D. Turner (2004). "Glutathione Metabolism and its Implications for Health". Journal of Nutrition. 134 (3): 489–492. doi:10.1093/jn/134.3.489. PMID 14988435.
- ^ Copley SD, Dhillon JK (29 April 2002). "Lateral gene transfer and parallel evolution in the history of glutathione biosynthesis genes". Genome Biology. 3 (5): research0025. doi:10.1186/gb-2002-3-5-research0025. PMC 115227. PMID 12049666.
- ^ Wonisch W, Schaur RJ (2001). "Chapter 2: Chemistry of Glutathione". In Grill D, Tausz T, De Kok L (eds.). Significance of glutathione in plant adaptation to the environment. Springer. ISBN 978-1-4020-0178-9 – via Google Books.
- ^ Witschi A, Reddy S, Stofer B, Lauterburg BH (1992). "The systemic availability of oral glutathione". European Journal of Clinical Pharmacology. 43 (6): 667–669. doi:10.1007/bf02284971. PMID 1362956. S2CID 27606314.
- ^ "Acetylcysteine Monograph for Professionals". Drugs.com.
- ^ "N-acetylcysteine - a safe antidote for cysteine/glutathione deficiency". ncbi.nlm.nih.gov.
- ^ Nagasawa, Herbert T. (27 November 2014). "COMPOSITIONS COMPRISING SUGAR-CYSTEINE PRODUCTS - US-20140348811-A1". ppubs.uspto.gov. United States Patent Office. p. 16. Retrieved 31 October 2023.
30. A method of increasing ATP and/or glutathione...
- ^ Ukwenya VO, Alese MO, Ogunlade B, Folorunso IM, Omotuyi OI (2022). "Anacardium occidentale leaves extract and riboceine mitigate hyperglycemia through anti-oxidative effects and modulation of some selected genes associated with diabetes". J Diabetes Metab Disord. 22 (1): 455–468. doi:10.1007/s40200-022-01165-2. PMID 37255827.
- ^ Iskusnykh IY, Zakharova AA, Pathak D (January 2022). "Glutathione in Brain Disorders and Aging". Molecules. 27 (1). doi:10.3390/molecules27010324. PMC 8746815. PMID 35011559.
- ^ Pastore A, Piemonte F, Locatelli M, Lo Russo A, Gaeta LM, Tozzi G, Federici G (August 2001). "Determination of blood total, reduced, and oxidized glutathione in pediatric subjects". Clinical Chemistry. 47 (8): 1467–1469. doi:10.1093/clinchem/47.8.1467. PMID 11468240.
- ^ Lu SC (May 2013). "Glutathione synthesis". Biochimica et Biophysica Acta (BBA) - General Subjects. 1830 (5): 3143–3153. doi:10.1016/j.bbagen.2012.09.008. PMC 3549305. PMID 22995213.
- ^ Halprin KM, Ohkawara A (1967). "The measurement of glutathione in human epidermis using glutathione reductase". The Journal of Investigative Dermatology. 48 (2): 149–152. doi:10.1038/jid.1967.24. PMID 6020678.
- ^ Couto N, Malys N, Gaskell SJ, Barber J (June 2013). "Partition and turnover of glutathione reductase from Saccharomyces cerevisiae: a proteomic approach". Journal of Proteome Research. 12 (6): 2885–2894. doi:10.1021/pr4001948. PMID 23631642.
- ^ Michael Brownlee (2005). "The pathobiology of diabetic complications: A unifying mechanism". Diabetes. 54 (6): 1615–1625. doi:10.2337/diabetes.54.6.1615. PMID 15919781.
- ^ Dalle-Donne, Isabella; Rossi, Ranieri; Colombo, Graziano; Giustarini, Daniela; Milzani, Aldo (2009). "Protein S-glutathionylation: a regulatory device from bacteria to humans". Trends in Biochemical Sciences. 34 (2): 85–96. doi:10.1016/j.tibs.2008.11.002. PMID 19135374.
- ^ Dringen R (December 2000). "Metabolism and functions of glutathione in brain". Progress in Neurobiology. 62 (6): 649–671. doi:10.1016/s0301-0082(99)00060-x. PMID 10880854. S2CID 452394.
- ^ Scholz RW, Graham KS, Gumpricht E, Reddy CC (1989). "Mechanism of interaction of vitamin E and glutathione in the protection against membrane lipid peroxidation". Annals of the New York Academy of Sciences. 570 (1): 514–517. Bibcode:1989NYASA.570..514S. doi:10.1111/j.1749-6632.1989.tb14973.x. S2CID 85414084.
- ^ Hughes RE (1964). "Reduction of dehydroascorbic acid by animal tissues". Nature. 203 (4949): 1068–1069. Bibcode:1964Natur.203.1068H. doi:10.1038/2031068a0. PMID 14223080. S2CID 4273230.
- ^ Ha SB, Smith AP, Howden R, Dietrich WM, Bugg S, O'Connell MJ, Goldsbrough PB, Cobbett CS (June 1999). "Phytochelatin synthase genes from Arabidopsis and the yeast Schizosaccharomyces pombe". The Plant Cell. 11 (6): 1153–1164. doi:10.1105/tpc.11.6.1153. JSTOR 3870806. PMC 144235. PMID 10368185.
- ^ Grant CM (2001). "Role of the glutathione/glutaredoxin and thioredoxin systems in yeast growth and response to stress conditions". Molecular Microbiology. 39 (3): 533–541. doi:10.1046/j.1365-2958.2001.02283.x. PMID 11169096. S2CID 6467802.
- ^ Melideo, SL; Jackson, MR; Jorns, MS (22 July 2014). "Biosynthesis of a central intermediate in hydrogen sulfide metabolism by a novel human sulfurtransferase and its yeast ortholog". Biochemistry. 53 (28): 4739–53. doi:10.1021/bi500650h. PMID 24981631.
- ^ Hayes, John D.; Flanagan, Jack U.; Jowsey, Ian R. (2005). "Glutathione transferases". Annual Review of Pharmacology and Toxicology. 45: 51–88. doi:10.1146/annurev.pharmtox.45.120403.095857. PMID 15822171.
- ^ Noctor G, Foyer CH (June 1998). "Ascorbate and Glutathione: Keeping Active Oxygen Under Control". Annual Review of Plant Physiology and Plant Molecular Biology. 49 (1): 249–279. doi:10.1146/annurev.arplant.49.1.249. PMID 15012235.
- ^ Ha SB, Smith AP, Howden R, Dietrich WM, Bugg S, O'Connell MJ, Goldsbrough PB, Cobbett CS (June 1999). "Phytochelatin synthase genes from Arabidopsis and the yeast Schizosaccharomyces pombe". The Plant Cell. 11 (6): 1153–1164. doi:10.1105/tpc.11.6.1153. PMC 144235. PMID 10368185.
- ^ Parisy V, Poinssot B, Owsianowski L, Buchala A, Glazebrook J, Mauch F (January 2007). "Identification of PAD2 as a gamma-glutamylcysteine synthetase highlights the importance of glutathione in disease resistance of Arabidopsis" (PDF). The Plant Journal. 49 (1): 159–172. doi:10.1111/j.1365-313X.2006.02938.x. PMID 17144898.
- ^ Rouhier N, Lemaire SD, Jacquot JP (2008). "The role of glutathione in photosynthetic organisms: emerging functions for glutaredoxins and glutathionylation" (PDF). Annual Review of Plant Biology. 59 (1): 143–166. doi:10.1146/annurev.arplant.59.032607.092811. PMID 18444899.
- ^ Rigaud J, Cheynier V, Souquet JM, Moutounet M (1991). "Influence of must composition on phenolic oxidation kinetics". Journal of the Science of Food and Agriculture. 57 (1): 55–63. doi:10.1002/jsfa.2740570107.
- ^ Vallverdú-Queralt A, Verbaere A, Meudec E, Cheynier V, Sommerer N (January 2015). "Straightforward method to quantify GSH, GSSG, GRP, and hydroxycinnamic acids in wines by UPLC-MRM-MS". Journal of Agricultural and Food Chemistry. 63 (1): 142–149. doi:10.1021/jf504383g. PMID 25457918.