일산화탄소
Carbon monoxide| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 일산화탄소 | |||
| 기타 이름 산화탄소 카본프로옥시드 탄소 산화물 탄소 프로톡시드 일산화탄소 탄소 산화물 카르보니아 산화물 옥시데드카르본 산화탄소(II) 카르보니 할로겐산염 옥스제나툼 카르본 카베이트 카르보닐 콜레녹시드 수성 가스 콜렌와세르스토프가스 연도 가스 라우흐가스 탄소가연성 공기 무거운 인화성 공기 탄화수소산염 탄산수소유전자 흰 습기 방화 습기 분말 가스 조명 가스 다우슨 가스 몬드 가스 전력 가스 생산 가스 고로 가스 석탄 가스 프롤기스톤 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 3587264 | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.010.118 | ||
| EC 번호 |
| ||
| 421 | |||
| 케그 | |||
| 메쉬 | 카본+일산화물 | ||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1016 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| 카이 트리아 오닐 | |||
| 몰 질량 | 28.010 g/g | ||
| 외모 | 무색 가스 | ||
| 냄새 | 무취 | ||
| 밀도 |
| ||
| 녹는점 | -205.02°C(-337.04°F, 68.13K) | ||
| 비등점 | -191.5°C(-312.7°F, 81.6K) | ||
| 27.6mg/L(25°C) | |||
| 용해성 | 클로로포름, 아세트산, 아세트산에틸, 에탄올, 수산화암모늄, 벤젠에 용해되는 | ||
헨리의 법칙 상수(kH) | 1.04 atm·m3/m/m240 | ||
자화율(δ) | - 9.8 · 10−6 cm3 / 세로 | ||
굴절률(nD) | 1.0003364 | ||
| 0.122 D | |||
| 열화학 | |||
열용량 (C) | 29.1 J/(K·mol) | ||
표준 어금니 엔트로피 (S | 197.7 J/(K·mol) | ||
표준 엔탈피/ 형성 (δHf⦵298) | - 110.5 kJ/mol | ||
표준 엔탈피/ 연소 (δHc⦵298) | - 283.0 kJ/mol | ||
| 약리학 | |||
| V04CX08 (WHO) | |||
| 위험 요소 | |||
| GHS 라벨링: | |||
   | |||
| 위험. | |||
| H220, H331, H360, H372 | |||
| P201, , , , , , , , , , , , , ,, | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | -191°C(-311.8°F, 82.1K) | ||
| 609 °C (1,128 °F, 882 K) | |||
| 폭발 한계 | 12.5–74.2% | ||
| 치사량 또는 농도(LD, LC): | |||
LC50(중간 농도) |
| ||
LCLo(최저 공개) |
| ||
| NIOSH(미국 건강 노출 제한):[3] | |||
PEL(허용) | TWA 50ppm (55mg/m3) | ||
REL(권장) |
| ||
IDLH(즉시 위험) | 1200ppm | ||
| 안전 데이터 시트(SDS) | ICSC 0023 | ||
| 관련 화합물 | |||
기타 음이온 | 일황화탄소 | ||
기타 캐티온 | 일산화 규소 일산화 게르마늄 산화 주석(II) 산화납(II) | ||
관련 탄소 산화물 | 이산화탄소 아산화탄소 옥소카본 | ||
| 보충 데이터 페이지 | |||
| 일산화탄소(데이터 페이지) | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
일산화탄소(화학식 CO)는 무색, 고독성, 무취, 무미, 인화성 가스이며 공기보다 밀도가 약간 낮습니다.일산화탄소는 하나의 탄소 원자와 하나의 산소 원자가 3중 결합으로 연결되어 있습니다.그것은 옥소카본과에서 가장 단순한 분자이다.배위 복합체에서는 일산화탄소 배위자를 카르보닐이라고 한다.그것은 산업 [5]화학의 많은 공정에서 중요한 요소이다.
일산화탄소의 가장 일반적인 공급원은 이산화탄소를 생성하기에 충분한 산소나 열이 존재할 때 탄소 함유 화합물이 부분적으로 연소되는 것입니다.또한 상당한 양의 일산화탄소를 발생시키고 배출하는 수많은 환경 및 생물학적 원천이 있습니다.그것은 약물, 향수, 그리고 [6]연료를 포함한 많은 화합물의 생산에서 중요하다.대기 중으로 방출되는 일산화탄소는 기후 [7]변화에 기여하는 여러 과정에 영향을 미칩니다.
일산화탄소는 계통발생의 왕국에서 중요한 생물학적 역할을 한다.그것은 인간을 포함한 많은 유기체에 의해 생산된다.포유류의 생리학에서 일산화탄소는 저농도가 내인성 신경전달물질(가스전달물질)로 작용하고 고농도는 독성으로 일산화탄소 중독을 일으키는 호르몬의 전형적인 예이다.시안화 음이온− CN과 등전자적입니다.
역사
선사 시대
인간은 기원전 80만 년 경 처음 불을 제어하는 법을 배운 이래로 일산화탄소와 복잡한 관계를 유지해왔다.초기 인류는 불을 주거지에 들여놓으면서 일산화탄소 중독의 독성을 발견했을 것이다.기원전 6000년경 청동기 시대에 등장한 야금 및 제련 기술의 초기 발전도 마찬가지로 일산화탄소 피폭으로 인류를 괴롭혔다.일산화탄소의 독성 외에도, 아메리카 원주민들은 샤머니즘적인 난로 옆에서 의식을 [8]통해 일산화탄소의 신경 활성 특성을 경험했을지도 모른다.
고대사
초기 문명은 인간과 불을 나눈 그리스 신화의 프로메테우스처럼 불의 기원을 설명하기 위해 신화적인 이야기를 발전시켰다.아리스토텔레스 (기원전 384–322)는 석탄을 태우면 유독가스가 발생한다고 처음으로 기록했습니다.그리스의 의사 갈렌(129–199 AD)은 흡입할 때 해를 끼치는 공기 구성에 변화가 있다고 추측했고, 그 시대의 많은 다른 사람들은 석탄 연무 독성의 맥락에서 일산화탄소에 대한 지식의 기초를 개발했다.클레오파트라는 일산화탄소 [8]중독으로 죽었을지도 모른다.
산업혁명 이전
게오르크 에른스트 스탈은 1697년에 일산화탄소로 생각되는 독성 증기와 관련하여 카르보나리 할리투스를 언급했다.Friedrich Hoffmann은 1716년 석탄에 의한 일산화탄소 중독에 대한 최초의 현대 과학 연구를 수행했다.Herman Boerhaave는 1730년대에 [8]일산화탄소가 동물에 미치는 영향에 대한 첫 번째 과학 실험을 했다.
조셉 프리스틀리는 1772년에 처음으로 일산화탄소를 합성한 것으로 여겨진다.칼 빌헬름 셸은 1773년에 비슷하게 숯에서 일산화탄소를 분리했고 그것이 연기를 유독하게 만드는 탄소 실체가 될 수 있다고 생각했다.Torbern Bergman은 1775년에 옥살산으로부터 일산화탄소를 분리했다.이후 1776년 프랑스의 화학자드은 코크스로 산화아연을 가열하여 이산화탄소를 발생시켰지만, 가스 생성물이 푸른 불꽃과 함께 타면서 수소라고 잘못 결론지었다.대기 중 농도를 포함한 산소가 존재하는 경우 일산화탄소는 파란색 불꽃과 함께 연소하여 이산화탄소를 발생시킵니다.앙투안 라부아지에는 1777년 라손과 비슷한 결론 없는 실험을 했다.이 가스는 1800년 [8][9]윌리엄 크루익생크에 의해 탄소와 산소를 포함한 화합물로 확인되었다.
토마스 베도스와 제임스 와트는 1793년 정맥혈을 밝게 하는 일산화탄소를 발견했다.와트는 석탄 연기가 혈액 속의 산소에 대한 해독제 역할을 할 수 있다고 제안했고, 베도스와 와트도 마찬가지로 탄화수소가 산소보다 동물성 섬유에 더 잘 친화한다고 1796년에 제안했습니다.1854년, Adrien Chetnot은 비슷하게 일산화탄소를 혈액에서 제거하고 몸에 의해 [8]산화되어 이산화탄소로 만들 것을 제안했습니다.일산화탄소 중독의 메커니즘은 클로드 버나드가 1846년에 시작하여 1857년에 발표한 회고록에서 "동맥혈이 정맥이 되는 것을 방지한다"고 널리 인정받고 있다.펠릭스 호프-세일러는 다음 해에 비슷한 결론을 [8]독립적으로 발표했다.
공업 화학의 출현
일산화탄소는 1900년대에 [5]귀중한 시약으로 인정받았다.세 가지 산업 공정은 산업에서의 진화를 보여줍니다.피셔-트롭쉬 프로세스에서 석탄과 관련된 탄소가 풍부한 공급 원료는 CO의 매개체를 통해 액체 연료로 전환된다.원래 국내 석유 부족에 대한 보상을 위해 독일 전쟁 노력의 일환으로 개발된 이 기술은 오늘날에도 계속되고 있다.또한 독일에서는 CO와 수소의 혼합물이 올레핀과 결합하여 알데히드를 생성하는 것으로 밝혀졌다.하이드로포밀레이션이라고 불리는 이 과정은 인기 있는 향료와 약품인 특수 화합물뿐만 아니라 계면활성제와 같은 많은 대규모 화학 물질을 생산하는데 사용된다.예를 들어, CO는 비타민 [10]A의 생산에 사용된다.몬산토의 연구자에 기인하는 세 번째 주요 공정에서 CO는 메탄올과 결합하여 아세트산을 생성한다.대부분의 아세트산은 카티바 공정에 의해 생산된다.하이드로포르밀화와 아세트산 합성은 무수한 카르보닐화 과정 중 두 가지이다.
물리적 및 화학적 특성
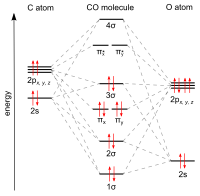
일산화탄소는 가장 단순한 옥소카본이며 시안화 음이온, 니트로소늄 양이온, 붕소 모노플루오르화물 및 분자 질소를 포함한 10개의 원자가 전자를 가진 다른 3중 결합 이원자 종과 등전자적입니다.몰 질량은 28.0으로 이상 기체 법칙에 따르면 평균 몰 질량은 28.8인 공기보다 약간 밀도가 낮다.
탄소와 산소는 순 2개의 파이 결합과 1개의 시그마 결합으로 구성된 삼중 결합에 의해 연결됩니다.탄소 원자와 산소 원자의 결합 길이는 112.[11][12]8pm이다.이 결합 길이는 분자 질소(N2)에서와 같이 유사한 결합 길이(109.76pm)와 거의 동일한 분자 질량을 갖는 삼중 결합과 일치한다.예를 들어 [13]포름알데히드에서 탄소-산소 이중 결합은 120.8pm으로 상당히 길다.끓는점(82K)과 녹는점(68K)은 N(각각 77K, 63K)과2 매우 유사하다.1072 kJ/mol의 결합-분리 에너지는 N(942 kJ/mol)보다2 강하며 알려진 [14]가장 강한 화학 결합을 나타낸다.
일산화탄소의 지상 전자상태는 짝이 없는 전자가 없기 때문에 단일한[15] 상태입니다.
결합 및 쌍극자 모멘트
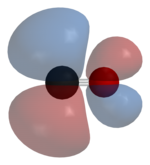
탄소와 산소는 모두 원자가 껍질에 총 10개의 전자를 가지고 있다.탄소와 산소의 옥텟 법칙에 따라, 두 원자는 유기 카르보닐 화합물에서 발견되는 일반적인 이중 결합이 아닌, 세 개의 결합 분자 궤도에서 6개의 공유 전자를 가진 삼중 결합을 형성합니다.공유된 전자 중 4개는 산소 원자로부터 오고 2개는 탄소로부터 오기 때문에, 하나의 결합 궤도는 산소에서 온 두 개의 전자에 의해 점유되어 날짜 또는 쌍극 결합을 형성합니다.이는 분자의 C←O 분극화를 유발하며, 탄소에 대해서는 작은 음전하를, 산소에 대해서는 적은 양의 전하를 일으킵니다.다른 두 개의 결합 궤도는 각각 탄소의 전자와 산소의 전자 각각에 의해 점유되며, 산소가 탄소보다 전기음성적이기 때문에 역방향 C→O 분극의 공유 결합을 형성합니다.유리 일산화탄소 분자는 탄소단에 순 부전하δ가– 남아 있으며, 분자는 0.122D의 [16]작은 쌍극자 모멘트를 가진다.
따라서 분자는 비대칭입니다. 산소는 탄소보다 전자 밀도가 높고 탄소가 음인 것에 비해 약간 양전하를 띠기도 합니다.이와는 대조적으로, 등전자 이질소 분자는 쌍극자 모멘트를 가지고 있지 않다.
일산화탄소는 계산된 부분 결합 순서가 2.6으로, "세 번째" 결합은 중요하지만 전체 [17]결합보다 다소 작음을 나타낸다.따라서, 원자가 결합의 관점에서 C≡O는 가장 중요한 구조이며, 반면 :C+=O는 옥텟이 아니지만 각 원자에서 중성적인 형식 전하를 가지며 두 번째로 중요한 공명 기여자를 나타낸다.이 공명 구조에서 탄소의 단독 쌍과 2가 때문에 일산화탄소는 종종 엄청나게 안정된 카르벤으로 [18]간주됩니다.이소시아니드는 O가 NR(R=알킬기 또는 아릴기)로 치환된 화합물이며 유사한 결합 체계를 가진다.
일산화탄소가 배위자로 작용하면 배위 [19]복합체의 구조에 따라 산소 끝에 순 음전하를 띠면서 다이폴의 극성이 역전될 수 있습니다.아래 "조정 화학" 섹션도 참조하십시오.
결합 극성 및 산화 상태
이론 및 실험 연구는 산소의 전기 음성도가 더 높음에도 불구하고, 쌍극자 모멘트는 더 음의 탄소 끝에서 더 양의 산소 [20][21]끝까지를 가리킨다는 것을 보여준다.3개의 결합은 사실 극성 공유 결합으로 강한 분극성을 가지고 있습니다.산소 원자 쪽으로 계산된 편광은 γ 결합의 경우 71%, 두 [22]γ 결합의 경우 77%입니다.
일산화탄소 내 탄소의 산화 상태는 각 구조에서 +2입니다.이는 모든 결합 전자를 더 많은 전기음성 산소에 속하는 것으로 계산하여 계산됩니다.탄소 위에 있는 두 개의 비결합 전자만이 탄소에 할당됩니다.이 수에서 탄소는 자유 원자에서 4개의 원자가 전자에 비해 분자 내에 2개의 원자가 전자만을 가지고 있다.
발생.
일산화탄소는 다양한 자연환경과 인공환경에서 발생한다.예를 들어 식물 물질의 광화학 열화는 연간 [24]약 600억 킬로그램의 양을 발생시킨다.ppm 단위의 일반적인 농도는 다음과 같습니다.
| 농도(ppmv[a]) | 원천 |
|---|---|
| 0.1 | 자연 대기 레벨(MOPIT)[26] |
| 0.5–5 | 가정의[27] 평균 수준 |
| 5–15 | 가정용 가스 스토브, 최신 차량 배기[28][citation needed] 가스 배출구 |
| 17 | 금성의 대기 |
| 100–200 | 1975년[29] 멕시코시티 중부지역 자동차 배기 가스 배출 |
| 700 | 화성의 대기 |
| 1,000 미만 | 촉매변환기를[30] 통과한 후 차량 배기 가스 |
| 5,000 | 가정용 목재[31] 화재의 배기 가스 |
| 30,000–100,000 | 촉매변환기[30] 미포함 원액 온열차 배기 |
대기 중 존재
일산화탄소(CO)는 지구 대기 중에 소량(약 80ppb)으로 존재한다.나머지 대부분은 연간 [32]약 5×10kg을12 생성하는 대류권에서의 광화학 반응으로 인한 자연 기원과 인간 활동에 의해 방출되는 유기 화합물과의 화학 반응에서 비롯된다.CO의 다른 자연 발생원에는 화산, 삼림 및 산불, 그리고 [33]화석 연료와 같은 기타 형태의 연소가 포함된다.일산화탄소가 지구 [34]맨틀의 고압의 용융된 화산암에 녹아있기 때문에 바다와 지질 활동에서도 소량이 배출된다.일산화탄소의 자연 발생원은 해마다 매우 다양하기 때문에 가스의 자연 배출량을 정확하게 측정하기는 어렵다.
일산화탄소는 메탄과 대류권 오존을 포함한 직접 온실가스의 농도를 높임으로써 복사 강제력에 간접적인 영향을 미친다.CO는 메탄을 [35]파괴할 수 있는 다른 대기 성분(주로 히드록실 라디칼, OH)과 화학적으로 반응할 수 있습니다.대기 중의 자연적 과정을 통해 이산화탄소와 오존으로 산화된다.일산화탄소는 대기 중 수명이 짧고([36]평균 수명이 약 1~2개월), 공간적으로 농도가 변동합니다.
중류권에서의 수명이 길기 때문에 일산화탄소는 오염물질 [37]플룸의 트레이서로도 사용됩니다.
오염
도시 오염
일산화탄소는 주로 내연기관(차량, 휴대용 및 예비발전기, 잔디깎이, 동력세탁기 등)의 배기가스로 인한 일시적 대기 오염물질이지만, 다양한 다른 연료(목재, 석탄, 목탄, 석유, 파라핀, 프로판, 천연가스 및 기타)의 불완전 연소로 인한 오염물질이다.휴지통)
대규모 CO 오염 사건은 우주에서 [38]도시 상공에서 관찰할 수 있다.
지상 오존 형성에 대한 역할
일산화탄소는 알데하이드와 함께 광화학 스모그를 형성하는 일련의 화학 반응의 일부입니다.히드록실 라디칼(•OH)과 반응하여 라디칼 중간 HOCO를 생성하며, 이 중간 HOCO는 라디칼 수소를 O로 빠르게2 전달하여 퍼옥시 라디칼(HO2•)과 이산화탄소([39]CO2)를 형성합니다.페르옥시기(Peroxy radical)는 질소산화물(NO)과 반응하여 이산화질소(NO2)와 수산기(hydroxyradical)를 형성한다.NO는2 광분해로 O(3P)를 주어 O와 반응2 후 O를 형성한다3.수산기 래디칼은 NO가2 형성되는 동안 형성되기 때문에 일산화탄소에서 시작하여 오존 형성에 이르는 일련의 화학반응의 균형은 다음과 같다.
- CO + 2O2 + hµ → CO2 + O3
(여기서 h refers는 NO2 분자에 의해 흡수된 빛의 광자를 의미한다.)
NO의 생성은2 저준위 오존 형성을 이끄는 중요한 단계이지만,[40] 오존과 반응할 수 있는 NO의 양을 줄임으로써 상호 배타적인 또 다른 방법으로 오존을 증가시킨다.
실내 오염
폐쇄적인 환경에서는 일산화탄소 농도가 치사 수준까지 상승할 수 있습니다.미국에서 매년 평균 170명의 사람들이 비자동차 소비자 [41]제품에 의해 생산되는 일산화탄소로 사망한다.이러한 제품에는 고로, 레인지, 온수기, 가스 및 등유 난방기 등 연료 연소 장치의 오작동, 휴대용 발전기 등 엔진 구동 장치(및 부속 차고에 방치된 자동차), 벽난로, 가정 및 기타 밀폐 공간에서 연소되는 숯 등이 포함됩니다.허리케인[41] 카트리나와 2021년 텍사스 전력 [42]위기와 같은 악천후로 정전 중에 많은 사망자가 발생했다.
채굴
광부들은 일산화탄소를 "화이트램프" 또는 "침묵의 살인자"라고 부른다.지표면 갱도와 지하 갱도 모두에서 환기가 잘 되지 않는 좁은 지역에서 발견될 수 있다.광업에서 일산화탄소의 가장 일반적인 공급원은 내연기관이나 폭발물이지만, 탄광에서는 [43]석탄의 저온 산화에 의해 일산화탄소가 발견되기도 한다."탄광 속의 카나리"라는 관용구는 일산화탄소의 [8]존재에 대한 조기 경고와 관련이 있다.
천문학
지구 너머에서, 일산화탄소는 성간 매질에서 수소 분자 다음으로 두 번째로 흔한 이원자 분자입니다.그 비대칭성 때문에, 이 극성 분자는 수소 분자보다 훨씬 밝은 스펙트럼 라인을 만들어, CO를 훨씬 쉽게 검출할 수 있게 한다.성간 CO는 1970년 전파망원경으로 처음 검출되었다.분자수소는 우주망원경을 필요로 하는 자외선을 통해서만 검출될 수 있기 때문에, 그것은 현재 은하간 매질에서 일반적으로 가장 일반적으로 사용되는 분자 가스 추적기입니다.일산화탄소 관측은 대부분의 별들이 [44][45]형성되는 분자 구름에 대한 많은 정보를 제공합니다.
화가자리에서 두 번째로 밝은 별인 화가자리 베타(Beta Pictoris)는 별 근처에 있는 많은 양의 먼지와 가스([46][47]일산화탄소 포함)로 인해 발생하는 일반적인 별들에 비해 적외선 방출이 과도하다는 것을 보여준다.
금성 대기 중 일산화탄소는 169nm 미만의 파장의 전자파 복사에 의해 이산화탄소가 광분해되면서 발생한다.또한 해왕성의 위성 트리톤의 [48]표면에서도 분광학적으로 확인되었다.
고체 일산화탄소는 [49]혜성의 구성요소이다.핼리 혜성은 약 15%의 [50]일산화탄소입니다.상온과 대기압에서 일산화탄소는 실제로 전이성(Boudouard 반응 참조)일 뿐이고 CO와
2 CO가 고체인 저온에서도 마찬가지이지만, 그럼에도 불구하고 혜성에서는 수십억 년 동안 존재할 수 있습니다.명왕성의 대기에는 혜성에서 생성된 것으로 보이는 이산화탄소가 거의 없다.이것은 명왕성 안에 액체 상태의 물이 있었기 때문일 것이다.
일산화탄소는 물과 반응하여 이산화탄소와 수소를 형성할 수 있습니다.
- CO + HO2 → H
2 + CO
2
이것은 기상에서 발생할 때 물-가스 이동 반응이라고 불리지만 수용액에서 발생할 수도 있습니다(매우 천천히).수소 분압이 충분히 높으면(예를 들어 지하 바다) 포름산이 형성됩니다.
- CO2 + HO → HCOOH
이러한 반응은 [51]명왕성에서 발견되는 온도에서도 몇 백만 년 후에 일어날 수 있다.
화학
일산화탄소는 화학의 모든 분야에 걸쳐 광범위한 기능을 한다.반응성의 4대 주요 범주는 금속-카르보닐 촉매 작용, 래디칼 화학,[52] 양이온 및 음이온 화학을 포함합니다.
배위 화학
대부분의 금속은 공유 결합 일산화탄소를 포함하는 배위 복합체를 형성합니다.낮은 산화 상태의 금속만 일산화탄소 배위자와 복합됩니다.이것은 금속 d-궤도에서xz CO의 δ* 분자 궤도로의 역기증을 용이하게 하기 위해 충분한 전자 밀도가 있어야 하기 때문이다.CO에 있는 탄소 원자의 유일한 쌍은 또한 시그마 결합을 형성하기 위해 금속의 d에x²−y² 전자 밀도를 기부합니다.이 전자공여는 또한 cis 효과 또는 cis 위치에서 CO 배위자의 편모화와 함께 나타난다.예를 들어, 니켈 카르보닐은 일산화탄소와 니켈 금속의 직접적인 조합에 의해 형성됩니다.
- Ni + 4 CO → Ni(CO)4 (1 bar, 55 °C)
이러한 이유로 튜브 또는 부품의 니켈이 일산화탄소와 장기간 접촉해서는 안 됩니다.니켈 카르보닐은 뜨거운 표면에 접촉하면 Ni 및 CO로 쉽게 분해되며 몬드 [53]공정에서 니켈의 공업용 정화에 사용된다.
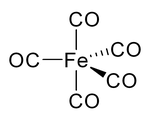
니켈 카르보닐 및 기타 카르보닐에서 탄소 위의 전자 쌍은 금속과 상호작용하고, 일산화탄소는 전자 쌍을 금속에 기증합니다.이러한 상황에서 일산화탄소는 카르보닐 배위자라고 불립니다.가장 중요한 금속 카르보닐 중 하나는 철 펜타카르보닐, Fe(CO)5입니다.
많은 금속-CO 복합체는 CO가 아닌 유기 용제의 탈카르보닐화에 의해 제조된다.예를 들어 트리염화 이리듐과 트리페닐포스핀은 끓는 2-메톡시에탄올 또는 DMF에서 반응하여 IrCl(CO)(PPH3)2을 얻는다.
배위화학의 금속 카르보닐은 보통 적외선 분광법을 사용하여 연구된다.
유기 및 주요 그룹 화학
강한 산과 물이 있을 때 일산화탄소는 알케인과 반응하여 카복실산을 형성하며 코흐-하프 [54]반응이라고 알려져 있습니다.Gattermann-Koch 반응에서 AlCl3 및 HCl의 [55]존재 하에서 아렌은 벤즈알데히드 유도체로 변환된다.유기석소 화합물(예: 부틸 리튬)은 일산화탄소와 반응하지만, 이러한 반응은 과학적으로 거의 사용되지 않습니다.
CO는 탄화수소 및 카르보이온과 반응하지만 [56]금속 촉매의 개입 없이 유기 화합물에 대해서는 상대적으로 반응하지 않는다.
주요 그룹 시약의 경우 CO는 몇 가지 주목할 만한 반응을 보입니다.CO의 염소화는 중요한 화합물 포스겐으로 가는 산업 경로이다.보란 CO와 함께 부가물3 HBCO를 형성하며, 이는 아세틸륨 양이온[HCCO3]+과 등전자적입니다.CO는 나트륨과 반응하여 아세틸렌지올레이트2Na+
22−
2·CO나트륨 등의 C-C 커플링 결과물을 생성한다.녹은 칼륨과 반응하여 유기금속 화합물, 아세틸렌디아레이트 칼륨 2K+
·CO
22−
2, 벤젠헥솔레이트 칼륨 6KCO+
66−
6,[57] 로드리존산칼륨 2K+
·[58]CO를
62−
6 혼합한다.
지금까지 미량으로만 얻은 시클로헥산헥손 또는 트리퀴노일(CO66)과 시클로펜타네펜톤 또는 루콘산(CO55)의 화합물은 일산화탄소 중합체로 볼 수 있다.5GPa를 초과하는 압력에서 일산화탄소는 대기압에서는 전이 가능하지만 [59][60]폭발성이 있는 고체 폴리머인 폴리카르보닐로 변환됩니다.
검사실 준비
일산화탄소는 예를 들어 농축황산과 [54][55][61]같은 포름산이나 옥살산의 탈수에 의해 실험실에서 쉽게 생성된다.또 다른 방법은 분말 아연 금속과 탄산칼슘의 혼합물을 가열하는 것입니다. 이 혼합물은 CO를 방출하고 산화아연과 산화칼슘을 남깁니다.
- Zn + CaCO3 → ZnO + CaO + CO
- CHI3 + 3AgNO32 + HO → 3HNO3 + CO + 3Agi
마지막으로 금속 옥살산염은 가열 시 CO를 방출하여 탄산염을 부산물로 남깁니다.
- NaCO
2
2
4 → NaCO
2
3 + CO
생산.
열연소는 일산화탄소의 가장 일반적인 원인이다.일산화탄소는 탄소 함유 화합물의 부분 산화로부터 생성됩니다. 일산화탄소는 밀폐된 공간에서 스토브나 내연기관을 작동할 때처럼 이산화탄소(CO2)를 생성하기에 충분한 산소가 없을 때 생성됩니다.예를 들어, 제2차 세계대전 동안, 일산화탄소를 포함한 가스 혼합물이 가솔린과 디젤 연료가 부족한 세계 일부 지역에서 자동차 운행을 유지하기 위해 사용되었다.외부(몇 가지 예외 제외) 숯 또는 목질 가스 발생기를 장착하고 대기 중 질소, 수소, 일산화탄소 및 가스화에 의해 생성된 소량의 기타 가스의 혼합물을 가스 믹서에 배관하였다.이 과정에서 생성되는 가스 혼합물을 목질 가스라고 합니다.
화학 물질 생산을 위한 산화 과정에서 대량의 CO 부산물이 형성됩니다.따라서 오프가스를 정제해야 한다.한편 공정조건을 [62]최적화하고 선택성이[63] 개선된 촉매를 개발하며 대상 제품 및 [64][65]부제품으로 이어지는 반응경로를 파악하기 위해 상당한 연구가 이루어지고 있다.
일산화탄소 생산에는 [66]많은 방법이 개발되어 왔다.
공업 생산
CO의 주요 산업적 공급원은 일산화탄소와 질소를 주로 포함하는 혼합물인 생산가스이며, 탄소가 과잉일 때 공기 중에 탄소가 연소되어 형성된다.오븐에서는 공기가 콜라층을 통과한다.초기에 생성된2 CO는 남은 열탄소와 평형을 이루어 [67]CO를 생성한다.CO와 탄소의 반응을2 Boudouard [68]반응이라고 한다.800°C 이상에서는 CO가 주요 제품입니다.
- CO2 (g) + C (s) → 2 CO (g) (δHr = 170 kJ/mol)
또 다른 공급원은 수소와 일산화탄소의 혼합물로 증기와 탄소의 흡열 반응을 통해 생성된다.
- HO2 (g) + C (s) → H2 (g) + CO (g) (δHr = 131 kJ/mol)
다른 유사한 "합성 가스"는 천연 가스와 다른 연료로부터 얻을 수 있다.
일산화탄소는 고체산화물 전해조세포에 [69]의한 이산화탄소의 고온 전해로도 발생할 수 있다.DTU Energy에서 개발한 방법 중 하나는 산화세륨 촉매를 사용하며 [70][71]촉매 오염 문제가 없습니다.
- 22 CO → 2 CO + O2
일산화탄소 또한 다음과 같이 단순화된 형태로 표시된 탄소와 함께 금속 산화물 광석의 감소로 인한 부산물이다.
- MO + C → M + CO
일산화탄소는 제한된 산소 또는 공기 공급에서 탄소의 직접 산화에 의해서도 발생합니다.
- 2 C + O2 → 2 CO
CO는 기체이기 때문에 환원 과정은 반응의 양(호감) 엔트로피를 이용하여 가열에 의해 구동될 수 있다.엘링엄 다이어그램은 고온에서 CO 형성이 CO보다2 더 좋다는 것을 보여줍니다.
사용하다
화학공업
일산화탄소는 벌크 화학약품 제조에 [72]많이 사용되는 산업용 가스입니다.알케인, 일산화탄소 및2 H의 하이드로포름 반응에 의해 많은 양의 알데히드가 생성된다.하이드로포르밀화는 쉘의 높은 올레핀 공정과 결합되어 세제에 전구체를 제공합니다.
이소시아네이트, 폴리카보네이트, 폴리우레탄 제조에 유용한 포스젠은 촉매 역할을 하는 다공질 활성탄 층에 정제된 일산화탄소 및 염소 가스를 통과시켜 제조된다.1989년 [73]이 화합물의 세계 생산량은 274만 t으로 추정됐다.
- CO + Cl2 → COCl2
메탄올은 일산화탄소의 수소화에 의해 생산된다.관련 반응에서 일산화탄소가 액체 탄화수소 연료로 수소화되는 피셔-트롭쉬 프로세스와 같이 일산화탄소의 수소화는 C-C 결합 형성과 결합된다.이 기술은 석탄이나 바이오매스를 디젤로 바꿀 수 있게 해준다.
Cativa 공정에서는 일산화탄소와 메탄올이 균질 이리듐 촉매와 요오드산의 존재 하에서 반응하여 아세트산을 얻는다.이 과정은 아세트산의 산업 생산의 대부분을 담당한다.
야금학
일산화탄소는 강력한 환원제이며 고대부터 광석에서 금속을 감소시키기 위해 화금속에 사용되어 왔다.일산화탄소는 금속산화물로부터 산소를 제거하여 고온에서 순수한 금속으로 환원하고 그 과정에서 이산화탄소를 형성합니다.일산화탄소는 통상 원자로 내에서 기체상 그대로 공급되는 것이 아니라 산소담지광석 또는 코크스 등의 석탄화제가 존재하는 고온에서 형성된다.고로 공정은 일산화탄소가 있는 광석에서 금속을 환원하는 공정의 전형적인 예입니다.
마찬가지로, 고로 상부에서 수거된 고로 가스는 여전히 일산화탄소의 10%~30%를 함유하고 있으며, 코퍼 스토브 및 노천 노상 제강의 Siemens-Martin 용해로에서 연료로 사용됩니다.
레이저
일산화탄소는 또한 고출력 [74]적외선 레이저의 끈 매체로 사용되어 왔다.
화성에서 연료로 사용 제안
일산화탄소는 화성에서 연료로 사용될 것으로 제안되었다.일산화탄소/산소 엔진은 일산화탄소와 산소 모두 지르코니아 전기 분해에 의해 화성의 이산화탄소 대기로부터 직접적으로 생성될 수 있기 때문에 초기 표면 운송 용도로 제안되어 왔습니다. 화성의 수자원을 사용하여 수소를 얻는 것은 메탄이나 수소 기반 f를 만드는 데 필요합니다.uel.[75]
생물학적 및 생리학적 특성
생리학
일산화탄소는 기체 신호 분자로 작용하는 생물 활성 분자입니다.그것은 많은 효소적 및 비효소적 [76]경로에 의해 자연적으로 생성되며, 가장 잘 알려진 것은 헤모글로빈과 [77]같은 혈단백질에서 유래한 헴에 대한 헴 산소효소의 이화 작용이다.1993년 [8]일산화탄소가 정상적인 신경전달물질이라는 첫 보고 이후 일산화탄소는 생물학적 조절물질로서 중요한 임상적 관심을 받고 있다.
일산화탄소의 신체에서의 역할 때문에, 일산화탄소의 신진대사의 이상은 신경퇴행성, 고혈압, 심부전, 그리고 병리학적 [78]염증을 포함한 다양한 질병과 연관되어 있다.많은 조직에서 일산화탄소는 항염증, 혈관확장, 혈관신장의 [79]촉진제 역할을 한다.동물 모델 연구에서 일산화탄소는 피부 상처 치유를 촉진하면서 실험적으로 유도된 세균성 패혈증, 췌장염, 간 허혈/재액 손상, 대장염, 골관절염, 폐 손상, 폐 이식 거부 및 신경성 통증의 심각도를 낮췄다.따라서 일산화탄소가 의약품이 되는 치료 잠재력과 [80]치료의 임상 기준에 상당한 관심이 있다.
약
일산화탄소와 관련된 연구는 항염증 및 세포 보호 특성 때문에 [81]전 세계의 많은 실험실에서 수행되어 왔다.이러한 특성은 허혈 재관류 손상, 이식 거부, 아테롬성 동맥경화, 심각한 패혈증, 심각한 말라리아 또는 [80]자가면역을 포함한 일련의 병리학적 조건의 발생을 예방하는 데 사용될 가능성이 있습니다.많은 의약품 전달 이니셔티브가 일산화탄소를 안전하게 투여하기 위한 방법을 개발했으며, 이후 통제된 임상 시험에서 [82]일산화탄소의 치료 효과를 평가했습니다.
미생물학
마이크로바이오타는 또한 일산화탄소를 [83]가스전달물질로 사용할 수 있다.일산화탄소 감지는 CoA와 [84][85][86]같은 단백질에 의해 촉진되는 신호 경로입니다.일산화탄소 감지를 위한 생물학적 역할의 범위는 아직 알려지지 않았다.
인간 마이크로바이옴은 [76]일산화탄소를 생산, 소비, 반응시킨다.예를 들어 어떤 세균에서는 생체에너지가 양호한 일산화탄소탈수소효소에 의해 이산화탄소를 감소시킴으로써 일산화탄소가 생성되어 세포 [87][76]하류운전에 전력을 공급한다.또 다른 예로, 일산화탄소는 [88]수소를 사용하여 메탄으로 환원하는 메타노제닉 고세균의 영양소이다.
일산화탄소는 전염병을 [76]치료하기 위해 연구되어 온 항균성을 가지고 있다.
식품과학
일산화탄소는 미국에서 신선한 외관을 유지하기 위해 주로 쇠고기, 돼지고기, 생선과 같은 신선한 육류 제품에 변형된 대기 포장 시스템에 사용됩니다.일산화탄소는 미생물 부패로부터 보호하고 고기 색깔을 높여 소비자에게 [89]어필할 수 있는 두 가지 장점이 있습니다.일산화탄소는 미오글로빈과 결합하여 밝은 체리 레드 색소인 카르복시미오글로빈을 형성합니다.카르복시미오글로빈은 미오글로빈의 산소화된 형태인 옥시미오글로빈보다 더 안정적이며, 옥시미오글로빈은 갈색 색소 메트미오글로빈으로 산화될 수 있습니다.이 안정된 빨간색은 보통 포장된 고기보다 훨씬 더 오래 지속될 수 있습니다.이 공정을 사용하는 시설에서 사용되는 일산화탄소의 일반적인 수준은 0.4%에서 0.[89]5% 사이입니다.
이 기술은 2002년 미국 식품의약국(FDA)에 의해 보조 포장 시스템으로 사용하기 위해 "일반적으로 안전하다고 인정됨"(GRAS) 지위를 부여받았으며 라벨 부착이 필요하지 않습니다.2004년 FDA는 CO가 부패 냄새를 [90]가리지 않는다고 선언하면서 CO를 1차 포장 방법으로 승인했습니다.이 과정은 현재 일본, 싱가포르,[91][92][93] 유럽연합을 포함한 많은 다른 나라에서 승인되지 않았습니다.
독성
일산화탄소 중독은 많은 [94]나라에서 치명적인 공기 중독의 가장 흔한 유형이다.질병통제예방센터는 매년 수천 명의 사람들이 일산화탄소 [95]중독 치료를 받기 위해 병원 응급실에 가는 것으로 추정하고 있다.플로리다 보건부에 따르면, "매년 500명 이상의 미국인들이 일산화탄소에 우연히 노출되어 사망하며, 미국 전역에서 수천 명 이상이 치명적이지 않은 일산화탄소 [96]중독에 대한 응급치료를 필요로 한다."미국독극물통제센터협회(AAPCC)는 2007년 [97]39명의 사망자를 낸 일산화탄소 중독 사례 15,2005년 CPSC는 94명의 발전기 관련 일산화탄소 중독 [41]사망자를 보고했다.
일산화탄소는 무색, 무취, 무미건조하다.따라서, 비교적 탐지할 수 없습니다.그것은 쉽게 헤모글로빈과 결합하여 잠재적으로 가스 교환에 영향을 미치는 카르복시헤모글로빈을 생성한다. 따라서 노출은 매우 독성이 강할 수 있다.667ppm의 낮은 농도는 신체 헤모글로빈의 최대 50%가 카르복시헤모글로빈으로 [98]전환되도록 할 수 있습니다.50%의 카르복시헤모글로빈 수치는 발작, 혼수 및 [99]사망을 초래할 수 있습니다.미국에서는 OSHA가 50ppm [100]이상의 장기 직장 피폭 수준을 제한한다.
일산화탄소는 산소공급에 영향을 미칠 뿐만 아니라 미오글로빈 및 미토콘드리아 시토크롬 산화효소, 금속 및 비금속 세포 표적과 같은 다른 혈단백질에도 결합하여 많은 세포활동에 영향을 미칩니다.
무기화
고대 역사에서, 한니발은 2차 포에니 전쟁 [8]동안 석탄 연기로 로마 포로들을 처형했다.
일산화탄소는 홀로코스트 기간 동안 켐노에 있는 가스 밴과 액션 T4 "안락사"[101] 프로그램에 의해 가장 주목되는 일부 구제 캠프에서 대량 학살에 사용되었다.
「 」를 참조해 주세요.
- 일산화탄소(데이터 페이지) – 화학 데이터 페이지
- 호흡 일산화탄소
- 일산화탄소 검출기 – 일산화탄소(CO)를 측정하는 장치
- 탄화수소(가스)
- 기준 대기 오염 물질
- 독성이 강한 가스 목록
- 흡연자의 역설
- 해저 및 고압 의학회 – 고압 생리학 및 의학 연구 및 교육을 위한 미국에 기반을 둔 조직.– CO 중독에 대한 고압 처리
- Rubicon Foundation – CO 중독에 관한 수중 다이빙 연구 기사 연구 및 정보 접근을 촉진하는 비영리 단체
레퍼런스
- ^ a b "Carbon monoxide". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Richard, Pohanish (2012). Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens (2 ed.). Elsevier. p. 572. ISBN 978-1-4377-7869-4. Retrieved 5 September 2015.
- ^ NIOSH Pocket Guide to Chemical Hazards. "#0105". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Carbon Monoxide - CAMEO Chemicals". cameochemicals.noaa.gov. US NOAA Office of Response and Restoration.
- ^ a b Bierhals, Jürgen (2001). "Carbon Monoxide". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a05_203.
- ^ Bierhals, Jürgen (2001). "Carbon Monoxide". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a05_203. ISBN 3527306730.
- ^ Voiland, Adam. "Fourteen years of carbon monoxide from MOPITT". Climate Change: Vital Signs of the Planet. Retrieved 2022-03-04.
- ^ a b c d e f g h i Hopper, Christopher P.; Zambrana, Paige N.; Goebel, Ulrich; Wollborn, Jakob (2021-06-01). "A brief history of carbon monoxide and its therapeutic origins". Nitric Oxide. 111–112: 45–63. doi:10.1016/j.niox.2021.04.001. ISSN 1089-8603. PMID 33838343. S2CID 233205099.
- ^ Stromeyer, Friedrich (1808). Grundriß der theoretischen Chemie: zum Behuf seiner Vorlesungen entworfen (in German). Röwer. pp. 1–18.
- ^ Kelkar, A.A. (2016). "Carbonylations and Hydroformylations for Fine Chemicals". Industrial Catalytic Processes for Fine and Specialty Chemicals. pp. 663–692. doi:10.1016/B978-0-12-801457-8.00014-8. ISBN 9780128014578.
- ^ Gilliam, O. R.; Johnson, C. M.; Gordy, W. (1950). "Microwave Spectroscopy in the Region from Two to Three Millimeters". Physical Review. 78 (2): 140–144. Bibcode:1950PhRv...78..140G. doi:10.1103/PhysRev.78.140.
- ^ Haynes, William M. (2010). Handbook of Chemistry and Physics (91 ed.). Boca Raton, Florida, USA: CRC Press. p. 9–33. ISBN 978-1-43982077-3.
- ^ Haynes, William M. (2010). Handbook of Chemistry and Physics (91 ed.). Boca Raton, Florida, USA: CRC Press. p. 9–39. ISBN 978-1-43982077-3.
- ^ 공통 결합 에너지(D) 및 결합 길이(r) wiredchemist.com
- ^ Vidal, C. R. (28 June 1997). "Highly Excited Triplet States of Carbon Monoxide". Archived from the original on 2006-08-28. Retrieved August 16, 2012.
- ^ Scuseria, Gustavo E.; Miller, Michael D.; Jensen, Frank; Geertsen, Jan (1991). "The dipole moment of carbon monoxide". J. Chem. Phys. 94 (10): 6660. Bibcode:1991JChPh..94.6660S. doi:10.1063/1.460293.
- ^ Martinie, Ryan J.; Bultema, Jarred J.; Vander Wal, Mark N.; Burkhart, Brandon J.; Vander Griend, Douglas A.; DeKock, Roger L. (2011-08-01). "Bond Order and Chemical Properties of BF, CO, and N2". Journal of Chemical Education. 88 (8): 1094–1097. Bibcode:2011JChEd..88.1094M. doi:10.1021/ed100758t. ISSN 0021-9584. S2CID 11905354.
- ^ Ulrich, Henri (2009). Cumulenes in click reactions. Wiley InterScience (Online service). Chichester, U.K.: Wiley. p. 45. ISBN 9780470747957. OCLC 476311784.
- ^ Lupinetti, Anthony J.; Fau, Stefan; Frenking, Gernot; Strauss, Steven H. (1997). "Theoretical Analysis of the Bonding between CO and Positively Charged Atoms". J. Phys. Chem. A. 101 (49): 9551–9559. Bibcode:1997JPCA..101.9551L. doi:10.1021/jp972657l.
- ^ Blanco, Fernando; Alkorta, Ibon; Solimannejad, Mohammad; Elguero, Jose (2009). "Theoretical Study of the 1:1 Complexes between Carbon Monoxide and Hypohalous Acids". J. Phys. Chem. A. 113 (13): 3237–3244. Bibcode:2009JPCA..113.3237B. doi:10.1021/jp810462h. hdl:10261/66300. PMID 19275137.
- ^ Meerts, W; De Leeuw, F.H.; Dymanus, A. (1 June 1977). "Electric and magnetic properties of carbon monoxide by molecular-beam electric-resonance spectroscopy". Chemical Physics. 22 (2): 319–324. Bibcode:1977CP.....22..319M. doi:10.1016/0301-0104(77)87016-X.
- ^ Stefan, Thorsten; Janoschek, Rudolf (2000). "How relevant are S=O and P=O Double Bonds for the Description of the Acid Molecules H2SO3, H2SO4, and H3PO3, respectively?". Journal of Molecular Modeling. 6 (2): 282–288. doi:10.1007/PL00010730. S2CID 96291857.
- ^ 글로벌 맵 일산화탄소earthobservatory.nasa.gov
- ^ Khalil, M.A.K; Pinto, J.P; Shearer, M.J (1999). "Atmospheric carbon monoxide". Chemosphere - Global Change Science. 1 (1–3): ix–xi. Bibcode:1999ChGCS...1D...9K. doi:10.1016/S1465-9972(99)00053-7.
- ^ 수치 출처: 이산화탄소, NOAA 지구 시스템 연구실 (2010.06 업데이트)Metan, IPCC TAR 표 6.1 Wayback Machine에서의 2007-06-15 아카이브(1998년으로 갱신).NASA의 총량은 17ppmv/100%였고, 여기서2 CO는 15ppmv 증가했다.정규화하려면2 N은 약 25ppmv, O는2 약 7ppmv 감소해야 합니다.
- ^ Committee on Medical and Biological Effects of Environmental Pollutants (1977). Carbon Monoxide. Washington, D.C.: National Academy of Sciences. p. 29. ISBN 978-0-309-02631-4.
- ^ Green W. "An Introduction to Indoor Air Quality: Carbon Monoxide (CO)". United States Environmental Protection Agency. Retrieved 2008-12-16.
- ^ Gosink, Tom (1983-01-28). "What Do Carbon Monoxide Levels Mean?". Alaska Science Forum. Geophysical Institute, University of Alaska Fairbanks. Archived from the original on 2008-12-25. Retrieved 2007-12-01.
- ^ Singer, Siegfried Fred (1975). The Changing Global Environment. Springer. p. 90. ISBN 978-9027704023.
- ^ a b "Carbon Monoxide Poisoning: Vehicles (AEN-208)". abe.iastate.edu. Retrieved 11 February 2018.
- ^ Gosink T (January 28, 1983). "What Do Carbon Monoxide Levels Mean?". Alaska Science Forum. Geophysical Institute, University of Alaska Fairbanks. Archived from the original on December 25, 2008. Retrieved December 16, 2008.
- ^ Weinstock, B.; Niki, H. (1972). "Carbon Monoxide Balance in Nature". Science. 176 (4032): 290–2. Bibcode:1972Sci...176..290W. doi:10.1126/science.176.4032.290. PMID 5019781. S2CID 25223868.
- ^ Seinfeld, John; Pandis, Spyros (2006). Atmospheric Chemistry and Physics: From Air Pollution to Climate Change. John Wiley & Sons. ISBN 978-0-471-72018-8.
- ^ Sigel, Astrid; Sigel, Roland K. O. (2009). Metal-Carbon Bonds in Enzymes and Cofactors. Royal Society of Chemistry. p. 243. ISBN 978-1-84755-915-9.
- ^ White, James Carrick; et al. (1989). Global climate change linkages: acid rain, air quality, and stratospheric ozone. Springer. p. 106. ISBN 978-0-444-01515-0.
- ^ Drummond, James (February 2, 2018). "MOPITT, Atmospheric Pollution, and Me: A Personal Story". Canadian Meteorological and Oceanographic Society. Retrieved August 1, 2018.
- ^ Pommier, M.; Law, K. S.; Clerbaux, C.; Turquety, S.; Hurtmans, D.; Hadji-Lazaro, J.; Coheur, P.-F.; Schlager, H.; Ancellet, G.; Paris, J.-D.; Nédélec, P.; Diskin, G. S.; Podolske, J. R.; Holloway, J. S.; Bernath, P. (2010). "IASI carbon monoxide validation over the Arctic during POLARCAT spring and summer campaigns". Atmospheric Chemistry and Physics. 10 (21): 10655–10678. Bibcode:2010ACP....1010655P. doi:10.5194/acp-10-10655-2010.
- ^ Pommier, M.; McLinden, C. A.; Deeter, M. (2013). "Relative changes in CO emissions over megacities based on observations from space". Geophysical Research Letters. 40 (14): 3766. Bibcode:2013GeoRL..40.3766P. doi:10.1002/grl.50704.
- ^ Reeves, Claire E.; Penkett, Stuart A.; Bauguitte, Stephane; Law, Kathy S.; Evans, Mathew J.; Bandy, Brian J.; Monks, Paul S.; Edwards, Gavin D.; Phillips, Gavin; Barjat, Hannah; Kent, Joss; Dewey, Ken; Schmitgen, Sandra; Kley, Dieter (2002). "Potential for photochemical ozone formation in the troposphere over the North Atlantic as derived from aircraft observationsduring ACSOE". Journal of Geophysical Research. 107 (D23): 4707. Bibcode:2002JGRD..107.4707R. doi:10.1029/2002JD002415.
- ^ Ozone and other photochemical oxidants. National Academies. 1977. p. 23. ISBN 978-0-309-02531-7.
- ^ a b c 미국 소비자 제품 안전 위원회, 일산화탄소 질의응답 2010-01-09년 웨이백 머신 보관, 2009-12-04 액세스
- ^ Treisman, Rachel (18 February 2021). "'A Disaster Within A Disaster': Carbon Monoxide Poisoning Cases Are Surging In Texas". NPR. Retrieved 2021-05-16.
- ^ "MSHA - Occupational Illness and Injury Prevention Program - Health Topics - Carbon Monoxide". arlweb.msha.gov. Archived from the original on 2017-12-31. Retrieved 2017-12-31.
- ^ Combes, Françoise (1991). "Distribution of CO in the Milky Way". Annual Review of Astronomy & Astrophysics. 29: 195–237. Bibcode:1991ARA&A..29..195C. doi:10.1146/annurev.aa.29.090191.001211.
- ^ Hamed, M. (2021). "Multiwavelength dissection of a massive heavily dust-obscured galaxy and its blue companion at z∼2". Astronomy & Astrophysics. 646: A127. arXiv:2101.07724. Bibcode:2021A&A...646A.127H. doi:10.1051/0004-6361/202039577. S2CID 231639096.
- ^ Khan, Amina. "Did two planets around nearby star collide? Toxic gas holds hints". Los Angeles Times. Retrieved March 9, 2014.
- ^ Dent, WR, Wyatt, MC, Roberge, A, Augereau, JC, Casassus, S, Corder, S, Greaves, JS, de Gregorio-Monsalvo, I, Hales, A, Jackson, AP, Hughes, AM, Meredith A, Lagrange, AM, Matthews, B, Wilner, D (March 6, 2014). "Molecular Gas Clumps from the Destruction of Icy Bodies in the β Pictoris Debris Disk". Science. 343 (6178): 1490–1492. arXiv:1404.1380. Bibcode:2014Sci...343.1490D. doi:10.1126/science.1248726. PMID 24603151. S2CID 206553853. Retrieved March 9, 2014.
- ^ Lellouch, E.; de Bergh, C.; Sicardy, B.; Ferron, S.; Käufl, H.-U. (2010). "Detection of CO in Triton's atmosphere and the nature of surface-atmosphere interactions". Astronomy and Astrophysics. 512: L8. arXiv:1003.2866. Bibcode:2010A&A...512L...8L. doi:10.1051/0004-6361/201014339. ISSN 0004-6361. S2CID 58889896.
- ^ Greenberg, J. Mayo (1998). "Making a comet nucleus". Astronomy and Astrophysics. 330: 375. Bibcode:1998A&A...330..375G.
- ^ Yeomans, Donald K. (2005). "Comets (World Book Online Reference Center 125580)". NASA. Archived from the original on 29 April 2005. Retrieved 20 November 2007.
- ^ Christopher Glein and Hunter Waite (May 11, 2018). "Primordial N2 provides a cosmo chemical explanation for the existence of Sputnik Planitia, Pluto". Icarus. 313: 79–92. arXiv:1805.09285. Bibcode:2018Icar..313...79G. doi:10.1016/j.icarus.2018.05.007. S2CID 102343522.
- ^ Peng, Jin-Bao; Geng, Hui-Qing; Wu, Xiao-Feng (2019-03-14). "The Chemistry of CO: Carbonylation". Chem. 5 (3): 526–552. doi:10.1016/j.chempr.2018.11.006. ISSN 2451-9294.
- ^ Mond L, Langer K, Quincke F (1890). "Action of carbon monoxide on nickel". Journal of the Chemical Society. 57: 749–753. doi:10.1039/CT8905700749.
- ^ a b Koch, H.; Haaf, W. (1973). "1-Adamantanecarboxylic Acid". Organic Syntheses.; Collective Volume, vol. 5, p. 20
- ^ a b Coleman, G. H.; Craig, David (1943). "p-Tolualdehyde". Organic Syntheses.; Collective Volume, vol. 2, p. 583
- ^ Chatani, N.; Murai, S. "일산화탄소" 유기합성용 시약 백과사전 (Ed: L. Paquet) 2004, J. Wiley & Sons, New York. doi: 10.1002/047084289X.
- ^ Büchner, W.; Weiss, E. (1964). "Zur Kenntnis der sogenannten "Alkalicarbonyle" IV[1] Über die Reaktion von geschmolzenem Kalium mit Kohlenmonoxid". Helvetica Chimica Acta. 47 (6): 1415–1423. doi:10.1002/hlca.19640470604.
- ^ Fownes, George (1869). A Manual of elementary chemistry. H.C. Lea. p. 678.
- ^ Katz, Allen I.; Schiferl, David; Mills, Robert L. (1984). "New phases and chemical reactions in solid carbon monoxide under pressure". The Journal of Physical Chemistry. 88 (15): 3176–3179. doi:10.1021/j150659a007.
- ^ Evans, W. J.; Lipp, M. J.; Yoo, C.-S.; Cynn, H.; Herberg, J. L.; Maxwell, R. S.; Nicol, M. F. (2006). "Pressure-Induced Polymerization of Carbon Monoxide: Disproportionation and Synthesis of an Energetic Lactonic Polymer". Chemistry of Materials. 18 (10): 2520–2531. doi:10.1021/cm0524446.
- ^ Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry Vol. 1, 2nd Ed. New York: Academic Press. p. 646. ISBN 978-0121266011.
- ^ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (PDF). 2011.
- ^ Amakawa, Kazuhiko; Kolen'Ko, Yury V.; Villa, Alberto; Schuster, Manfred E/; Csepei, Lénárd-István; Weinberg, Gisela; Wrabetz, Sabine; Naumann d'Alnoncourt, Raoul; Girgsdies, Frank; Prati, Laura; Schlögl, Robert; Trunschke, Annette (26 April 2013). "Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol". ACS Catalysis. 3 (6): 1103–1113. doi:10.1021/cs400010q.
- ^ Naumann d'Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; Girgsdies, Frank; Schuster, Manfred E.; Schlögl, Robert; Trunschke, Annette (March 2014). "The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts" (PDF). Journal of Catalysis. 311: 369–385. doi:10.1016/j.jcat.2013.12.008. hdl:11858/00-001M-0000-0014-F434-5. Archived from the original (PDF) on 2016-02-15. Retrieved 2018-04-14.
- ^ Hävecker, Michael; Wrabetz, Sabine; Kröhnert, Jutta; Csepei, Lenard-Istvan; Naumann d'Alnoncourt, Raoul; Kolen'Ko, Yury V.; Girgsdies, Frank; Schlögl, Robert; Trunschke, Annette (January 2012). "Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid" (PDF). Journal of Catalysis. 285 (1): 48–60. doi:10.1016/j.jcat.2011.09.012. hdl:11858/00-001M-0000-0012-1BEB-F. Archived from the original (PDF) on 2016-10-30. Retrieved 2018-04-14.
- ^ Holleman, A. F., Wiberg, E. "유기화학" 학술 출판사: 샌디에이고, 200.ISBN 0-12-352651-5.
- ^ "Carbon Monoxide". Retrieved 21 May 2021.
- ^ Higman, C; van der Burgt, M (2003). Gasification. Gulf Professional Publishing. p. 12. ISBN 978-0-7506-7707-3.
- ^ Zheng, Yun; Wang, Jianchen; Yu, Bo; Zhang, Wenqiang; Chen, Jing; Qiao, Jinli; Zhang, Jiujun (2017). "A review of high temperature co-electrolysis of H O and CO to produce sustainable fuels using solid oxide electrolysis cells (SOECs): advanced materials and technology". Chem. Soc. Rev. 46 (5): 1427–1463. doi:10.1039/C6CS00403B. PMID 28165079.
- ^ "New route to carbon-neutral fuels from carbon dioxide discovered by Stanford-DTU team - DTU". dtu.dk.
- ^ Skafte, Theis L.; Guan, Zixuan; Machala, Michael L.; Gopal, Chirranjeevi B.; Monti, Matteo; Martinez, Lev; Stamate, Eugen; Sanna, Simone; Garrido Torres, Jose A.; Crumlin, Ethan J.; García-Melchor, Max; Bajdich, Michal; Chueh, William C.; Graves, Christopher (October 8, 2019). "Selective high-temperature CO 2 electrolysis enabled by oxidized carbon intermediates". Nature Energy. 4 (10): 846–855. Bibcode:2019NatEn...4..846S. doi:10.1038/s41560-019-0457-4. hdl:2262/93685. S2CID 202640892 – via www.nature.com.
- ^ Elschenbroich, C.; Salzer, A. (2006). Organometallics: A Concise Introduction (2nd ed.). Weinheim: Wiley-VCH. ISBN 978-3-527-28165-7.
- ^ Wolfgang Schneider; Werner Diller. "Phosgene". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a19_411.
- ^ Ionin, A.; Kinyaevskiy, I.; Klimachev, Y.; Kotkov, A.; Kozlov, A. (2012). "Novel mode-locked carbon monoxide laser system achieves high accuracy". SPIE Newsroom. doi:10.1117/2.1201112.004016. S2CID 112510554.
- ^ Landis (2001). "Mars Rocket Vehicle Using In Situ Propellants". Journal of Spacecraft and Rockets. 38 (5): 730–735. Bibcode:2001JSpRo..38..730L. doi:10.2514/2.3739.
- ^ a b c d Hopper, Christopher P.; De La Cruz, Ladie Kimberly; Lyles, Kristin V.; Wareham, Lauren K.; Gilbert, Jack A.; Eichenbaum, Zehava; Magierowski, Marcin; Poole, Robert K.; Wollborn, Jakob; Wang, Binghe (2020-12-23). "Role of Carbon Monoxide in Host–Gut Microbiome Communication". Chemical Reviews. 120 (24): 13273–13311. doi:10.1021/acs.chemrev.0c00586. ISSN 0009-2665. PMID 33089988. S2CID 224824871.
- ^ Ryter, Stefan W.; Alam, Jawed; Choi, Augustine M. K. (2006-04-01). "Heme Oxygenase-1/Carbon Monoxide: From Basic Science to Therapeutic Applications". Physiological Reviews. 86 (2): 583–650. doi:10.1152/physrev.00011.2005. ISSN 0031-9333. PMID 16601269.
- ^ Wu, L; Wang, R (December 2005). "Carbon Monoxide: Endogenous Production, Physiological Functions, and Pharmacological Applications". Pharmacol Rev. 57 (4): 585–630. doi:10.1124/pr.57.4.3. PMID 16382109. S2CID 17538129.
- ^ Campbell, Nicole K.; Fitzgerald, Hannah K.; Dunne, Aisling (2021-01-29). "Regulation of inflammation by the antioxidant haem oxygenase 1". Nature Reviews Immunology. 21 (7): 411–425. doi:10.1038/s41577-020-00491-x. ISSN 1474-1741. PMID 33514947. S2CID 231762031.
- ^ a b Motterlini, Roberto; Otterbein, Leo E. (2010). "The therapeutic potential of carbon monoxide". Nature Reviews Drug Discovery. 9 (9): 728–743. doi:10.1038/nrd3228. ISSN 1474-1784. PMID 20811383. S2CID 205477130.
- ^ Motterlini, Roberto; Foresti, Roberta (2017-01-11). "Biological signaling by carbon monoxide and carbon monoxide-releasing molecules". American Journal of Physiology. Cell Physiology. 312 (3): C302–C313. doi:10.1152/ajpcell.00360.2016. ISSN 0363-6143. PMID 28077358.
- ^ Hopper, Christopher P.; Meinel, Lorenz; Steiger, Christoph; Otterbein, Leo E. (2018-10-11). "Where is the Clinical Breakthrough of Heme Oxygenase-1 / Carbon Monoxide Therapeutics?". Current Pharmaceutical Design. 24 (20): 2264–2282. doi:10.2174/1381612824666180723161811. PMID 30039755. S2CID 51712930.
- ^ Wareham, Lauren K.; Southam, Hannah M.; Poole, Robert K. (2018-09-06). "Do nitric oxide, carbon monoxide and hydrogen sulfide really qualify as 'gasotransmitters' in bacteria?". Biochemical Society Transactions. 46 (5): 1107–1118. doi:10.1042/BST20170311. ISSN 0300-5127. PMC 6195638. PMID 30190328.
- ^ Roberts, G. P.; Youn, H.; Kerby, R. L. (2004). "CO-Sensing Mechanisms". Microbiology and Molecular Biology Reviews. 68 (3): 453–473. doi:10.1128/MMBR.68.3.453-473.2004. PMC 515253. PMID 15353565.
- ^ Shimizu, Toru; Lengalova, Alzbeta; Martínek, Václav; Martínková, Markéta (2019-12-09). "Heme: emergent roles of heme in signal transduction, functional regulation and as catalytic centres". Chemical Society Reviews. 48 (24): 5624–5657. doi:10.1039/C9CS00268E. ISSN 1460-4744. PMID 31748766. S2CID 208217502.
- ^ Shimizu, Toru; Huang, Dongyang; Yan, Fang; Stranava, Martin; Bartosova, Martina; Fojtíková, Veronika; Martínková, Markéta (2015-07-08). "Gaseous O2, NO, and CO in Signal Transduction: Structure and Function Relationships of Heme-Based Gas Sensors and Heme-Redox Sensors". Chemical Reviews. 115 (13): 6491–6533. doi:10.1021/acs.chemrev.5b00018. ISSN 0009-2665. PMID 26021768.
- ^ Jaouen, G., ed. (2006). Bioorganometallics: Biomolecules, Labeling, Medicine. Weinheim: Wiley-VCH. ISBN 978-3-527-30990-0.
- ^ Thauer, R. K. (1998). "Biochemistry of methanogenesis: a tribute to Marjory Stephenson. 1998 Marjory Stephenson Prize Lecture" (Free). Microbiology. 144 (9): 2377–2406. doi:10.1099/00221287-144-9-2377. PMID 9782487.
- ^ a b Van Rooyen, Lauren Anne; Allen, Paul; O'Connor, David I. (October 2017). "The application of carbon monoxide in meat packaging needs to be re-evaluated within the EU: An overview". Meat Science. 132: 179–188. doi:10.1016/j.meatsci.2017.03.016. PMID 28465017.
- ^ Eilert EJ (2005). "New packaging technologies for the 21st century". Journal of Meat Science. 71 (1): 122–127. doi:10.1016/j.meatsci.2005.04.003. PMID 22064057.
- ^ "Proof in the Pink? Meat Treated to Give It Fresh Look". ABC News. November 14, 2007. Retrieved May 5, 2009.
- ^ Carbon Monoxide in Meat Packaging: Myths and Facts. American Meat Institute. 2008. Archived from the original on 2011-07-14. Retrieved May 5, 2009.
- ^ "CO in packaged meat". Carbon Monoxide Kills Campaign. Archived from the original on September 26, 2010. Retrieved May 5, 2009.
- ^ Omaye ST (2002). "Metabolic modulation of carbon monoxide toxicity". Toxicology. 180 (2): 139–150. doi:10.1016/S0300-483X(02)00387-6. PMID 12324190.
- ^ 질병 통제 및 예방 센터, 국가 환경 공중 보건 추적 네트워크, 일산화탄소 중독 2009-12-10 웨이백 머신에 보관, 2009-12-04 액세스
- ^ "Tracking Carbon Monoxide". Environmental Public Health Tracking – Florida Dept. of Health. Archived from the original on 2011-09-27.
- ^ 「AAPCC Annual Data Reports 2007」.미국 독극물 통제 센터 협회.
- ^ Tikuisis, P; Kane, DM; McLellan, TM; Buick, F; Fairburn, SM (1992). "Rate of formation of carboxyhemoglobin in exercising humans exposed to carbon monoxide". Journal of Applied Physiology. 72 (4): 1311–9. doi:10.1152/jappl.1992.72.4.1311. PMID 1592720.
- ^ Blumenthal, Ivan (1 June 2001). "Carbon monoxide poisoning". J R Soc Med. 94 (6): 270–272. doi:10.1177/014107680109400604. PMC 1281520. PMID 11387414.
- ^ "OSHA CO guidelines". OSHA. Archived from the original on January 26, 2010. Retrieved May 27, 2009.
- ^ Kitchen, Martin (2006). A history of modern Germany, 1800–2000. Wiley-Blackwell. p. 323. ISBN 978-1-4051-0041-0.
외부 링크
- 일산화탄소 분포 세계지도
- 구조에 대한 설명
- 일산화탄소안전협회
- 국제 화학 안전 카드 0023
- CDC NIOSH 화학적 위험에 대한 포켓 가이드: 일산화탄소 - 미국 국립산업안전보건연구소(NIOSH), 미국 질병통제예방센터(CDC)
- 일산화탄소-NIOSH 작업장 안전보건 토픽: CDC
- 일산화탄소 중독 - 자주 묻는 질문 -CDC
- 외부 MSDS 데이터 시트
- 일산화탄소 검출기 배치
- 일산화탄소 정화법
- 일산화탄소 마이크로스케일 가스화학 실험
- "Instant insight: Don't blame the messenger". Chemical Biology (11: Research News). 18 October 2007. Archived from the original on 28 October 2007. Retrieved 27 October 2019.
Outlining the physiology of carbon monoxide from the Royal Society of Chemistry.