염화설페닐
Sulfenyl chloride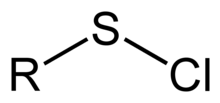
염화설페닐은 R–S–Cl 연결을 가진 기능 그룹이며, 여기서 R은 알킬[1] 또는 아릴이다. Sulfenyl clorides는 RS의+ 원천으로 작용하는 반응성 화합물이다. 그것들은 RS-N과 RS-O 결합의 형성에 사용된다. IUPAC 명명법에 따르면 그것들은 알킬 티오하이포염소산(alkyl tiohypoclorite), 즉 티오하이포염소산의 에스테르로 명명된다.
준비

Sulfenyl 염소화물은 일반적으로 이황화물의 염소화에 의해 준비된다.[2][3]
- RS22 + Cl2 → 2 RSCl
이 반응은 테오도르 아연케를 인정하여 이황화 아연케 반응이라고도 한다.[4][5] 전형적으로, 설페닐 할로겐화물은 전기 대체 물질에 의해 안정화된다. 이러한 추세는 이황화탄소의 염소화를 통해 얻은 CClSCl의3 안정성에 의해 설명된다.
반응
Percloromethyl mercaptan(CCLSCl3)은 염기성분이 있는 곳에서 N-H 함유 화합물과 반응하여 황산염을 다음과 같이 발생시킨다.
- CClSCl3 + RNH2 → CClSNR32 + HCl
Sulfenyl clorides는 알케인에 다음과 같이 첨가된다.[6]
- CH2=CH2 + RSCl → RSCHCl22
- CHSCl3 + Cl2 → [CHSCl32]Cl
Sulfenyl clorides는 알코올과 반응하여 Sulfenyl 에스테르를 발생시킨다. 이 에스테르에는 RSOR′[7]라는 공식이 있다.
- CHSCl65 + ROH → CHSOR65 + HCl
황화비닐 할로겐화 루트
Sulfenyl 염소화물은 sulfenyl cloride (RS(O)Cl)로 변환할 수 있다. 한 가지 접근방식에서 염화 황화비닐은 염화 황화물을
2
2 함유한 티올의 반응으로 시작하여 두 단계로 생성된다. 어떤 경우에는 염화 황화비닐이 대신 2,2,2-트리플루오로-1,1-디페닐타네티올과 같이 발생한다. 그런 다음 삼불화합산 산화를 통해 황페닐 염소산염의 형성에 대한 일반적인 접근법을 제공한다.[8]
관련 화합물
설페닐브로미드도 알려져 있다.[9] 단순황산염은 이황화물과 요오드에 관해서 불안정하기 때문에 알려져 있지 않다.
- 22 RSI → (RS)2 + I
황산염 요오드화물은 황산염의 경우와 같이 반응성 기능의 운동 안정화 기법을 설명하면서 알킬 보호 그룹을 캐비티 모양의 골조의 일부로 포함하면 안정적인 화합물로 격리될 수 있다.[10]
관련 화합물 등급은 알킬설푸르 트리클로라이드(Methylsulfur trichloride, CHSCl33)로 대표되는 알킬설푸르 트리클로라이드다.[11]
해당 셀레네닐 할로겐화물(예: CHSeCl65)은 실험실에서 더 흔히 접하게 된다. 설페닐염화물은 고무의 경화작용에 사용되는 제제의 생산에 사용된다.
참조
- ^ Drabowicz, J.; Kiełbasiński, P.; Łyżwa, P.; Zając, A.; Mikołajczyk, M. (2008). Kambe, N. (ed.). Alkanesulfenyl Halides. Science of Synthesis. Vol. 39. pp. 544–550. ISBN 9781588905307.
- ^ Hubacher, Max H. (1943). "o-Nitrophenylsulfur chloride". Organic Syntheses.; Collective Volume, vol. 2, p. 455
- ^ a b Douglass, Irwin B.; Norton, Richard V. (1973). "Methanesulfinyl Chloride". Organic Syntheses.; Collective Volume, vol. 5, pp. 709–715
- ^ Zincke, Th. (1911). "Über eine neue Reihe aromatischer Schwefelverbindungen". Chemische Berichte (in German). 44 (1): 769–771. doi:10.1002/cber.191104401109.
- ^ Zincke, Th.; Farr, Fr. (1912). "Über o-Nitrophenylschwefelchlorid und Umwandlungsprodukte". Justus Liebig's Annalen der Chemie (in German). 391 (1): 57–88. doi:10.1002/jlac.19123910106.
- ^ 브린칭거(Brintzinger, H.; Langhek), M. "신테센 mit Alkylschwefel cloriden (X. Mitteil). über 조직체 슈베펠클로라이드)", Chemische Berichte 1954, 제87권, 325-330. doi:10.1002/cber.19540870306
- ^ Petrovic, Goran; Saicic, Radomir N.; Cekovic, Zivorad (2005). "Phenylsulfenylation of Nonactivated Carbon Atom by Photolysiis of Alkyl Benzenesulfenated: Preparation of 2-Phenylthio-5-heptanol". Organic Syntheses. 81: 244. doi:10.15227/orgsyn.081.0244.
- ^ Page, P. C. B.; Wilkes, R. D.; Reynolds, D. (1995). "Alkyl Chalcogenides: Sulfur-based Functional Groups". In Ley, Steven V. (ed.). Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Comprehensive Organic Functional Group Transformations. Elsevier. pp. 113–276. ISBN 9780080423234.
- ^ Reno, Daniel S.; Pariza, Richard J. (1998). "Phenyl Vinyl Sulfide". Organic Syntheses.; Collective Volume, vol. 9, p. 662
- ^ Sase, S.; Aoki, Y.; Abe, N.; Goto, K. (2009). "Stable Sulfenyl Iodide Bearing a Primary Alkyl Steric Protection Group with a Cavity-shaped Framework". Chemistry Letters. 38 (12): 1188–1189. doi:10.1246/cl.2009.1188.
- ^ Braverman, S.; Cherkinsky, M.; Levinger, S. (2008). "Alkylsulfur Trihalides". Sci. Synth. 39: 187–188. ISBN 9781588905307.



