아미노 래디컬
Amino radical| | |||
| 이름 | |||
|---|---|---|---|
| 체계적 IUPAC 이름 | |||
| 기타 이름 아미도겐; 아미닐 래디컬; 아자닐 래디컬 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
펍켐 CID | |||
| 특성. | |||
| NH 2• | |||
| 어금질량 | 16.0226 g mol−1 | ||
| 열화학 | |||
성 어금니 엔트로피 (S | 194.71 J K−1 mol−1 | ||
의 성 엔탈피 대형화 (ΔfH⦵298) | 190.37 kJ mol−1 | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
아미노 래디컬, NH는
2 아미닐 래디컬 또는 아자닐 래디컬로도 알려져 있으며, 아미드 이온(NH−
2)의 중성 형태다. 아미닐은 반응성이 매우 높아서 결과적으로 대부분의 급진파와 같이 수명이 짧지만 질소 화학에서 중요한 부분을 차지한다. 충분히 높은 농도에서 아미노산소는 히드라진을 형성하기 위해 디머라이징한다. 기능 집단으로서의 NH는2 많은 화합물(예: 페네틸아민)의 일부를 구성하는 자연에서 흔히 볼 수 있지만, 급진적인 것은 자유로운 형태로 고립될 수 없다.[2]
합성
반응 1: 암모니아로부터 아미노산 라디칼의 형성
아미노산산산소는 조사된 수용액에서 OH 래디컬과 암모니아를 반응시킴으로써 생성될 수 있다. 이 반응은 수소 추상화 반응으로 공식화된다.[3]
- NH3 + •OH → •NH2 + H2O
이 반응에 대한 속도 상수(k1)는 1.0×10Ms로8−1−1 결정되었고, NH와+
4 OH의 병렬 반응은 훨씬 느린 것으로 밝혀졌다. 이 비율은 pH 11.4에서 벤조산염과 티오시아네이트 이온과 2펄스 방사분해 경쟁 방법을 사용하여 재결정되었다. 두 시스템1 모두에서 k = (97 + 1−1)×10−1 M s의 값을 얻었다. 산성 용액에 있는 동안, NH에+
4 대한 OH의 대응 반응은 맥박 전파분해로 관찰되기에는 너무 느리다.
반응 2: 히드록시아민으로부터 아미노산 라디칼의 형성
또한 아미노 라디칼은 히드록시아민(NHOH2)과 e−(aq)의 반응에 의해 생성될 수 있다. 또한 몇몇 연구에서는 전자파파자기공명(ESR) 분광과 극성분석을 이용한 아미노산소 생성을 위해III Ti-NHOH의2 redox 시스템을 활용했다.[3]
- TiIII + NH2OH → TiIV + •NH2 + OH−
반응 3: 암모늄에서 아미노 라디칼의 형성
e−(aq)에 의한 히드록시아민 감소도 다음과 같은 반응에서 아미노 라디칼을 생성하기 위해 제안되었다.[3]
- •NH+
3 ⇌ •NH2 + H+
이 반응에서 아미노 라디칼의 반응성은 pH에 의존할 것으로 예상되며 pH 3-7 지역에서 발생해야 한다.
특성.
전자 상태
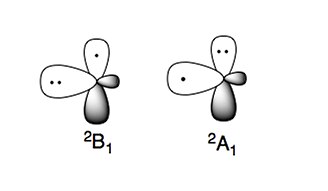
아미노 래디컬은 두 가지 특징적인 전자 상태를 가지고 있다.
보다 안정된 전자 상태는 B인데1, 여기서 손상된 전자는 분자의 평면에 수직인 p-오르비탈(p-orbital)에 있다. 고에너지 전자상태인 A는1 p-오르비탈에 두 개의 전자가 있고, sp2 궤도에는 손상되지 않은 전자가 있다.[4][5]
아민과 같은 질소 중심 화합물은 자연에서 핵성분이다. 이 성질은 아미노산에서도 나타나는데, 이는 핵종이라고 볼 수 있다.[4][5]
스펙트럼 특성
아미노 래디컬은 가시 영역에서만max 매우 낮은 광학 흡수율( exhibits = 530nm, εmax = 81Ms−1)을 보이는−1 반면 UV에서의 흡수율(<260nm)은 OH와 비슷하다. 이 때문에, 아미노 라디칼의 붕괴를 따라 유기 화합물과의 아미노 라디칼의 반응 속도를 결정하는 것은 비현실적이다.
반응도
일반적으로 아미노산소는 반응성이 높고 수명이 짧지만, 일부 유기 분자와 반응할 때는 그렇지 않다. 여러 유기 화합물을 가진 아미노 라디칼의 상대적 반응성은 보고되었지만, 그러한 반응에 대한 절대 속도 상수는 여전히 알려져 있지 않다. 반응 1에서, 활성산소가 OH보다 더 강한 산화제라는 점에서 아미노 라디칼이 NH와3 더 빠르게 반응하고 NH를+
4 산화시켜 산성 용액에서 아미노 라디칼을 생산할 수 있다는 가설을 세웠다. 이를 테스트하기 위해 황산염과 인산염 급진 음이온이 사용됐다. 황산염과 인산염 급진 음이온은 아미노 급진보다 NH에3 더 느리게 반응하고 전자전달 산화 작용이 아닌 수소 추상화에 의해 암모니아와 반응하는 것으로 밝혀졌다.[3]
아미노산 라디칼을 벤조산 이온과 반응하면 속도 상수가 매우 낮고 UV 스펙트럼의 약한 흡수만 관측돼 아미노산소가 벤젠과 빠르게 반응하지 않는다는 것을 알 수 있다. 반면 페놀은 아미노 레디컬에 더 빠르게 반응하는 것으로 밝혀졌다. pH 11.3과 12의 실험에서, 1.5 M NH와3 4 - 10 mM 사이의 다양한 페놀 농도를 사용하여 페노실 과격 흡수가 (3 + 0.4)×106 Ms의−1−1 속도 상수로 관찰되었다. 이러한 반응은 두 가지 가능한 메커니즘을 통해 페노실산소를 생성할 수 있다.[3]
- 링에 추가 후 NH3, 또는
- 직접 전자전달에 의한 산화

아미노 라디칼은 약하게 반응하는 것으로 알려져 있는 반면, 히드라진을 형성하기 위한 두 아미노 라디칼의 재조합 과정은 가장 빠른 것 중 하나로 보인다. 결과적으로, 그것은 종종 다른 NH2 반응들과 경쟁한다.
- NH2 + NH2 → NH24
낮은 압력에서 이러한 반응은 가장 빠르고 따라서 NH2 실종의 주된 모드다.[6]
참고 항목
참조
- ^ Jump up to: a b "aminyl (CHEBI:29318)". Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. IUPAC Names.
- ^ die.net. "Amidogen". Archived from the original on February 21, 2013. Retrieved May 16, 2012.
- ^ Jump up to: a b c d e f Neta, P.; Maruthamuthu, P.; Carton, P. M.; Fessenden, R. W. (1978). "Formation and reactivity of the amino radical". The Journal of Physical Chemistry. 82 (17): 1875–1878. doi:10.1021/j100506a004. ISSN 0022-3654.
- ^ Jump up to: a b "Amino Radical". NIST Chemistry WebBook. National Institute of Science and Technology. 2017. Retrieved 15 June 2018.
- ^ Jump up to: a b Koenig, T.; Hoobler, J. A.; Klopfenstein, C. E.; Hedden, G.; Sunderman, F.; Russell, B. R. (1974). "Electronic configurations of amido radicals". Journal of the American Chemical Society. 96 (14): 4573–4577. doi:10.1021/ja00821a036. ISSN 0002-7863.
- ^ Khe, P. V.; Soulignac, J. C.; Lesclaux, R. (1977). "Pressure and temperature dependence of amino radical recombination rate constant". The Journal of Physical Chemistry. 81 (3): 210–214. doi:10.1021/j100518a006.
추가 읽기
- Davies, P (2008). "Detection of the amino radical NH2 by laser magnetic resonance spectroscopy". The Journal of Chemical Physics. 62 (9): 3739. doi:10.1063/1.430970.
- Buttner, T (2005). "A stable aminyl radical metal complex". Science. 307 (5707): 235–8. Bibcode:2005Sci...307..235B. doi:10.1126/science.1106070. PMID 15653498.
- John, Seely (1977). "Temperature and Pressure Dependence of the Rate Constant for the HO2 + NO Reaction". The Journal of Physical Chemistry. 81 (10): 210–214. doi:10.1021/jp952553f.
- Koenig, Hoobler (1974). "Electronic configurations of amino radicals". Journal of the American Chemical Society. 96 (14): 4573–4577. doi:10.1021/ja00821a036.