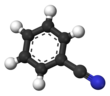
벤조니트릴
Benzonitrile| | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 벤조니트릴 | |||
| 시스템 IUPAC 이름 벤제네카보니트릴 | |||
| 기타 이름 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 3 DMet | |||
| 506893 | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.002.596 | ||
| EC 번호 |
| ||
| 2653 | |||
| 케그 | |||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 2224 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C6H5(CN) | |||
| 몰 질량 | 103.12 g/g | ||
| 밀도 | 1.0 g/ml | ||
| 녹는점 | -13 °C (9 °F, 260 K) | ||
| 비등점 | 188~191°C(370~376°F, 461~464K) | ||
| 0.5g/100ml 미만(22°C) | |||
자화율(δ) | - 65.19 · 10−6 cm3 / 세로 | ||
굴절률(nD) | 1.5280 | ||
| 위험 요소 | |||
| GHS 라벨링: | |||
 | |||
| 경고 | |||
| H302, H312 | |||
| P264, P270, P280, P301+P312, P302+P352, P312, P322, P330, P363, P501 | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | 75 °C (167 °F, 348 K) | ||
| 550 °C (1,022 °F, 823 K) | |||
| 폭발 한계 | 1.4–7.2% | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
벤조니트릴은 화학식이65 CH(CN), PhCN인 화합물이다.이 방향족 유기 화합물은 달콤하고 쓴 아몬드 냄새가 나는 무색의 액체입니다.주로 수지 벤조구아나민의 전구체로 사용된다.
생산.
400~450°C(752~842°F)[1]에서 암모니아 및 산소(또는 공기)와의 반응인 톨루엔의 암모니아 산화(ammoxidation)로 제조된다.
- CHCH653 + 3/22 O + NH3 → CH65(CN) + 3 HO2
실험실에서는 벤조아미드의 탈수 또는 구리 시안화물 또는 NaCN/DMO 및 브로모벤젠을 사용한 로젠문트-본 브라운 반응에 의해 제조될 수 있다.
적용들
실험실의 용도
벤조니트릴은 유용한 용매이며 많은 유도체들의 다용도 전구체이다.그것은 가수분해 후에 [2]N-치환 벤조아미드를 생성하기 위해 아민과 반응한다.브롬화페닐마그네슘과의 반응을 거쳐 메타노분해로 [3]디페닐케티민 PhC2=NH(b. 페이지 151°C, 8mm Hg)의 전구체이다.
벤조니트릴은 유기용매에 용해되고 쉽게 휘어지는 전이 금속과 배위 복합체를 형성합니다.예를2 들어 PdCl(PhCN)2이 있습니다.벤조니트릴 배위자는 보다 강한 배위자에 의해 쉽게 치환되어 벤조니트릴 복합체를 유용한 합성 [4]중간체로 만든다.
역사
벤조니트릴은 1844년 헤르만 펠링에 의해 보고되었다.그는 벤조산암모늄의 열탈수 결과물로 이 화합물을 발견했다.그는 이미 알려진 포름산 암모늄의 아날로그 반응으로 시안화수소(포름니트릴)를 생성해 그 구조를 추론했다.그는 또한 벤조니트릴이라는 이름을 만들어 모든 [5]질화합물의 이름을 만들었다.
2018년에는 [6]성간매질에서 벤조니트릴이 검출된 것으로 보고되었다.
레퍼런스
- ^ Maki, Takao; Takeda, Kazuo (June 2000). "Benzoic Acid and Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a03_555. ISBN 3527306730.
- ^ Cooper, F. C.; Partridge, M. W. (1963). "N-Phenylbenzamidine". Organic Syntheses.; Collective Volume, vol. 4, p. 769
- ^ Pickard, P. L.; Tolbert, T. L. (1973). "Diphenyl Ketimine". Organic Syntheses.; Collective Volume, vol. 5, p. 520
- ^ Anderson, Gordon K.; Lin, Minren (1990). "Bis(Benzonitrile)Dichloro Complexes of Palladium and Platinum". Reagents for Transition Metal Complex and Organometallic Syntheses. Inorganic Syntheses. Vol. 28. John Wiley & Sons. pp. 60–63. doi:10.1002/9780470132593.ch13. ISBN 978-0-470-13259-3.
- ^ Fehling, Hermann (1844). "Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme" (PDF). Annalen der Chemie und Pharmacie. 49 (1): 91–97. doi:10.1002/jlac.18440490106.
- ^ McGuire, Brett A.; et al. (January 2018). "Detection of the aromatic molecule benzonitrile (c\sC6H5CN) in the interstellar medium". Science. 359 (6372): 202–205. arXiv:1801.04228. Bibcode:2018Sci...359..202M. doi:10.1126/science.aao4890. PMID 29326270.