할로늄 이온
Halonium ion할로늄 이온은 양의 전하를 운반하는 할로겐 원자를 함유하고 있는 오늄 이온이다. 이 양이온에는 일반적인 구조 R-+X-RR가 있는데, 여기서 X는 할로겐이고 R에 대한 제한이 없으며,[1] 이 구조는 순환 또는 개방 체인 분자 구조일 수 있다. 불소, 염소, 브로민, 요오드 등으로 형성된 할로늄 이온을 각각 플루오늄, 클로로늄, 브로모늄, 요오드늄으로 부른다.[1] 전기영역 할로겐화의 매개체로 일반적으로 제안되는 주기적 다양성을 한츠슈-위드만 명명 체계를 사용하여 할리란륨 이온이라고 할 수 있다.
구조
가장 단순한 할로늄 이온은 H-X-H 구조(X = F, Cl, Br, I)이다. 많은 할로늄 이온은 에폭시드와 유사한 3원자 순환구조를 가지고 있는데, 이는 할로겐이 알켄에 첨가되었을 때와 같이 C=C 이중결합에 할로겐이온 X를+ 공식적으로 첨가한 데서 비롯된다.[1]
할로늄 이온을 브리징하는 성향이 I > Br > Cl > F의 순서로 되어 있다. 요오드와 브롬이온이 쉽게 결합한 요오드늄과 브로모늄 이온을 형성하는 반면, 플루오늄 이온은 최근에야 불소 단독쌍과 탄수화물 중심부의 근접 조우를 강제하는 설계 시스템에서 특징지어졌다. 실제로 구조적으로 대칭적으로 브리징된 할로늄, 탄소 중심 중 하나에 오랫동안 약한 결합을 가진 비대칭 할로늄, 할로늄 문자가 없는 진정한 β-할로카르바위션 사이에 연속성이 존재한다. 평형 구조는 양의 전하를 수용하는 탄소 원자와 할로겐의 능력에 따라 달라진다. 따라서 1차 탄소와 3차 탄소를 연결하는 브로모늄 이온은 종종 왜곡된 구조를 보이며, 3차 중심부에 약한 결합(중대한 탄수화물 특성을 갖는)과 1차 탄소에 강한 결합을 가진다. 양전하를 안정시키기 위해 3차 탄소의 안정성이 높아졌기 때문이다. 더 극단적인 경우, 예를 들어 제 3 센터가 이중 벤지릭이라면, 개방된 형태가 선호될 수 있다. 마찬가지로 브롬에서 염소로 전환하면 브롬에 비해 염소의 전기성이 높고 전자 밀도를 공유하는 성향이 낮아 브리지 성격도 약해진다.
반응도
이온들은 보통 단명 반응 매개체일 뿐이다; 그들은 3-엠베드 링의 높은 링 변형률과 할로겐의 양전하 때문에 매우 반응적이다; 이 양전하 는 그들을 훌륭한 전기영역으로 만든다. 거의 모든 경우에서 할로늄 이온은 아주 짧은 시간 내에 핵포자기의 공격을 받는다. 물과 같은 약한 핵분열체도 할로늄 이온을 공격할 것이다. 이것이 바로 후광 무수체를 만들 수 있는 방법이다.
때때로 할로늄 원자는 탄수화물로 재배열된다. 이것은 보통 탄수화물이 동맹이거나 벤질 탄수화물일 때만 발생한다.[2]
역사
할로늄 이온은 1937년 로버츠와 킴볼에[3] 의해 알케인에 대한 할로겐 첨가 반응에서 관찰된 항 이질제거율을 설명하기 위해 처음 가정되었다. 그들은 브롬화의 초기 반응 중간이 개방형 체인 X-C–C인+ 경우, C–C 단일 결합을 중심으로 회전하면 동일한 양의 디할로겐 동기 이소머와 반 이소머가 혼합될 수 있다고 올바르게 주장하였는데, 이는 그렇지 않다. 그들은 또한 양전하를 띤 할로겐 원자는 산소와 함께 등전자적이며 탄소 및 브롬은 유사한 이온화 잠재력을 가지고 있다고 주장했다. 특정 아릴 대체 알케네의 경우, 양이온 중간에서 할로늄 문자의 약화 또는 부재로 인해 항 입체성이 감소하거나 상실된다.
1970년 조지 A. 올라는 이산화황의 안티몬 펜타플루오린드와 테트라플루오메탄 복합체에 -78°C에서 이산화황의 메틸브로미드나 염화메틸 등 메틸 할리드를 첨가해 할로겐염의[4] 제조와 분리에 성공했다. 이 과정은 아황산가스를 증발시킨 후 [HC3–+–CH3][SbF6]–의 결정을 상온에서는 안정적이지만 습기는 유지하지 못하게 했다. 플루오늄 이온은 최근 저온에서 용액 단계(이산화황이나 염화불화불화황으로 분해)에서 특징지어졌다.[5]
순환 및 아세클릭 클로로늄, 브로모늄, [6]요오드늄 이온은 아래에 나타낸 바이오(다만틸리딘)에서 유래한 브로모늄 양이온과 같이 X선 결정학에 의해 구조적으로 특징지어졌다.[7]
 | 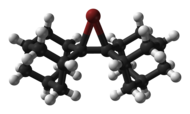 |
3가 또는 4가 할로늄 이온을 함유한 화합물은 존재하지 않지만 일부 가상의 화합물에 대해서는 안정성이 계산적으로 시험되었다.[8]
참조
- ^ Jump up to: a b c IUPAC, 화학용어 종합편찬, 제2편. ("금책")(1997년). 온라인 수정 버전: (2006–) "할로늄 이온". doi:10.1351/골드북.H02728
- ^ Bruice, Paula Yurkanis (2014). Organic Chemistry (7th ed.). Pearson Education. ISBN 978-0-321-80322-1.
- ^ Roberts, Irving; Kimball, George E. (1937). "The Halogenation of Ethylenes". J. Am. Chem. Soc. 59 (5): 947. doi:10.1021/ja01284a507.
- ^ Olah, George A.; DeMember, John R. (1970). "Friedel-Crafts chemistry. V. Isolation, carbon-13 nuclear magnetic resonance, and laser Raman spectroscopic study of dimethylhalonium fluoroantimonates". J. Am. Chem. Soc. 92 (3): 718. doi:10.1021/ja00706a058.
- ^ Pitts, Cody Ross; Holl, Maxwell Gargiulo; Lectka, Thomas (2018). "Spectroscopic Characterization of a [C–F–C]+ fluoronium ion in solution". Angew. Chem. 130 (7). doi:10.1002/ange.201712021.
- ^ Mori, T.; Rathore, R. (1998). "X-Ray structure of bridged 2,2′-bi(adamant-2-ylidene) chloronium cation and comparison of its reactivity with a singly bonded chloroarenium cation". ChemComm (8): 927–928. doi:10.1039/a709063c.
- ^ Brown, R. S.; Nagorski, R. W.; Bennet, A. J.; McClung, R. E. D.; Aarts, G. H. M.; Klobukowski, M.; McDonald, R.; Santarsiero, B. D. (March 1994). "Stable Bromonium and Iodonium Ions of the Hindered Olefins Adamantylideneadamantane and Bicyclo[3.3.1]nonylidenebicyclo[3.3.1]nonane. X-Ray Structure, Transfer of Positive Halogens to Acceptor Olefins, and ab Initio Studies". J. Am. Chem. Soc. 116 (6): 2448–2456. doi:10.1021/ja00085a027.
- ^ Schneider, Tobias F.; Werz, Daniel B. (2010). "The Quest for Tetracoordinated Halonium Ions: A Theoretical Investigation". Org. Lett. 12 (21): 4844–4847. doi:10.1021/ol102059b. PMID 20923174.
| 위키미디어 커먼스는 할로늄 이온과 관련된 미디어를 가지고 있다. |




