방향성
Aromaticity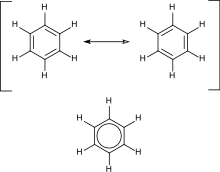
화학에서 방향족성(aromaticity)은 분자가 비국재화된 전자를 포함하는 공명에서 파이 결합을 갖는 고리형(고리형) 구조를 갖는 것을 의미합니다.[1]방향족 고리는 단일 결합을 갖는 포화 화합물과 동일한 원자 집합을 갖는 다른 기하학적 또는 연결적 비순환적 배열에 비해 안정성을 향상시킵니다.방향족 고리는 매우 안정적이고 쉽게 분해되지 않습니다.방향족이 아닌 유기 화합물은 지방족 화합물로 분류되는데, 이들은 고리형일 수 있지만, 방향족 고리만이 안정성을 강화합니다.이 뜻을 가진 방향성이라는 용어는 역사적으로 향을 가진다는 개념과 관련이 있지만, 그 뜻과는 다른 특성입니다.[2]
가장 일반적인 방향족 화합물은 벤젠의 유도체(석유 및 그 증류물에 일반적인 방향족 탄화수소)이기 때문에, 방향족이라는 단어는 비공식적으로 벤젠 유도체를 지칭하는 경우가 있어 처음 정의되었습니다.그럼에도 불구하고, 많은 비벤젠 방향족 화합물들이 존재합니다.예를 들어, 생물체에서 가장 흔한 방향족 고리는 RNA와 DNA에 있는 이중 고리 염기입니다.방향족 작용기 또는 다른 치환기를 아릴기라고 합니다.
분자의 전자적 특성의 측면에서, 방향족성은 종종 루이스 다이어그램에 나타나는 결합된 시스템을 고리에서 단일 결합과 이중 결합으로 설명합니다.실제로 루이스 다이어그램에서 이중 결합으로 표시된 전자는 실제로 고리 주변에 고르게 분포되어("비국재화") 분자의 안정성을 증가시킵니다.루이스 다이어그램을 그리는 방식에 의해 부과된 제약으로 인해 분자는 하나의 다이어그램으로 표현될 수 없으며 벤젠의 두 공명 구조와 같은 여러 다른 다이어그램의 혼합물(공진이라고 함)입니다.이 분자들은 한 위치에 더 긴 단일 결합과 다른 위치에 더 짧은 이중 결합을 갖는 이러한 표현 중 어느 하나에서도 찾을 수 없습니다(아래 § 이론 참조).오히려 분자는 전형적인 단일 결합과 이중 결합 사이의 모든 동일한 결합 길이를 나타냅니다.벤젠이 단일결합과 이중결합(사이클로헥사트리엔)을 번갈아 갖는 6원 탄소 고리로 형성되었다는 아이디어는 오귀스트 케쿨레(August Kekulé)에 의해 개발되었습니다(아래 § 역사 참조).벤젠 모형은 두 개의 공명 형태로 구성되어 있으며, 이중 결합과 단일 결합이 중첩되어 6개의 1.5개의 결합이 생성됩니다.벤젠은 전하 비국재화를 고려하지 않고 예상되는 것보다 더 안정적인 분자입니다.
이론과 구조
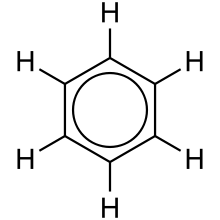
벤젠의 C-C 길이는 1.40Å으로 단일 결합과 이중 결합의 평균임을 나타냅니다.[3][2]하나의 대표적인 것이 원형의 π-결합(암스트롱의 내부 주기)인데, 전자 밀도는 고리 위와 아래의 π-결합을 통해 고르게 분포되어 있습니다.
원자가 결합 이론의 언어에서 단일 결합은 탄소 핵 사이에 일렬로 있는 혼성 원자 sp 궤도의 중첩으로 형성됩니다. 이를 σ 결합이라고 합니다.이중 결합은 σ 결합과 π 결합으로 구성됩니다.π 결합은 고리의 평면 위와 아래의 원자 p 궤도의 중첩으로 형성됩니다.다음 다이어그램은 이러한 p-궤도의 위치를 보여줍니다.
그들이 원자의 평면을 벗어나 있기 때문에, 이 궤도들은 전자가 비국재화할 수 있도록 서로 상호작용할 수 있습니다.
역사
"방향성"이라는 용어
화학 용어로서 "방향족"이라는 단어가 처음 사용된 것으로 알려진 것은 1855년 아우구스트 빌헬름 호프만의 논문에서 발견되었습니다.[4][5]호프만(Hofmann)은 벤젠 화합물의 한 종류에 이 용어를 사용했는데, 벤젠 화합물의 대부분은 순수한 포화 탄화수소와는 달리 냄새(아로마)를 가지고 있습니다.화학적 성질로서 방향성은 그러한 화합물들의 후각적 성질 (냄새가 나는 방법)과 일반적인 관계가 없지만, 1855년에 벤젠이나 유기 화합물의 구조가 이해되기 전에 호프만과 같은 화학자들은 테르펜과 같은 식물들로부터 침엽수 분자들을 이해하기 시작했습니다.오늘날 우리가 인식하는 화학적 특성은 벤젠과 같은 불포화 석유 탄화수소와 비슷합니다.이것이 정말로 그 용어의 가장 초기 도입이었다면, 호프만은 왜 그가 주목할 만한 향기를 가지고 있는 화학 물질 그룹에 적용하기 위해 후각적 성격을 나타내는 형용사를 도입했는지에 대해 아무 말도 하지 않는 것이 궁금합니다.또한, 알려진 가장 냄새나는 유기 물질 중 일부는 화학적인 의미에서 방향성이 없는 테르펜입니다.테르펜과 벤제노이드 물질은 공통적으로 화학적 특성을 가지고 있는데, 즉 많은 지방족 화합물보다 더 높은 불포화도를 가지고 있으며, 호프만은 두 분류를 구별하지 못했을 수도 있습니다.벤젠과 톨루엔과 같은 초기에 알려진 방향족 화합물의 많은 예들은 독특한 기분 좋은 냄새를 가지고 있습니다.이 성질은 이 종류의 화합물에 대한 "방향성"이라는 용어로 이어졌고, 따라서 결국 발견된 전자적 성질에 대한 "방향성"이라는 용어로 이어졌습니다.[6][7]
벤젠 고리의 구조는


19세기에, 화학자들은 벤젠이 추정되는 높은 포화도를 감안할 때, 추가 반응에 대해 그렇게 반응하지 않을 수 있다는 것을 혼란스럽게 생각했습니다.벤젠에 대한 사이클로헥사트리엔 구조는 1865년 아우구스트 케쿨레에 의해 처음으로 제안되었습니다.[9][10]대부분의 화학자들은 이 구조를 재빨리 받아들였는데, 방향족 화학의 알려진 이성질체 관계의 대부분을 차지했기 때문입니다.육각형 구조는 벤젠의 이성질체가 하나만 존재하는 이유와 치환된 화합물이 왜 3개의 이성질체를 가지고 있는지 설명합니다.[5]
1897년에서 1906년 사이에 전자의 발견자인 J. J. 톰슨은 벤젠의 각 탄소 원자 쌍 사이에 3개의 등가 전자를 제안했습니다.벤젠의 예외적인 안정성에 대한 설명은 일반적으로 로버트 로빈슨 경에 기인합니다. 그는 1925년에 [11]붕괴에 저항하는 6개의 전자 그룹으로서 방향족 6종이라는 용어를 처음으로 만든 것으로 보입니다.
사실, 이 개념은 1922년 어니스트 크로커(Ernest Crocker)를 통해 헨리 에드워드 암스트롱(Henry Edward Armstrong)에게 더 거슬러 올라갈 수 있는데,[12] 그는 1890년에 "6개의 중심 친화성은 주기 내에서 작용한다 … 벤젠은 이중 고리로 표현될 수 있다 … 그리고 첨가제 화합물이 형성될 때 친화성의 내부 주기는 붕괴를 겪는다,"필요에 따라 아무것도 부착되지 않은 연속적인 탄소 atoms가 에틸렌성 조건을 획득합니다."
여기서 암스트롱은 적어도 네 가지 현대적 개념을 설명하고 있습니다.[verification needed]첫째, 그의 "친밀성"은 오늘날 전자로 더 잘 알려져 있으며, 불과 7년 후에 J. J. 톰슨에 의해 발견될 예정이었습니다.둘째, 그는 친전자성 방향족 치환을 기술하고 있으며, (세 번째) 고리의 컨쥬게이션(conjugation)이 깨지는 윌랜드 중간체(wheeland miderate)를 통해 진행하고 있습니다.그는 고리를 중심으로 하는 기호 C를 내적 순환의 축약어로 소개하여 에리히 클라의 표기법을 예상했습니다.그의 친화력이 단순히 점입자가 아닌 방향성을 가지고 있다는 것을 인식했기 때문에 파동역학의 성질도 예측했다는 주장이[by whom?] 있고,그리고 벤젠 고리에 치환기를 도입함으로써 변화될 수 있는 분포(much를 들어, 한 물체의 전하 분포가 다른 물체에 가깝게 함으로써 변화됨)를 총체적으로 가지고 있습니다.
이러한 안정성, 즉 방향성의 양자역학적 기원은 1931년 Hückel에 의해 처음으로 모델링되었습니다.그는 결합 전자를 시그마 전자와 파이 전자로 분리한 최초의 사람이었습니다.
임의 방향족 화합물의 방향성은 핵 비의존 화학 이동(NIC) 계산법과[14] 방향성 백분율법에[15] 의해 정량적으로 측정될 수 있습니다.
방향족계의 특성
방향족 고리는 다음과 같은 특정 특성을 가진 공유결합된 원자들의 집합을 포함합니다.
- 비국재화된 공액 π 시스템, 가장 일반적으로 단일 결합과 이중 결합이 교대로 배열된 것
- 공면 구조, 모든 기여 원자가 같은 평면에 있는
- 하나 이상의 고리에 배열된 기여 원자
- 다수의 π들이 4의 배수는 아니지만 짝수인 전자를 비국재화했습니다.즉, 4n + 2 π- electrons, 여기서 n = 0, 1, 2, 3 등입니다.이것은 휘켈의 법칙으로 알려져 있습니다.
휘켈의 법칙에 의하면, 분자가 4n+2개의 π 전자를 가지면 방향족이지만, 4n개의 π 전자를 가지면 그 분자는 항방향족이라고 합니다.벤젠이 방향족인 반면(6개의 전자, 3개의 이중 결합에서), 시클로부타디엔은 반방향성인데, 이는 π 비국재화 전자의 수가 당연히 4의 배수이기 때문입니다.그러나 사이클로부타디엔화(2-) 이온은 방향족(6 전자)입니다.방향족 계의 원자는 계의 일부가 아닌 다른 전자를 가질 수 있으므로 4n + 2 규칙에서 무시됩니다.퓨란에서, 산소 원자는 sp2 혼성화되어 있습니다.한 쌍은 π계에 있고 다른 한 쌍은 고리의 평면에 있습니다(다른 위치의 C-H 결합과 유사함).6개의 π 전자가 있어서 퓨란은 방향족입니다.
방향족 분자는 일반적으로 유사한 비방향족 분자에 비해 향상된 화학적 안정성을 나타냅니다.방향성을 가질 수 있는 분자는 방향성을 향해 변화하는 경향이 있을 것이고, 추가된 안정성은 분자의 화학을 변화시킵니다.방향족 화합물은 친유성 방향족 치환 및 친유성 방향족 치환 반응을 거치지만, 탄소-탄소 이중 결합과 같은 친유성 부가 반응은 겪지 않습니다.
자기장이 존재하는 경우, 방향족 분자의 순환하는 π 전자는 추가적인 자기장을 유도하는 방향족 고리 전류를 생성하는데, 이는 핵자기 공명에서 중요한 효과입니다.방향족 고리 평면에서 양성자의 NMR 신호는 비방향족 sp2 탄소보다 훨씬 더 아래쪽으로 이동합니다.이것은 방향성을 감지하는 중요한 방법입니다.동일한 메커니즘에 의해, 링 축 근처에 위치한 양성자의 신호는 위쪽 필드로 이동됩니다.
방향족 분자는 π-π 적층이라고 불리는 일종의 π 상호작용에 의해 서로 상호작용할 수 있습니다.π 시스템은 "대면" 방향으로 중첩된 두 개의 평행 링을 형성합니다.방향족 분자는 또한 "가장자리 대 면" 방향으로 상호작용할 수 있습니다.한 분자의 고리 원자에 있는 치환기의 약간의 양전하는 다른 분자의 방향족계의 약간의 음전하에 끌립니다.
4n개의 π-전자를 포함하는 평면형 단환 분자는 반방향족이라고 불리며, 일반적으로 불안정합니다.반방향족일 수 있는 분자들은 이 전자적 또는 형태로부터 변화하는 경향이 있고, 따라서 비방향족이 됩니다.예를 들어, 사이클로옥타테트라엔(COT)은 평면성을 벗어나 왜곡되어 인접한 이중 결합 사이의 π 중첩을 파괴합니다.최근의 연구에 따르면, 사이클로부타디엔은 단일 결합과 이중 결합이 공진 없이 실제로 교대하는 비대칭적인 직사각형 구성을 채택하고 있으며, 단일 결합은 이중 결합보다 현저하게 길며, 불리한 p-안와 중첩을 감소시키고 있습니다.이러한 대칭의 감소는 이전에 결합하지 않은 두 분자 오비탈의 퇴화를 들어올리는데, 훈드의 법칙에 의해 두 쌍의 짝을 이루지 않은 전자는 약한 결합 오비탈로 강제됩니다(또한 약한 결합 오비탈은 약한 결합 오비탈을 만듭니다.따라서 사이클로부타디엔은 비방향성입니다. 비대칭 구성의 변형률은 대칭 사각 구성에 영향을 미칠 수 있는 반방향성 불안정을 능가합니다.
휘켈의 방향성 규칙은 분자를 단일항 바닥 상태(S0)로 처리합니다.여기에 설명된 화합물의 안정성 경향은 베어드의 규칙에 따라 가장 낮은 누운 삼중항 및 단일항 여기 상태1(T1 및 S)에서 반대로 나타남을 알 수 있습니다.이것은 바닥 상태에서 4n + 2개의 π 전자와 방향족 특성을 가진 벤젠과 같은 화합물이 반방향족이 되고 들뜬 상태에서 대칭 구조를 덜 채택하는 경우가 많다는 것을 의미합니다.
컴파운드
중성동호환
벤젠뿐만 아니라 식 CH(n은 자연수)를 갖는 대부분의 다른 아눌렌, 예컨대 사이클로테트라데카헵타엔(n=3).많은 화학적 화합물들은 다른 작용기들이 붙어있는 방향족 고리입니다.예를 들면 트리니트로톨루엔(TNT), 아세틸살리실산(아스피린), 파라세타몰, DNA의 뉴클레오티드 등이 있습니다.
복소환
헤테로환 방향족(heteroaromatics)에서 고리에 있는 원자 중 하나 이상은 탄소가 아닌 다른 원소입니다.benzanulated 아날로그가 포함되어 있어서 범위가 큽니다.
유명한 "방향족 헤테로사이클"에는 피리딘, 피라진, 피롤, 이미다졸, 피라졸, 옥사졸, 티오펜 등이 있습니다.이 모든 예에서 π-전자의 수는 6이며, 이중 결합에서 나오는 π-전자와 헤테로 원자에서 나오는 전자 때문입니다.이 화합물들은 평면적이고 6-pi 전자를 가지고 있지만, 벤젠보다 덜 방향족적이고, 종종 상당히 적습니다.[18]
- 피리딘의 전자 카운팅은 다음과 같습니다. 5개의 sp-하이브리드 탄소는 각각 1개의 π-전자를 pi-시스템에 기여합니다.또한 sp-hybridized2 된 질소 원자는 p-orbital에 한 개의 전자를 기여하여 총 6개의 p-전자를 생성합니다.피리딘은 이런 계산에 의해 방향족입니다.질소에 있는 외쌍은 방향족 π 시스템의 일부가 아닙니다.
- 피롤에서의 전자 카운팅은 다음과 같습니다. 4개의 sp-하이브리드 탄소는 각각 하나의 π-전자에 기여합니다.또한 sp-hybridized 된 질소 원자는 외쌍으로부터 두 개의 π-전자를 기여합니다.
- 이미다졸에서의 전자 카운팅은 피리딘과 피롤에 대해 보이는 패턴을 따릅니다. 하나의 N 중심은 하나의 쌍을 기여하고 두 개의 좌표 N 중심은 하나의 전자를 기여합니다.[19]
융합방향족 및 다환류
다환 방향족 탄화수소는 두 개 이상의 단순한 방향족 고리를 포함하는 분자로, 이웃하는 두 개의 탄소 원자를 공유함으로써 서로 융합됩니다.예를 들면 나프탈렌, 안트라센, 페난트렌 등이 있습니다.융합 방향족에서 모든 탄소-탄소 결합이 반드시 동등한 것은 아니며, 전자가 분자 전체에 걸쳐 비국재화되지 않기 때문입니다.이 분자들의 방향성은 그들의 궤도 사진을 이용하여 설명될 수 있습니다.벤젠 및 다른 단환 방향족 분자와 마찬가지로, 다환은 고리의 평면 위 및 아래에 p-궤도 겹침을 갖는 순환 공액 파이 시스템을 갖습니다.[19]
방향족 이온
이 섹션은 확장이 필요합니다.추가하면 도움이 됩니다. (2015년 4월) |
방향족 분자는 중성 분자일 필요는 없습니다.평면, 순환, 공액 분자에서 허클의 4n + 2 π 전자 법칙을 만족하는 이온은 방향족 이온으로 간주됩니다.예를 들어, 사이클로펜타디에닐 음이온과 사이클로헵타트리에닐 양이온은 둘 다 방향족 이온으로 간주되고, 아줄렌 분자는 둘 다의 조합으로 근사화될 수 있습니다.
원자를 sp에서3 sp로2 전환하기 위해서는 탄소 위치, 탄소 음이온 또는 탄소 라디칼이 형성되어야 합니다.이것들은 방향족 분자의 π 시스템에 참여할 수 있는 sp-hybridized carbons를 남깁니다.중성방향족 화합물처럼, 이 화합물들은 안정적이고 쉽게 형성됩니다.사이클로펜타디엔닐 음이온은 매우 쉽게 형성되며 따라서 1,3-사이클로펜타디엔은 pK가a 16인 매우 산성 탄화수소입니다.[19]방향족 이온의 다른 예로는 사이클로프로페늄 양이온(2 π-전자)과 사이클로옥타테트라에닐디아니온(10 π 전자)이 있습니다.
전형적인 방향족 화합물
방향성은 탄소가 아닌 화학 원소로만 구성된 고리에서도 발생합니다.벤젠과 유사한 무기 6원 고리 화합물이 합성되었습니다.예를 들어, 보라진은 고리의 각 원자에 하나의 수소 원자가 붙어 있는 붕소와 질소 원자로 구성된 6개의 고리입니다.비국재화된 π 시스템을 가지고 있으며, 비방향족 분자가 기대하는 반응보다는 방향성 고리에 적합한 친전자성 치환 반응을 거칩니다.
꽤 최근에, Zintl 상 LiSi에서127 발생하는 평면 Si6−
5 고리의 방향성은 Li 고체 상태 NMR에 의해 실험적으로 증명되었습니다.[21][non-primary source needed] 금속 방향성은 알루미늄과 갈륨의 특정 클러스터, 특히 Ga와32- Al에42- 존재하는 것으로 여겨집니다.[22]
호모방향성(homoaromaticity)은 단일 sp3 혼성화된 탄소 원자에 의해 접합이 중단되는 시스템의 상태입니다.[23]
Y 방향성은 공명 결합을 가진 Y 모양의 평면형(평평한) 분자를 설명하는 데 사용됩니다.이 개념은 구아니디늄 양이온의 특별한 안정성과 높은 염기성을 설명하기 위해 개발되었습니다.구아니디늄은 고리 분자가 아니며, 연속적으로 붙은 원자들의 π계가 아니라 교차 결합되어 있지만, 6개의 π 전자가 분자 전체에 걸쳐 비국재화되어 있다고 보고되어 있습니다.이 개념은 논란의 여지가 있고 일부 저자들은 다른 효과를 강조합니다.[24][25][26]이는 트리메틸엔산화가 부타디엔산화보다 더 안정적이라는 이유로도 제시되고 있습니다.[27]
σ-aromatic성은 시그마 결합의 비국재화로 인해 발생하는 안정화를 말합니다.클러스터 화학에서 자주 언급되며 웨이드의 법칙과 밀접한 관련이 있습니다.또한 2021년에는 σ-방향성 Th 복합체가 보고되었으며, 이는 σ-방향성의 개념이 원칙 양자 번호 6인 궤도와 여전히 관련이 있음을 나타냅니다.
기타대칭
| 유형 | 순환대칭 | 전자규칙 | 발생 |
|---|---|---|---|
| 휘켈 방향성 | 원통형 | 4n + 2 | 방향족환 |
| 뫼비우스 방향족성 | 뫼비우스 | 4n | 트랜스 방향족 고리 |
| 구형방향성 | 구면 | 2(n+1)2 | 풀러렌 |
뫼비우스 방향성은 p개의π 원자 궤도로 형성되고 4n(n은 정수)개의 전자에 의해 닫힌 껍질에 채워진 분자 궤도의 순환계가 뫼비우스 띠를 형성하기 위해 단일 반트위스트가 주어질 때 발생합니다.평평한(뒤집지 않은) 고리에 4n개의 전자를 가진 π계는 반방향족일 것이고, 따라서 원자 궤도의 조합의 대칭으로 인해 매우 불안정할 것입니다.고리를 비틀면 계의 대칭성이 변화하고 허용됩니다(뫼비우스도 참조).자세한 내용은 휴켈(Hückel) 개념입니다.트위스트는 왼손잡이일 수도 있고 오른손잡이일 수도 있기 때문에 결과적으로 뫼비우스 방향족은 비대칭이거나 카이랄합니다.그러나 2012년 현재 뫼비우스 방향족 분자는 합성되지 않았습니다.[29][30]패러다임 위상에 해당하는 두 개의 반이 꼬인 방향족은 요한 리스팅에 의해 처음으로 제안되었습니다.[31]카르보벤젠의 한 형태에서, 고리는 팽창되고 알킨 및 알렌기를 포함합니다.
구형 방향성은 풀러렌에서 발생하는 방향성입니다.2000년에, 독일 에를랑겐의 안드레아스 허쉬와 동료들은 플러렌이 언제 향이 나는지를 결정하는 규칙을 만들었습니다.그들은 π 전자가 2개(n + 1개)개일 경우 플러렌이 방향족 특성을 나타낸다는 것을 발견했습니다.이는 방향족 플러렌이 완전한 정이면체(또는 다른 적절한) 대칭을 가져야 하기 때문에 분자 궤도가 완전히 채워져야 한다는 사실에서 비롯됩니다.이것은 정확히 2(n + 1)2개의 전자가 있는 경우에만 가능하며, 여기서 n은 음이 아닌 정수입니다.
참고 항목
참고문헌
- ^ Zhdankin, Viktor; Grunt, Peter (2015). Organic Chemistry (1st ed.). Cognella. pp. 275–305. ISBN 978-1-63487-899-9.
- ^ a b Reusch, William (5 May 2013). "Aromaticity". Virtual Textbook of Organic Chemistry. www2.chemistry.msu.edu.
- ^ "Bonding in benzene – the Kekulé structure". www.chemguide.co.uk. Retrieved 25 December 2015.
- ^ Hofmann, A. W. (1855). "On Insolinic Acid". Proceedings of the Royal Society. 8: 1–3. doi:10.1098/rspl.1856.0002.
- ^ a b Rocke, A. J. (2015). "It Began with a Daydream: The 150th Anniversary of the Kekulé Benzene Structure". Angew. Chem. Int. Ed. 54 (1): 46–50. doi:10.1002/anie.201408034. PMID 25257125.
- ^ Gourkrishna, Dasmohapatra. Chemistry-I (As per AICTE). Vikas Publishing House. p. 71. ISBN 9789353381547.
- ^ McMurry, John; McMurry, Susan (2007). Study Guide with Solutions Manual for McMurry's Organic Chemistry, 7th Edition. Cengage Learning/Brooks-Cole. pp. 515. ISBN 9780495112686. OCLC 1044583885.
- ^ Kekulé, F. A. (1872). "Ueber einige Condensationsproducte des Aldehyds". Liebigs Ann. Chem. 162 (1): 77–124. doi:10.1002/jlac.18721620110.
- ^ Kekulé, F. A. (1865). "Sur la constitution des substances aromatiques". Bulletin de la Société Chimique de Paris. 3: 98–110.
- ^ Kekulé, F. A. (1866). "Untersuchungen über aromatische Verbindungen Ueber die Constitution der aromatischen Verbindungen. I. Ueber die Constitution der aromatischen Verbindungen". Liebigs Ann. Chem. 137 (2): 129–196. doi:10.1002/jlac.18661370202.
- ^ Armit, James Wilson; Robinson, Robert (1925). "CCXI. Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases". J. Chem. Soc. Trans. 127: 1604–1618. doi:10.1039/CT9252701604.
- ^ Crocker, Ernest C. (1922). "Application Of The Octet Theory To Single-Ring Aromatic Compounds". J. Am. Chem. Soc. 44 (8): 1618–1630. doi:10.1021/ja01429a002.
- ^ Armstrong, Henry Edward (1890). "The structure of cycloid hydrocarbon". Proceedings of the Chemical Society. 6 (85): 101–105. doi:10.1039/PL8900600095. 102쪽 참조.
- ^ Schleyer, Paul von Ragué; Maerker, Christoph; Dransfeld, Alk; Jiao, Haijun; Van Eikema Hommes, Nicolaas J. R. (1996). "Nucleus-Independent Chemical Shifts: A Simple and Efficient Aromaticity Probe". J. Am. Chem. Soc. 118 (26): 6317–6318. doi:10.1021/ja960582d. PMID 28872872.
- ^ Mucsi, Z.; Viskolcz, B.; Csizmadia, I. G. (2007). "A Quantitative Scale for the Degree of Aromaticity and Antiaromaticity". J. Phys. Chem. A. 111 (6): 1123–1132. Bibcode:2007JPCA..111.1123M. doi:10.1021/jp0657686. PMID 17286363.
- ^ Merino, Gabriel; Heine, Thomas; Seifert, Gotthard (2004). "The Induced Magnetic Field in Cyclic Molecules". Chemistry: A European Journal. 10 (17): 4367–71. doi:10.1002/chem.200400457. PMID 15352120.
- ^ Rosenberg, Martin; Dahlstrand, Christian; Kilså, Kristine; Ottosson, Henrik (28 May 2014). "Excited State Aromaticity and Antiaromaticity: Opportunities for Photophysical and Photochemical Rationalizations". Chemical Reviews. 114 (10): 5379–5425. doi:10.1021/cr300471v. ISSN 0009-2665. PMID 24712859.
- ^ Horner, Kate E.; Karadakov, Peter B. (2015). "Shielding in and around Oxazole, Imidazole, and Thiazole: How Does the Second Heteroatom Affect Aromaticity and Bonding?". The Journal of Organic Chemistry. 80 (14): 7150–7157. doi:10.1021/acs.joc.5b01010. PMID 26083580.
- ^ a b c McMurry, John (2011). Organic Chemistry (8th ed.). Brooks-Cole. pp. 544. ISBN 978-0-8400-5444-9.
- ^ Islas, Rafael; Chamorro, Eduardo; Robles, Juvencio; Heine, Thomas; Santos, Juan C.; Merino, Gabriel (2007). "Borazine: to be or not to be aromatic". Structural Chemistry. 18 (6): 833–839. doi:10.1007/s11224-007-9229-z. S2CID 95098134.
- ^ Kuhn, Alexander; Sreeraj, Puravankara; Pöttgen, Rainer; Wiemhöfer, Hans-Dieter; Wilkening, Martin; Heitjans, Paul (2011). "Li NMR Spectroscopy on Crystalline Li12Si7: Experimental Evidence for the Aromaticity of the Planar Cyclopentadienyl-Analogous Si6−
5 Rings". Angew. Chem. Int. Ed. 50 (50): 12099–102. doi:10.1002/anie.201105081. PMID 22025292. - ^ Krämer, Katrina. "The search for the grand unification of aromaticity". Chemistry World.
- ^ IUPAC, 화학 용어 해설서, 제2판("골드북") (1997).온라인 수정판: (2006~) "Homoaromatic", Doi:10.1351/goldbook.H02839
- ^ Gobbi, Alberto; Frenking, Gernot (1993). "Y-Conjugated compounds: the equilibrium geometries and electronic structures of guanidine, guanidinium cation, urea, and 1,1-diaminoethylene". J. Am. Chem. Soc. 115 (6): 2362–2372. doi:10.1021/ja00059a035.
- ^ Wiberg, Kenneth B. (1990). "Resonance interactions in acyclic systems. 2. Y-Conjugated anions and cations". J. Am. Chem. Soc. 112 (11): 4177–4182. doi:10.1021/ja00167a011.
- ^ Caminiti, R.; Pieretti, A.; Bencivenni, L.; Ramondo, F.; Sanna, N. (1996). "Amidine N−C(N)−N Skeleton: Its Structure in Isolated and Hydrogen-Bonded Guanidines from ab Initio Calculations". J. Phys. Chem. 100 (26): 10928–10935. doi:10.1021/jp960311p.
- ^ Dworkin, Amy; Naumann, Rachel; Seigfredi, Christopher; Karty, Joel M.; Mo, Yirong (2005). "Y-aromaticity: Why is the trimethylenemethane dication more stable than the butadienyl dication?". J. Org. Chem. 70 (19): 7605–7616. doi:10.1021/jo0508090. PMID 16149789.
- ^ Boronski, Josef T.; Seed, John A.; Hunger, David; Woodward, Adam W.; van Slagren, Joris; Wooles, Ashley J.; Natrajan, Louise S.; Kaltsoyannis, Nikolas; Liddle, Stephen T. (2021). "A Crystalline Tri-thorium Cluster with σ-Aromatic Metal-Metal Bonding". Nature. 598 (7879): 72–75. Bibcode:2021Natur.598...72B. doi:10.1038/s41586-021-03888-3. PMID 34425584. S2CID 237281580.
- ^ Ajami, D.; Oeckler, O.; Simon, A.; Herges, R. (2003). "Synthesis of a Möbius aromatic hydrocarbon". Nature. 426 (6968): 819–21. Bibcode:2003Natur.426..819A. doi:10.1038/nature02224. PMID 14685233. S2CID 4383956.
- ^ Castro, Claire; Chen, Zhongfang; Wannere, Chaitanya S.; Jiao, Haijun; Karney, William L.; Mauksch, Michael; Puchta, Ralph; Van Eikema Hommes, Nico J. R.; Schleyer, Paul von R. (2005). "Investigation of a Putative Möbius Aromatic Hydrocarbon. The Effect of Benzannulation on Möbius [4n]Annulene Aromaticity". J. Am. Chem. Soc. 127 (8): 2425–2432. doi:10.1021/ja0458165. PMID 15724997.
- ^ Rzepa, Henry S. (2005). "A Double-Twist Möbius-Aromatic Conformation of [14]Annulene". Organic Letters. 7 (21): 4637–9. doi:10.1021/ol0518333. PMID 16209498.
외부 링크
 Wikimedia Commons의 아로마틱스
Wikimedia Commons의 아로마틱스






