케틴
Ketene케틴은 R′R″C=C=O 형태의 유기 화합물로, 여기서 R과 R'은 두 개의 임의의 모노밸런스 화학 그룹(또는 동일한 분자의 두 개의 별도 대체 사이트)이다.[1] 그 이름은 또한 가장 단순한 케틴인 특정 화합물인 etenone H2C
=C=O를 지칭할 수도 있다.[2]
그것들은 매우 유용하지만, 대부분의 케틴은 불안정하다. 화학적 시술에서 시약으로 사용할 경우 일반적으로 필요할 때 생성되며, 생산되는 즉시(또는 그 동안) 소비된다.[1]
역사
케테네스는 1905년 이전에 헤르만 스타우딩거에 의해 한 학급으로 처음 연구되었다.[3]
케테네는 1905년 헤르만 스토우딩거에 의해 다이페닐케텐( \alpha -클로로디페닐 아세틸 염화물 아연)의 형태로 조직적으로 조사되었다. 스타우딩거는 1900년(트리페닐메틸 그룹과 비교한) 모세 곰베르크가 발견한 반응성 유기 매개체와 안정된 활성산소의 첫 사례에서 영감을 얻었다.[4]
특성.
케틴은 sp문자 때문에 이질 원자와 결합한 탄소 원자에 전기영양성이 높다. 케틴은 각각 케틴, 티오케틴, 셀레노케틴으로 명명된 O, S 또는 S와 같이 sp 탄소 원자에 결합된 서로 다른 이질 원자로 형성될 수 있다.
가장 단순한 케틴인 에덴은 이중 결합 각각에 대한 실험 길이가 다르다. C=O 결합은 1,160å, C=C 결합은 1,314å이다. 두 H 원자 사이의 각도는 121.5°이며, 이론적으로 이상적인 각도는 sp2 탄소 원자와 H 대체물 사이의 유사하다. [5]
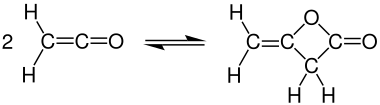
케틴은 불안정하여 저장할 수 없다. 반응할 핵물질이 없을 때, 에덴은 디메라이스하여 주기적인 에스테르인 β-락톤을 부여한다. 케틴이 분해되면 디머라이제이션 제품은 대체 시클로부타디온이다. 단분해 케틴의 경우, 조광제는 에스테르나 디케톤 제품 중 하나를 살 수 있다.
합성
아세톤의 열분해(열 균열)에 의해 etenone이 생성될 수 있다.[6]
- CH-CO-CH33 → CH2=C=O + CH4
다른 케틴은 HCl이 손실되는 제거 반응에 의해 아킬 염소화로부터 준비될 수 있다.
이 반응에서, 보통 트리에틸아민인 베이스는 카보닐 그룹에 산성 양성자 알파를 제거하여 탄소-탄소 이중 결합의 형성과 염화 이온의 상실을 유도한다.
케텐은 울프 재배치에 의해 α-다이아조케톤으로부터도 형성될 수 있다.
케틴을 생성하는 또 다른 방법은 2피리디아민으로 된 플래시 진공 열전분해(FVT)를 통해서이다. 플뤼그와 랑럽은 1997년 가벼운 조건(480°C)을 이용해 수분 불감증이 있는 안정적인 FVT로 케틴을 생산하기 위해 FVT 반응을 개선한 방법을 개발했다. N-피리디아민은 N-아미노(피리딘)와 DCC를 용매로 한 R-말론산염으로 응결하여 제조한다.[9]
케틴을 준비하는 더 강력한 방법은 금속 카르벤의 카보닐레이션이며, 따라서 이미인, 아민 또는 알코올과 같은 적절한 시약으로 생성된 고반응 케틴의 현장 반응이다.[10] 이 방법은 α-diazocarbonyl 화합물의 카보닐화 및 Ko(II)-포르피린 금속으로 촉매되는 다양한 N–to-sylhydrazone의 효율적인 1-pot 탠덤 프로토콜이며, 이후 다양한 핵포파일 및 이미인과 반응하여 에스테르, 아미드 및 β락탐을 형성한다. 이 시스템은 광범위한 기질 범위를 가지며 카베네 전구체, 핵포자, 이미인의 다양한 조합에 적용할 수 있다.[11]
반응 및 응용 프로그램
그들의 응집된 이중 결합 때문에 케틴은 매우 반응적이다.[12]
카르복실산 에스테르 형성
알코올과의 반응에 의해 다음과 같은 카르복실산 에스테르가 형성된다.
무수화물 카복실리크 형성
케틴은 카르복실산과 반응하여 무수화물인 카르복실산을 형성한다.
카르복실산아미드 형성
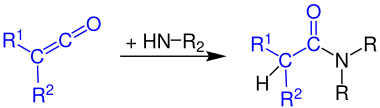
1차 아민에 대한 케틴의 반응은 2차 아미드를 생성한다.
케틴은 2차 아민과 반응하여 3차 아미드를 부여한다.
가수 분해
물과의 반응에 의해 카복실산은 케틴으로부터 형성된다.
에놀 에스테르 형성
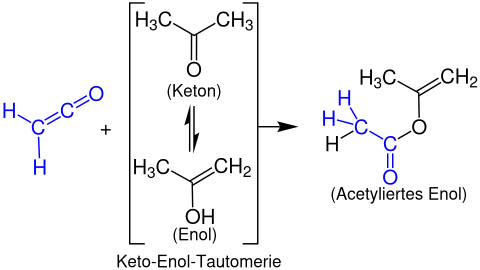
에놀 에스테르는 에놀리스성 카보닐 화합물을 가진 케틴으로부터 형성된다. 다음 예제는 프로펜-2-yl 아세테이트를 형성하기 위해 아세톤을 사용한 etenone의 반응을 보여준다.
조광화
상온에서 케틴은 디케틴으로 빠르게 약해지지만, 케틴은 가열하여 회수할 수 있다.
[2+2]-사이클로 추가
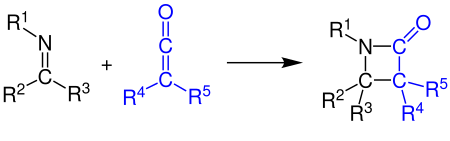
케틴은 알케네, 카보닐 화합물, 카르보디미드 및 이미네와 [2+2] 사이클로어드 추가로 반응할 수 있다. 예는 이미인과 케틴의 반응에 의한 β-락탐 합성을 보여준다(Staudinger 합성 참조).[13][14]
적용들
케틴은 일반적으로 반응성이 매우 높으며, 다양한 사이클로아드에 참여한다. 한 가지 중요한 과정은 프로피오락톤을 주기 위한 조광법이다. 종이산업에서 널리 쓰이는 알킬케틴 다이머를 공급하기 위해 스테아릭산의 케틴을 조광하는 것이 구체적인 예다.[1] AKD는 에스테르화 반응을 통해 셀룰로오스의 히드록실 그룹과 반응한다.
그들은 또한 시클로부테논을 형성하기 위해 전자가 풍부한 알키네와 [2+2] 사이클로부테논 또는 베타락톤을 형성하기 위한 카보닐 그룹을 형성하기 위해 추가 반응을 겪게 될 것이다. 이미인과 함께 베타락탐이 형성된다. 이것은 스타우딩거 합성이며, 이 중요한 종류의 화합물로 가는 손쉬운 경로다. 아세톤과 함께 케틴은 이소프로페닐 아세테이트를 주기 위해 반응한다.[1]
다양한 히드록시 화합물은 에놀 또는 에스테르 제품을 형성하면서 핵성분으로 첨가될 수 있다. 예를 들어, 물 분자는 케틴에 쉽게 첨가되어 1,1-디하이드록시메테네를 주고 아세트산 무수화물은 아세트산과 케틴의 반응에 의해 생성된다. 디올(HO-R-OH)과 비스켓네(O=C=CH-R′=CH=CH=C=C=C=C=C=C=C=C=C=C=C=O)의 반응으로 폴리에스터가 생성되며 반복 단위는 (-O-O-CO-R-CO-CO)이다.
유기합성의 중요한 시작 물질인 에틸 아세토아세테이트(Ethyl acetoacetate)는 에탄올과 반응하여 디케틴을 사용하여 준비할 수 있다. 그들은 직접적으로 에틸 아세테이트를 형성하고, 통제된 상황에서 수행될 때 수확량이 높다. 따라서 이 방법은 산업적으로 사용된다.
참고 항목
참조
- ^ Jump up to: a b c d Miller R, Abaecherli C, Said A, Jackson B (2001). "Ketenes". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a15_063. ISBN 978-3527306732.
- ^ Saul Patai, ed. (1980). Ketenes, Allenes and Related Compounds: Part 1, Volume 1. PATAI'S Chemistry of Functional Groups. John Wiley & Sons. doi:10.1002/9780470771600. ISBN 9780470771600.Saul Patai, ed. (1980). Ketenes, Allenes and Related Compounds: Part 2, Volume 2. PATAI'S Chemistry of Functional Groups. John Wiley & Sons. doi:10.1002/9780470771617. ISBN 9780471276708.
- ^ Staudinger H (1905). "Ketene, eine neue Körperklasse" [Ketenes, a new class of substances]. Berichte der Deutschen Chemischen Gesellschaft. 38 (2): 1735–1739. doi:10.1002/cber.19050380283.
- ^ 토마스 T. 티드웰, 케테네스 1세기 (1905년-2005년) : 반응하는 중간자 가족의 탄생, 안젤완테 케미에, 인트. 에디션, 밴드 44, 2005, S. 5778–5785
- ^ Ma NL, Wong M (2000). "A Theoretical Study of the Properties and Reactivities of Ketene, Thioketene, and Selenoketene". European Journal of Organic Chemistry. 2000 (8): 1411_1421. doi:10.1002/(SICI)1099-0690(200004)2000:8<1411::AID-EJOC1411>3.0.CO;2-N.
- ^ Weygand C (1972). Hilgetag G, Martini A (eds.). Weygand/Hilgetag Preparative Organic Chemistry (4th ed.). New York: John Wiley & Sons, Inc. pp. 1031–1032. ISBN 978-0471937494.
- ^ Hurd CD, Kamm O (1941). "Ketene in Organic Syntheses". Organic Syntheses. Collective Vol. 1. p. 330.
- ^ Schmidlin J, Bergman M (1910). "Darstellung des Ketens aus Aceton" [Preparation of ketene from acetone]. Berichte der Deutschen Chemischen Gesellschaft (in German). 43 (3): 2821–2823. doi:10.1002/cber.19100430340.
- ^ Carsten Plüg ,Hussein Kanaani and Curt Wentrup (12 February 2015). "Ketenes from N-(2-Pyridyl)amides". Australian Journal of Chemistry. 68 (4): 687. doi:10.1071/CH14714.
- ^ Paul ND, Chirila A, Lu H, Zhang XP, de Bruin B (September 2013). "Carbene radicals in cobalt(II)-porphyrin-catalysed carbene carbonylation reactions; a catalytic approach to ketenes". Chemistry. 19 (39): 12953–8. doi:10.1002/chem.201301731. PMC 4351769. PMID 24038393.
- ^ Chirila A, van Vliet KM, Paul ND, de Bruin B (2018). "[Co(MeTAA)] Metalloradical Catalytic Route to Ketenes via Carbonylation of Carbene Radicals" (PDF). European Journal of Inorganic Chemistry. 2018 (20–21): 2251–2258. doi:10.1002/ejic.201800101. ISSN 1099-0682.
- ^ Siegfried Hauptmann (1985), Organische Chemie: mit 65 Tabellen (in German), Leipzig: Deutscher Verlag für Grundstoffindustrie, pp. 410–412, ISBN 3871449024
- ^ Jie Jack Li (2006), Name reactions. A collection of detailed reaction mechanisms (in German) (3 ed.), Berlin: Springer-Verlag, pp. 561-562, doi:10.1007/3-540-30031-7, ISBN 9783540300304
- ^ Hermann Staudinger (1907), "Zur Kenntnis der Ketene. Diphenylketen", Justus Liebigs Annalen der Chemie (in German), John Wiley & Sons, Inc., 356 (1–2), pp. 51–123, doi:10.1002/jlac.19073560106
외부 링크
 위키미디어 커먼스의 케테네스 관련 매체
위키미디어 커먼스의 케테네스 관련 매체