비등점
Boiling point물질의 비등점은 액체의 증기 압력이 액체를[1][2] 둘러싼 압력과 동일하고 액체가 증기로 변하는 온도입니다.
액체의 비등점은 주변의 환경 압력에 따라 달라집니다.부분진공 중의 액체는 대기압일 때보다 비등점이 낮다.저압 상태의 액체는 대기압 상태의 액체에 비해 끓는점이 낮습니다.이 때문에 물은 해수면에서는 표준 압력으로 99.97°C(211.95°F)에서 끓지만, 고도 1,905m(6,250ft)[3]에서는 93.4°C(200.1°F)에서 끓는다.주어진 압력에 대해, 다른 액체는 다른 온도에서 끓습니다.
액체의 정상 비등점(대기 비등점 또는 대기압 비등점이라고도 함)은 액체의 증기 압력이 해수면에서 정의된 대기압과 동일한 특수한 경우입니다.[4][5]이 온도에서 액체의 증기압은 기압을 극복하고 액체의 부피 내에 기포가 형성되도록 하기에 충분하다.표준 비등점은 1982년부터 IUPAC에 의해 1bar의 [6]압력 하에서 비등하는 온도로 정의되어 왔다.
기화열은 주어진 양의 물질(몰, kg, 파운드 등)을 주어진 압력(종종 대기압)에서 기체로 변환하는 데 필요한 에너지입니다.
액체는 증발 과정을 통해 끓는점 이하의 온도에서 증기로 변할 수 있습니다.증발은 액체의 가장자리 부근에 위치한 분자가 액체의 압력에 의해 충분히 억제되지 않고 증기로서 주변으로 빠져나가는 표면 현상이다.반면 끓는 것은 액체 속 분자가 빠져나가는 과정으로 액체 안에 증기 기포가 형성된다.
포화 온도 및 압력
포화 액체는 끓지 않고 가능한 한 많은 열에너지를 포함합니다(또는 반대로 포화 증기는 응축하지 않고 가능한 한 적은 열 에너지를 포함합니다).
포화온도는 끓는점을 의미한다.포화 온도는 액체가 증기상으로 비등할 때 대응하는 포화 압력의 온도입니다.그 액체는 열에너지로 포화상태라고 할 수 있다.열에너지를 추가하면 상전이 발생합니다.
시스템의 압력이 일정하게 유지되면(등압), 열 에너지(열)가 제거됨에 따라 포화 온도에서 증기가 액상으로 응축되기 시작합니다.마찬가지로, 포화 온도와 압력에 있는 액체는 추가적인 열에너지가 가해지면 그 기상으로 끓어오릅니다.
비등점은 액체의 증기 압력이 주변 환경 압력과 동일한 온도에 해당합니다.따라서 비등점은 압력에 따라 달라집니다.비등점은 NIST, 미국 표준 압력 101.325kPa(또는 1atm) 또는 IUPAC 표준 압력 100.000kPa와 관련하여 발표될 수 있다.기압이 훨씬 낮은 높은 고도에서는 비등점도 낮아집니다.끓는점은 기체와 액체의 특성이 같아지는 임계점까지 압력이 증가함에 따라 증가합니다.비등점은 임계점 이상으로 증가할 수 없습니다.마찬가지로 비등점은 3중점에 도달할 때까지 압력이 감소함에 따라 감소합니다.비등점은 삼중점 이하로 낮출 수 없습니다.
특정 온도에서 증기의 열과 액체의 증기 압력을 알고 있는 경우, 비등점은 Clausius-Clapeyron 방정식을 사용하여 계산할 수 있습니다. 따라서 다음과 같습니다.
여기서:
- 는 관심 압력의 비등점입니다.
- R은 이상적인 가스 상수입니다.
- P는 액체의 증기 압력입니다.
- 0은 하는 0(\이 알려진 압력입니다(보통 데이터는 1atm 또는 100kPa에서 사용 가능).
- H{ \ vap}}}은 액체의 기화열입니다.
- 0 T_은 끓는 온도입니다.
- 은 자연 로그입니다.
포화압력은 액체가 기상으로 비등할 때 대응하는 포화온도에 대한 압력입니다.포화 압력과 포화 온도는 직접적인 관계가 있습니다. 포화 압력이 증가하면 포화 온도도 증가합니다.
시스템의 온도가 일정하게 유지되면(등온 시스템), 시스템 압력이 높아짐에 따라 포화 압력 및 온도의 증기가 액상으로 응축되기 시작합니다.마찬가지로, 포화 압력과 온도의 액체는 시스템 압력이 감소함에 따라 증기 단계로 깜박이는 경향이 있습니다.
물의 표준 비등점에는 두 가지 규칙이 있습니다.정상 비등점은 1atm(즉, 101.325kPa)의 압력에서 99.97°C(211.9°F)입니다.100kPa(1bar)[7]의 표준 압력에서 물의 IUPAC 권장 비등점은 99.61°C(211.3°F)[6][8]입니다.비교를 위해 에베레스트 산 정상의 해발 8,848m(29,029ft)에서 압력은 약 34kPa(255Torr)[9]이고 물의 비등점은 71°C(160°F)이다.1954년까지 섭씨 온도 척도는 두 가지 포인트로 정의되었다. 즉, 0°C는 물 결빙점으로 정의되고 100°C는 표준 대기압에서 물 끓는점으로 정의된다.
액체의 정상 비등점과 증기압과의 관계
주어진 온도에서 액체의 증기 압력이 높을수록 액체의 정상 비등점(즉, 대기압에서 비등점)이 낮아집니다.
오른쪽에 있는 증기 압력 차트에는 다양한 [10]액체의 증기 압력 대 온도를 나타내는 그래프가 있습니다.도표에서 볼 수 있듯이 증기 압력이 가장 높은 액체는 정상 끓는점이 가장 낮습니다.
예를 들어, 주어진 온도에서 염화메틸은 차트에 있는 액체 중 가장 높은 증기 압력을 가집니다.또한 정상 비등점(-24.2°C)이 가장 낮으며, 이는 염화메틸(파란색 선)의 증기 압력 곡선이 절대 증기 압력의 한 대기(atm)의 수평 압력선과 교차하는 지점이다.
액체의 임계점은 실제로 끓는 최고 온도(및 압력)입니다.
물의 증기 압력을 참조하십시오.
화학원소의 비등점
끓는점이 가장 낮은 원소는 헬륨이다.레늄과 텅스텐의 비등점은 모두 표준 압력에서 5000K를 초과합니다. 바이어스 없이 극단적인 온도를 정확하게 측정하기 어렵기 때문에 문헌에서는 둘 다 비등점이 [11]더 높은 것으로 언급되었습니다.
순수 화합물의 기준 특성으로서의 비등점
위의 그림에서 알 수 있듯이, 주어진 순수 화합물에 대한 증기 압력 대 온도의 로그 그래프에서 볼 수 있듯이, 정상 끓는점은 해당 화합물의 전체적인 휘발성을 나타내는 지표가 될 수 있다.주어진 순수 화합물은 정상 끓는점이 1개(있는 경우)밖에 없으며, 화합물의 정상 끓는점과 녹는점은 참고서에 나열된 해당 화합물의 특성으로 작용할 수 있다.화합물의 정상 끓는점이 높을수록 해당 화합물은 전체적으로 휘발성이 떨어지고, 반대로 화합물의 정상 끓는점이 낮을수록 해당 화합물은 전체적으로 휘발성이 높아집니다.일부 화합물은 정상 끓는점이나 때로는 녹는점에 도달하기 전에 더 높은 온도에서 분해됩니다.안정적인 화합물의 경우 비등점은 외부 압력에 따라 3배에서 임계점까지 다양합니다.삼중점을 넘어서 화합물의 정상 끓는점이 있다면, 그 녹는점보다 높다.임계점을 넘어서 화합물의 액상과 기상이 하나의 상으로 합쳐지는데, 이를 과열 기체라고 부를 수 있다.주어진 온도에서 화합물의 정상 끓는점이 더 낮으면 해당 화합물은 일반적으로 대기 외부 압력에서 기체로 존재합니다.화합물의 정상 끓는점이 더 높으면 해당 화합물은 대기 외부 압력에서 주어진 온도에서 액체 또는 고체로 존재할 수 있으며, 증기가 포함된 경우 증기와 평형 상태로 존재할 수 있습니다.화합물의 증기가 포함되어 있지 않으면 일부 휘발성 화합물은 끓는점이 높음에도 불구하고 결국 증발할 수 있습니다.
일반적으로 이온 결합을 가진 화합물은 이러한 고온에 도달하기 전에 분해되지 않으면 정상 끓는점이 높다.많은 금속들이 끓는점이 높지만 전부는 아니다.매우 일반적으로 (다른 요인이 동일하지만) 공유 결합 분자가 있는 화합물에서는 분자(또는 분자 질량)의 크기가 증가함에 따라 정상 끓는점이 증가한다.분자 크기가 고분자, 고분자 또는 기타 매우 커지면, 화합물은 종종 끓는점에 도달하기 전에 고온에서 분해된다.화합물의 정상 끓는점에 영향을 미치는 또 다른 요인은 분자의 극성이다.화합물 분자의 극성이 증가함에 따라, 정상 끓는점은 증가하며, 다른 요소들은 동일하다.분자(액체 상태)가 수소 결합을 형성할 수 있는 능력이 밀접하게 관련되어 있는데, 이는 분자가 액체 상태를 벗어나기 어렵게 만들고 따라서 화합물의 정상 끓는 점을 증가시킨다.단순 카르본산은 분자 사이에 수소 결합을 형성함으로써 이량화된다.끓는점에 영향을 미치는 작은 요인은 분자의 형태이다.분자의 모양을 더 촘촘하게 만드는 것은 표면적이 더 많은 동등한 분자에 비해 정상 끓는 점을 약간 낮추는 경향이 있다.
| 통칭 | n-부탄 | 이소부탄 |
|---|---|---|
| IUPAC 이름 | 부탄 | 2-메틸프로판 |
| 분자의 형태 | 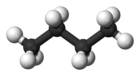 | 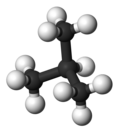 |
| 끓다 점(°C) | −0.5 | −11.7 |
| 통칭 | n펜탄 | 이소펜탄 | 네오펜탄 |
|---|---|---|---|
| IUPAC 이름 | 펜탄 | 2-메틸부탄 | 2,2-디메틸프로판 |
| 분자의 형태 |  |  |  |
| 끓다 점(°C) | 36.0 | 27.7 | 9.5 |

대부분의 휘발성 화합물(주변 온도에 가까운 곳)은 고체에서 기상으로 전환되는 동안 중간 액체 단계를 거칩니다.끓는 것에 비해 승화는 고체가 직접 증기로 변하는 물리적 변환으로 대기압의 이산화탄소와 같은 몇 가지 경우에 발생합니다.이러한 화합물에 대해 승화점은 증기로 직접 변하는 고체가 외부 압력과 동일한 증기 압력을 갖는 온도이다.
불순물 및 혼합물
앞 절에서는 순수 화합물의 비등점을 다루었다.물질의 증기압 및 끓는점은 용해된 불순물(용액) 또는 혼합 가능한 다른 화합물의 존재, 불순물 또는 다른 화합물의 농도에 따른 영향 정도에 의해 영향을 받을 수 있다.주성분 화합물보다 훨씬 낮은 휘발성의 소금이나 화합물과 같은 비휘발성 불순물이 존재하면 몰 분율과 용액의 휘발성이 감소하므로 용질 농도에 비례하여 정상 끓는점이 상승한다.이 효과를 비등점 상승이라고 합니다.일반적인 예로, 소금물은 순수한 물보다 높은 온도에서 끓는다.
혼합성 화합물(성분)의 다른 혼합물에서는 변동성이 다양한 성분이 2개 이상 있을 수 있으며, 각 성분은 주어진 압력에서 자체 순수한 성분 비등점을 가진다.혼합물에 포함된 다른 휘발성 성분의 존재는 증기 압력에 영향을 미쳐 혼합물에 포함된 모든 성분의 끓는점과 이슬점에 영향을 미칩니다.이슬점은 증기가 액체로 응축되는 온도이다.또한 소정의 온도에서 증기의 조성은 대부분의 경우 액체의 조성과 다르다.혼합물의 휘발성 성분 간에 이러한 영향을 설명하기 위해 비등점 다이어그램을 일반적으로 사용한다.증류란 액상과 증기상의 성분 차이를 이용하는 끓는 과정과 [보통] 응축 과정입니다.
테이블
| 그룹 → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ 기간 | |||||||||||||||||||||
| 1 | H220.271 K (-252.879°C) | 그4.222K (-268.928°C) | |||||||||||||||||||
| 2 | 리1603 K (1330°C) | 있다2742 K (2469°C) | B 4,200 K (3927°C) | C 3915 K (하위) (3642°C) | N277.355 K (-195.795°C) | 오290.188K (-182.962°C) | 에프285.03 K (-188.11°C) | 네27.104 K (-246.046°C) | |||||||||||||
| 3 | 나1156.090 K (882.940°C) | Mg1363 K (1091°C) | 알2743 K (2470°C) | 시3538 K (3265°C) | P 553.7 K (280.5°C) | S 7,17.8 K (444.6°C) | 클론2239.11 K (-34.04°C) | 아르87.302 K (−185.848 °C) | |||||||||||||
| 4 | K 1,032 K (759°C) | Ca1757 K (1484 °C) | Sc3109 K (2836 °C) | Ti3560 K (3287°C) | V 3680 K (3407°C) | Cr2945.15 K (2672.0°C) | Mn2334 K (2061°C) | Fe3134 K (2861°C) | Co3200 K (2927°C) | Ni3003 K (2730°C) | 2835원 (2562°C) | Zn1180 K (907°C) | Ga2673 K (2400°C) | Ge3106 K (2833 °C) | ~하듯이887 K (하위) (615°C) | 세958 K (685°C) | 브르2332.0 K (58.8°C) | Kr119.735 K (-153.415°C) | |||
| 5 | Rb961 K (688°C) | 시르1650 K (1377°C) | Y 3203 K (2930°C) | Zr4650 K (4377°C) | Nb5017 K (4744°C) | Mo4912 K (4639°C) | Tc4538 K (4265°C) | Ru4423 K (4150°C) | Rh3968 K (3695°C) | Pd3236 K (2963°C) | Ag2483 K (2210 °C) | CD1040 K (767°C) | In2345 K (2072°C) | Sn2875 K (2602°C) | Sb1908 K (1635 °C) | Te1261 K (988°C) | 나2457.4 K (184.3°C) | Xe165.051 K (-108.099°C) | |||
| 6 | Cs944 K (671°C) | 바2118 K (1845°C) | Lu3675 K (3402°C) | Hf4876 K (4603°C) | Ta5731 K (5458°C) | W6203 K (5930°C) | Re5900.15K (5627.0°C) | Os5285 K (5012°C) | Ir4403 K (4130°C) | Pt4098 K (3825°C) | Au3243 K (2970°C) | Hg629.88 K (356.73°C) | Tl1746 K (1473 °C) | PB2022 K (1749°C) | 비1837 K (1564 °C) | 포1235 K (962°C) | 앳2503±3K (230±3°C) | Rn211.5 K (-61.7°C) | |||
| 7 | 프루950 K (677°C) | 라2010년 K (1737°C) | Lr | Rf5800K (5500°C) | 데이터베이스 | Sg | Bh | Hs | 산 | Ds | Rg | Cn340±10K (67±10°C) | Nh1430 K (1130°C) | 플380K (107°C) | 맥최대 1,400 K (1100°C까지) | Lv1035 – 1135 K (762–862 °C) | Ts883 K (610 °C) | 오그450±10 K (177±10°C) | |||
| La3737 K (3464°C) | Ce3716 K (3443°C)6 | Pr3403 K (3130°C) | Nd3347 K (3074°C) | PM3273 K (3000°C) | SM2173 K (1900°C) | Eu1802 K (1529 °C) | Gd3273 K (3000°C) | Tb3396 K (3123 °C) | Dy2840 K (2567 °C) | Ho2873 K (2600°C) | Er3141 K (2868 °C) | Tm2223 K (1950°C) | Yb1469 K (1196°C) | ||||||||
| AC3471 K (3198 °C) | Th(Th)5061 K (4788°C) | 빠4300? K (4027°C) | U 4404 K (4131 °C) | Np4175.15 K (3902.0°C) | Pu3508.15 K (3235.0°C) | Am2880 K (2607°C) | Cm3383 K (3110 °C) | Bk2900 K (2627°C) | Cf1743 K (1470°C) | ES1269 (996°C) | Fm | Md | 아니요. | ||||||||
| 범례 | |||||||||||||||||||||
| 값은 켈빈 K와 섭씨 °C(반올림)입니다. | |||||||||||||||||||||
| 화씨 °F의 등가물에 대해서는, 요소의 비등점(데이터 페이지)을 참조해 주세요. | |||||||||||||||||||||
| 일부 값은 예측입니다. | |||||||||||||||||||||
「 」를 참조해 주세요.
- 요소의 비등점(데이터 페이지)
- 비등점 표고
- 임계점(열역학)
- 액체의 비등점을 정확하게 측정하는 장치인 에불리오미터
- 헤게돈 온도
- 조백법(분자구조에서 정상비등점 추정)
- 비등점을 포함한 기체 목록
- 녹는점
- 과냉각
- 과열
- 비등점과 잠열을 관련짓는 트라우톤의 상수
- 트리플 포인트
레퍼런스
- ^ Goldberg, David E. (1988). 3,000 Solved Problems in Chemistry (1st ed.). McGraw-Hill. section 17.43, p. 321. ISBN 0-07-023684-4.
- ^ Theodore, Louis; Dupont, R. Ryan; Ganesan, Kumar, eds. (1999). Pollution Prevention: The Waste Management Approach to the 21st Century. CRC Press. section 27, p. 15. ISBN 1-56670-495-2.
- ^ "Boiling Point of Water and Altitude". www.engineeringtoolbox.com.
- ^ General Chemistry Glossary Purdue University 웹사이트 페이지
- ^ Reel, Kevin R.; Fikar, R. M.; Dumas, P. E.; Templin, Jay M. & Van Arnum, Patricia (2006). AP Chemistry (REA) – The Best Test Prep for the Advanced Placement Exam (9th ed.). Research & Education Association. section 71, p. 224. ISBN 0-7386-0221-3.
- ^ a b Cox, J. D. (1982). "Notation for states and processes, significance of the word standard in chemical thermodynamics, and remarks on commonly tabulated forms of thermodynamic functions". Pure and Applied Chemistry. 54 (6): 1239–1250. doi:10.1351/pac198254061239.
- ^ 표준 압력 IUPAC는 "표준 압력"을 10Pa(1bar에 해당)로5 정의합니다.
- ^ 부록 1: 속성 표 및 차트(SI 단위)를 아래로 스크롤하여 표 A-5로 이동하고 100kPa(1bar)의 압력에서 99.61°C의 온도 값을 읽습니다.McGrow-Hill의 Higher Education 웹사이트에서 입수.
- ^ West, J. B. (1999). "Barometric pressures on Mt. Everest: New data and physiological significance". Journal of Applied Physiology. 86 (3): 1062–6. doi:10.1152/jappl.1999.86.3.1062. PMID 10066724.
- ^ Perry, R.H.; Green, D.W., eds. (1997). Perry's Chemical Engineers' Handbook (7th ed.). McGraw-Hill. ISBN 0-07-049841-5.
- ^ DeVoe, Howard (2000). Thermodynamics and Chemistry (1st ed.). Prentice-Hall. ISBN 0-02-328741-1.
외부 링크
- . . 1914.


 관심 압력의 비등점입니다.
관심 압력의 비등점입니다.
 액체의
액체의 
 알려진 압력입니다(보통 데이터는 1atm 또는 100kPa에서 사용 가능).
알려진 압력입니다(보통 데이터는 1atm 또는 100kPa에서 사용 가능).