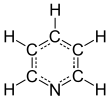
피리딘
Pyridine
| |||
| |||
 | |||
| 이름들 | |||
|---|---|---|---|
| 선호 IUPAC 이름 피리딘[1] | |||
| 계통 IUPAC명 아자벤젠 | |||
| 기타이름 아지네 아지닌 | |||
| 식별자 | |||
3D 모델(JSMO) | |||
| ChEBI | |||
| 쳄블 | |||
| 켐스파이더 | |||
| ECHA 인포카드 | 100.003.464 | ||
| EC 번호 |
| ||
| 케그 | |||
펍켐 CID | |||
| 유니아이 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C5H5N | |||
| 어금니 질량 | 79.102g·mol−1 | ||
| 외모 | 무색액체[2] | ||
| 냄새 | 메스꺼움, 물고기 같은[3] | ||
| 밀도 | 0.9819g/mL (20°C)[4] | ||
| 융점 | -41.63°C(-42.93°F, 231.52K)[4] | ||
| 비등점 | 115.2°C (239.4°F, 388.3K)[4] | ||
| 혼섬[4] | |||
| 로그 P | 0.65[5] | ||
| 증기압 | 16mmHg(20°C)[3] | ||
| 산도(pKa) | 5.23(피리디늄)[6] | ||
| 공액산 | 피리디늄 | ||
| -48.7·10cm−63/mol[7] | |||
| 열전도율 | 0.166 W/(m·K)[8] | ||
굴절률(nD) | 1.5095(20°C)[4] | ||
| 점도 | 0.879cP(25°C)[9] | ||
| 2.215 D[10] | |||
| 열화학[11] | |||
열용량 (C) | 132.7 J/(mol·K) | ||
스덴탈피 형성 (δ) | 100.2 kJ/mol | ||
스덴탈피 연소. (δ) | −2.782 MJ/mol | ||
| 유해성[15] | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험요소 | 낮은 위험에서 중간 위험까지[13] | ||
| GHS 라벨링: | |||
  [12] [12] | |||
| 위험 | |||
| H225, H302, H312, H315, H319, H332[12] | |||
| P210, P280, P301+P312, P303+P361+P353, P304+P340+P312, P305+P351+P338[12] | |||
| NFPA 704 (파이어다이아몬드) | |||
| 플래시 포인트 | 20°C(68°F; 293K)[16] | ||
| 482°C (900°F; 755K)[16] | |||
| 폭발한계 | 1.8–12.4%[3] | ||
임계값(TLV) | 5 ppm (TWA) | ||
| 치사량 또는 농도(LD, LC): | |||
LD50(중앙선량) | 891mg/kg(쥐, 경구) 1500 mg/kg (mouse, 경구) 1580mg/kg(쥐, 경구)[14] | ||
LC50(중위농도) | 9000ppm (쥐, 1시간)[14] | ||
| NIOSH(미국 건강 노출 한도): | |||
PEL(허용) | TWA 5ppm (15mg/m3)[3] | ||
REL (권장) | TWA 5ppm (15mg/m3)[3] | ||
IDLH(즉각 위험) | 1000ppm[3] | ||
| 관련화합물 | |||
| 피콜린 퀴놀린 | |||
관련화합물 | 아닐린 피리미딘 피페리딘 | ||
| 부가자료페이지 | |||
| 피리딘 (자료 페이지) | |||
별도의 언급이 없는 경우를 제외하고, 표준 상태(25 °C [77 °F], 100 kPa에서)의 재료에 대한 데이터가 제공됩니다. | |||
피리딘은 화학식이 있는 염기성 헤테로고리 유기 화합물입니다. CHN. 벤젠과 구조적으로 관련이 있으며, 1개의 메틴기(=CH-)가 질소 원자로 치환되어 있습니다.이것은 인화성이 높고 알칼리성이 약하며 물과 섞일 수 있는 독특하고 불쾌한 물고기 같은 냄새를 가진 액체입니다.피리딘은 무색이지만, 오래되거나 불순한 샘플은 상당한 전기 전도성을 보이는, 연장된 불포화 중합체 사슬의 형성으로 인해 노란색으로 보일 수 있습니다.[17]피리딘 고리는 농약, 의약품, 비타민을 포함한 많은 중요한 화합물에서 발생합니다.역사적으로, 피리딘은 콜타르로부터 생산되었습니다.2016년 현재 전 세계적으로 연간 약 2만 톤 규모로 합성되고 있습니다.[2]
특성.

물리적 특성

피리딘은 반자성입니다.중요한 매개변수는 압력 5.63 MPa, 온도 619 K, 부피 248 cm3·mol입니다−1.[19]온도 범위 340-426°C에서 증기압 p는 앙투안 방정식으로 설명할 수 있습니다.
여기서 T는 온도, A = 4.16272, B = 1371.358K, C = -58.496K입니다.
구조.
피리딘 고리는 CN5 육각형을 형성합니다.C-C 및 C-N 거리의 약간의 변화와 결합 각도가 관찰됩니다.
결정학
피리딘은 공간군 Pna2와 격자 매개변수 a = 1752 pm, b = 897 pm, c = 1135 pm, 단위 셀 당 16개의 공식 단위(153 K에서 measured)를 갖는 정방정계에서 결정화됩니다.비교를 위해, 결정질 벤젠은 또한 오르쏘옴빅이며, 우주 그룹 Pbca, a = 729.2 pm, b = 947.1 pm, c = 674.2 pm (78 K에서)이지만, 셀 당 분자 수는 4개에 불과합니다.이 차이는 부분적으로 개별 피리딘 분자의 낮은 대칭(벤젠의2v6h 경우 C 대 D)과 관련이 있습니다.삼수화물(피리딘·3)HO)가 알려져 있으며; 또한 공간군 Pbca의 정사홈 시스템에서 결정화되며, 격자 매개변수 a = 1244 pm, b = 1783 pm, c = 679 pm 및 단위 셀 당 8개의 공식 단위(223 K에서 measured).
분광학
헥산의 피리딘의 광학 흡수 스펙트럼은 195, 251, 270 nm 파장의 밴드로 구성되어 있습니다.7500, 2000 및 450 L·mol·cm의 각각의 소멸 계수(ε)를 사용하여 이 대역은 π → π*, π π* 및 n → π* 전이에 할당됩니다.
H 핵자기공명(NMR) 스펙트럼은 α-(δ 8.5), γ-(δ 7.5) 및 β-양성자(δ 7)에 대한 신호를 보여줍니다.반대로 벤젠의 양성자 신호는 δ7.27에서 발견됩니다.벤젠과 비교하여 α- 및 γ-양성자의 화학적 변화가 더 큰 것은 공명 구조에서 유도될 수 있는 α- 및 γ-위치의 낮은 전자 밀도에서 기인합니다.피리딘과 벤젠의 CNMR 스펙트럼은 상황이 다소 비슷합니다. 피리딘은 δ(α-C) = 150 ppm, δ(β-C) = 124 ppm, δ( γ-C) = 136 ppm에서 삼중항을 보여주는 반면 벤젠은 129 ppm에서 단일선을 보여줍니다.용매가 없는 물질에 대해서는 모든 변이가 인용됩니다.[22]피리딘은 일반적으로 가스 크로마토그래피 및 질량 분석 방법에 의해 검출됩니다.[23]
본딩
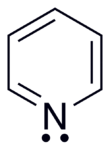
피리딘은 고리 위에 비국재화된 6개의 π 전자로 구성된 결합계를 가지고 있습니다.분자는 평면이고 따라서 방향족 시스템에 대한 휘켈 기준을 따릅니다.벤젠과는 대조적으로 전자 밀도가 고리 전체에 고르게 분포하지 않아 질소 원자의 음의 유도 효과를 반영합니다.이러한 이유로 피리딘은 벤젠보다 쌍극자 모멘트와 약한 공명 안정화를 가지고 있습니다(피리딘의 공명 에너지 117 kJ·mol−1 대 벤젠의 150−1 kJ·[24]mol.
피리딘 분자의 고리 원자는 sp-hybridization2 됩니다.질소는 혼성화되지 않은 p 오비탈을 사용하여 π 결합 방향족 시스템에 관여합니다.외쌍은 σ 결합과 같은 평면으로 고리 바깥쪽으로 돌출된, 회전 궤도 안에 있습니다.결과적으로, 외쌍은 방향족 시스템에 기여하지 않지만, 피리딘의 화학적 특성에 중요하게 영향을 미치는데, 이는 그것이 친전자성 공격을 통한 결합 형성을 쉽게 지원하기 때문입니다.[25]그러나, 방향족 고리 시스템으로부터 외쌍의 분리 때문에, 질소 원자는 긍정적인 중합체 효과를 나타낼 수 없습니다.
피리딘의 많은 유사체들은 N이 원소 주기율표의 같은 열에서 다른 헤테로 원자로 대체된 것으로 알려져 있습니다(아래 그림 참조).피리딘에서 하나의 C-H가 두 번째 N으로 치환되면 피리다진, 피리미딘 및 피라진이라는 이름을 가진 디아진 헤테로사이클(CHN442)이 생성됩니다.
역사

불순한 피리딘은 의심할 여지 없이 초기 연금술사들이 동물의 뼈와 다른 유기물을 가열하여 제조한 것이지만,[26] 최초로 기록된 문헌은 스코틀랜드의 과학자 토마스 앤더슨에 기인합니다.[27][28]1849년 앤더슨은 동물 뼈를 고온 가열하여 얻은 기름의 함량을 조사했습니다.[28]다른 물질들 중에서도, 그는 불쾌한 냄새를 가진 무색의 액체를 기름에서 분리했고, 2년 후에 순수한 피리딘을 분리했습니다.그는 이것이 물에 잘 녹고, 가열할 때 농축산과 소금에 쉽게 녹고, 기름에는 약간만 녹는다고 설명했습니다.
가연성 때문에 앤더슨은 그리스어에서 불을 뜻하는 πῦρ(pyr)의 이름을 따 이 새로운 물질을 피리딘이라 이름 지었습니다.접미사 아이딘(idine)은 톨루이딘(toluidine)에서와 같이 화학 명명법에 따라 첨가되어 질소 원자를 포함하는 고리형 화합물을 나타냄.[29][30]
피리딘의 화학적 구조는 발견된 지 수십 년 후에 밝혀졌습니다.빌헬름 쾨르너([31]Wilhelm Körner, 1869)[32][33]와 제임스 드워(James Dewar, 1871)는 퀴놀린과 나프탈렌 사이에서 유사하게 피리딘의 구조는 하나의 C-H 단위를 질소 원자로 치환함으로써 벤젠으로부터 유도된다고 제안했습니다.[34][35]쾨르너와 드워의 제안은 나중에 피리딘이 에탄올에 나트륨과 함께 피페리딘으로 환원된 실험에서 확인되었습니다.[36][37]1876년 윌리엄 램지는 아세틸렌과 시안화수소를 불에 달궈진 철-튜브 용광로에서 피리딘으로 결합했습니다.[38]이것이 헤테로방향족 화합물의 첫 합성이었습니다.[23][39]
피리딘 유도체의 최초의 주요 합성은 1881년 아서 루돌프 한츠쉬에 의해 기술되었습니다.[40]한츠쉬 피리딘 합성은 일반적으로 β-케토산(종종 아세토아세테이트), 알데히드(종종 포름알데히드) 및 암모니아 또는 그 염의 2:1:1 혼합물을 질소 공여체로 사용합니다.먼저, 이중 수소화된 피리딘을 얻고, 이는 상응하는 피리딘 유도체로 산화됩니다.에밀 노베나겔은 비대칭적으로 치환된 피리딘 유도체가 이 과정을 통해 생성될 수 있음을 보여주었습니다.[41]

피리딘 생산의 현대적인 방법들은 낮은 수율을 가지고 있었고, 새로운 화합물에 대한 증가하는 수요는 더 효율적인 경로를 모색하도록 촉구했습니다.1924년 러시아의 화학자 알렉세이 치치바빈이 저렴한 시약을 기반으로 한 피리딘 합성 반응을 발명하면서 돌파구가 생겼습니다.[42]이 방법은 피리딘의 산업 생산에 여전히 사용됩니다.[2]
발생
피리딘은 벨라도나(Atropa belladonna)[43]와 마시멜로(Althaea Officinalis)의 잎과 뿌리를 제외하고는 자연에서 풍부하지 않습니다.[44]그러나 피리딘 유도체는 종종 알칼로이드와 같은 생체 분자의 일부입니다.
일상생활에서, 미량의 피리딘은 닭튀김,[45] 스키야키,[46] 구운 커피,[47] 감자칩,[48] 그리고 베이컨 튀김과 같은 로스팅과 통조림 과정에서 생성되는 휘발성 유기 화합물의 성분입니다.[49]피리딘의 흔적은 보포트 치즈,[50] 질 분비물,[51] 홍차,[52] 치은염을 앓고 있는 사람들의 침,[53] 해바라기 꿀 등에서 찾을 수 있습니다.[54]
생산.
역사적으로 피리딘은 콜타르에서 추출되거나 석탄 가스화의 부산물로 얻어졌습니다.이 공정은 노동력이 많이 들고 비효율적입니다. 콜타르에는 피리딘이 약 0.1%만 포함되어 있기 [55]때문에 다단 정제가 필요하여 생산량이 더욱 줄었습니다.오늘날 대부분의 피리딘은 암모니아, 알데하이드, 니트릴로 합성되는데, 이 중 몇 가지 조합이 피리딘 자체에 적합합니다.다양한 이름 반응들도 알려져 있지만, 그것들은 규모에 따라 실행되지 않습니다.[2]
1989년에는 전 세계적으로 26,000톤의 피리딘이 생산되었습니다.다른 주요 유도체로는 2-, 3-, 4-메틸피리딘과 5-에틸-2-메틸피리딘이 있습니다.이들 알킬피리딘의 결합된 스케일은 피리딘 자체의 스케일과 일치합니다.[2]피리딘의 가장 큰 생산지 25곳 중 11곳이 유럽에 위치해 있습니다(1999년 기준).[23]피리딘의 주요 생산지는 에보닉 인더스트리, 뤼트거 화학, 주빌란트 생명과학, 임페리얼 케미칼 인더스트리, 코에이 케미칼 등입니다.[2]피리딘 생산은 2000년대 초반에 크게 증가하여 중국 본토에서만 연간 30,000톤의 생산 능력을 보유하고 있습니다.[56]현재 피리딘 생산의 세계적인 리더는 미국과 중국의 합작 회사인 버텔러스입니다.[57]
치치바빈 합성
치치바빈 피리딘 합성은 1924년에 보고되었으며 기본 접근법은 여러 산업 경로를 뒷받침합니다.[42]일반적인 형태에서, 반응은 암모니아 또는 암모니아 유도체에서 알데하이드, 케톤, α,β-불포화 카보닐 화합물, 또는 상기의 임의의 조합의 축합 반응을 포함합니다.치치바빈 피리딘 합성의 적용은 종종 약 30%[58]의 낮은 수율로 고통받지만, 전구체는 저렴합니다.특히, 치환되지 않은 피리딘은 포름알데히드와 아세트알데히드로부터 생성됩니다.첫째, 아세트알데히드와 포름알데히드로부터 크노베나겔 축합에서 아크로레인이 형성됩니다.아크롤린은 이후 아세트알데히드와 암모니아와 응축하여 디히드로피리딘을 생성하고, 디히드로피리딘은 피리딘으로 산화됩니다.이 과정은 400~450°C의 기체 상태에서 수행됩니다.대표적인 촉매는 알루미나와 실리카의 변형된 형태입니다.그 반응은 다양한 메틸피리딘을 생산하도록 맞추어졌습니다.[2]


치환된 피리딘의 탈알킬화 및 탈카복실화
피리딘은 다른 피리딘의 합성에서 부산물로 얻어지는 알킬화된 피리딘의 탈알킬화에 의해 제조될 수 있습니다.산화적 탈알킬화는 바나듐(V) 산화물 촉매 위의 공기,[59] 니켈계 촉매 위의 증기 탈알킬화 또는 [60][61]은 또는 백금계 촉매 위의 수소 탈알킬화를 이용하여 수행됩니다.[62]니켈 기반 촉매를 사용하면 피리딘의 수율이 93%에 이를 수 있습니다.[2]피리딘은 또한 니코틴산과 구리 크로마이트의 탈카복실화에 의해 생성될 수 있습니다.[63]
본만 순환론

니트릴 분자의 일부와 아세틸렌의 두 부분을 피리딘으로 삼량화하는 것을 본만 고리화라고 합니다.레페 합성의 이러한 변형은 열 또는 빛에 의해 활성화될 수 있습니다.열 활성화를 위해서는 높은 압력과 온도가 필요하지만, 광유도 사이클로디온은 CoCp(cod)(Cp = cyclopentadienyl, cod = 1,5- cyclooctadiene)를 촉매로 하여 주변 조건에서 진행되며, 물속에서도 수행할 수 있습니다.이러한 방법으로 일련의 피리딘 유도체를 제조할 수 있습니다.니트릴로 아세토니트릴을 사용하면 2-메틸피리딘이 얻어지는데, 이는 피리딘으로 탈알킬화될 수 있습니다.
기타방법
크뢴케 피리딘 합성은 피리딘 자체를 시약으로 사용하여 치환된 피리딘을 생성하는 상당히 일반적인 방법을 제공하며 최종 제품에는 포함되지 않습니다.피리딘과 브로모메틸 케톤의 반응은 메틸렌 그룹이 높은 산성인 관련 피리디늄 염을 제공합니다.이 종은 피리디늄 브로마이드뿐만 아니라 표적화된 치환된 피리딘의 고리 폐쇄 및 형성을 겪기 위해 아세트산 암모늄의 존재하에서 α,β-불포화 카보닐에 미카엘과 유사한 첨가를 겪습니다.[65]

시아미시안-덴스테드 재배열은[66] 디클로로카벤과 함께 피롤의 3-클로로피리딘으로의 고리 확장을 수반합니다.[67][68][69]

가터만-스키타 합성에서 [70]말론산 에스테르염은 디클로로메틸아민과 반응합니다.[71]

다른 방법으로는 보거 피리딘 합성과 알켄과 옥사졸의 디엘스-알더 반응이 있습니다.[72]
생합성
몇몇 피리딘 유도체는 생물학적 시스템에서 중요한 역할을 합니다.그것의 생합성은 완전히 이해되지는 않지만, 니코틴산(비타민 B)은3 일부 박테리아, 곰팡이, 포유류에서 발생합니다.포유류는 아미노산 트립토판의 산화를 통해 니코틴산을 합성하는데, 여기서 중간생성물인 아닐린 유도체 키누레닌은 피리딘 유도체인 퀴놀리네이트와 니코틴산을 생성합니다.반대로, 박테리아 마이코박테리움 결핵과 대장균은 글리세르알데히드 3-인산과 아스파르트산의 축합에 의해 니코틴산을 생성합니다.[73]
반응
피리딘 고리의 전기음성 질소 때문에, 피리딘은 벤젠 유도체보다 더 쉽게 친전자성 방향족 치환 반응에 들어갑니다.[74]대신 반응성 면에서 피리딘은 니트로벤젠과 유사합니다.[75]
이에 상응하여 피리딘은 강한 유기금속 염기에 의한 금속화의 용이함으로 입증된 바와 같이 친핵성 치환의 가능성이 더 높습니다.[76][77]피리딘의 반응성은 세 가지 화학 그룹에 대해 구별될 수 있습니다.전자기기에서는 피리딘이 방향족 특성을 발현하는 곳에서 친전자성 치환이 이루어집니다.친핵체에서 피리딘은 2번과 4번 위치에서 반응하므로 이민과 카보닐과 유사하게 작용합니다.많은 루이스 산들과의 반응은 피리딘의 질소 원자를 더하게 하는데, 이것은 3차 아민의 반응성과 유사합니다.피리딘과 그 유도체가 산화하여 아민 산화물(N-산화물)을 형성하는 능력도 3차 아민의 특징입니다.[78]
피리딘의 질소 중심은 기본적인 외톨이 전자쌍을 특징으로 합니다.이 단독 쌍은 방향족 π계 고리와 겹치지 않으므로 피리딘은 기본이고 3차 아민과 유사한 화학적 특성을 갖습니다.양성자화는 피리디늄, CHNH를55+ 생성합니다.컨쥬게이트 산(피리디늄 양이온)의a pK는 5.25입니다.피리딘과 피리디늄의 구조는 거의 같습니다.[79]피리디늄 양이온은 벤젠과 등전자성입니다.피리딘 p-톨루엔술폰산(PPTS)은 피리딘에 p-톨루엔술폰산을 처리하여 생성되는 대표적인 피리디늄 염.피리딘은 양성자화 이외에도 N-중심 알킬화, 아실화, N-산화를 겪습니다.피리딘 및 폴리(4-비닐) 피리딘은 UV 조사에서 현저한 폴리에니민 구조의 전도성 분자 와이어를 형성하는 것으로 나타났으며, 이는 노화된 피리딘 샘플에 의한 가시광 흡수의 적어도 일부를 차지합니다.이러한 와이어는 이론적으로 매우 효율적인 전자 공여체와 수용체 모두로 예측되어 왔지만 공기 산화에 대해서는 저항력이 있습니다.[80]
친전자성 치환
방향족계의 전자 밀도 감소로 인해 피리딘과 그 유도체에서는 친전자성 치환이 억제됩니다.프리델-크래프트 알킬화 또는 아실화는 질소 원자에서 첨가만 유도하기 때문에 피리딘의 경우 일반적으로 실패합니다.치환은 일반적으로 고리에서 가장 전자가 풍부한 탄소 원자인 3-위치에서 발생하며 따라서 친전자성 첨가에 더 취약합니다.



피리딘의 직접적인 질화가 부진합니다.[81][82]질소 원자가 입체적으로 및/또는 전자적으로 스크리닝된 피리딘 유도체는 니트로늄 테트라플루오로보레이트(NObF)와의 질화에 의해 수득될 수 있습니다.24이러한 방식으로, 3-니트로피리딘은 2,6-디브로모피리딘의 합성을 통해 얻을 수 있고, 이어서 질화 및 탈색을 통해 얻을 수 있습니다.[83][84]
피리딘의 술폰화는 질화보다 훨씬 더 어렵습니다.그러나 피리딘-3-설폰산은 얻을 수 있습니다.SO3 그룹과의 반응은 특히 수은이 존재할 때 질소 원자에 황을 첨가하는 것을 용이하게 합니다.II) 황산염 촉매.[76][85]
느린 질산염과 술폰화와는 대조적으로 피리딘의 브롬화와 염소화는 잘 진행됩니다.[2]

피리딘 N-옥사이드

피리딘의 산화는 질소에서 일어나 피리딘 N-산화물을 만듭니다.산화는 과산에 의해 이루어질 수 있습니다.[86]
- CHN + RCOH → CHNO + RCOH
피리딘의 일부 친전자성 치환은 피리딘 N-산화물을 사용하여 유용하게 효과를 얻은 후 탈산소화됩니다.산소 첨가는 질소 원자에서의 추가 반응을 억제하고 2-탄소와 4-탄소에서의 치환을 촉진합니다.그리고 나서 산소 원자는 아연 먼지를 사용하여 제거될 수 있습니다.[87]
친핵성 치환
벤젠 고리와는 대조적으로 피리딘은 몇 가지 친핵성 치환을 효율적으로 지원합니다.그 이유는 고리의 탄소 원자의 전자 밀도가 상대적으로 낮기 때문입니다.이러한 반응에는 수소 이온의 제거를 통한 치환과 중간 아라인 구성의 형성을 통한 제거-첨가가가 포함되며, 보통 2-위치 또는 4-위치에서 진행됩니다.[76][77]



많은 친핵성 치환은 맨 피리딘이 아니라 브롬, 염소, 불소 또는 술폰산 조각으로 변형된 피리딘으로 더 쉽게 발생하며 이후 이탈 그룹이 됩니다.따라서 불소는 유기 리튬 화합물로 치환할 수 있는 가장 좋은 이탈 그룹입니다.친핵성 공격 화합물은 알콕사이드, 티올레이트, 아민 및 암모니아(상승된 압력에서)일 수 있습니다.[88]
일반적으로 수소화 이온은 불량한 이탈 그룹이며 몇 가지 헤테로고리 반응에서만 발생합니다.그것들은 2-위치에서 아민화된 피리딘 유도체를 생성하는 치치바빈 반응을 포함합니다.여기서 아미드 나트륨은 2-아미노피리딘을 생산하는 친핵체로 사용됩니다.이 반응에서 방출되는 수소 이온은 사용 가능한 아미노기의 양성자와 결합하여 수소 분자를 형성합니다.[77][89]
벤젠과 유사하게 피리딘에 대한 친핵성 치환은 헤테로아린으로 피리딘 중간체를 형성할 수 있습니다.이러한 목적으로 피리딘 유도체는 나트륨 및 칼륨 tert-butoxide와 같은 강력한 염기를 사용하여 좋은 이탈 그룹으로 제거될 수 있습니다.삼중 결합에 친핵체를 추가하는 것은 선택성이 낮으며, 그 결과 두 가지 가능한 부가물의 혼합입니다.[76]
라디칼 반응
피리딘은 일련의 라디칼 반응을 지원하며, 이는 비피리딘으로 이량체화하는 데 사용됩니다.피리딘과 원소 나트륨 또는 라이니 니켈을 라디칼 이량체화하면 화학 산업에서 중요한 전구체 시약인 [91]4,4'-비피리딘 또는 [90]2,2'-비피리딘이 선택적으로 생성됩니다.활성산소와 관련된 이름 반응 중 하나가 미니시 반응입니다.97%의 수율로 피리딘과 황산의 피발산, 질산은 및 암모늄을 반응시키면 2-tert-butylpyridine을 생성할 수 있습니다.[76]
질소 원자에 대한 반응

루이스 산은 피리딘의 질소 원자에 쉽게 첨가되어 피리디늄 염을 형성합니다.알킬할라이드와의 반응은 질소 원자의 알킬화를 야기합니다.이것은 산화와 환원에 대한 피리딘의 반응성을 증가시키는 양전하를 고리에 생성합니다.아연케 반응은 피리디늄 화합물에 라디칼을 선택적으로 도입하는 데 사용됩니다(화학 원소 아연과는 관련이 없음).
수소화 및 환원

피페리딘은 니켈, 코발트, 루테늄 기반 촉매와 함께 피리딘의 수소화 반응에 의해 높은 온도에서 생성됩니다.[92]피리딘을 피페리딘으로 수소화하면 193.8 kJ·mol이−1 방출되는데,[93] 이는 벤젠의 수소화 에너지(205.3 kJ·mol−1)보다 약간 작습니다.[93]
부분 수소화 유도체는 온화한 조건에서 얻어집니다.예를 들어, 리튬 알루미늄 하이드라이드로 환원하면 1,4-디히드로피리딘, 1,2-디히드로피리딘 및 2,5-디히드로피리딘의 혼합물이 생성됩니다.[94]1,4-디히드로피리딘의 선택적 합성은 마그네슘과 아연의 유기금속 복합체의 존재하에서 달성되며, (δ3,4)-테트라히드로피리딘은 피리딘의 전기화학적 환원에 의해 얻어집니다.자작나무 환원은 피리딘을 디히드로피리딘으로 전환시킵니다.[97]
루이스 염기성 및 배위화합물
피리딘은 루이스 염기로, 루이스 산에 전자쌍을 기증합니다.그것의 Lewis 기저 특성은 ECW 모델에서 논의됩니다.다른 Lewis 염기와 비교하여 일련의 산에 대한 상대적인 공여 강도는 C-B 플롯으로 설명할 수 있습니다.[98][99]하나의 예는 알코올을 황산 에스테르로 전환하는 데 사용되는 황화제인 삼산화 피리딘 복합체(융점 175 ℃)입니다.피리딘-보란(CHNBH553, 녹는점 10-11 °C)은 순한 환원제입니다.

전이금속 피리딘 복합체는 매우 많습니다.[100][101]전형적인 팔면체 복합체는 화학양론적 MCl2(py)4과 MCl3(py)을 갖습니다.3유형 M(py)+6의 팔면체 호몰리틱 복합체는 드물거나 피리딘을 해리하는 경향이 있습니다.크랩트리의 촉매와 같은 수많은 사각 평면 복합체들이 알려져 있습니다.[102]반응 중에 교체된 피리딘 리간드는 반응이 완료된 후 복원됩니다.
η 벤젠 복합체에서 발생하는 η 배위 모드는 질소 중심을 차단하는 입체적으로 방해받는 유도체에서만 관찰됩니다.
적용들
농약 및 의약품
피리딘의 주요 용도는 제초제 파라콰트와 디콰트의 전구체입니다.[2]살충제 클로피리포스의 첫 번째 합성 단계는 피리딘의 염소화로 이루어져 있습니다.피리딘은 또한 피리티온계 살균제의 제조를 위한 출발 화합물입니다.[23]세틸피리디늄과 라우릴피리디늄은 징크(Zincke) 반응으로 피리딘(pyridine)으로부터 생성될 수 있으며, 구강 및 치과용 케어 제품에서 방부제로 사용됩니다.[104]피리딘은 알킬화제에 의해 쉽게 공격되어 N-알킬피리디늄 염을 제공합니다.하나의 예는 세틸피리디늄 클로라이드 입니다.

면화의 네트워크 용량을 향상시키기 위해 섬유 산업에서도 사용됩니다.[104]
실험실사용
피리딘은 극성, 염기성, 반응성이 낮은 용매로 사용되며, 예를 들어 크노베나겔 축합에서 사용됩니다.[23][106]특히 탈할로겐화에 적합하며, 탈할로겐화 반응의 염기로 작용합니다.에스테르화와 아실화에서 피리딘은 카르복실산 염화물과 무수물을 활성화시킵니다.이러한 반응에서 더욱 활성화된 것은 유도체 4-디메틸아미노피리딘(DMAP) 및 4-(1-피롤리디닐) 피리딘입니다.피리딘은 또한 일부 축합 반응에서 염기로 사용됩니다.[107]

시약

염기로는 칼 피셔 시약으로 피리딘을 사용할 수 있지만, 보통 이미다졸과 같이 보다 쾌적한 냄새를 가진 대체제로 대체됩니다.[108]
클로로크롬산 피리디늄, 다이크롬산 피리디늄, 콜린스 시약(산화크롬의 복합체)은 알코올의 산화에 사용됩니다.[109]
유해성
피리딘은 강하고 불쾌한 비린내를 가진 독성이 있는 가연성 액체입니다.0.04~20ppm의 악취 임계값은 악영향에 대한 임계값 한계치인 5ppm에 가깝기 [110]때문에 대부분의 성인(모든 성인은 아니지만)이 언제 유해 수준에 있는지 알 수 있습니다.피리딘은 물에 쉽게 녹고 수생 시스템에서 동식물 모두에게 해를 끼칩니다.[111]
불
피리딘은 인화점이 20°C이므로 인화성이 높습니다.연소는 바이피리딘, 질소산화물, 일산화탄소를 포함할 수 있는 유독 가스를 생성합니다.[12]
단기노출
피리딘은 피부에 닿으면 화학적 화상을 일으킬 수 있으며, 연기가 눈이나 흡입 시 자극적일 수 있습니다.[112]피리딘은 3600ppm 이상의 증기 농도에 중독되는 것과 유사한 증상을 일으키며 건강에 더 큰 위험을 주는 신경계를 억제합니다.[2]그 영향은 몇 시간 지연된 시작을 가질 수 있고 어지러움, 두통, 조정력 부족, 메스꺼움, 침, 식욕 감퇴를 포함합니다.복통, 폐 울혈, 의식불명으로 진행될 수도 있습니다.[113]피리딘 섭취에 대한 인간의 가장 낮은 치사량(LDLo)은 500mg·kg입니다−1.
장기노출
피리딘에 장기간 노출되면 간, 심장, 신장이 손상될 수 있습니다.[12][23][114]피리딘의 발암 가능성이 있는 물질로 평가한 결과 피리딘의 발암성에 대해서는 실험동물에서 충분한 증거가 있음에도 불구하고 사람에게서는 증거가 불충분함을 보여주었습니다.따라서 IARC는 피리딘을 사람에게 발암 가능성이 있는 것으로 간주합니다(그룹 2B).[115]
발생
담배 연기에서 최대 16 µg·m의 미량이 검출됐습니다.소량의 피리딘은 철강 제조,[116] 오일 셰일 가공, 석탄 가스화, 코크스 공장 및 소각로와 같은 일부 산업 공정에서 환경으로 방출됩니다.[23]오일 셰일 가공 공장의 대기는 최대 13 µg·m의 피리딘 농도를 포함할 수 있으며 석탄 가스화 공장 인근 지하수에서는 53 µg·m 수준이 측정되었습니다.미국 국립산업안전보건연구소의 연구에 따르면, 약 43,000명의 미국인들이 피리딘과 접촉하여 일하고 있습니다.[119]
음식에서
피리딘은 역사적으로 쓴 맛을 내기 위해 음식에 첨가되어 왔지만, 이 관행은 현재 미국에서는 금지되어 있습니다.[120][121] 그것은 여전히 마시기에 부적합하도록 만들기 위해 에탄올에 첨가될 수 있습니다.[104]
신진대사
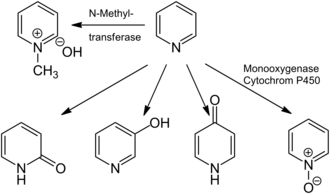
피리딘에 노출되면 일반적으로 피리딘은 폐와 위장관에서 흡입 및 흡수가 일어나며, 피리딘은 변하지 않거나 대사됩니다.피리딘 대사의 주요 생성물은 N-메틸트랜스퍼라제(예를 들어, 피리딘 N-메틸트랜스퍼라제)에 의해 형성되는 N-메틸피리디늄하이드록사이드(N-methylpyridinium hydroxide)와, 모노옥시제나제의 작용에 의해 생성되는 2-, 3-, 4-하이드록시피리딘.인간에서 피리딘은 N-메틸피리디늄하이드록사이드로만 대사됩니다.[12][114]
환경운명
피리딘은 세균에 의해 암모니아와 이산화탄소로 쉽게 분해됩니다.[122]비치환된 피리딘 고리는 피콜린, 루티딘, 클로로피리딘 또는 아미노피리딘보다 더 빠르게 분해되고,[123] 다수의 피리딘 분해제는 피리딘의 존재 하에서 리보플라빈을 과잉 생성하는 것으로 나타났습니다.[124]피리딘을 포함한 이온화 가능한 N-헤테로고리 화합물은 토양 유기물로의 분할, 양이온 교환 및 표면 복합체화를 포함한 다양한 pH 의존적 메커니즘을 통해 환경 표면(토양 및 퇴적물 등)과 상호작용합니다.[125]표면에 대한 이러한 흡착은 미생물 분해제와 다른 생물체에 대한 피리딘의 생체이용률을 감소시켜 분해 속도를 늦추고 생태 독성을 감소시킵니다.[126]
명명법
피리딘의 계통명은 IUPAC에서 권장하는 한츠쉬-위드만 명명법에 포함되어 있으며, 아지노선입니다.그러나 단순한 화합물에 대한 체계적인 이름은 매우 드물게 사용됩니다. 대신 헤테로고리 명명법은 역사적으로 확립된 공통 이름을 따릅니다.IUPAC는 피리딘을 선호하여 아진/아진의 사용을 억제합니다.[127]피리딘의 고리 원자 번호는 질소에서 시작됩니다(정보 상자 참조).그리스 문자(α-γ)에 의한 위치의 할당과 호모아로마틱 시스템(ortho, meta, para)에 대해 일반적인 치환 패턴 명명법이 때때로 사용됩니다.여기서 α(ortho), β(메타), γ(para)는 각각 2, 3, 4 위치를 의미합니다.피리딘 유도체의 계통명은 피리디닐이며, 치환된 원자의 위치는 숫자 앞에 나옵니다.그러나, 피리딜이라는 역사적인 이름은 IUPAC에 의해 권장되고 체계적인 이름 대신 사용됩니다.[128]질소 원자에 전기영동체를 첨가하여 형성된 양이온 유도체를 피리디늄이라고 합니다.
참고 항목
- 하나의 탄소가 다른 그룹으로 대체된 6-memb 방향족 고리: 보라벤젠, 실라벤젠, 게르마벤젠, 스타나벤젠, 피리딘, 포스포린, 아르사벤젠, 스티바벤젠, 비스마벤젠, 피릴륨, 티오필륨, 셀레노피릴륨, 텔루로피릴륨
- 두 개의 질소 원자를 가진 6개의 memb 고리: 디아진
- 3개의 질소 원자를 가진 6개의 memb 고리: 트리아진
- 4개의 질소 원자를 가진 6개의 memb 고리: 테트라진
- 5개의 질소 원자를 가진 6개의 memb 고리: 펜타진
- 6개의 질소 원자를 가진 6개의 memb 고리: 헥사진
참고문헌
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 141. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d e f g h i j k Shimizu, S.; Watanabe, N.; Kataoka, T.; Shoji, T.; Abe, N.; Morishita, S.; Ichimura, H. "Pyridine and Pyridine Derivatives". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_399.
- ^ a b c d e f NIOSH Pocket Guide to Chemical Hazards. "#0541". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c d e 헤인즈, 페이지 3.474
- ^ 헤인즈, 페이지 5.176
- ^ 헤인즈, 페이지 5.95
- ^ 헤인즈, 페이지 3.579
- ^ 헤인즈, 페이지 6.258
- ^ 헤인즈, 페이지 6.246
- ^ 헤인즈, 페이지 9.65
- ^ 헤인즈, 페이지 5.34, 5.67
- ^ a b c d e f 산업안전보건연구원 GESTIS 물질 데이터베이스의 피리딘 기록
- ^ 피리딘(Pyridine): 주요 위험, 주의사항 및 독성
- ^ a b "Pyridine". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Pyridine MSDS". fishersci.com. Fisher.
- ^ a b 헤인즈, 페이지 15.19
- ^ Vaganova, Evgenia; Eliaz, Dror; Shimanovich, Ulyana; Leitus, Gregory; Aqad, Emad; Lokshin, Vladimir; Khodorkovsky, Vladimir (January 2021). "Light-Induced Reactions within Poly(4-vinyl pyridine)/Pyridine Gels: The 1,6-Polyazaacetylene Oligomers Formation". Molecules. 26 (22): 6925. doi:10.3390/molecules26226925. ISSN 1420-3049. PMC 8621047. PMID 34834017.
- ^ a b Cox, E. (1958). "Crystal Structure of Benzene". Reviews of Modern Physics. 30 (1): 159–162. Bibcode:1958RvMP...30..159C. doi:10.1103/RevModPhys.30.159.
- ^ 헤인즈, 페이지 6.80
- ^ McCullough, J. P.; Douslin, D. R.; Messerly, J. F.; Hossenlopp, I. A.; Kincheloe, T. C.; Waddington, Guy (1957). "Pyridine: Experimental and Calculated Chemical Thermodynamic Properties between 0 and 1500 K.; a Revised Vibrational Assignment". Journal of the American Chemical Society. 79 (16): 4289. doi:10.1021/ja01573a014.
- ^ Mootz, D. (1981). "Crystal structures of pyridine and pyridine trihydrate". The Journal of Chemical Physics. 75 (3): 1517–1522. Bibcode:1981JChPh..75.1517M. doi:10.1063/1.442204.
- ^ 줄, 페이지 16
- ^ a b c d e f g h Pyridine (PDF). 1985.
{{cite book}}:work=무시됨(도움말) - ^ 줄, 7쪽
- ^ Sundberg, Francis A. Carey; Richard J. (2007). Advanced Organic Chemistry : Part A: Structure and Mechanisms (5. ed.). Berlin: Springer US. p. 794. ISBN 978-0-387-68346-1.
{{cite book}}: CS1 유지 : 여러 이름 : 저자 목록 (링크) - ^ Weissberger, A.; Klingberg, A.; Barnes, R. A.; Brody, F.; Ruby, P.R. (1960). Pyridine and its Derivatives. Vol. 1. New York: Interscience.
- ^ Anderson, Thomas (1849). "On the constitution and properties of picoline, a new organic base from coal-tar". Transactions of the Royal Societies of Edinburgh University. 16 (2): 123–136. doi:10.1017/S0080456800024984. S2CID 100301190.
- ^ a b Anderson, T. (1849). "Producte der trocknen Destillation thierischer Materien" [Products of the dry distillation of animal matter]. Annalen der Chemie und Pharmacie (in German). 70: 32–38. doi:10.1002/jlac.18490700105.
- ^ Anderson, Thomas (1851). "On the products of the destructive distillation of animal substances. Part II". Transactions of the Royal Society of Edinburgh. 20 (2): 247–260. doi:10.1017/S0080456800033160. S2CID 102143621. 253쪽: "피리딘.이 기지들 중 첫번째로 피리딘이라는 이름을 붙인 것은…"
- ^ Anderson, T. (1851). "Ueber die Producte der trocknen Destillation thierischer Materien" [On the products of dry distillation of animal matter]. Annalen der Chemie und Pharmacie (in German). 80: 44–65. doi:10.1002/jlac.18510800104.
- ^ Koerner, W. (1869). "Synthèse d'une base isomère à la toluidine" [Synthesis of a base [that is] isomeric to toluidine]. Giornale di Scienze Naturali ed Economiche (Journal of Natural Science and Economics (Palermo, Italy)) (in French). 5: 111–114.
- ^ Dewar, James (27 January 1871). "On the oxidation products of picoline". Chemical News. 23: 38–41.
- ^ Rocke, Alan J. (1988). "Koerner, Dewar and the Structure of Pyridine". Bulletin for the History of Chemistry. 2: 4.

- ^ Ladenburg, Albert. Lectures on the history of the development of chemistry since the time of Lavoisier. (PDF). pp. 283–287.

- ^ Bansal, Raj K. (1999). Heterocyclic Chemistry. New Age International. p. 216. ISBN 81-224-1212-2.
- ^ Ladenburg, A. (1884). "Synthese des Piperidins" [Synthesis of piperidine]. Berichte der Deutschen Chemischen Gesellschaft (in German). 17: 156. doi:10.1002/cber.18840170143.
- ^ Ladenburg, A. (1884). "Synthese des Piperidins und seiner Homologen" [Synthesis of piperidine and its homologues]. Berichte der Deutschen Chemischen Gesellschaft (in German). 17: 388–391. doi:10.1002/cber.188401701110.
- ^ Ramsay, William (1876). "On picoline and its derivatives". Philosophical Magazine. 5th series. 2 (11): 269–281. doi:10.1080/14786447608639105.
- ^ "A. Henninger, aus Paris. 12. April 1877". Berichte der Deutschen Chemischen Gesellschaft (Correspondence). 10: 727–737. 1877. doi:10.1002/cber.187701001202.
- ^ Hantzsch, A. (1881). "Condensationsprodukte aus Aldehydammoniak und ketonartigen Verbindungen" [Condensation products from aldehyde ammonia and ketone-type compounds]. Berichte der Deutschen Chemischen Gesellschaft. 14 (2): 1637–1638. doi:10.1002/cber.18810140214.
- ^ Knoevenagel, E.; Fries, A. (1898). "Synthesen in der Pyridinreihe. Ueber eine Erweiterung der Hantzsch'schen Dihydropyridinsynthese" [Syntheses in the pyridine series. On an extension of the Hantzsch dihydropyridine synthesis]. Berichte der Deutschen Chemischen Gesellschaft. 31: 761–767. doi:10.1002/cber.189803101157.
- ^ a b Chichibabin, A. E. (1924). "Über Kondensation der Aldehyde mit Ammoniak zu Pyridinebasen" [On condensation of aldehydes with ammonia to make pyridines]. Journal für Praktische Chemie. 107: 122. doi:10.1002/prac.19241070110.
- ^ Burdock, G. A., ed. (1995). Fenaroli's Handbook of Flavor Ingredients. Vol. 2 (3rd ed.). Boca Raton: CRC Press. ISBN 0-8493-2710-5.
- ^ Täufel, A.; Ternes, W.; Tunger, L.; Zobel, M. (2005). Lebensmittel-Lexikon (4th ed.). Behr. p. 450. ISBN 3-89947-165-2.
- ^ Tang, Jian; Jin, Qi Zhang; Shen, Guo Hui; Ho, Chi Tang; Chang, Stephen S. (1983). "Isolation and identification of volatile compounds from fried chicken". Journal of Agricultural and Food Chemistry. 31 (6): 1287. doi:10.1021/jf00120a035.
- ^ Shibamoto, Takayuki; Kamiya, Yoko; Mihara, Satoru (1981). "Isolation and identification of volatile compounds in cooked meat: sukiyaki". Journal of Agricultural and Food Chemistry. 29: 57–63. doi:10.1021/jf00103a015.
- ^ Aeschbacher, HU; Wolleb, U; Löliger, J; Spadone, JC; Liardon, R (1989). "Contribution of coffee aroma constituents to the mutagenicity of coffee". Food and Chemical Toxicology. 27 (4): 227–232. doi:10.1016/0278-6915(89)90160-9. PMID 2659457.
- ^ Buttery, Ron G.; Seifert, Richard M.; Guadagni, Dante G.; Ling, Louisa C. (1971). "Characterization of Volatile Pyrazine and Pyridine Components of Potato Chips". Journal of Agricultural and Food Chemistry. Washington, DC: ACS. 19 (5): 969–971. doi:10.1021/jf60177a020.
- ^ Ho, Chi Tang; Lee, Ken N.; Jin, Qi Zhang (1983). "Isolation and identification of volatile flavor compounds in fried bacon". Journal of Agricultural and Food Chemistry. 31 (2): 336. doi:10.1021/jf00116a038.
- ^ Dumont, Jean Pierre; Adda, Jacques (1978). "Occurrence of sesquiterpene in mountain cheese volatiles". Journal of Agricultural and Food Chemistry. 26 (2): 364. doi:10.1021/jf60216a037.
- ^ Labows, John N. Jr.; Warren, Craig B. (1981). "Odorants as Chemical Messengers". In Moskowitz, Howard R. (ed.). Odor Quality and Chemical Structure. Washington, DC: American Chemical Society. pp. 195–210. doi:10.1021/bk-1981-0148.fw001. ISBN 9780841206076.
- ^ Vitzthum, Otto G.; Werkhoff, Peter; Hubert, Peter (1975). "New volatile constituents of black tea flavor". Journal of Agricultural and Food Chemistry. 23 (5): 999. doi:10.1021/jf60201a032.
- ^ Kostelc, J. G.; Preti, G.; Nelson, P. R.; Brauner, L.; Baehni, P. (1984). "Oral Odors in Early Experimental Gingivitis". Journal of Periodontal Research. 19 (3): 303–312. doi:10.1111/j.1600-0765.1984.tb00821.x. PMID 6235346.
- ^ Täufel, A.; Ternes, W.; Tunger, L.; Zobel, M. (2005). Lebensmittel-Lexikon (4th ed.). Behr. p. 226. ISBN 3-89947-165-2.
- ^ Gossauer, A. (2006). Struktur und Reaktivität der Biomoleküle. Weinheim: Wiley-VCH. p. 488. ISBN 3-906390-29-2.
- ^ "Pyridine's Development in China". AgroChemEx. 11 May 2010. Archived from the original on 20 September 2018. Retrieved 7 January 2011.
- ^ "About Vertellus". vertellus.com. Archived from the original on 18 September 2012. Retrieved 7 January 2011.
- ^ Frank, R. L.; Seven, R. P. (1949). "Pyridines. IV. A Study of the Chichibabin Synthesis". Journal of the American Chemical Society. 71 (8): 2629–2635. doi:10.1021/ja01176a008.
- ^ DE 특허 1917037, Swift, Graham, "Verfahren zur Hersstellung von Pyridin und Methylpyridinen", 1968년 발표
- ^ JP 특허 7039545, 일본 카야쿠, "전기 보조 자전거, 그 구동 시스템 및 제조 방법" 1967년 발표
- ^ BE 특허 758201, Koei Chemical, "Procede de preparation de bas pyridique", 1969년 발행
- ^ Mensch, F. (1969). "Hydrodealkylierung von Pyridinbasen bei Normaldruck". Erdöl Kohle Erdgas Petrochemie. 2: 67–71.
- ^ Scott, T. A. (1967). "A method for the Degradation of Radioactive Nicotinic Acid". Biochemical Journal. 102 (1): 87–93. doi:10.1042/bj1020087. PMC 1270213. PMID 6030305.
- ^ Behr, A. (2008). Angewandte homogene Katalyse. Weinheim: Wiley-VCH. p. 722. ISBN 978-3-527-31666-3.
- ^ Kroehnke, Fritz (1976). "The Specific Synthesis of Pyridines and Oligopyridines". Synthesis. 1976 (1): 1–24. doi:10.1055/s-1976-23941. S2CID 95238046..
- ^ Ciamician, G. L.; Dennstedt, M. (1881). "Ueber die Einwirkung des Chloroforms auf die Kaliumverbindung Pyrrols". Berichte der Deutschen Chemischen Gesellschaft. 14 (1): 1153–1163. doi:10.1002/cber.188101401240. ISSN 0365-9496.
- ^ Skell, P. S.; Sandler, R. S. (1958). "Reactions of 1,1-Dihalocyclopropanes with Electrophilic Reagents. Synthetic Route for Inserting a Carbon Atom Between the Atoms of a Double Bond". Journal of the American Chemical Society. 80 (8): 2024. doi:10.1021/ja01541a070.
- ^ Jones, R. L.; Rees, C. W. (1969). "Mechanism of heterocyclic ring expansions. Part III. Reaction of pyrroles with dichlorocarbene". Journal of the Chemical Society C: Organic (18): 2249. doi:10.1039/J39690002249.
- ^ Gambacorta, A.; Nicoletti, R.; Cerrini, S.; Fedeli, W.; Gavuzzo, E. (1978). "Trapping and structure determination of an intermediate in the reaction between 2-methyl-5-t-butylpyrrole and dichlorocarbene". Tetrahedron Letters. 19 (27): 2439. doi:10.1016/S0040-4039(01)94795-1.
- ^ Gattermann, L.; Skita, A. (1916). "Eine Synthese von Pyridin-Derivaten" [A synthesis of pyridine derivatives]. Chemische Berichte. 49 (1): 494–501. doi:10.1002/cber.19160490155.
- ^ "Gattermann–Skita". Institute of Chemistry, Skopje. Archived from the original on 16 June 2006.
- ^ Karpeiskii, Y.; Florent'ev V. L. (1969). "Condensation of Oxazoles with Dienophiles — a New Method for the Synthesis of Pyridine Bases". Russian Chemical Reviews. 38 (7): 540–546. Bibcode:1969RuCRv..38..540K. doi:10.1070/RC1969v038n07ABEH001760. S2CID 250852496.
- ^ Tarr, J. B.; Arditti, J. (1982). "Niacin Biosynthesis in Seedlings of Zea mays". Plant Physiology. 69 (3): 553–556. doi:10.1104/pp.69.3.553. PMC 426252. PMID 16662247.
- ^ Sundberg, Francis A. Carey; Richard J. (2007). Advanced Organic Chemistry : Part A: Structure and Mechanisms (5. ed.). Berlin: Springer US. p. 794. ISBN 978-0-387-68346-1.
{{cite book}}: CS1 유지 : 여러 이름 : 저자 목록 (링크) - ^ Campaigne, E. (1986). "Adrien Albert and the Rationalization of Heterocyclic chemistry". J. Chem. Educ. 63 (10): 860. Bibcode:1986JChEd..63..860C. doi:10.1021/ed063p860.
- ^ a b c d e 줄, 페이지 125–141
- ^ a b c Davies, D. T. (1992). Aromatic Heterocyclic Chemistry. Oxford University Press. ISBN 0-19-855660-8.
- ^ Milcent, R.; Chau, F. (2002). Chimie organique hétérocyclique: Structures fondamentales. EDP Sciences. pp. 241–282. ISBN 2-86883-583-X.
- ^ Krygowski, T. M.; Szatyowicz, H.; Zachara, J. E. (2005). "How H-bonding Modifies Molecular Structure and π-Electron Delocalization in the Ring of Pyridine/Pyridinium Derivatives Involved in H-Bond Complexation". J. Org. Chem. 70 (22): 8859–8865. doi:10.1021/jo051354h. PMID 16238319.
- ^ Vaganova, Evgenia; Eliaz, Dror; Shimanovich, Ulyana; Leitus, Gregory; Aqad, Emad; Lokshin, Vladimir; Khodorkovsky, Vladimir (January 2021). "Light-Induced Reactions within Poly(4-vinyl pyridine)/Pyridine Gels: The 1,6-Polyazaacetylene Oligomers Formation". Molecules. 26 (22): 6925. doi:10.3390/molecules26226925. ISSN 1420-3049. PMC 8621047. PMID 34834017.
- ^ Bakke, Jan M.; Hegbom, Ingrid (1994). "Dinitrogen Pentoxide-Sulfur Dioxide, a New nitrate ion system". Acta Chemica Scandinavica. 48: 181–182. doi:10.3891/acta.chem.scand.48-0181.
- ^ Ono, Noboru; Murashima, Takashi; Nishi, Keiji; Nakamoto, Ken-Ichi; Kato, Atsushi; Tamai, Ryuji; Uno, Hidemitsu (2002). "Preparation of Novel Heteroisoindoles from nitropyridines and Nitropyridones". Heterocycles. 58: 301. doi:10.3987/COM-02-S(M)22.
- ^ Duffy, Joseph L.; Laali, Kenneth K. (1991). "Aprotic Nitration (NO+
2BF−
4) of 2-Halo- and 2,6-Dihalopyridines and Transfer-Nitration Chemistry of Their N-Nitropyridinium Cations". The Journal of Organic Chemistry. 56 (9): 3006. doi:10.1021/jo00009a015. - ^ 줄, 페이지 126
- ^ Möller, Ernst Friedrich; Birkofer, Leonhard (1942). "Konstitutionsspezifität der Nicotinsäure als Wuchsstoff bei Proteus vulgaris und Streptobacterium plantarum" [Constitutional specificity of nicotinic acid as a growth factor in Proteus vulgaris and Streptobacterium plantarum]. Berichte der Deutschen Chemischen Gesellschaft (A and B Series). 75 (9): 1108. doi:10.1002/cber.19420750912.
- ^ Mosher, H. S.; Turner, L.; Carlsmith, A. (1953). "Pyridine-N-oxide". Org. Synth. 33: 79. doi:10.15227/orgsyn.033.0079.
- ^ Campeau, Louis-Charles; Fagnou, Keith (2011). "Synthesis of 2-aryl Pyridines By Palladium-catalyzed Direct Arylation of Pyridine N-oxides". Org. Synth. 88: 22. doi:10.15227/orgsyn.088.0022.
- ^ 줄, 133쪽
- ^ Shreve, R. Norris; Riechers, E. H.; Rubenkoenig, Harry; Goodman, A. H. (1940). "Amination in the Heterocyclic Series by Sodium amide". Industrial & Engineering Chemistry. 32 (2): 173. doi:10.1021/ie50362a008.
- ^ Badger, G; Sasse, W (1963). The Action of Metal Catalysts on Pyridines. Advances in Heterocyclic Chemistry. Vol. 2. pp. 179–202. doi:10.1016/S0065-2725(08)60749-7. ISBN 9780120206025. PMID 14279523.
- ^ Sasse, W. H. F. (1966). "2,2'-bipyridine" (PDF). Organic Syntheses. 46: 5–8. doi:10.1002/0471264180.os046.02. ISBN 0471264229. Archived from the original (PDF) on 21 January 2012.
- ^ Eller, K.; Henkes, E.; Rossbacher, R.; Hoke, H. "Amines, aliphatic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH.
- ^ a b Cox, J. D.; Pilcher, G. (1970). Thermochemistry of Organic and Organometallic Compounds. New York: Academic Press. pp. 1–636. ISBN 0-12-194350-X.
- ^ Tanner, Dennis D.; Yang, Chi Ming (1993). "On the structure and mechanism of formation of the Lansbury reagent, lithium tetrakis(N-dihydropyridyl) aluminate". The Journal of Organic Chemistry. 58 (7): 1840. doi:10.1021/jo00059a041.
- ^ De Koning, A.; Budzelaar, P. H. M.; Boersma, J.; Van Der Kerk, G. J. M. (1980). "Specific and selective reduction of aromatic nitrogen heterocycles with the bis-pyridine complexes of bis(1,4-dihydro-1-pyridyl)zinc and bis(1,4-dihydro-1-pyridyl)magnesium". Journal of Organometallic Chemistry. 199 (2): 153. doi:10.1016/S0022-328X(00)83849-8.
- ^ Ferles, M. (1959). "Studies in the pyridine series. II. Ladenburg and electrolytic reductions of pyridine bases". Collection of Czechoslovak Chemical Communications. Institute of Organic Chemistry & Biochemistry. 24 (4): 1029–1035. doi:10.1135/cccc19591029.
- ^ Donohoe, Timothy J.; McRiner, Andrew J.; Sheldrake, Peter (2000). "Partial Reduction of Electron-Deficient Pyridines". Organic Letters. 2 (24): 3861–3863. doi:10.1021/ol0065930. PMID 11101438.
- ^ Laurence, C. and Gal, J-F. (2010) Lewis Basicity and Affinity Scales, Data and Measurement.와일리 50-51쪽ISBN 978-0-470-74957-9
- ^ Cramer, R. E.; Bopp, T. T. (1977). "Graphical display of the enthalpies of adduct formation for Lewis acids and bases". Journal of Chemical Education. 54: 612–613. doi:10.1021/ed054p612. 이 문서에 표시된 그림은 오래된 모수를 사용했습니다.ECW 모델에는 개선된 E&C 파라미터가 나열되어 있습니다.
- ^ Nakamoto, K. (1997). Infrared and Raman spectra of Inorganic and Coordination compounds. Part A (5th ed.). Wiley. ISBN 0-471-16394-5.
- ^ Nakamoto, K. (31 July 1997). Infrared and Raman spectra of Inorganic and Coordination compounds. Part B (5th ed.). p. 24. ISBN 0-471-16392-9.
- ^ Crabtree, Robert (1979). "Iridium compounds in catalysis". Accounts of Chemical Research. 12 (9): 331–337. doi:10.1021/ar50141a005.
- ^ Elschenbroich, C. (2008). Organometallchemie (6th ed.). Vieweg & Teubner. pp. 524–525. ISBN 978-3-8351-0167-8.
- ^ a b c RÖMPP Online – Version 3.5. 2009.
{{cite book}}:work=무시됨(도움말) - ^ "Environmental and health criteria for paraquat and diquat". Geneva: World Health Organization. 1984.
- ^ Carey, Francis A.; Sundberg, Richard J. (2007). Advanced Organic Chemistry: Part B: Reactions and Synthesis (5th ed.). New York: Springer. p. 147. ISBN 978-0387683546.
- ^ Sherman, A. R. (2004). "Pyridine". In Paquette, L. (ed.). Encyclopedia of Reagents for Organic Synthesis. e-EROS (Encyclopedia of Reagents for Organic Synthesis). New York: J. Wiley & Sons. doi:10.1002/047084289X.rp280. ISBN 0471936235.
- ^ "Wasserbestimmung mit Karl-Fischer-Titration" [Water analysis with the Karl Fischer titration] (PDF). Jena University. Archived from the original (PDF) on 19 July 2011.
- ^ Tojo, G.; Fernandez, M. (2006). Oxidation of alcohols to aldehydes and ketones: a guide to current common practice. New York: Springer. pp. 28, 29, 86. ISBN 0-387-23607-4.
- ^ "Pyridine MSDS" (PDF). Alfa Aesar. Retrieved 3 June 2010.
- ^ "Database of the (EPA)". U.S. Environmental Protection Agency.
- ^ Aylward, G (2008). SI Chemical Data (6th ed.). Wiley. ISBN 978-0-470-81638-7.
- ^ International Agency for Research on Cancer (IARC) (22 August 2000). "Pyridine Summary & Evaluation". IARC Summaries & Evaluations. IPCS INCHEM. Retrieved 17 January 2007.
- ^ a b Bonnard, N.; Brondeau, M. T.; Miraval, S.; Pillière, F.; Protois, J. C.; Schneider, O. (2011). "Pyridine" (PDF). Fiche Toxicologique (in French). INRS.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (2019). Some chemicals that cause tumours of the urinary tract in rodents (PDF). International Agency for Research on Cancer. Lyon, France. pp. 173–198. ISBN 978-92-832-0186-1. OCLC 1086392170.
{{cite book}}: CS1 유지 관리: 위치 누락 게시자(링크) - ^ Junk, G. A.; Ford, C. S. (1980). "A review of organic emissions from selected combustion processes". Chemosphere. 9 (4): 187. Bibcode:1980Chmsp...9..187J. doi:10.1016/0045-6535(80)90079-X. OSTI 5295035.
- ^ Hawthorne, Steven B.; Sievers, Robert E. (1984). "Emissions of organic air pollutants from shale oil wastewaters". Environmental Science & Technology. 18 (6): 483–90. Bibcode:1984EnST...18..483H. doi:10.1021/es00124a016. PMID 22247953.
- ^ Stuermer, Daniel H.; Ng, Douglas J.; Morris, Clarence J. (1982). "Organic contaminants in groundwater near to underground coal gasification site in northeastern Wyoming". Environmental Science & Technology. 16 (9): 582–7. Bibcode:1982EnST...16..582S. doi:10.1021/es00103a009. PMID 22284199.
- ^ National Occupational Exposure Survey 1981–83. Cincinnati, OH: Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute for Occuptional Safety and Health.
- ^ 83 FR 50490
- ^ "FDA Removes 7 Synthetic Flavoring Substances from Food Additives List". 5 October 2018. Retrieved 8 October 2018.
- ^ Sims, G. K.; O'Loughlin, E. J. (1989). "Degradation of pyridines in the environment". CRC Critical Reviews in Environmental Control. 19 (4): 309–340. doi:10.1080/10643388909388372.
- ^ Sims, G. K.; Sommers, L.E. (1986). "Biodegradation of pyridine derivatives in soil suspensions". Environmental Toxicology and Chemistry. 5 (6): 503–509. doi:10.1002/etc.5620050601.
- ^ Sims, G. K.; O'Loughlin, E.J. (1992). "Riboflavin production during growth of Micrococcus luteus on pyridine". Applied and Environmental Microbiology. 58 (10): 3423–3425. Bibcode:1992ApEnM..58.3423S. doi:10.1128/AEM.58.10.3423-3425.1992. PMC 183117. PMID 16348793.
- ^ Bi, E.; Schmidt, T. C.; Haderlein, S. B. (2006). "Sorption of heterocyclic organic compounds to reference soils: column studies for process identification". Environ Sci Technol. 40 (19): 5962–5970. Bibcode:2006EnST...40.5962B. doi:10.1021/es060470e. PMID 17051786.
- ^ O'Loughlin, E. J; Traina, S. J.; Sims, G. K. (2000). "Effects of sorption on the biodegradation of 2-methylpyridine in aqueous suspensions of reference clay minerals". Environmental Toxicology and Chemistry. 19 (9): 2168–2174. doi:10.1002/etc.5620190904. S2CID 98654832.
- ^ Powell, W. H. (1983). "Revision of the extended Hantzsch-Widman system of nomenclature for hetero mono-cycles" (PDF). Pure and Applied Chemistry. 55 (2): 409–416. doi:10.1351/pac198855020409. S2CID 4686578.
- ^ Hellwinkel, D. (1998). Die systematische Nomenklatur der Organischen Chemie (4th ed.). Berlin: Springer. p. 45. ISBN 3-540-63221-2.
서지학
- Sundberg, Francis A. Carey; Richard J. (2007). Advanced Organic Chemistry : Part A: Structure and Mechanisms (5. ed.). Berlin: Springer US. ISBN 978-0-387-68346-1.
{{cite book}}: CS1 유지 : 여러 이름 : 저자 목록 (링크) - Haynes, William M., ed. (2016). CRC Handbook of Chemistry and Physics (97th ed.). CRC Press. ISBN 9781498754293.
- Joule, J. A.; Mills, K. (2010). Heterocyclic Chemistry (5th ed.). Chichester: Blackwell Publishing. ISBN 978-1-4051-3300-5.