큐베인
Cubane| | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 큐베인[1] | |||
| 시스템 IUPAC 이름 펜타사이클로 [4.2.0.03,8.02,5.04,7]옥탄 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
PubChem CID | |||
| 유니 | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C8H8 | |||
| 몰 질량 | 104.15 g/g | ||
| 밀도 | 1.29g/cm3 | ||
| 녹는점 | 133.5 °C (272.3 °F, 406.6 [2]K) | ||
| 비등점 | 161.6°C(322.9°F, 434.8K)[2] | ||
| 관련 화합물 | |||
관련 탄화수소 | 쿠네아네 도데카헤드라인 테트라헤드라인 프리스마네 프리스마네 C8 | ||
관련 화합물 | 옥타플루오로쿠반 옥타니트로쿠반 옥타아자쿠반 | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
큐베인은 입방체의 모서리에 배열된 8개의88 탄소 원자로 구성된 합성 탄화수소 분자로 각 탄소 원자에 수소 원자가 하나씩 붙어 있다.고체 결정성 물질인 큐베인은 플라톤 탄화수소 중 하나이며 프리스마인의 구성원입니다.그것은 1964년 필립 이튼과 토마스 [3]콜에 의해 처음 합성되었다.이 연구가 있기 전에, 연구원들은 입방체 탄소 기반 분자가 [citation needed]존재하기에는 너무 불안정할 것이라고 믿었다.입방체 형태에서는 탄소 원자가 비정상적으로 날카로운 90° 결합 각도를 채택해야 하며, 이는 사면체 탄소의 109.45° 각도에 비해 매우 변형됩니다.큐베인은 일단 형성되면 쉽게 이용할 수 있는 분해 경로가 부족하기 때문에 상당히 동태적으로 안정적입니다.그것은 팔면체 대칭을 가진 가장 단순한 탄화수소이다.
높은 위치 에너지를 가지지만 운동 안정성은 큐베인과 그 유도체 화합물을 에너지 저장 제어에 유용하게 만듭니다.예를 들어 옥타니트로쿠반과 헵타니트로쿠반은 고성능 폭발물로 연구되어 왔다.
이 화합물들은 또한 일반적으로 탄화수소 분자에 대해 매우 높은 밀도를 가지고 있다.결과적으로 높은 에너지 밀도는 많은 양의 에너지를 비교적 작은 공간에 저장할 수 있다는 것을 의미하며, 이는 연료 저장 및 에너지 수송 분야에서 중요한 고려사항이다.
합성
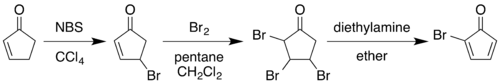
1964년의 전형적인 합성은 2-시클로펜테논을 2-브로모시클로펜타디에논으로 [3][4]변환하는 것으로 시작된다.
사염화탄소 중 N-브로모수시크니미드에 의한 알릴 브롬화에 이어 알켄에 브롬 분자를 첨가함으로써 2,3,4-트리브로모시클로펜타논을 얻을 수 있다.이 화합물을 디에틸에테르에서 디에틸아민으로 처리하면 브롬화수소 2당량을 제거하여 디엔 생성물을 얻을 수 있다.
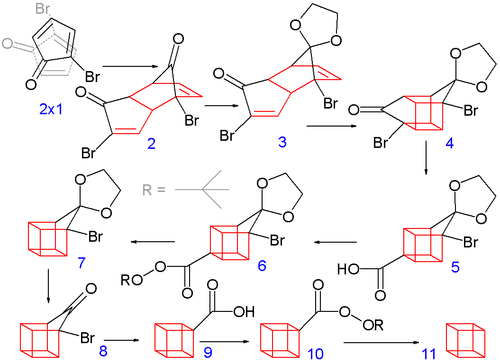
8개의 탄소로 이루어진 큐베인 프레임워크의 건설은 2-브로모시클로펜타디논이 자발적인 디엘스-알더 이량화 과정을 거치면서 시작된다.이어서 엔도 이성질체의 1개의 케탈을 염산수로부터 선택적으로 3으로 탈보호한다.
다음 공정에서는 광화학 [2+2] 사이클로드디션에서 엔도 이성질체 3(양쪽 알켄기 근접)이 케이지상 이성질체 4를 형성한다.브로모케톤기는 수산화칼륨과의 Favoreskii 재배열로 고리 수축 카르본산 5로 변환된다.다음으로 염화티오닐(염화티오닐)과 테르트부틸페레스터6(테르트부틸히드로페옥시드 및 피리딘)을 통해 7까지 열탈카복실화를 한 후 8에서 다시 아세탈을 제거한다.제2의 Favorskii 전위는 9가 되고, 마지막으로 제1의 탈탄산화물은 10을 통해 큐반(11)이 된다.
보다 접근하기 쉬운 이치환 큐베인의 실험실 합성은 트리브로마이클로펜타논 유도체를 얻기 위해 시클로펜타논의 에틸렌케탈을 브롬화하는 것을 포함한다.후속 단계에는 탈수로브롬화, 디엘-알더 이량화 [5][6]등이 포함된다.
생성된 큐반-1,4-디카르본산은 다른 치환 큐반을 합성하는 데 사용된다.큐베인 자체는 티오히드록사메이트 에스테르(바톤 탈탄산)[7]의 광화학 탈탄산화에 의해 거의 정량적으로 얻을 수 있다.
파생상품
1962년 Freedman에 의한 테트라페닐시클로부타디엔 니켈브로마이드로부터의 옥타페닐 유도체의 합성은 모화합물보다 앞선다.425~427°[2][8][9][10]C에서 녹는 용해성 무색 화합물이다.하이퍼큐브와 같은 구조를 가진 하이퍼큐브가 2014년 [11][12]출판물에서 존재할 것으로 예측되었다.큐벤의 두 가지 이성질체가 합성되었고, 세 번째 이성질체가 계산적으로 분석되었습니다.오르토 큐벤의 알켄은 피라미드화된 기하학적 구조 때문에 예외적으로 반응한다.합성 당시, 이것은 성공적으로 [13]만들어진 가장 피라미드화된 알켄이었다.메타큐벤 이성질체는 훨씬 덜 안정적이며 파라큐벤 이성질체는 아마도 실제 대각 [14]결합이 아닌 디라디칼로만 존재할 것이다.
큐빌쿠반 및 올리고쿠반
큐벤(1,2-데히드로쿠반) 및 1,4-쿠바네딜(1,4-데히드로쿠반)은 모두 매우 빠르게 친핵첨가를 하는 매우 왜곡된 화합물이며, 이를 통해 화학자는 큐빌쿠반을 합성할 수 있었다.X선 회절 구조 용액은 중앙 큐빌쿠반 결합이 매우 짧은(1.458Ω) 것으로 나타나 일반적인 C-C 단일 결합(1.578Ω)보다 훨씬 짧습니다.이것은 큐베인의 순환 외 안와가 s가 풍부하고 [15]핵에 가깝다는 사실에 기인한다.시카고 대학의 화학자들은 다수의 [n]쿠빌쿠반 올리고머를 [16]준비할 수 있는 방식으로 배열을 확장하고 수정했습니다.[n]큐빌쿠반은 UV 투명도가 뛰어난 액정을 만들 때 특별한 가능성을 가진 단단한 분자봉이다.cubylcubane의 용해도 [n]cubylcubane의 결합 단위가 증가함에 따라 용해도도 저하되어 제한된 체인 길이(최대 40 단위)만이 용액에서 성공적으로 합성되었다.[n]큐빌쿠반의 골격은 여전히 엄청나게 변형된 탄소 입방체로 구성되어 있어 안정성을 제한한다.반면 펜 주립대 연구진은 고체 반응으로 합성된 폴리큐반은 사면체각(109.5°)과 100% sp3 탄소 결합으로 뛰어난 광학 특성(고굴절률)을 보였다.[17]
반응
쿠네인은 금속이온 촉매에 의한 [18][19]γ-결합 전위에 의해 큐반에서 생성될 수 있다.
로듐 촉매와 함께 먼저 시클로옥타테트라엔으로 열분해될 수 있는 syn-트리시클로옥타디엔을 형성한다.[20]
「 」를 참조해 주세요.
레퍼런스
- ^ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 169. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The retained names adamantane and cubane are used in general nomenclature and as preferred IUPAC names.
- ^ a b c Biegasiewicz, Kyle; Griffiths, Justin; Savage, G. Paul; Tsanakstidis, John; Priefer, Ronny (2015). "Cubane: 50 years later". Chemical Reviews. 115 (14): 6719–6745. doi:10.1021/cr500523x. PMID 26102302.
- ^ a b Eaton, Philip E.; Cole, Thomas W. (1964). "Cubane". J. Am. Chem. Soc. 86 (15): 3157–3158. doi:10.1021/ja01069a041.
- ^ Eaton, Philip E.; Cole, Thomas W. (1964). "The Cubane System". J. Am. Chem. Soc. 86 (5): 962–964. doi:10.1021/ja01059a072.
- ^ Bliese, Marianne; Tsanaktsidis, John (1997). "Dimethyl Cubane-1,4-dicarboxylate: A Practical Laboratory Scale Synthesis". Australian Journal of Chemistry. 50 (3): 189. doi:10.1071/C97021.
- ^ Fluorochem, Inc (July 1989). "Cubane Derivatives for Propellant Applications" (PDF). Archived (PDF) from the original on 2021-07-09.
- ^ Eaton, Philip E. (1992). "Cubane: Ausgangsverbindungen für die Chemie der neunziger Jahre und des nächsten Jahrhunderts". Angewandte Chemie (in German). 104 (11): 1447–1462. Bibcode:1992AngCh.104.1447E. doi:10.1002/ange.19921041105.
- ^ Freedman, H. H. (1961). "Tetraphenylcyclobutadiene Derivatives. II.1 Chemical Evidence for the Triplet State". J. Am. Chem. Soc. 83 (9): 2195–2196. doi:10.1021/ja01470a037.
- ^ Freedman, H. H.; Petersen, D. R. (1962). "Tetraphenylcyclobutadiene Derivatives. IV.1 "Octaphenylcubane"; A Dimer of Tetraphenylcyclobutadiene". J. Am. Chem. Soc. 84 (14): 2837–2838. doi:10.1021/ja00873a046.
- ^ Pawley, G. S.; Lipscomb, W. N.; Freedman, H. H. (1964). "Structure of the Dimer of tetraphenylcyclobutadiene". J. Am. Chem. Soc. 86 (21): 4725–4726. doi:10.1021/ja01075a042.
- ^ Pichierri, F. (2014). "Hypercubane: DFT-based prediction of an Oh-symmetric double-shell hydrocarbon". Chem. Phys. Lett. 612: 198–202. Bibcode:2014CPL...612..198P. doi:10.1016/j.cplett.2014.08.032.
- ^ "Hypercubane: DFT-based prediction of an Oh-symmetric double-shell hydrocarbon".
- ^ Eaton, Philip E.; Maggini, Michele (1988). "Cubene (1,2-dehydrocubane)". J. Am. Chem. Soc. 110 (21): 7230–7232. doi:10.1021/ja00229a057.
- ^ Minyaev, Ruslan M.; Minkin, Vladimir I.; Gribanova, Tatyana N. (2009). "2.3 A Theoretical Approach to the Study and Design of Prismane Systems". In Dodziuk, Helena (ed.). Strained Hydrocarbons. Wiley. p. 55. ISBN 9783527627141.
- ^ Gilardi, Richard.; Maggini, Michele.; Eaton, Philip E. (1 October 1988). "X-ray structures of cubylcubane and 2-tert-butylcubylcubane: short cage-cage bonds". Journal of the American Chemical Society. 110 (21): 7232–7234. doi:10.1021/ja00229a058. ISSN 0002-7863.
- ^ Eaton, Philip E. (1992). "Cubanes: Starting Materials for the Chemistry of the 1990s and the New Century". Angewandte Chemie International Edition in English. 31 (11): 1421–1436. doi:10.1002/anie.199214211. ISSN 1521-3773.
- ^ Huang, Haw-Tyng; Zhu, Li; Ward, Matthew D.; Wang, Tao; Chen, Bo; Chaloux, Brian L.; Wang, Qianqian; Biswas, Arani; Gray, Jennifer L.; Kuei, Brooke; Cody, George D.; Epshteyn, Albert; Crespi, Vincent H.; Badding, John V.; Strobel, Timothy A. (21 January 2020). "Nanoarchitecture through Strained Molecules: Cubane-Derived Scaffolds and the Smallest Carbon Nanothreads". Journal of the American Chemical Society. 142 (42): 17944–17955. doi:10.1021/jacs.9b12352. ISSN 0002-7863. PMID 31961671. S2CID 210870993.
- ^ Smith, Michael B.; March, Jerry (2001). March's Advanced Organic Chemistry (5th ed.). John Wiley & Sons. p. 1459. ISBN 0-471-58589-0.
- ^ Kindler, K.; Lührs, K. (1966). "Studien über den Mechanismus chemischer Reaktionen, XXIII. Hydrierungen von Nitrilen unter Verwendung von Terpenen als Wasserstoffdonatoren". Chem. Ber. 99: 227–232. doi:10.1002/cber.19660990135.
- ^ Cassar, Luigi; Eaton, Philip E.; Halpern, Jack (1970). "Catalysis of symmetry-restricted reactions by transition metal compounds. Valence isomerization of cubane". Journal of the American Chemical Society. 92 (11): 3515–3518. doi:10.1021/ja00714a075. ISSN 0002-7863.