헥산
Hexane
 | |
 | |
 | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 헥산[2] | |
| 기타 이름 Sextane,[1] 헥사카반 | |
| 식별자 | |
3D 모델(JSmol) | |
| 1730733 | |
| 체비 | |
| 첸블 | |
| 켐스파이더 | |
| 드러그뱅크 | |
| ECHA 정보 카드 | 100.003.435 |
| EC 번호 |
|
| 1985 | |
| 케그 | |
| 메쉬 | n-디옥탄 |
PubChem CID | |
| RTECS 번호 |
|
| 유니 | |
| UN 번호 | 1208 |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| C6H14 | |
| 몰 질량 | 86.199g/140g/140−1 |
| 외모 | 무색 액체 |
| 냄새 | 페트롤릭 |
| 밀도 | 0.6606 g mL−1[3] |
| 녹는점 | -96 ~ -94 °C, -141 ~ -137 °F, 177 ~179 K |
| 비등점 | 68.5~69.1°C, 155.2~156.3°F, 341.6~342.2K |
| 9.5 mg L−1 | |
| 로그 P | 3.764 |
| 증기압 | 17.60kPa(20.0°C에서) |
헨리의 법칙 상수(kH) | 7.6 nmol Pa−1 kg−1 |
| UV-vis (µmax) | 200 nm |
자화율(δ) | - 74.6 · 10−6 cm3 / 세로 |
굴절률(nD) | 1.375 |
| 점성 | 0.3 mPa/s |
| 0.08 D | |
| 열화학 | |
열용량 (C) | 265.2 JK−1−1 몰 |
표준 어금니 엔트로피 (S | 296.06 JK−1−1 몰 |
표준 엔탈피/ 형성 (δHf⦵298) | -199.4 ~198.0 kJ−1 mol |
표준 엔탈피/ 연소 (δHc⦵298) | -4180 –-4140 kJ−1 mol |
| 위험 요소 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 요소 | 생식 독성 – 흡인 후 폐부종, 폐렴[4] |
| GHS 라벨링: | |
    | |
| 위험. | |
| H225, , , , , , , , | |
| P201, , , , , , , , , , , , , , , , , , , , , , , , , , ,, | |
| NFPA 704(파이어 다이아몬드) | |
| 플래시 포인트 | -26.0°C(-14.8°F, 247.2K) |
| 234.0 °C (453.2 °F, 507.1 K) | |
| 폭발 한계 | 1.2–7.7% |
| 치사량 또는 농도(LD, LC): | |
LD50(중간선량) | 25g−1 (구강, 쥐) 28710mg/kg (랫드, 경구)[6] |
LDLo(최저 공개) | 56137mg/kg (랫드, 경구)[6] |
| NIOSH(미국 건강 노출 제한): | |
PEL(허용) | TWA 500ppm (1,800mg/[5]m3) |
REL(권장) | TWA 50ppm (180 mg3/[5]m |
IDLH(즉시 위험) | 1100ppm[5] |
| 관련 화합물 | |
관련 알칸 | |
| 보충 데이터 페이지 | |
| Hexane(데이터 페이지) | |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
헥산(/hhkksenn/)은 6개의 탄소원자를 가진 직쇄 알칸으로 분자식이614 CH인 유기화합물이다.
무색 액체이며, 순수할 때 냄새가 없고 끓는점이 약 69°C(156°F)입니다.값싸고, 비교적 안전하며, 대부분 반응성이 없고 쉽게 증발하는 비극성 용매로 널리 사용되고 있으며, 최신 가솔린 혼합물에는 약 3%의 [7]헥산이 함유되어 있습니다.
헥산(hexanes)이라는 용어는 헥산이 대부분(>60%)으로 구성되고 다양한 양의 이성질 화합물 2-메틸펜탄 및 3-메틸펜탄, 그리고 소량의 비 이성질체5 C, C6 및7 C(cyclo) 알칸이 혼합된 것을 말한다.이러한 헥산은 순수한 헥산보다 저렴하며 단일 이성질체를 필요로 하지 않는 대규모 작업(예: 세척 용매 또는 크로마토그래피)에 종종 사용됩니다.
이성질체
| 통칭 | IUPAC 이름 | 텍스트 수식 | 골격식 |
|---|---|---|---|
| 노멀 헥산 n-디옥탄 | 헥산 | CH3(CH2)4CH3 | |
| 이소헥산 | 2-메틸펜탄 | (CH3)2CH(CH2)2CH3 | 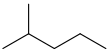 |
| 3-메틸펜탄 | CHCH32(CH3) CHCH23 | 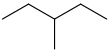 | |
| 2,3-디메틸부탄 | (CH3)2CH(CH3)2 | 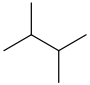 | |
| 네오헥산 | 2,2-디메틸부탄 | (CH3)3CCH23 | 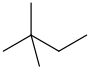 |
사용하다
산업에서는 헥산이 신발, 가죽 제품 및 지붕용 접착제 제조에 사용됩니다.또한 씨앗에서 식용유(유채유나 콩기름 등)를 추출하고, 다양한 품목을 정제 및 탈지하며, 섬유 제조에도 사용됩니다.미국에서는 식품 기반 콩기름 추출에 일반적으로 사용되며, 이 기술이 사용되는 모든 콩 식품에 잠재적으로 오염 물질로 존재한다. 이 오염 물질에 대한 FDA의 규제 부족은 [8][9]논란의 여지가 있다.
헥산의 일반적인 실험실 용도는 [10]분석하기 위해 물과 토양에서 기름과 그리스 오염 물질을 추출하는 것입니다.헥산은 쉽게 탈양성자가 되지 않기 때문에 유기석소 제조와 같이 매우 강한 염기를 수반하는 반응에 실험실에서 사용된다.예를 들어, 낙탄은 일반적으로 헥산 [11]용액으로 공급됩니다.
헥산은 일반적으로 크로마토그래피에서 비극성 용매로 사용됩니다.헥산에 불순물로 존재하는 더 높은 알칸은 용매와 유사한 유지 시간을 가지며, 이는 헥산을 포함하는 분율도 이러한 불순물을 포함한다는 것을 의미합니다.준비 크로마토그래피에서 대량의 헥산이 농축되면 시료가 알칸에 의해 상당히 오염될 수 있다.이로 인해 고체 화합물이 오일로 얻어지고 알칸이 [12]분석에 방해가 될 수 있다.
생산.
헥산은 주로 원유를 정제하여 얻는다.분율의 정확한 구성은 주로 석유의 공급원(크루드 또는 리폼)과 정제 제약에 따라 달라집니다.산업 제품(일반적으로 직쇄 이성질체의 무게로 약 50%)은 65–70°C(149–158°F)에서 끓는 비율이다.
물리 속성
모든 알칸은 [13][14]무색이다.다양한 헥산의 끓는점은 어느 정도 비슷하며, 일반적으로 다른 알칸과 마찬가지로 가지가 많은 형태일수록 낮다.녹는점이 상당히 다르고 추세가 [15]뚜렷하지 않다.
| 이성질체 | MP (°C) | MP (°F) | 혈압(°C) | 혈압(°F) |
|---|---|---|---|---|
| n-디옥탄 | −95.3 | −139.5 | 68.7 | 155.7 |
| 3-메틸펜탄 | −118.0 | −180.4 | 63.3 | 145.9 |
| 2-메틸펜탄(이소헥산) | −153.7 | −244.7 | 60.3 | 140.5 |
| 2,3-디메틸부탄 | −128.6 | −199.5 | 58.0 | 136.4 |
| 2,2-디메틸부탄(헥산) | −99.8 | −147.6 | 49.7 | 121.5 |
헥산은 실온에서 상당한 증기 압력을 가집니다.
| 온도(°C) | 온도(°F) | 증기압(mmHg) | 증기압(kPa) |
|---|---|---|---|
| −40 | −40 | 3.36 | 0.448 |
| −30 | −22 | 7.12 | 0.949 |
| −20 | −4 | 14.01 | 1.868 |
| −10 | 14 | 25.91 | 3.454 |
| 0 | 32 | 45.37 | 6.049 |
| 10 | 50 | 75.74 | 10.098 |
| 20 | 68 | 121.26 | 16.167 |
| 25 | 77 | 151.28 | 20.169 |
| 30 | 86 | 187.11 | 24.946 |
| 40 | 104 | 279.42 | 37.253 |
| 50 | 122 | 405.31 | 54.037 |
| 60 | 140 | 572.76 | 76.362 |
반응성
대부분의 알칸과 마찬가지로 헥산은 반응성이 낮으며 반응성 화합물에 적합한 용제입니다.그러나 n-헥산의 상업용 샘플은 종종 메틸시클로펜탄을 포함하고 있는데, 메틸시클로펜탄은 일부 라디칼 [16]반응과 양립할 수 없는 3차 C-H 결합을 특징으로 한다.
안전.
n-헥산을 5000ppm으로 10분 동안 흡입하면 현저한 현기증이 발생한다. 12시간 동안 2500-1000ppm은 졸음, 피로, 식욕부진 및 말단 마취, 2500-5000ppm은 근육 약화, 사지의 냉맥동, 시야 흐림, 두통 및 [17]거식증을 일으킨다.높은 수준의 n-헥산에 대한 만성적인 직업적 노출은 미국의 자동차 기계에서의 말초 신경 장애와 아시아, 유럽 및 북미의 [18]인쇄기, 신발 및 가구 공장 근로자들의 신경 독성과 관련이 있는 것으로 입증되었습니다.
미국 국립산업안전보건연구소(NIOSH)는 8시간 근무에 걸쳐 헥산 이성질체(n-헥산이 아님)에 대한 권장 노출 한계([19]REL)를 100ppm(350mg/m3(0.15g/cuft)로 설정했다.단, n-헥산의 경우 현재 NIOSH REL은 8시간 [20]근무일 동안 50ppm(180mg/m3(0.079gr/cuft)입니다.이 한계는 1989년 산업안전보건국에 의해 허용 피폭 한계(PEL)로 제안되었지만 1992년 [21]미국 법원에서 기각되었다.현재 미국의 n-헥산 PEL은 500ppm(1,800mg/m3(0.79g/cuft))[20]입니다.
헥산 및 기타 휘발성 탄화수소(휘발유 에테르)는 흡인 [22]위험이 있습니다.n-헥산은 알코올의 변성제, 섬유, 가구, 가죽 산업에서 세정제로 사용되기도 합니다.서서히 다른 [23]용제로 교체되고 있습니다.
휘발유와 마찬가지로 헥산은 휘발성이 매우 높으며 폭발 위험이 있습니다.랄스턴푸리나 소유의 콩 가공 공장에서 루이빌(켄터키) 하수구로 불법으로 배출된 헥산 증기의 발화로 인해 그 도시의 21km가 넘는 하수관과 도로가 파괴된 일련의 폭발이 잇따랐다.
사고
직업성 헥산 중독은 일본인 샌들 노동자, 이탈리아인 신발 노동자,[24] 대만 프레스 프레스 프루프 노동자 [25]등에게 발생했다.대만 근로자들을 분석한 결과, n-헥산을 [26]포함한 물질에 대한 직업적 노출이 나타났다.2010-2011년에는 아이폰을 제조하는 중국 근로자들이 헥산 [27][28]중독에 걸린 것으로 보고되었다.
헥산은 1981년 2월 13일 미국 켄터키 주 루이빌 중심부의 21km(13마일) 이상의 하수관과 도로를 파괴한 루이빌 하수관 폭발의 원인으로 확인되었다.
생체 변환
n-헥산은 체내에서 2-헥산올로, 나아가 2,5-헥산디올로 생체변환된다.이 변환은 공기 중의 산소를 이용하는 시토크롬 P450 효소에 의해 촉매된다. 2,5-헥산디올은 신경독성이 있고 다발성 [23]뉴로파시를 생성하는 2,5-헥산디온으로 더욱 산화될 수 있다.이러한 거동을 고려하여 용매로서의 n-헥산의 치환에 대해 논의되어 왔습니다.n-헥탄은 가능한 [29]대안입니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Hofmann, August Wilhelm Von (1 January 1867). "I. On the action of trichloride of phosphorus on the salts of the aromatic monamines". Proceedings of the Royal Society of London. 15: 54–62. doi:10.1098/rspl.1866.0018. S2CID 98496840.
- ^ "n-hexane – Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 16 September 2004. Identification and Related Records. Archived from the original on 8 March 2012. Retrieved 31 December 2011.
- ^ William M. Haynes (2016). CRC Handbook of Chemistry and Physics (97th ed.). Boca Raton: CRC Press. pp. 3–298. ISBN 978-1-4987-5429-3.
- ^ [PubChem]에서의 GHS 분류
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. "#0322". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "n-Hexane". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "n-Hexane - Hazardous Agents". Haz-Map. Retrieved 7 July 2022.
- ^ "The Tofurky Company : Our Ingredients". Tofurky.com. Archived from the original on 17 March 2015. Retrieved 17 March 2015.
- ^ Palmer, Brian (26 April 2010). "A study found hexane in soy protein. Should you stop eating veggie burgers?". Slate.com. Archived from the original on 9 March 2015. Retrieved 17 March 2015.
- ^ Use of ozone depleting substances in laboratories. Kbh: Nordisk Ministerråd. 2003. ISBN 92-893-0884-2. OCLC 474188215. Archived from the original on 16 July 2012.
- ^ Schwindeman, James A.; Woltermann, Chris J.; Letchford, Robert J. (1 May 2002). "Safe handling of organolithium compounds in the laboratory". Chemical Health & Safety. 9 (3): 6–11. doi:10.1016/s1074-9098(02)00295-2. ISSN 1074-9098.
- ^ "The Hexane Molecule". www.worldofmolecules.com. Retrieved 30 December 2021.
- ^ "Organic Chemistry-I" (PDF). Nsdl.niscair.res.in. Archived from the original (PDF) on 29 October 2013. Retrieved 17 February 2014.
- ^ "13. Hydrocarbons Textbooks". Textbook.s-anand.net. Archived from the original on 6 October 2014. Retrieved 17 February 2014.
- ^ William D. McCain (1990). The properties of petroleum fluids. PennWell. ISBN 978-0-87814-335-1.
- ^ Koch, H.; Haaf, W. (1973). "1-Adamantanecarboxylic Acid". Organic Syntheses.; Collective Volume, vol. 5, p. 20
- ^ "N-HEXANE". Toxicology data network Hazardous Substances Data Bank. National Library of Medicine. Archived from the original on 4 September 2015.
- ^ Centers for Disease Control and Prevention (CDC) (16 November 2001). "n-Hexane-related peripheral neuropathy among automotive technicians--California, 1999-2000". MMWR. Morbidity and Mortality Weekly Report. 50 (45): 1011–1013. ISSN 0149-2195. PMID 11724159.
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Hexane isomers (excluding n-Hexane)". cdc.gov. Archived from the original on 31 October 2015. Retrieved 3 November 2015.
- ^ a b CDC (28 March 2018). "n-Hexane". Centers for Disease Control and Prevention. Retrieved 3 May 2020.
- ^ "Appendix G: 1989 Air Contaminants Update Project - Exposure Limits NOT in Effect". www.cdc.gov. 20 February 2020. Retrieved 3 May 2020.
- ^ Gad, Shayne C (2005), "Petroleum Hydrocarbons", Encyclopedia of Toxicology, vol. 3 (2nd ed.), Elsevier, pp. 377–379
- ^ a b Clough, Stephen R; Mulholland, Leyna (2005). "Hexane". Encyclopedia of Toxicology. Vol. 2 (2nd ed.). Elsevier. pp. 522–525.
- ^ Rizzuto, N; De Grandis, D; Di Trapani, G; Pasinato, E (1980). "N-hexane polyneuropathy. An occupational disease of shoemakers". European Neurology. 19 (5): 308–15. doi:10.1159/000115166. PMID 6249607.
- ^ n-Hexane, Environmental Health Criteria, World Health Organization, 1991, archived from the original on 19 March 2014
- ^ Liu, C. H.; Huang, C. Y.; Huang, C. C. (2012). "Occupational Neurotoxic Diseases in Taiwan". Safety and Health at Work. 3 (4): 257–67. doi:10.5491/SHAW.2012.3.4.257. PMC 3521924. PMID 23251841.
- ^ "Workers poisoned while making iPhones – ABC News (Australian Broadcasting Corporation)". Australian Broadcasting Corporation. 26 October 2010. Archived from the original on 8 April 2011. Retrieved 17 March 2015.
- ^ David Barboza (22 February 2011). "Workers Sickened at Apple Supplier in China". The New York Times. Archived from the original on 7 April 2015. Retrieved 17 March 2015.
- ^ Filser JG, Csanády GA, Dietz W, Kessler W, Kreuzer PE, Richter M, Störmer A (1996). "Comparative estimation of the neurotoxic risks of n-hexane and n-heptane in rats and humans based on the formation of the metabolites 2,5-hexanedione and 2,5-heptanedione". Adv Exp Med Biol. Advances in Experimental Medicine and Biology. 387: 411–427. doi:10.1007/978-1-4757-9480-9_50. ISBN 978-1-4757-9482-3. PMID 8794236.
외부 링크
- International Chemical Safety Card 1262 (2-메틸펜탄)
- 헥산용 물질 안전 데이터 시트
- 국가 오염 물질 목록 – n-헥산 팩트 시트
- Phytokemica L 데이터베이스 엔트리
- 질병통제예방센터
- 국가안전위원회 경고 "일반 화학물질 자동차 기계장치 영향"
- 호주 국가 오염 물질 인벤토리(NPI) 페이지
- "EPA는 n-헥산을 인간의 발암 물질로 분류할 수 있다고 생각하지 않습니다."연방관보 / 제66권, 제71호 / 2001년 4월 12일 목요일 / 규칙 및 규칙



