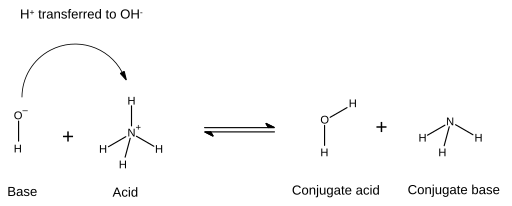
켤레(산염기 이론)
Conjugate (acid-base theory)| 산과 염기 |
|---|
 |
| 산 타입 |
| 베이스 타입 |
브뢴스테드 내의 켤레산-저산염기이론은 산이 양성자를 기증할 때 형성되는 화합물이다.H+) 염기로—즉, 수소 이온이 첨가된 염기로, 역반응에서는 수소 이온이 손실된다.반면에, 켤레 염기는 화학 반응 중에 산이 양성자를 기증한 후에 남는 것이다.따라서 결합염기는 산으로부터 양성자를 제거함으로써 형성되는 종이며, 역반응에서는 수소이온을 [1]얻을 수 있다.일부 산은 여러 개의 양성자를 방출할 수 있기 때문에 산의 켤레 염기 자체는 산성일 수 있습니다.
요약하면, 이는 다음과 같은 화학 반응으로 나타낼 수 있다.
요하네스 니콜라우스 브뢴스테드와 마틴 로리가 브뢴스테드를 소개했습니다.로리 이론은 양성자를 다른 화합물로 옮길 수 있는 화합물은 산이고 양성자를 받아들이는 화합물은 염기라고 제안했다.양성자는 단위 양의 전하를 가진 핵 입자이며 수소 [2]원자의 핵, 즉 수소 양이온을 구성하기 때문에 기호+ H로 나타납니다.
양이온은 켤레산이 될 수 있고 음이온은 켤레염기가 될 수 있으며, 이는 어떤 물질이 관여하고 어떤 산-염기 이론이 관점인지에 따라 달라질 수 있다.결합염기가 될 수 있는 가장 간단한 음이온은 결합산이 원자 수소인 용해 전자이다.
산염기 반응
산-염기 반응에서 산과 염기는 반응하여 결합염기와 결합산을 형성한다.산은 양성자를 잃고 염기는 양성자를 얻는다.이를 설명하는 화학도에서는 염기와 양성자 사이에 형성된 새로운 결합은 일반적으로 염기의 전자쌍에서 시작되고 화살촉이 전달되는 수소이온(양성자)에서 끝나는 화살표로 나타납니다.
이때 물분자는 수산화이온이 암모늄에 의해 기증된 수소이온을 받은 후 수산화이온의 켤레산이다.한편 암모늄은 암모늄이 수소이온을 공여해 물분자를 만들어 낸 후 산암모늄의 켤레염기이다.또한 물 분자는 양성자를 기증하여 역반응에서 NH를 주기+
4 때문에 OH는− HO의
2 켤레 염기로 간주할 수 있다."산", "염기", "공역산" 및 "공역염기"라는 용어는 특정 화학종에 대해 고정된 것이 아니라 발생하는 반응에 따라 교환할 수 있다.
켤레 강도
켤레산의 강도는 해리 상수에 정비례한다.켤레산이 강하면 해리는 평형상수가 높아져 반응 생성물이 선호된다.켤레 염기의 강도는 수소 양성자를 자기 쪽으로 끌어당기는 종들의 경향으로 볼 수 있다.만약 켤레 염기가 강한 것으로 분류된다면, 그것은 용액에 있을 때 수소 양성자에 "붙어" 있을 것이고 그것의 산은 분리되지 않을 것이다.
만약 어떤 종이 강산으로 분류된다면, 그것의 결합 염기는 [3]약해질 것이다.이 사례의 예는 물 속의 염산 HCl의 해리가 될 것이다.HCl은 강한 산이기 때문에(대부분 분해), 그 결합염기(Cl−
)는 약한 결합염기가 될 것이다.따라서 이 시스템에서 대부분의+
H는 Cl 음이온에− 부착되는 대신 하이드로늄 이온
3+
HO의 형태를 띠게 되며, 켤레 염기는 물 분자보다 약할 것이다.
한편, 만약 종이 약산으로 분류된다면, 그것의 결합 염기는 반드시 강한 염기가 될 필요는 없을 것이다.아세트산의 결합염기인 아세테이트는 염기해리상수(Kb)가 약 5.6×10으로−10 약염기이다.종이 강한 결합 염기를 가지기 위해서는 물과 같이 매우 약한 산이 되어야 한다.
켤레산-염기쌍 식별
켤레산을 식별하기 위해 관련된 화합물 쌍을 찾습니다.산염기 반응은 전후로 볼 수 있다.앞은 방정식의 반응물 측이고, 뒤는 방정식의 곱 측입니다.방정식 뒷면의 켤레산은 수소이온을 얻기 때문에 방정식 앞쪽에 켤레산의 수소이온이 하나 적은 화합물이 염기가 된다.방정식 뒷면의 켤레 염기는 수소 이온을 잃었기 때문에 방정식 앞쪽에 켤레 염기의 수소 이온을 하나 더 가진 화합물이 산이다.
다음과 같은 산염기 반응을 고려합니다.
- HNO
3 + HO
2 → HO
3+
+ NO−
3
질산(HNO
3)은 물 분자에 양성자를 기증하고 결합 염기가 질산염(NO)이기−
3 때문에 산이다.물 분자는 수소 양이온(프로톤)을 받고 그 결합산이 하이드로늄 이온(HO
3+
)이기 때문에 염기 역할을 한다.
| 방정식 | 산성의 | 기초 | 켤레 기저 | 켤레산 |
|---|---|---|---|---|
| HClO 2 + HO 2 → ClO− 2 + HO 3+ | HClO 2 | 호 2 | CLO− 2 | 호 3+ |
| ClO− + HO 2 → HClO + OH− | 호 2 | CLO− | 오− | HClO |
| HCl + HPO 2− 4 → Cl− + HPO 3 4 | HCL | H 2PO− 4 | 클론− | H 3PO 4 |
적용들
복합산 및 염기의 한 가지 용도는 완충액을 포함하는 완충 시스템에 있습니다.완충제는 적정공정 중 pH변화를 제한하기 위해 약산 및 그 결합염기(소금의 형태) 또는 약염기와 그 결합산을 사용한다.버퍼에는 유기 및 비유기 화학 용도가 모두 있습니다.예를 들어 실험 과정에서 사용되는 완충제 외에 사람의 혈액은 pH를 유지하기 위한 완충제 역할을 한다.우리 혈류에서 가장 중요한 완충제는 탄산-중탄산 완충제로, CO가 유입될 때 급격한
2 pH 변화를 방지합니다.이것은 다음과 같이 기능합니다.
또, 공통 버퍼의 표를 다음에 나타냅니다.
버퍼링 에이전트 pKa 유용한 pH 범위 구연산 3.13, 4.76, 6.40 2.1 - 7.4 아세트산 4.8 3.8 - 5.8 KH2PO4 7.2 6.2 - 8.2 체이스 9.3 8.3–10.3 붕산염 9.24 8.25 - 10.25
유기 화합물에 대한 두 번째 일반적인 용도는 아세트산을 사용한 완충제 생산이다.화학식이
3 CHCOOH인 약한 산인 아세트산을 완충액으로 만들었을 경우, 아세트산은 결합염기
3−
CHCOO와 소금 형태로 결합되어야 한다.이렇게 만들어진 혼합물은 아세테이트 완충제라고 불리며, 수성
3 CHCOOH와 수성
3 CHCONa로 구성됩니다. 아세트산은 다른 많은 약한 산과 함께 각기 다른 실험실 환경에서 각각의 pH 범위 내에서 유용한 완충제 성분으로 사용됩니다.
상기 고분산염 용액은 유기산, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘, 칼슘과 결합이 결합되어 있다 수술y 또는 화상입니다.[5]
산 및 그 결합염기 표
아래 표는 산과 그 결합 염기의 몇 가지 예입니다. 단 하나의 양성자(H+ 이온)로 어떻게 다른지 주목하십시오.산 강도는 감소하고 복합 염기 강도는 테이블 아래로 증가한다.
| 산성의 | 켤레 기저 |
|---|---|
| HF 2+ 플루오로늄 이온 | HF 플루오르화 수소 |
| HCl 염산 | 염화물− |
| 황산24 | HSO− 4 황산수소 이온(이황산 이온) |
| HNO3 질산 | 질산− 3 이온 없음 |
| HO3+ 하이드로늄 이온 | HO2 워터 |
| HSO− 4 황산수소 이온 | SO2− 4 황산 이온 |
| HPO인산34 | HPO2− 4 인산수소 이온 |
| CHCOOH3 아세트산 | CHCOO3− 아세테이트 이온 |
| HF 불산 | F− 불소 이온 |
| HCO탄산23 | HCO− 3 탄산수소 이온 |
| HS2 하이드로황산 | HS− 황화수소 이온 |
| HPO2− 4 인산수소 이온 | HPO2− 4 인산수소 이온 |
| NH+ 4 암모늄 이온 | NH3 암모니아 |
| HO2 물 (pH=7) | 수산화수소− 이온 |
| HCO− 3 탄산수소 이온(중탄산염) 이온 | 탄산2− 3 이온 |
염기 및 그 결합산 표
대조적으로, 이것은 염기와 그들의 결합산들의 표이다.마찬가지로, 염기 강도는 감소하고 복합산 강도는 표 아래로 증가한다.
| 기초 | 켤레산 |
|---|---|
| 채널 2 5 2 에틸아민 | CHNH 2 5+ 3 에틸암모늄 이온 |
| 채널 3 2 메틸아민 | CHNH 3+ 3 메틸암모늄 이온 |
| NH 3 암모니아 | NH+ 4 암모늄 이온 |
| 채널 5 5 피리딘 | 채널 5 6+ 피리디늄속 |
| 채널 6 5 2 아닐린 | CHNH 6 5+ 3 페닐암모늄 이온 |
| 벤조산 CHCO 6 5− 2 이온 | C 6H 6CO 2 안식향산 |
| F− 불소 이온 | 고주파 플루오르화수소 |
| PO인산3− 4 이온 | HPO2− 4 인산수소 이온 |
| 수산화수소− 이온 | HO2 물(중립, pH 7) |
| HCO− 3 중탄산염 | H 2CO 3 탄산 |
| CO2− 3 탄산 이온 | HCO− 3 중탄산염 |
| 브르− 브롬 | HBr 브롬화수소 |
| HPO2− 4 인산수소 | H 2PO− 4 |
| 염화물− | HCL 염화수소 |
| 호 2 물. | HO 3+ 하이드로늄 이온 |
| 2-{\ 아질산 이온 | 아질산 |
「 」를 참조해 주세요.
레퍼런스
- ^ 줌달, 스티븐 S & 줌달, 수잔 A.케미스트리.Hougton Mifflin, 2007년 ISBN0618713700
- ^ "Brønsted–Lowry theory chemistry". Encyclopedia Britannica. Retrieved 25 February 2020.
- ^ "Strength of Conjugate Acids and Bases Chemistry Tutorial". www.ausetute.com.au. Retrieved 25 February 2020.
- ^ British national formulary: BNF 69 (69 ed.). British Medical Association. 2015. p. 683. ISBN 9780857111562.
- ^ Pestana, Carlos (7 April 2020). Pestana's Surgery Notes (Fifth ed.). Kaplan Medical Test Prep. pp. 4–5. ISBN 978-1506254340.