히드라존
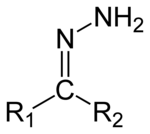
Hydrazone히드라존은 RRC
1
2=NNH
2 구조를 가진 유기 화합물의 일종이다.[1] 그것들은 산소를 NNH
2 기능 그룹으로 대체함으로써 케톤과 알데히드와 관련이 있다. 그것들은 보통 케톤이나 알데히드에 히드라진의 작용에 의해 형성된다.[2][3]
합성
히드라진, 오르가노하이드라진, 그리고 1,1-다이오르가노하이드라진은 알데히드, 케톤과 반응하여 하이드라존을 준다.
페닐하이드라진은 환원당과 반응해 오사존으로 알려진 하이드라존을 형성하는데, 독일의 화학자 에밀 피셔가 단당류를 구별하기 위한 시험으로 개발한 것이다.[4][5]
사용하다
히드라존은 케톤과 알데히드의 다양한 분석의 기초가 된다. 예를 들어 실리카 흡수제에 코팅된 디니트로페닐하이드라진은 흡착 카트리지의 기본이다. 그런 다음 하이드라존은 용출되어 UV 검출기를 사용하여 HPLC에 의해 분석된다.
복합 카보닐 시안화-p-trifluoromethoxyphenylhydrazone(약칭 FCCP)은 분자생물학에서 ATP 합성을 분리하고 산화 인산화 산소의 감소를 위해 사용된다.
히드라존은 생체역학 전략의 기본이다.[6][7] 히드라존 기반 결합 방법은 특정 유형의 암세포에 대한 항체 등 표적항체에 약물을 결합하기 위해 의료 생명공학에서 사용된다(ADC 참조). 히드라존 기반 결합은 중성 pH(혈액 내)에서는 안정적이지만 세포의 리소솜의 산성 환경에서 급속히 파괴된다. 그 약물은 따라서 세포에서 분비되는데, 세포는 그 기능을 발휘한다.[8]
반응
히드라존은 가수분해에 취약하다.
- RC2=N-NR'2 + HO2 → RC2=O + HN-NR2'2
알킬 하이드라존은 유추산소보다 가수분해에 10배에서23 10배 정도 더 민감하다.[9]
하이드라진 자체에서 파생된 하이드라존은 아진(Azine)을 제공하기 위해 카보닐과 같은 두 번째 등가물로 응축된다.[10]
- RC2=N-NH'2 + RC2=O → RC2=N-N=CR2 + HO2
하이드라존은 울프-키슈너 축소의 매개체다.
하이드라존은 하이드라존 요오드화, 샤피로 반응, 그리고 비닐 화합물에 대한 밤포드-스테븐 반응의 반응제다. 하이드라존은 또한 β-케토-아세트 또는 β-케토-에스테르와 아릴 디아조늄 염을 통한 Japp-Klingemann 반응에 의해 합성될 수 있다. 하이드라존은 3,5 방산 1H-피라졸의 조제에 사용될 때 아진으로 변환되는데,[11] 하이드라진 하이드레이트를 사용한 반응도 잘 알려져 있다.[12][13] 전이 금속 촉매로 하이드라존은 다양한 전기세포와 반응하는 유기측정 시약 대용물 역할을 할 수 있다.[14]
N,N-다이얼킬하이드라존
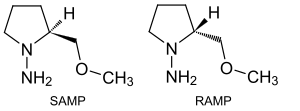
N,N-다이얼킬하이드라존에서[15] C=N 본드는 가수 분해, 산화 및 감소할 수 있으며, N-N 본드는 자유 아민으로 감소할 수 있다. C=N 결합의 탄소 원자는 유기물 핵물질과 반응할 수 있다. 알파-수소 원자는 케톤에 비해 10배 정도 더 산성이 높기 때문에 핵성분이 더 많다. 예를 들어, LDA와의 감응은 알킬 할로겐화물에 의해 알킬화 될 수 있는 아자놀레이트를 제공한다.[16] 히드라진 SAMP와 RAMP는 키랄 보조의 기능을 한다.[17][18]
갤러리
참고 항목
참조
- ^ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7
- ^ Stork, G.; Benaim, J. (1977). "Monoalkylation of α,β-Unsaturated Ketones via Metalloenamines: 1-butyl-10-methyl-Δ1(9)-2-octalone". Organic Syntheses. 57: 69.; Collective Volume, vol. 6, p. 242
- ^ Day, A. C.; Whiting, M. C. (1970). "Acetone hydrazone". Organic Syntheses. 50: 3.; Collective Volume, vol. 6, p. 10
- ^ Fischer, Emil (1908). "Schmelzpunkt des Phenylhydrazins und einiger Osazone". Berichte der Deutschen Chemischen Gesellschaft. 41: 73–77. doi:10.1002/cber.19080410120.
- ^ Fischer, Emil (1894). "Ueber einige Osazone und Hydrazone der Zuckergruppe". Berichte der Deutschen Chemischen Gesellschaft. 27 (2): 2486–2492. doi:10.1002/cber.189402702249.
- ^ Kölmel, Dominik K.; Kool, Eric T. (2017). "Oximes and Hydrazones in Bioconjugation: Mechanism and Catalysis". Chemical Reviews. 117 (15): 10358–10376. doi:10.1021/acs.chemrev.7b00090. PMC 5580355. PMID 28640998.
- ^ Algar, W. Russ; Prasuhn, Duane E.; Stewart, Michael H.; Jennings, Travis L.; Blanco-Canosa, Juan B.; Dawson, Philip E.; Medintz, Igor L. (2011). "The Controlled Display of Biomolecules on Nanoparticles: A Challenge Suited to Bioorthogonal Chemistry". Bioconjugate Chemistry. 22 (5): 825–858. doi:10.1021/bc200065z. PMID 21585205.
- ^ Wu, Anna M.; Senter, Peter D. (7 September 2005). "Arming antibodies: prospects and challenges for immunoconjugates". Nature Biotechnology. 23 (9): 1137–46. doi:10.1038/nbt1141. PMID 16151407. S2CID 27226728.
- ^ Kalia, J.; Raines, R. T. (2008). "Hydrolytic stability of hydrazones and oximes". Angew. Chem. Int. Ed. 47 (39): 7523–6. doi:10.1002/anie.200802651. PMC 2743602. PMID 18712739.
- ^ Day, A. C.; Whiting, M. C. (1970). "Acetone Hydrazone". Organic Syntheses. 50: 3. doi:10.15227/orgsyn.050.0003.
- ^ Lasri, Jamal; Ismail, Ali I. (2018). "Metal-free and FeCl3-catalyzed synthesis of azines and 3,5-diphenyl-1H-pyrazole from hydrazones and/or ketones monitored by high resolution ESI+-MS". Indian Journal of Chemistry, Section B. 57B (3): 362–373.
- ^ Outirite, Moha; Lebrini, Mounim; Lagrenée, Michel; Bentiss, Fouad (2008). "New one step synthesis of 3,5-disubstituted pyrazoles under microwave irradiation and classical heating". Journal of Heterocyclic Chemistry. 45 (2): 503–505. doi:10.1002/jhet.5570450231.
- ^ Zhang, Ze; Tan, Ya-Jun; Wang, Chun-Shan; Wu, Hao-Hao (2014). "One-pot synthesis of 3,5-diphenyl-1H-pyrazoles from chalcones and hydrazine under mechanochemical ball milling". Heterocycles. 89 (1): 103–112. doi:10.3987/COM-13-12867.
- ^ Wang, H; Dai, X.-J.; Li, C.-J. (2017). "Aldehydes as alkyl carbanion equivalents for additions to carbonyl compounds". Nature Chemistry. 9 (4): 374–378. doi:10.1038/nchem.2677. S2CID 11653420.
- ^ Lazny, R.; Nodzewska, A. (2010). "N,N-dialkylhydrazones in organic synthesis. From simple N,N-dimethylhydrazones to supported chiral auxiliaries". Chemical Reviews. 110 (3): 1386–1434. doi:10.1021/cr900067y. PMID 20000672.
- ^ Enders, Dieter; Reinhold, Ulrich (1997). "Asymmetric synthesis of amines by nucleophilic 1,2-addition of organometallic reagents to the CN-double bond". Tetrahedron: Asymmetry. 8 (12): 1895–1946. doi:10.1016/S0957-4166(97)00208-5.
- ^ Enders, Dieter; Fey, Peter; Kipphardt, Helmut (1987). "(S)-(−)-1-Amino-2-methoxymethylpyrrolidine (SAMP) and (R)-(+)-1-amino-2-methoxymethylpyrrolidine (RAMP), Versatile Chiral Auxiliaries". Organic Syntheses. 65: 173. doi:10.15227/orgsyn.065.0173.
- ^ Enders, Dieter; Kipphardt, Helmut; Fey, Peter (1987). "Asymmetric Syntheses Using the SAMP-/RAMP-Hydrazone Method: (S)-(+)-4-methyl-3-heptanone". Organic Syntheses. 65: 183. doi:10.15227/orgsyn.065.0183.
- ^ Tameem, Abdassalam Abdelhafiz; Salhin, Abdussalam; Saad, Bahruddin; Rahman, Ismail Ab.; Saleh, Muhammad Idiris; Ng, Shea-Lin; Fun, Hoong-Kun (2006). "Benzophenone 2,4-dinitrophenylhydrazone". Acta Crystallographica Section E. 62 (12): o5686–o5688. doi:10.1107/S1600536806048112.