색시톡신
Saxitoxin | |||
| | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 [(3aS,4R,10aS)-10,10-디히드록시-2,6-다이미노옥타히드로-1H,8H-피롤로[1,2-c]푸린-4-일]메틸카르바메이트 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.160.395 | ||
| 케그 | |||
PubChem CID | |||
| 유니 | |||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C10H17N7O4 | |||
| 몰 질량 | 299.291 g/120−1 | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
색시톡신(STX)은 강력한 신경독소이며 가장 잘 알려진 마비성 패류독소이다.사람에 의한 삭시톡신 섭취는 보통 독성 녹조에 의해 오염된 조개의 섭취에 의해 마비성 조개 중독으로 알려진 질병의 원인이 된다.
색시톡신이라는 용어는 그것이 처음 분리되었던 버터 조개속 이름에서 유래했다.그러나 색시톡신이라는 용어는 또한 색시톡신 자체(STX), 네오삭시톡신(NSTX), 곤야톡신(GTX), 데카바모일락시톡신(Decarbamoylsaxitoxin)을 포함한 원생동물, 조류 및 시아노박테리아에 의해 생성되는 구조적으로 관련된 50개 이상의 신경독신(이하 "색시톡신"이라 함)을 지칭할 수 있다.
색톡신은 홍합, 바지락, 굴, 가리비 같은 이매패류에 존재하여 미국 북동부 및 서부, 서유럽, 동아시아, 호주 등 온대 연안에서 상업 및 레크리에이션용 조개 채취를 금지시키는 경우가 많기 때문에 환경 및 경제적 영향이 크다.트랄리아, 뉴질랜드, 남아프리카공화국.미국에서는 캘리포니아, 오리건, 워싱턴, 알래스카, 뉴잉글랜드에서 마비성 조개 중독이 발생했다.
자연의 원천
색시톡신은 특정 해양성 디노플라겔레이트(알렉산드리움, 나노디늄, 파이로디늄)와 민물 시아노박테리아(돌리코스페르멈 시시날레, 일부 아파니조메논, 원통로스퍼셉시스, 플랑카)에 의해 자연적으로 생성되는 신경독소이다.색시톡신은 연체동물(이족류와 복족류), 갑각류, 극피동물 등 [3]다식성 무척추동물에 축적된다.
색시톡신은 또한 아시아의 최소 12종의 해양 복어와 브라질의 [4]한 마리의 민물고기 틸라피아에서 발견되었다.그러나 STX의 궁극적인 출처는 여전히 불확실한 경우가 많습니다.쌍편모충 Pyrodinium bahamense는 [5][6]플로리다에서 발견된 STX의 원천이다.최근 연구에 따르면 "Indian River Lagoon" 남부 복어의 피부, 근육, 내장 및 생식선에서 STX가 검출되었으며, 난소에서 가장 높은 농도(22,104μg STX eq/100g 조직)가 측정되었습니다.감금된 지 1년이 지났는데도 피부 점액은 강한 [7]독성으로 남아 있었다.미국산 복어의 농도는 필리핀, 태국,[6] 일본,[6][8] 남미에서 [9]볼 수 있는 것과 비슷하다.복어는 또한 구조적으로 구별되는 독소인 테트로도톡신을 [10]축적한다.
구조 및 합성
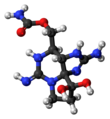
색시톡신디염산염은 비정질 흡습성 고체이지만 결정성 유도체의 X선 결정학으로 [11][12]색시톡신 구조를 확인할 수 있었다.색시톡신의 산화에 의해 형광성 푸린 유도체가 생성되어 그 [13]존재를 검출하는 데 이용되고 있다.
색시톡신 총합성이 [14][15][16]몇 가지 이루어졌다.
작용 메커니즘
색시톡신은 선택적 가역성 나트륨 채널 차단제 [17][18]역할을 하는 신경 독소이다.가장 강력한 천연 독소 중 하나인 이 독소는 뉴런의 전압 게이트 나트륨 채널에 작용하여 정상적인 세포 기능을 방해하고 [3]마비를 초래합니다.
정상적인 신경 기능을 위해서는 전압 게이트 나트륨 채널이 필수적입니다.그것은 뉴런의 축삭을 따라 배치된 통합막 단백질로 존재하며 세포막을 가로지르는 4개의 도메인을 가지고 있다.전압 개폐 나트륨 채널의 개방은 전압의 변화 또는 일부 배위자가 올바른 방식으로 결합될 때 발생합니다.이러한 나트륨 채널은 활동 전위의 전파에 필수적이기 때문에 올바르게 기능하는 것이 가장 중요합니다.이 능력이 없으면, 신경 세포는 신호를 전달할 수 없게 되고, 그것이 쇠약하게 만드는 신체 부위는 신경계에서 차단된다.이는 [3]색시톡신처럼 해당 부위의 마비로 이어질 수 있다.
색시톡신은 나트륨 채널에 가역적으로 결합한다.그것은 채널 단백질의 모공에 직접 결합하여 개구부를 막고 막을 통한 나트륨 이온의 흐름을 막는다.이로 인해 [3]위에서 설명한 신경 차단이 발생합니다.
생합성
색시톡신의 생합성은 복잡해 보이지만, 두 개의 다른 왕국, 정말로 두 개의 다른 영역, 즉 해양 편모충과 민물 시아노박테리아에서 온 유기체들은 이러한 독소를 생산할 수 있다.디노플라겔라테스 생산의 지배적인 이론은 시아노박테리아와의 공생상호주의에 의한 것이었지만, 디노플라겔라테스 자체가 색시톡신 [19]합성에 필요한 유전자를 가지고 있다는 증거가 나타났다.
색시톡신 생합성은 색시톡신 생합성의 정확한 메커니즘은 여전히 이론적인 모델이지만 박테리아에 대해 기술된 최초의 비테르펜 알칼로이드 경로이다.기질이 효소에 어떻게 결합하는지에 대한 정확한 메커니즘은 아직 알려지지 않았으며 색시톡신의 생합성에 관련된 유전자는 추정적이거나 최근에야 확인되었다.[19][20]
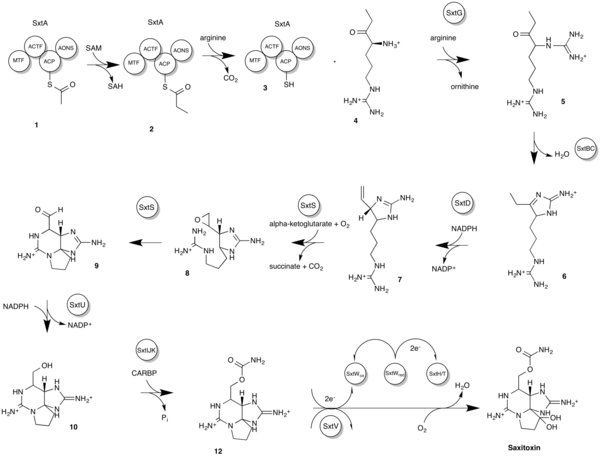
과거에 두 개의 생리학이 제안되었다.초기 버전은 최초 제안 당시에는 이용할 수 없었던 유전적 증거뿐만 아니라 생합성 고려사항에 기초한 켈만 등의 보다 최근의 제안과는 다르다.보다 최근의 모델은 보다 우호적인 반응을 얻기 위해 사용된 STX 유전자 클러스터(sxt)를 설명한다.시아노박테리아에서[20] Sxt의 가장 최근의 반응 시퀀스는 다음과 같다.자세한 생합성 및 중간 구조는 도표를 참조하십시오.
- 아세틸-CoA에서 아세트산염으로 아실 캐리어 단백질(ACP)을 장전하여 중간 1을 생성한다.
- 이어서 아세틸-ACP의 SxTA 촉매 메틸화가 이루어지며, 아세틸-ACP는 프로피오닐-ACP로 변환되어 중간체 2를 생성한다.
- 그 후 다른 SxtA는 프로피오닐-ACP와 아르기닌 사이에서 클라이젠 축합반응을 일으켜 중간체 4와 중간체 3을 생성한다.
- SxtG는 아미디노기를 아르기닌에서 중간체 5를 생성하는 중간체 4의 α-아미노기로 전이시킨다.
- 중간체 5는 SxtBC에 의해 레트로알돌과 같은 축합을 거쳐 중간체 6을 생성한다.
- SxtD는 중간 6의 C-1과 C-5 사이에 이중 결합을 부가하여 중간 7의 C-5와 C-6 사이의 1,2-H 시프트를 일으킨다.
- SxtS는 중간체 8을 생성하는 이중결합을 에폭시화한 후 알데히드에 대해 에폭시드를 개방하여 중간체 9를 형성한다.
- SxTU는 STX 중간체 9의 말단 알데히드기를 환원하여 중간체 10을 형성한다.
- SxtIJK는 카르바모일기를 중간 10에서 유리 수산기로의 전달을 촉매하여 중간 11을 형성한다.
- SxtH 및 SxtT는 SxtV 및 SxtW 유전자 클러스터와 함께 C-12의 연속 히드록실화라는 유사한 기능을 수행하므로 색시톡신이 생성되고 STX 생합성 경로가 종료된다.
질병과 중독
독물학
색시톡신은 기니피그에게 매우 독성이 강하며 근육 내 주입 시 5μg/kg으로 치명적이다.생쥐의 치사량(LD50)은 다양한 투여 경로와 매우 유사하다. 즉, i.v.는 3.4μg/kg, i.p.는 10μg/kg, p.o.는 263μg/kg이다.사람의 경구 LD50은 5.7μg/kg이므로 약 0.57mg(모래 중간 크기의 1/8)을 섭취하면 치사하고 주입에 의한 치사량은 약 1/10(약 0.6μg/kg)이다.에어로졸화 색시톡신의 인체 흡입 독성은 5 mg·min/m로3 추정된다.색시톡신은 열린 상처를 통해 체내에 들어갈 수 있으며, 이 경로로 인해 사람당 50μg의 치사량이 [21]제안되었다.
인간의 질병
삭시톡신의 해로운 수치의 섭취와 관련된 인간의 질병은 마비성 패류 중독 또는 PSP로 알려져 있으며 삭시톡신과 그 유도체는 종종 "PSP 독소"[1]라고 불립니다.
색시톡신의 의학적, 환경적 중요성은 다이노플라겔레이트나 시아노박테리아에서 독소를 농축할 수 있는 오염된 조개류와 특정 핀피쉬의 섭취에서 비롯된다.PSP에서 일어나는 신경 나트륨 채널의 차단은 증상 진행을 통해 희생자를 침착하고 의식적으로 만드는 박리 마비를 일으킨다.호흡 부전으로 사망하는 경우가 많다.PSP 독소는 해조류 원천에서 먹이 사슬을 통해 상위 [3]포식자로의 영양 전달과 관련된 다양한 해양 동물 사망과 관련이 있다.
동물에 대한 연구는 색시톡신의 치사 효과를 4-아미노피리딘으로 [22][23][24]되돌릴 수 있다는 것을 보여주었지만, 인간 실험 대상자들에 대한 연구는 없다.다른 마비제와 마찬가지로, 구강 대 구강 인공호흡이나 인공호흡은 해독제가 투여되거나 [25]독이 사라질 때까지 독이 든 희생자를 살려둘 것이다.
군사적 이익
색시톡신은 LD50이 매우 낮기 때문에 무기화에 쉽게 적응한다.과거에는 미국이 군사용으로 여겼으며 [26]미군이 화학무기로 개발했다.색시톡신은 미국 중앙정보국([27]CIA)의 은밀한 목적과 공공연하게 군사용으로 개발된 것으로 알려졌다.무기 비축량 중에는 색시톡신이나 보툴리누스 독소 또는 둘 [28]다 혼합된 M1 군수품이 있었다.한편 미 중앙정보국(CIA)은 U-2 정찰기 조종사 프랜시스 게리 파워스에게 소량의 색시톡신을 은화 안에 숨겨둔 소량의 주사액 형태로 전달해 체포와 [27][28]구금에 대비해 사용한 것으로 알려졌다.
1969년 닉슨 대통령에 의한 생물전 금지 이후 미국의 색시톡신 비축량이 파괴되었고, 군사 무기로서의 색시톡신 개발은 [29]중단되었다.그러나 1975년 CIA는 [27]닉슨의 명령에 반하여 소량의 색시톡신과 코브라 독을 보관하고 있다고 의회에 보고했다.
그것은 화학무기협약의 스케줄 1에 기재되어 있다.미군은 색시톡신을 분리해 화학무기 명칭인 [30]TZ를 부여했다.
「 」를 참조해 주세요.
- 캐나다 참조 자료
- 활동 전위 – 전기 자극에 의한 뉴런 커뮤니케이션
- 알렉산드륨 타마렌세 – 단세포 생물종
- Anabaena circinalis – 박테리아의 종류
- 해조류 발생 – 해양생물을 죽일 수 있는 생물 개체 수 폭발적 증가
- 마비성 패류 중독 – 패류 중독 증후군
- 브레베톡신 – 자연적으로 생성되는 화합물 등급
- 시가톡신 – 화합물군
- 도모산
- 오카다산
- 테트로도톡신 - 뉴로독신
레퍼런스
- ^ a b Clark R. F.; Williams S. R.; Nordt S. P.; Manoguerra A. S. (1999). "A review of selected seafood poisonings". Undersea Hyperb Med. 26 (3): 175–84. PMID 10485519. Retrieved 2008-08-12.
- ^ Landsberg, Jan H. (2002). "The Effects of Harmful Algal Blooms on Aquatic Organisms". Reviews in Fisheries Science. 10 (2): 113–390. doi:10.1080/20026491051695. S2CID 86185142.
- ^ a b c d e "Saxitoxin". Retrieved April 10, 2022.
- ^ Galvão, J. A.; Oetterer, M.; Bittencourt-Oliveira Mdo, M. D. C.; Gouvêa-Barros, S.; Hiller, S.; Erler, K.; Luckas, B.; Pinto, E.; Kujbida, P. (2009). "Saxitoxins accumulation by freshwater tilapia (Oreochromis niloticus) for human consumption". Toxicon. 54 (6): 891–894. doi:10.1016/j.toxicon.2009.06.021. PMID 19560484.
- ^ Smith, E. A.; Grant, F.; Ferguson, C. M. J.; Gallacher, S. (2001). "Biotransformations of Paralytic Shellfish Toxins by Bacteria Isolated from Bivalve Molluscs". Applied and Environmental Microbiology. 67 (5): 2345–2353. Bibcode:2001ApEnM..67.2345S. doi:10.1128/AEM.67.5.2345-2353.2001. PMC 92876. PMID 11319121.
- ^ a b c Sato, S.; Kodama, M.; Ogata, T.; Saitanu, K.; Furuya, M.; Hirayama, K.; Kakinuma, K. (1997). "Saxitoxin as a toxic principle of a freshwater puffer, Tetraodon fangi, in Thailand". Toxicon. 35 (1): 137–140. doi:10.1016/S0041-0101(96)00003-7. PMID 9028016.
- ^ Landsberg, J. H.; Hall, S.; Johannessen, J. N.; White, K. D.; Conrad, S. M.; Abbott, J. P.; Flewelling, L. J.; Richardson, R. W.; Dickey, R. W.; Jester, Edward L.E.; Etheridge, Stacey M.; Deeds, Jonathan R.; Van Dolah, Frances M.; Leighfield, Tod A.; Zou, Yinglin; Beaudry, Clarke G.; Benner, Ronald A.; Rogers, Patricia L.; Scott, Paula S.; Kawabata, Kenji; Wolny, Jennifer L.; Steidinger, Karen A. (2006). "Saxitoxin Puffer Fish Poisoning in the United States, with the First Report of Pyrodinium bahamense as the Putative Toxin Source". Environmental Health Perspectives. 114 (10): 1502–1507. doi:10.1289/ehp.8998. PMC 1626430. PMID 17035133.
- ^ Deeds, J. R.; Landsberg, J. H.; Etheridge, S. M.; Pitcher, G. C.; Longan, S. W. (2008). "Non-Traditional Vectors for Paralytic Shellfish Poisoning". Marine Drugs. 6 (2): 308–348. doi:10.3390/md6020308. PMC 2525492. PMID 18728730.
- ^ Lagos, N. S.; Onodera, H.; Zagatto, P. A.; Andrinolo, D. ́O.; Azevedo, S. M. F. Q.; Oshima, Y. (1999). "The first evidence of paralytic shellfish toxins in the freshwater cyanobacterium Cylindrospermopsis raciborskii, isolated from Brazil". Toxicon. 37 (10): 1359–1373. doi:10.1016/S0041-0101(99)00080-X. PMID 10414862.
- ^ TTX-producing 박테리아 종 metazoans와 관련된 보다 포괄적인 고찰은 이 독소 또는 독성 관찰 생합성, 차우 R, Kalaitzis JA, Neilan BA(7월 2011년)를 참조하십시오. 격리되어 있다."tetrodotoxin의 기원과 생합성에"(PDF).수생 독물학. 104(1–2):61–72. doi:10.1016/j.aquatox.2011.04.001.PMID 21543051.
- ^ Bordner J.; Thiessen W. E.; Bates H. A.; Rapoport H. (1975). "The structure of a crystalline derivative of saxitoxin. The structure of saxitoxin". Journal of the American Chemical Society. 97 (21): 6008–12. doi:10.1021/ja00854a009. PMID 1176726.
- ^ Schantz E. J.; Ghazarossian V. E.; Schnoes H. K.; Strong F. M.; Springer J. P.; Pezzanite J. O.; Clardy J. (1975). "The structure of saxitoxin". Journal of the American Chemical Society. 97 (5): 1238–1239. doi:10.1021/ja00838a045. PMID 1133383.
- ^ Bates H. A.; Kostriken R.; Rapoport H. (1978). "A chemical assay for saxitoxin. Improvements and modifications". Journal of Agricultural and Food Chemistry. 26 (1): 252–4. doi:10.1021/jf60215a060. PMID 621331.
- ^ Tanino H.; Nakata T.; Kaneko T.; Kishi Y. (1997). "A stereospecific total synthesis of d,l-saxitoxin". Journal of the American Chemical Society. 99 (8): 2818–9. doi:10.1021/ja00450a079. PMID 850038.
- ^ Bhonde V. R.; Looper R. E. (2011). "A stereocontrolled synthesis of (+)-saxitoxin". Journal of the American Chemical Society. 133 (50): 20172–4. doi:10.1021/ja2098063. PMC 3320040. PMID 22098556.
- ^ Fleming J. J.; McReynolds M. D.; Du Bois J. (2007). "(+)-Saxitoxin: a first and second generation stereoselective synthesis". Journal of the American Chemical Society. 129 (32): 9964–75. doi:10.1021/ja071501o. PMID 17658800.
- ^ Handbook of toxicology of chemical warfare agents. Gupta, Ramesh C. (Ramesh Chandra), 1949- (Second ed.). London: Academic Press. 21 January 2015. p. 426. ISBN 978-0-12-800494-4. OCLC 903965588.
{{cite book}}: CS1 유지보수: 기타 (링크) - ^ Huot, R. I.; Armstrong, D. L.; Chanh, T. C. (June 1989). "Protection against nerve toxicity by monoclonal antibodies to the sodium channel blocker tetrodotoxin". Journal of Clinical Investigation. 83 (6): 1821–1826. doi:10.1172/JCI114087. PMC 303901. PMID 2542373.
- ^ a b Stüken, Anke; Orr, Russell; Kellmann, Ralf; Murray, Shauna; Neilan, Brett; Jakobsen, Kjetill (18 May 2011). "Discovery of Nuclear-Encoded Genes for the Neurotoxin Saxitoxin in Dinoflagellates". PLOS ONE. 6 (5): e20096. Bibcode:2011PLoSO...620096S. doi:10.1371/journal.pone.0020096. PMC 3097229. PMID 21625593.
- ^ a b Kellmann, R.; Mihali, T. K.; Jeon, Y. J.; Pickford, R.; Pomati, F.; Neilan, B. A. (2008). "Biosynthetic Intermediate Analysis and Functional Homology Reveal a Saxitoxin Gene Cluster in Cyanobacteria". Applied and Environmental Microbiology. 74 (13): 4044–4053. Bibcode:2008ApEnM..74.4044K. doi:10.1128/AEM.00353-08. PMC 2446512. PMID 18487408.
- ^ Patocka J; Stredav L (April 23, 2002). Price, Richard (ed.). "Brief Review of Natural Nonprotein Neurotoxins". ASA Newsletter. 02–2 (89): 16–23. ISSN 1057-9419. Retrieved 26 May 2012.
- ^ Benton, B. J.; Keller, S. A.; Spriggs, D. L.; Capacio, B. R.; Chang, F. C. (1998). "Recovery from the lethal effects of saxitoxin: A therapeutic window for 4-aminopyridine (4-AP)". Toxicon. 36 (4): 571–588. doi:10.1016/s0041-0101(97)00158-x. PMID 9643470.
- ^ Chang, F. C.; Spriggs, D. L.; Benton, B. J.; Keller, S. A.; Capacio, B. R. (1997). "4-Aminopyridine reverses saxitoxin (STX)- and tetrodotoxin (TTX)-induced cardiorespiratory depression in chronically instrumented guinea pigs". Fundamental and Applied Toxicology. 38 (1): 75–88. doi:10.1006/faat.1997.2328. PMID 9268607.
- ^ Chen, H.; Lin, C.; Wang, T. (1996). "Effects of 4-Aminopyridine on Saxitoxin Intoxication". Toxicology and Applied Pharmacology. 141 (1): 44–48. doi:10.1006/taap.1996.0258. PMID 8917674.
- ^ "Paralytic shellfish poisoning (PSP)" (PDF). Fish Dept. Sabah Malaysia. Retrieved April 10, 2022.
- ^ Stewart, Charles Edward (2006). Weapons of Mass Casualties and Terrorism Response Handbook. Jones & Bartlett Learning. p. 175. ISBN 978-0-7637-2425-2. Retrieved 4 May 2015.
- ^ a b Wheelis, Mark; Rozsa, Lajós; Dando, Malcolm (2006). Deadly Cultures: Biological Weapons since 1945. President and Fellows of Harvard College. p. 39. ISBN 978-0-674-01699-6. Retrieved 4 May 2015.
- ^ Mauroni, Albert J. (2000). America's Struggle with Chemical-biological Warfare. 88 Post Road West, Westport, CT 06881: Praeger Publishers. p. 50. ISBN 978-0-275-96756-7. Retrieved 4 May 2015.
{{cite book}}: CS1 유지보수: 위치(링크) - ^ "Saxitoxin fact sheet" (PDF). Organisation for the Prohibition of Chemical Weapons (OPCW). June 2014.
외부 링크
- [1] 마비성 패류 중독
- [2] 닐 에드워즈화학 연구소.화학, 물리, 환경과학부.서섹스 대학교 브라이튼입니다색시톡신 - 식중독에서 화학전까지
- 수중 독성 시아노박테리아: 공중위생에 미치는 영향, 감시 및 관리에 대한 가이드입니다.1999년 잉그리드 코러스와 제이미 바트람에 의해 편집되었습니다.세계보건기구에서 발행.ISBN 0-419-23930-8