탄저균 독소
Anthrax toxin| 탄저균 독소 치사인자 중간 영역 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
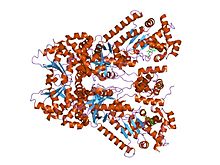 소분자 억제제인 bi-mfm3, 3-{5-[5-(4-클로로페닐)-프랑-2-일메틸렌]-4-옥소-2-티오옥소-티아졸리딘-3-일}-프로피온산에 결합된 탄저균 치사 인자의 X선 결정 구조. | |||||||||
| 식별자 | |||||||||
| 기호. | 탄저균-톡스_M | ||||||||
| 팜 | PF09156 | ||||||||
| 인터프로 | IPR015239 | ||||||||
| SCOP2 | 1j7n/SCOPe/SUPFAM | ||||||||
| OPM 슈퍼 패밀리 | 35 | ||||||||
| |||||||||
| 탄저균 독소 치사 인자 N 및 C 말단 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
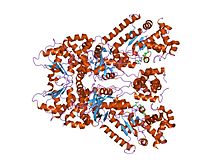 탄저균 치사인자의 결정구조로 티오아세틸-아세틸-프로-메트아미드, 금속함유펩티딜소분자억제제 복합체 | |||||||||
| 식별자 | |||||||||
| 기호. | ATLF | ||||||||
| 팜 | PF07737 | ||||||||
| 인터프로 | IPR014781 | ||||||||
| 메롭스 | M34 | ||||||||
| SCOP2 | 1pwq/SCOPe/SUPFAM | ||||||||
| |||||||||
| 탄저균 독소 LF 서브유닛 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | 탄저균_톡스a | ||||||||
| 팜 | PF03497 | ||||||||
| SCOP2 | 1jky/SCOPe/SUPFAM | ||||||||
| |||||||||

탄저균 독소는 탄저균의 원인물질인 안트라시스균의 독성이 강한 변종에서 분비되는 3단백질 엑소톡신이다.독소는 1954년 [1]해리 스미스에 의해 처음 발견되었다.탄저균 독소는 보호항원으로 알려진 세포결합 단백질과 부종인자와 치사인자로 불리는 두 가지 효소 성분으로 구성되어 있다.이 세 가지 단백질 성분은 함께 작용하여 생리적인 영향을 준다.독소성분을 포함한 조립착체를 내구성한다.엔도솜에서 독소의 효소 성분이 표적 세포의 세포질로 전이된다.일단 세포에 들어가면, 독소의 효소 성분이 다양한 면역 세포 기능, 즉 세포 신호 전달과 세포 이동을 방해합니다.이 독소는 대식세포에서 관찰된 바와 같이 세포 용해를 유도할 수도 있다.탄저균 독소는 박테리아가 면역체계를 회피하고, 증식하며,[2] 궁극적으로 숙주를 죽일 수 있게 해준다.탄저균 독소에 대한 연구는 또한 고분자 집합체의 생성, 단백질 전위, 모공 형성, 세포내막증, 그리고 다른 생화학적 과정에 대한 통찰력을 제공합니다.
무연통균 독성인자
탄저균은 포자형성 그램 양성 막대모양균인 Bacillus Anthracis에 의한 질병이다(그림 1 ).이 질병의 치사율은 (i) 항식세포인 폴리글루탐산 캡슐과 (ii) 탄저균 독소라고 불리는 삼분단백질 독소의 두 가지 주요 독성 인자에 의해 발생한다.탄저균 독소는 (i) 보호항원 (PA), (ii) 부종인자 (EF) 및 (ii) 치사인자 (LF)의 세 가지 단백질 성분들의 혼합물이다.
작용 메커니즘
탄저균 독소는 A/B 독소이다.각각의 탄저균 독소 단백질은 독성이 없다.독성 증상은 이러한 단백질을 실험 동물에게 개별적으로 주입할 때 관찰되지 않는다.PA와 EF의 공주사는 부종을 일으키고 PA와 LF의 공주사는 치명적이다.전자의 조합을 부종 독소라고 하고 후자의 조합을 치사 독소라고 합니다.따라서 생리학적 증상의 징후는 어느 경우든 PA를 필요로 한다.
동물 모델 실험에서 관찰된 PA 요구 사항은 A/B 패러다임이라고 불리는 박테리아 독소에 대한 공통 패러다임을 보여준다.A 성분은 효소적으로 활성이며, B 성분은 세포 결합 성분이다.탄저균 독소는 AB형이며2 EF와 LF라는 두 효소가 A 성분이고 PA가 B 성분입니다.따라서 PA는 트로이 목마 역할을 하며, EF와 LF를 혈장막을 통해 세포로 운반하여 정상적인 세포 [citation needed]생리를 방해하는 반응을 촉매할 수 있습니다.
탄저균 독소 조립 및 전위
탄저균 독소 단백질 성분이 기능하기 위해서는 홀로톡신 복합체로 조립되어야 한다.LF와 EF가 대상 세포 내에서 기능하기 위해서는 세포에 국재하고 세포질로 들어가야 한다.일련의 단계를 통해 PA는 EF와 LF를 셀에 전송할 수 있습니다(그림 2).이 과정은 PA83이라고 불리는 83-kDa 형태의 PA가 탄저균 독소 수용체에 결합할 때 시작됩니다.PA83에 결합하는 두 개의 알려진 상동 수용체가 있는데, 종양 내피 마커 8과 모세관 형태 형성 단백질 2라고 불립니다.[3]그런 다음 20kDa 단편(PA20)은 푸린 계열의 막내단백질가수분해효소에 의해 PA83의 아미노 말단에서 분리된다.PA20이 분리될 때 PA63이라고 불리는 PA의 나머지 수용체 결합 부분은 7중합체[4] 또는 8중합체[5] 고리 모양의 올리고머로 조립될 수 있다.이 고리 모양의 올리고머는 종종 PA의 프리 포어(또는 프리 채널) 형태로 언급되는데, 이는 나중에 경로에서 트랜스로카아제 기공이 되기 때문이다.PA20 부분 방출 시 노출된 프리포어 올리고머의 표면은 LF 및 [6]EF에 결합할 수 있습니다.이어서 PA 올리고머의 7중합체 및 8중합체 형태는 각각 [5][7]최대 3분자 또는 4분자의 EF 및/또는 LF와 결합할 수 있다.그런 다음 세포는 이 조립된 복합체를 세포 내 산성으로 운반한다.엔도솜에서 발생하는 pH가 낮으면 PA63 프리채널이 양이온 선택채널로 변환됩니다.EF와 LF는 pH 구배에 의해 채널을 통해 구동되며, 효소 인자가 세포로 [8]들어갈 수 있습니다.
LF 및 EF의 효소 기능
사이토솔에 들어가면 EF 및 LF는 각각의 손상 유도 [9]프로세스를 수행합니다.
- EF는2+ Ca 및 칼모듈린 의존성 아데닐산 시클라아제 역할을 하여 세포 내 cAMP 수치를 크게 증가시킨다.이러한 cAMP의 증가는 물의 항상성을 혼란시키고, 세포 내 신호 전달 경로를 심각하게 불균형시키며, 대식세포 기능을 손상시켜 박테리아가 면역 체계를 더욱 회피할 수 있게 한다.
- LF는 또한 대식세포를 죽임으로써 박테리아가 면역체계를 회피하도록 돕는다.일단 이러한 세포에서 LF는 마이트젠 활성 단백질 키나제(MAPKK)의 N 말단을 잘라내는 Zn2+ 의존성 엔도프로테아제 역할을 한다.이것은 기질에 효율적으로 결합하는 것을 허용하지 않음으로써 이러한 키나아제들을 억제하고, 이는 신호 경로를 변화시키고 궁극적으로 아포토시스(apoptosis)로 이끈다.
따라서, 이 세 가지 단백질의 상승 효과는 단백질이 세포로 들어가 세포 기능을 방해할 수 있는 일련의 사건들을 통해 세포사로 이어진다.
세포외 독소구조-기능관계
탄저균 독소 작용의 메커니즘은 숙주 세포의 생체 분자와 결합된 세 가지 독소 단백질의 분자 구조의 결과이다.분자 상호작용은 PA, EF, LF 및 세포 수용체(ANTXR1 및 ANTXR2)의 구조에 대한 상세한 분석을 수행함으로써 명백해진다.독소 분자(그림 3-5), 수용체 및 분자 복합체에 대한 구조는 모두 이러한 단백질의 상승 작용에 대한 통찰력을 제공했다.결합 부위와 구조 변경에 대한 분석은 표 1에 간략히 설명한 바와 같이 PA, LF 및 EF의 각 영역의 기능을 설명하면서 구조 연구를 강화했다.
PA의 구조가 가장 먼저 결정되었다(그림 3).[10]이러한 구조와 세포 수용체의 구조는 인식과 [11]결합의 특이성에 많은 빛을 비춥니다.PA와 수용체 CMG2(타입 I와 유사)의 특이성은 금속 이온 의존 접착 부위(MIDAS), 소수성 홈 및 β-헤어핀 투영을 통한 상호작용에 기인한다.이 모든 것은 CMG2(및 TEM8)의 많은 단백질 표면적이 [12]묻혀 있는 긴밀한 상호작용에 기여합니다.
Petosa 등은 PA63 헵타머의 구조를 4.5Ω(0.45nm)[10]에서 해결했다.이들이 해결한 구조는 비막 결합 프리 포어(pre-pore)로, 복합체가 혈장막을 통해 β-배럴을 확장하여 LF와 EF를 세포로 셔틀링하기 전의 헵타머의 구조였다.
PA20 프래그먼트에 의해 헵타머화 및 기공 형성이 입체적으로 저해되지만 단량체 상부에서 제거되면 프리포어가 빠르게 형성된다.헵타머 형성은 각 개별 단량체의 형태에 큰 변화를 일으키지는 않지만, 결합함으로써 단백질 표면 15400Ω²(154nm2) 이상이 묻힌다.이 매립 표면은 대부분 도메인 1과 [10]2의 극성 또는 대전 측 그룹으로 구성됩니다.
또한 PA는 8진수 프리채널 [5]구조를 형성합니다.팔분지형은 칠분지형보다 내열성이 높은 것으로 나타나 탄저균 감염 [5]시 팔분지 올리고머가 숙주의 혈장에서 지속될 수 있다.
PA63의 올리고머화 중에 EF 및/또는 LF 분자가 PA 프리채널에 신속하고 동시에 결합한다.이 바인딩은 PA20 도메인을 삭제한 후 PA63 도메인1에서 큰 소수성 표면이 발견되기 때문에 발생합니다.도메인 1은 가 EF 및 [13]LF의 N 말단과 상호작용하는 큰 표면을 제공하며, 이는 첫 번째 ~36개의 잔류물에 대해 거의 완전히 상동성이며 첫 번째 ~250개의 [14]잔류물에 대해서는 3차 구조가 유사하다.LF와 EF의 결합 영역에 대한 연구는 헵타머 [15]구성일 때 큰 표면적이 인접한 2개의 PA63 분자의 도메인 1과 접촉한다는 것을 보여주었다.이 큰 결합 영역은 이전 연구들이 PA63 헵타머에서 최대 3개의 분자만 결합할 수 있었던 이유를 설명해 줍니다.N-terminal LF와 복잡한 PA 옥타머의 공동 결정 구조는 결합 상호작용이 실제로는 두 개의 불연속적인 사이트임을 [13]밝혀냈습니다.C-말단 서브사이트라고 불리는 한 사이트는 염교와 정전 상호작용을 예측한 전형적인 "핫스팟"과 유사하다.알파클램프 서브사이트라고 불리는 다른 부위는 LF의 N 말단 알파나선 및 짧은 베타 가닥을 비특이적으로 결합하는 깊은 균열로 기질의 N 말단을 PA 프리채널 내강으로 유도한다.이와 같이 알파 클램프는 단백질 전위, 비특이적 결합 및 [16]기질에서 풀리면서 2차 구조를 펼치는 데 도움이 된다.LF/EF 결합 부위는 현재 융합 단백질을 통한 치료제 전달에 이용되고 있다.
프리포어 형성 및 LF 및/또는 EF의 부착에 따라 헵타머는 지질 뗏목으로 이동하여 신속하게 엔도사이즈된다.엔도사이토시스는 일련의 사건의 결과로 발생한다.이것은 CMG2 또는 TEM8이 팔미토일화되었을 때 시작되며, 이것은 지질 뗏목과의 수용체 연결을 억제합니다.이것은 PA83이 절단되기 전에 그리고 LF 또는 EF가 헵타머와 결합하기 전에 수용체가 내구성되는 것을 억제한다.PA63이 수용체에 결합하여 헵타머화 할 때 콜레스테롤 및 글리코스피드가 풍부한 마이크로도메인(지질 뗏목)과 수용체의 재결합이 일어난다.일단 수용체와 PA가 지질 뗏목으로 돌아오면, E3 유비퀴틴 리가아제 Cb1은 수용체의 세포질 꼬리를 유비퀴티화하고, 수용체 및 세포내 종양을 위한 관련 독소 단백질 신호를 보낸다.탄저균 독소가 클라트린 의존 [17]경로를 통해 세포로 들어가는 것을 나타내는 이 엔도사이토시스 발생에는 다이너신과 Eps15가 필요하다.
앞서 설명한 바와 같이 각 분자는 탄저균 독소의 세포내이입을 유도하기 위해 여러 분자와 상호작용한다.일단 안에 들어가면 복합체는 산성 구획으로 이동되며, 여기서 여전히 비막 스패닝 프리 포어 배열을 가진 헵타머는 EF 및 LF의 세포내 [18]전위를 위해 준비된다.
소포에서 세포졸까지의 구조-기능 관계
모공 형성
얼핏 보면 PA의 1차 배열은 막간 단백질의 1차 배열과 달라 보인다.소수성 그림에는 가능한 막 확장 도메인에 공통적인 패턴이 없습니다.디프테리아 독소와 같은 다른 다량체 막 단백질의 구조는 PA가 막에 걸쳐 있는 방법에 대한 답을 제공한다.PA는 각 단량체의 [10]극성 아미노산과 비극성 아미노산의 연장으로부터 만들어진 β-배럴을 형성하는 이러한 다량막 단백질과 같은 작용을 하는 것으로 생각된다.
β-배럴 모공의 형성은 pH의 강하에 의해 촉진된다.pH가 떨어졌을 때 배럴을 형성하려면 PA63 도메인2에서 가장 큰 컨피그레이션 변경이 필요합니다.도메인 2의 구조를 조사하면(그림 7), 이 도메인에는 그리스어 키 모티브(그림 7의 금색 부분)가 포함되어 있는 것을 알 수 있다.그림 8에 그리스어 키 모티브의 개략도를 나타냅니다.도메인 2의 그리스어 키에는 큰 무질서 루프가 연결되어 있습니다.모공 형성에 있어서 이 루프의 필요성은 돌연변이 유발과 키모트립신에 의한 루프의 단백질 분해를 통해 나타난다.시스테인 치환의 추가적인 전기생리학적인 측정은 이 루프의 아미노산을 막 삽입된 모공의 내강 안에 배치합니다.도메인 2의 무질서한 루프는 또한 소수성 아미노산과 친수성 아미노산이 번갈아 나타나는 패턴을 가지며, 이는 포린의 막확장 부분에 보존된 패턴이다.유일한 문제는 루프가 β-배럴의 막을 덮을 만큼 크지 않다는 것입니다.이 막 삽입은 추가적인 구조 변화가 있어야만 발생할 수 있습니다.그리스 키 모티브가 전개되는 곳에서 큰 배향 변화가 일어나 막에 아래쪽을 향해 돌출되어 복합체의 다른 6개의 단량체와 β배럴을 형성한다(그림 9a 및 9b).최종 기공의 지름은 12Ω(1.2nm)로 이 [10]모델의 이론적 값에 부합합니다.
이 모델은 그리스-키 모티프가 도메인의 중심에서 벗어나면서 많은 수소 결합의 파괴와 함께 도메인 2의 큰 구조 변화를 필요로 한다.Petosa 등은 [10]이러한 현상이 어떻게 일어나는지에 대한 모델을 제안했다.PA 그리스어 키 모티브는 헵타머가 산성화되었을 때 막에 삽입된다.인공 양층에서는 pH가 7.4에서 6.5로 떨어졌을 때 이러한 현상이 발생하며, 이는 삽입 트리거가 히스티딘의 적정을 수반함을 시사한다.도메인 2에는 다수의 히스티딘(그림9a에서는 아스타리스크로 표시)이 포함되어 있기 때문에, 이것은 PA의 시퀀스에 확실히 들어맞습니다.3개의 히스티딘 잔기는 무질서 루프에서 발견되며, 그 중 하나는 극성 아미노산 클러스터 내의 그리스 키 히스티딘과 함께 존재한다.이 클러스터(히스티딘 2개, 아르기닌 3개, 글루타메이트 1개 포함)는 그리스 키 모티브의 상단에 내장되어 있기 때문에 이들 히스티딘의 양성자화가 클러스터를 교란시키는 것을 쉽게 알 수 있다.또한 그리스 키 모티브의 밑부분에 다수의 소수성 잔류물과 함께 또 다른 히스티딘이 위치한다(그림 7 및 9a의 녹색 세그먼트).pH 7.4에서 이 세그먼트는 순서가 매겨지지만, pH 6.0에서 결정이 성장하면 무질서가 된다.이러한 무질서 전환 순서는 PA 막 삽입의 첫 번째 단계입니다.
PA는 수용체에 부착된 수용성 헵타머로서 엔도사이팅되며, LF 또는 EF는 화물로서 헵타머에 부착된다.자궁내막증 후 첫 단계는 자궁내막의 산성화이다.산성화는 독소의 수명에 두 가지 역할을 한다.첫째, PA에 대한 CMG2 또는 TEM8 수용체의 꽉 막힌 그립을 완화하여 모공 형성을 촉진합니다(다른 수용체는 약간 다른 [12]pH로 삽입할 수 있습니다).둘째, pH의 강하에 의해 PA 도메인 2의 무질서한 루프와 그리스어 키 모티브가 헵타머 프리 포어에서 접혀 나와 산성 소포의 벽을 통해 삽입되어 기공이 형성된다(그림 7~9).
Santelli 등은 PA/CMG2 [12]복합체의 결정 구조를 확인한 후 이 과정에 대해 더 많은 것을 설명했다.이 복합체의 구조는 PA의 도메인2와 4에 의한 CMG2의 바인딩을 나타내고 있습니다.이 상호작용은 그리스 키를 펼 수 있는 자유가 적음을 보여준다.추가 분석에 따르면 PA의 9개의 히스티딘 중7개가 도메인 2/도메인 4 인터페이스 상에 있습니다.이러한 히스티딘의 양성자화는 그리스 키가 튀어나올 수 있을 정도로 도메인이 분리되고 삽입에 관여하는 β-헤어핀을 형성하는데 도움을 준다.또한 PA가 CMG2에 결합하면 인공막에 삽입할 때와 마찬가지로 pH 6.5에서 삽입하지 않는다.대신 자연 세포에 삽입하려면 5.0의 pH가 필요합니다.이 차이는 CMG2의 MIDAS 모티브 옆에 포켓이 있기 때문이라고 설명했습니다.이 주머니에는 도메인 2가 부착되는 바닥에 히스티딘이 묻혀 있습니다.이 히스티딘은 낮은 pH에서 양성자화되어 PA에 더 큰 안정성을 부여한다.이 추가된 안정성은 더 산성 조건이 충족될 때까지 그리스 키가 움직이지 못하게 합니다.이 히스티딘들은 모두 헵타머가 내구성세포증이 발생하기 전에 일찍 삽입되는 것을 막기 위해 함께 작용한다.
Santeli와 동료들(그림 10)도 막 삽입 PA/CMG2 구조의 가상 구조를 구축했다.이 모델은 β-배럴의 길이가 약 70Ω(7nm)이고, 이 중 30Ω(3nm)은 막에 걸쳐 있으며, 40Ω(4nm) 간격은 CMG2 수용체의 나머지 세포 외 부분(잔기 약 100개)으로 채워져 있음을 보여준다.CMG2는 모공을 추가로 지지합니다.
단백질 전위
최근 여러 연구에 따르면 PA63 모공이 내강이 매우 작을 때 EF와 LF를 세포질로 유입시키는 방법을 보여줍니다.PA63 모공의 내강은 지름이 15Ω(1.5nm)에 불과하며, 이는 LF 또는 EF의 직경보다 훨씬 작습니다.전위는 산화될 때 내핵체에서 시작되는 일련의 사건들을 통해 발생한다.LF와 EF는 pH에 민감하며 pH가 떨어지면 구조가 안정성이 떨어집니다.pH 6.0 이하(엔도솜의 pH)에서는 LF와 EF 모두 무질서한 용융구체가 됩니다.분자가 이러한 형태일 때, N-말단은 양성자 구배와 양의 막 통과 전위에 의해 모공으로 빨려 들어간다.모공(페닐알라닌 클램프)의 구강 엔도솜 측에 있는 7개의 페닐알라닌 고리는 LF 또는 EF에서 발견되는 소수성 잔류물과 상호작용함으로써 LF 또는 EF의 전개를 돕는다.양성자 구배는 모공을 통해 단백질을 묶기 시작합니다.레이싱 메커니즘은 기울기에 의해 구동되지만 래칫 모션을 위해서는 페닐알라닌 클램프가 필요합니다.EF와 LF의 처음 250개의 잔류물은 염기성, 산성 및 소수성 잔류물의 불규칙한 교대로 배열되어 있다.페닐알라닌 클램프와 양성자화 상태 사이의 상호작용은 N 말단 리폴드로서 모공을 통해 나머지를 끌 수 있을 만큼 충분히 세포질로 교차될 때까지 단백질을 구동하는 래칫 효과를 일으킨다.[19]
레퍼런스
- ^ Smith H, Keppie J (1954). "Observations on experimental anthrax: demonstration of a specific lethal factor produced in vivo by Bacillus anthracis". Nature. 173 (4410): 869–70. Bibcode:1954Natur.173..869S. doi:10.1038/173869a0. PMID 13165673. S2CID 4171690.
- ^ Maldonado-Arocho; et al. (2009). "Anthrax Toxin". Microbial Toxins: Current Research and Future Trends. Caister Academic Press. ISBN 978-1-904455-44-8.
- ^ Sternbach, G. (2003). "The history of anthrax". Journal of Emergency Medicine. 24 (4): 463–467. doi:10.1016/S0736-4679(03)00079-9. PMID 12745053.
- ^ Green, B. D.; Battisti, L.; Koehler, T. M.; Thorne, C. B.; Ivins, B. E. (1985). "Demonstration of a capsule plasmid in Bacillus anthracis". Infection and Immunity. 49 (2): 291–297. doi:10.1128/iai.49.2.291-297.1985. PMC 262013. PMID 3926644.
- ^ a b c d Kintzer, A. F.; Thoren, K. L.; Sterling, H. J.; Dong, K. C.; Feld, G. K.; Tang, I. I.; Zhang, T. T.; Williams, E. R.; Berger, J. M.; Krantz, B. A. (2009). "The Protective Antigen Component of Anthrax Toxin Forms Functional Octameric Complexes". Journal of Molecular Biology. 392 (3): 614–629. doi:10.1016/j.jmb.2009.07.037. PMC 2742380. PMID 19627991.
- ^ Abrami L, Reig N, van der Goot FG (2005). "Anthrax toxin: the long and winding road that leads to the kill". Trends Microbiol. 13 (2): 72–78. doi:10.1016/j.tim.2004.12.004. PMID 15680766.
- ^ Grinberg LM, Abramova FA, Yampolskaya OV, Walker DH, Smith JH (2001). "Quantitative pathology of inhalational anthrax I: quantitative microscopic findings". Mod Pathol. 14 (5): 482–495. doi:10.1038/modpathol.3880337. PMID 11353060.
- ^ Friedlander AM, Bhatnagar R, Leppla SH, Johnson L, Singh Y (1993). "Characterization of macrophage sensitivity and resistance to anthrax lethal toxin". Infect Immun. 61 (1): 245–252. doi:10.1128/iai.61.1.245-252.1993. PMC 302711. PMID 8380282.
- ^ Singh Y, Leppla SH, Bhatnagar R, Friedlander AM (1989). "Internalization and processing of Bacillus anthracis lethal toxin by toxin-sensitive and -resistant cells". J Biol Chem. 264 (19): 11099–11102. doi:10.1016/S0021-9258(18)60433-8. PMID 2500434.
- ^ a b c d e f Petosa, C.; Collier, R. J.; Klimpel, K. R.; Leppla, S. H.; Liddington, R. C. (1997). "Crystal structure of the anthrax toxin protective antigen". Nature. 385 (6619): 833–838. Bibcode:1997Natur.385..833P. doi:10.1038/385833a0. PMID 9039918. S2CID 4341696.
- ^ Lacy, D. B.; Wigelsworth, D. J.; Scobie, H. M., Young, J. A.; Collier, R. J. 결정구조 폰 윌브랜드 인자의 인간 모세혈관 형태형성 단백질 2 도메인: 탄저독소 수용체.검사님, Natl.학술원, 미국 과학부 2004, 101, 6367-6372.
- ^ a b c 탄저균 독소와 숙주 세포 수용체 사이의 복합체의 결정 구조, Leppla, S. H., Liddington, R. C.자연.2004, 430, 905–908.
- ^ a b Feld GK, Thoren KL, 킨처 AF, 스털링 HJ, 탕 II, 그린버그 SG, 윌리엄스 ER, 크랜츠 BA.보호 항원 올리고머에 의해 탄저균 치사 인자가 발현되는 구조적 기초.Nat Structure Mol Biol.2010, 17(11):1383-80.
- ^ 파니퍼, T.Y. 웡, R. 레나투스, M. 페토사, C. 비엔코우스카, J. 레이시, D. 콜리에, R. J., 파크, S. 렙, S.자연.2001, 414, 230–233.
- ^ Melnyk, R. A., H. M., H. H. M. H. L., L., Gessner, C. R., L., L., Woods, L., Collier, R. J. 탄저균의 치명적인 결합에 대한 구조적 결정인자.J. Biol.2006년, 281, 1630-1635년
- ^ Feld GK, 브라운 MJ, 크랜츠 BA탄저균 독소로 단백질 전이를 촉진하고 있어Prot Sci. 2012, 21(5):606-24.
- ^ Abrami, L.; Liu, S.; Cosson, P.; Leppla, S. H.; van der goot, F. G. 탄저균 독소는 지질 뗏목 매개 클라트린 의존성 과정을 통해 수용체의 세포내 이식을 유발한다.J. 셀바이올2003, 160, 321–328.
- ^ Mourez, M. 탄저균 독소.피솔 목사님생화학.약골.2004, 152, 135–164.
- ^ A. Krantz Bryan, Bryan; Finkelstein, Alan; Collier, John (2006). "Protein Translocation through the Anthrax Toxin Transmembrane Pore is Driven by a Proton Gradient" (PDF). Journal of Molecular Biology. 355 (5): 968–979. doi:10.1016/j.jmb.2005.11.030. PMID 16343527. Retrieved 14 September 2021.
외부 링크
- '이 달의 분자' 2012년 4월
- PDB for UniProt: P15917(치명적 인자)에서 PDBe-KB에 제공되는 모든 구조 정보의 개요.







