도르사이언스
Dauricine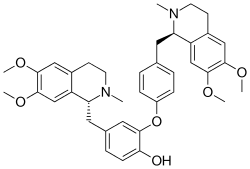 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 (1R1,7R1)-16,17,76,7-테트라메트호xy-172,7-디메틸-121,12,13,1,741,723,7-옥타하이드로-4-옥사-14,7(1)-다이소퀴놀리나-3(1,3),5(1,4)-디벤젠나헵탄-3-3-3-올4 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.208.622 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C38H44N2O6 | |
| 어금질량 | 624.778 g·1998−1 |
| 밀도 | 1.186 g/mL |
| 녹는점 | 섭씨 115도 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
다우르센은 식물 대사물로 화학적으로 페놀, 방향족 에테르, 이소퀴놀린 알칼로이드로 분류된다.[1] 그것은 보통 아시아 문씨로 알려진 아시아의 포도나무 메니스퍼름 다우리쿰과 캐나다 문씨로 알려진 북아메리카의 포도나무 메니스퍼름 캐나다로부터 격리되었다.[2] 과학자인 가메타니 데쓰지와 일본의 후쿠모토 게이이치로가 1964년 처음으로 아른트-에이스터 반응과 비슐러-나피에랄스키 반응을 모두 이용해 다우라이센을 합성했다는 평가를 받고 있다.[3] 도우리센은 암세포 성장을[4][5][6][7] 억제하고 심장의 투과성 Na+, K+, Ca2+ 이온 전류를 차단할 수 있는 잠재력으로 체외에서 연구되어 왔다.[8]
참조
- ^ "CHEBI:4331 - dauricine". ChEBI. Retrieved 30 May 2015.
- ^ Kametani, Tetsuji; Fukumoto, Keiichiro (1964). "Total synthesis of (±)-dauricine". Tetrahedron Letters. 5 (38): 2771–2775. doi:10.1016/S0040-4039(00)71728-X.
- ^ Manske, R.H.F. (1967). The Alkaloids: Chemistry and Physiology V9. New York: Academic Press. p. 141. ISBN 9780080865331. Retrieved 30 May 2015.
- ^ Yang, Zhengfeng; Li, Chenghai; Wang, Xiu; Zhai, Chunyan; Yi, Zhengfang; Wang, Lei; Liu, Bisheng; Du, Bing; Wu, Huihui; Guo, Xizhi; Liu, Mingyao; Li, Dali; Luo, Jian (2010). "Dauricine induces apoptosis, inhibits proliferation and invasion through inhibiting NF-kappaB signaling pathway in colon cancer cells". J. Cell. Physiol. 225 (1): 266–75. doi:10.1002/jcp.22261. PMID 20509140. S2CID 5501319.
- ^ Jin, Hua; Dai, Jieyu; Chen, Xiaoyan; Liu, Jia; Zhong, Dafang; Gu, Yansong; Zheng, Jiang (2009). "Pulmonary Toxicity and Metabolic Activation of Dauricine in CD-1 Mice". The Journal of Pharmacology and Experimental Therapeutics. 332 (3): 738–46. doi:10.1124/jpet.109.162297. PMID 20008063. S2CID 21824941.
- ^ Tang, Xu-dong; Zhou, Xin; Zhou, Ke-yuan (2009). "Dauricine inhibits insulin-like growth factor-I-induced hypoxia inducible factor 1alpha protein accumulation and vascular endothelial growth factor expression in human breast cancer cells". Acta Pharmacol Sin. 30 (5): 605–16. doi:10.1038/aps.2009.8. PMC 4002832. PMID 19349962.
- ^ Wang, Jun; Li, Yuan; Zu, Xiong-Bing; Chen, Min-Feng; Qi, Li (2012). "Dauricine can inhibit the activity of proliferation of urinary tract tumor cells". Asian Pac J Trop Med. 5 (12): 973–76. doi:10.1016/S1995-7645(12)60185-0. PMID 23199717.
- ^ Qian, JQ (2002). "Cardiovascular pharmacological effects of bisbenzylisoquinoline alkaloid derivatives". Acta Pharmacol Sin. 23 (12): 1086–92. PMID 12466045.


