AB독소5
AB5 toxin| 엔테로톡신(OB-fold B 서브유닛) | |
|---|---|
| 식별자 | |
| 기호. | 엔테로톡신 |
| 인터프로 | IPR008992 |
| SCOP2 | 2bos/SCOPe/SUPFAM |
AB5 독소는 콜레라, 이질, 용혈성 요독 증후군과 같은 인간 질병을 일으키는 것으로 알려진 특정 병원성 박테리아에 의해 분비되는 6성분 단백질 복합체이다.1개의 성분은 A 서브유닛으로 알려져 있으며, 나머지 5개의 성분은 B 서브유닛입니다.이러한 모든 독소는 표적 숙주 세포에 들어가기 위한 유사한 구조와 메커니즘을 공유합니다.B 서브유닛은 수용체에 결합하여 A 서브유닛이 세포로 들어가는 경로를 여는 역할을 한다.그런 다음 A 서브유닛은 촉매기계를 사용하여 숙주 세포의 규칙적인 기능을 [1][2]이어받을 수 있습니다.
가족들

AB5 독소에는 4가지 주요 종류가 있다.이러한 제품군은 촉매 [4]활성뿐만 아니라 A(촉매) 서브유닛의 배열로 특징지어집니다.
콜레라 독소
이 과는 Ct 또는 Ctx로도 알려져 있으며 [5]LT로 알려진 열가연성 장독소도 포함되어 있습니다.콜레라 독소의 발견은 많은 사람들에 의해 Sambhu Nath De 박사의 공로를 인정받고 있다.그는 1959년 캘커타(현재의 콜카타)에서 그의 연구를 수행했지만, 1883년 로버트 코흐에 의해 처음 정제되었다.콜레라 독소는 비브리오콜레라에 [6]의해 분비되는 단백질 복합체로 구성되어 있다.이 독소의 몇몇 증상들은 만성적이고 널리 퍼진 물성 설사와 경우에 따라 죽음에 이르는 탈수를 포함한다.
백일해독소
이 과는 Ptx로도 알려져 있고 백일해를 일으키는 독소를 함유하고 있다.백일해독소는 그램음성균인 보데텔라 백일해균에서 분비된다.백일해는 매우 전염성이 높으며 [7]예방접종에도 불구하고 미국에서 발병 건수가 서서히 증가하고 있다.증상으로는 발작성 기침과 백일해 그리고 심지어 [8]구토도 포함된다.보데텔라 백일해 박테리아는 백일해로 처음 확인되었고 1900년 프랑스에서 [9]줄스 보데와 옥타브 겅구에 의해 분리되었다.그 독소는 콜레라 [5]독소와 메커니즘을 공유한다.
살모넬라 장기의 ArtAB 독소는 두 개의 다른 계열에서 발견되는 것과 유사한 성분을 가지고 있다: ArtA(Q404H4) 서브유닛은 백일해 독소 A와 상동성이며, ArtB(Q404H3) 서브유닛은 다른 살모넬라 균주에서 발견되는 단백질과 상동성이다.A별 분류 규칙에 따르면 Ptx 계열의 [10][4]독소이다.
시가독소
STX라고도 알려진 시가 독소는 막대 모양의 시겔라 이질균과 대장균(SEC)에 의해 생성되는 독소이다.이 박테리아에 오염된 음식과 음료가 감염의 근원이며 이 독소가 어떻게 [11]퍼지는지를 알려준다.증상은 묽은 설사뿐만 아니라 복통도 포함한다.생명을 위협하는 심각한 사례는 출혈성 대장염(HC)[12]으로 특징지어진다.시가 독소의 발견은 1898년 시가 기요시 박사의 공적으로 인정된다.
서브틸라아제세포독소
이 과는 SubAB로도[4] 알려져 있으며 1990년대에 [13]발견되었다.장구소실(LEE)[14]의 궤적이 없는 SEC 변종에서 생성되며 용혈요독증후군(HUS)을 일으키는 것으로 알려져 있다.A 서브유닛 배열이 무연균의 서브유닛 계열 세린 단백질 분해효소 배열과 유사하기 때문에 서브틸라아제 세포독소라고 불린다.이 독소에 의한 증상으로는 혈소판수 감소나 혈소판감소증, 백혈구수 증가, 신장세포 [15]손상 등이 있습니다.
서브틸라아제 사이토톡신 A 서브유닛(subA, Q6EZC2)은 결합 면역글로불린 단백질(BiP)을 분해하는 단백질 분해효소로서, 소포체 스트레스 및 세포사멸을 초래한다.B 서브유닛(subB, Q6EZC3)은 [16]친화력이 높은 세포에서 N-글리콜릴뉴라민산(Neu5Gc) 글리칸에 결합한다.subB만으로도 베로세포의 [17]액포화를 일으키기에 충분하다.Neu5GC는 사람에 의해 만들어지지 않지만 SEC 감염의 빈번한 원천인 붉은 고기 및 유제품과 같은 식품 공급원으로부터 인간의 [18]내장으로 유입된다.
구조.
완전한 AB5 독소 복합체는 6개의 단백질 단위를 포함한다.5개의 유닛은 구조가 비슷하거나 동일하며 B 서브 유닛을 구성한다.마지막 단백질 단위는 독특하며 A 서브단위로 알려져 있다.
서브유닛
AB5 독소의 A 서브유닛은 특정 표적의 촉매작용을 담당하는 부분이다.시가 독소 패밀리의 경우 A 서브유닛은 트립신 감수성 영역을 형성하고 있으며, 분할 시 2개의 단편화된 도메인을 방출한다.이 지역은 다른 AB5 독소 계열에 대해서는 [2]아직 확인되지 않았다.일반적으로 A1과 A2라는 이름의 A 서브유닛의 두 도메인은 이황화 결합에 의해 연결되어 있다.도메인 A1(콜레라 독소 또는 열연성 장독소의 경우 약 22kDa)은 독성 영향을 일으키는 독소의 일부입니다.도메인 A2(콜레라 독소 또는 열연성 장독소의 경우 약 5kDa)는 B 서브유닛의 중앙 [5]모공을 통해 B 서브유닛에 비공유 결합을 제공한다.콜레라 독소의 A1 사슬은 ADP-리보실화인자(ARF)를 이용하여 니코틴아미드 아데닌 디뉴클레오티드(NAD)에서 아르기닌 또는 기타 구아니딘 화합물로의 ADP-리보스의 전달을 촉매한다.아르기닌 또는 단순 구아니디노 화합물이 없는 경우, 독소 매개 NAD+뉴클레오시다아제(NADAase) 활성은 물을 [19]친핵체로 사용하여 진행된다.
B 서브유닛
B 서브유닛은 5원짜리 또는 5원짜리 고리를 형성하며, 여기서 A 서브유닛의 한쪽 끝이 들어가 고정됩니다.이 B 서브유닛 고리는 또한 숙주 [20]세포의 표면에 있는 수용체, 보통 당단백질 또는 당지질에 [5]결합할 수 있습니다.B 서브유닛이 없으면 A 서브유닛은 세포에 부착하거나 세포 안으로 들어갈 수 없기 때문에 독성효과를 발휘할 수 없다.콜레라 독소, 시가 독소, SubAB 독소는 모두 동일한 단백질 성분 5개로 구성된 B 서브유닛을 가지고 있으며, 이는 B 서브유닛이 호모펜타머임을 의미합니다.백일해 독소는 5중 고리가 4개의 다른 단백질 성분으로 구성되고, 그 성분 중 하나가 반복되어 헤테로펜타머를 [5]형성한다는 점에서 다르다.
메커니즘
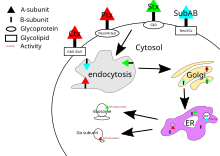
콜레라 독소, 백일해 독소, 시가 독소는 모두 세포의 세포에 표적이 있다.B 서브유닛이 세포 표면의 수용체에 결합하면 독소는 세포에 둘러싸여 클라트린 의존성 엔도시스 또는 클라트린 비의존성 엔도시스 [21]중 하나를 통해 내부로 운반된다.
콜레라 독소는 콜레라 독소의 주요 당지질 수용체가 간글리오시드 GM1이며,[20] 골지 기기로의 엔도시스 후 이 독소는 내소체망으로 [5]유도된다.A 서브유닛이 목표치에 도달하기 위해서는 A1 도메인과 A2 도메인 간의 디술피드 결합이 파괴되어야 한다.이 파괴는 소포체 내에 있는 단백질 이황화물[22] 이성질화효소에 의해 촉매된다.분리 후, A1 도메인은 전개되어 세포졸로 리다이렉트 되고, 거기서 특정 G단백질 알파 서브유닛의 ADP-리보실화를 재결합[5] 및 촉매한다.이 때 아데닐산환가수분해효소를 [20]활성화함으로써 G단백질신호전달경로의 하류효과를 저해한다[4].이는 세포 내 cAMP의 높은 농도를 유발하여 이온수송 메커니즘의 [5]조절을 방해한다.
백일해 독소는 특정 수용체를 가지고 있지 않으며 시알릴화 [13]당단백질에 결합한다.백일해 독소의 기전은 내구성 후 콜레라 독소와 같다.
시가 독소의 주요 수용체는 글로보트리아오실세라미드 또는 Gb3이다.[23]시가독소 또한 골지장치에 반입된 후 PDI를 위해 소포체로 유도되어 디술피드 결합을 절단한다.시가독소의 A 서브유닛은 세포로 돌아와 최종적으로 세포사멸을 일으키는 28S 리보솜[5] RNA에 특정 아데닌 염기를 분해함으로써 RNA N-글리코시다아제[4] 활성으로 진핵생물 단백질 합성을 억제한다.
SubAB의 표적은 세포의 소포체 내에 있으며, 클라트린 매개성 엔도사이토시스([20]Endocytosis)를 통해 세포 내로 반입된다.SubAB에 대한 글리칸 수용체는 보통 α2-3-결합 N-글리콜뉴라민산(Neu5Gc)[13]으로 끝난다.SubAB는 세린단백질가수분해효소로서 작용하여 소포체 [4]샤페론인 Bip/GRP78을 절단하는 A 서브유닛을 가진다.이 샤페론의 분열은 단백질 [14]억제를 통해 세포 스트레스를 유발하고 결과적으로 [5]세포의 죽음을 초래한다.
의료 용도
암 치료
AB5 독소의 B 서브유닛은 결합 글리칸에 대한 친화력을 가지며, 어떤 종류의 종양은 글리칸을 가지고 있는 것으로 보여 쉽게 표적이 된다.대장, 췌장, 유방 등 암세포 표면에 발현을 보이는 CD77(Gb3)과 특이적으로 결합하는 StxB가 한 예다.StxB는 일단 암세포를 목표로 하면 독소의 A 서브유닛을 전달하여 암세포를 [5]죽인다.
또 다른 방법은 생쥐를 대상으로 테스트한 ER 스트레스 유도제를 사용하여 시너지 반응을 보이는 것이다.이는 SubAB의 A 서브유닛과 표피성장인자(EGF)의 융합을 통해 달성된다.EGF 수용체를 발현하는 암세포는 SubAB [24]독성을 경험하게 된다.
백신
AB5 독소의 또 다른 용도는 LT 패밀리의 구성원을 보조제로 사용하는 것이다.이것은 IgG2a, IgA, Th17과 같은 면역학적 반응을 촉진하여 백신을 [25][26]투여할 때 위 헬리코박터균 감염과 싸울 수 있게 한다.
이 AB5 독소들 중 일부는 박테리아 감염을 막기 위한 백신을 만드는 데 사용될 뿐만 아니라, 그것들은 바이러스 감염을 막기 위한 결합체 역할을 하기 위해 연구되고 있다.예를 들어 바이러스콜레라 독소결합백신의 비강내 공동투여와 함께 전신면역접종은 바이러스 특이항체반응을 [27]유도하여 센다이 바이러스로부터 상부호흡기를 어느 정도 보호하였다.
최근 연구 분야
베셀 빔 평면 조명 현미경법 및 FLET 기반 센서 분자의 사용과 같은 생명공학 실험 방법의 새로운 발전은 갭 접합 플라크의 동적 구조를 더 잘 보여줄 수 있다.이러한 실험을 위해 다양한 유형의 AB5 독소를 사용하여 E에서 tCDR의 빠른 형성을 유도할 수 있습니다.대장균 세포.그런 다음 FLET 기반 센서 구조를 사용하여 갭 접합 결합 셀의 cAMP 농도 변동을 기록한다.연구에 따르면 CDR은 아마도 간극 접합 플라크 내의 코넥신 채널에서 지질 및 단백질의 빠른 재배치와 관련이 있을 수 있다.이것은 박테리아 [28][29]감염에 노출되었을 때 K+ 세포 손실이 뒤따르는 신호 캐스케이드를 이해하는 데 도움을 줄 수 있다.
SubAB 독소는 결합 단백질인 BiP에 특이성을 나타내는 것으로 관찰되었습니다.이 특성은 스트레스 Hela [5]세포에서 Endoplasmic-reticulum 관련 분해와 함께 세포 BiP 자체의 역할을 연구하기 위해 사용되었습니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Le Nours, J.; Paton, A. W.; Byres, E.; Troy, S.; Herdman, B. P.; Johnson, M. D.; Paton, J. C.; Rossjohn, J.; Beddoe, T. (6 August 2013). "Structural Basis of Subtilase Cytotoxin SubAB Assembly". Journal of Biological Chemistry. 288 (38): 27505–27516. doi:10.1074/jbc.M113.462622. PMC 3779744. PMID 23921389.
- ^ a b Middlebrook, JL; Dorland, RB (Sep 1984). "Bacterial toxins: cellular mechanisms of action". Microbiological Reviews. 48 (3): 199–221. doi:10.1128/mr.48.3.199-221.1984. PMC 373009. PMID 6436655.
- ^ Locht, C; Antoine, R (1995). "A proposed mechanism of ADP-ribosylation catalyzed by the pertussis toxin S1 subunit". Biochimie. 77 (5): 333–40. doi:10.1016/0300-9084(96)88143-0. PMID 8527486.
- ^ a b c d e f Wang, H; Paton, JC; Herdman, BP; Rogers, TJ; Beddoe, T; Paton, AW (Mar 2013). "The B subunit of an AB5 toxin produced by Salmonella enterica serovar Typhi up-regulates chemokines, cytokines, and adhesion molecules in human macrophage, colonic epithelial, and brain microvascular endothelial cell lines". Infection and Immunity. 81 (3): 673–83. doi:10.1128/IAI.01043-12. PMC 3584882. PMID 23250951.
- ^ a b c d e f g h i j k l Beddoe, Travis; Paton, Adrienne W.; Le Nours, Jérôme; Rossjohn, Jamie; Paton, James C. (July 2010). "Structure, biological functions and applications of the AB5 toxins". Trends in Biochemical Sciences. 35 (7): 411–418. doi:10.1016/j.tibs.2010.02.003. PMC 2929601. PMID 20202851.
- ^ Bharati, K; Ganguly, N. K. (2011). "Cholera toxin: A paradigm of a multifunctional protein". The Indian Journal of Medical Research. 133 (2): 179–187. PMC 3089049. PMID 21415492.
- ^ Millen, S. H.; Schneider, O. D.; Miller, W. E.; Monaco, J. J.; Weiss, A. A. (2013). "Pertussis Toxin B-Pentamer Mediates Intercellular Transfer of Membrane Proteins and Lipids". PLOS ONE. 8 (9): e72885. Bibcode:2013PLoSO...872885M. doi:10.1371/journal.pone.0072885. PMC 3760862. PMID 24019885.
- ^ Carbonetti, N. H. (2010). "Pertussis toxin and adenylate cyclase toxin: Key virulence factors of Bordetella pertussis and cell biology tools". Future Microbiology. 5 (3): 455–469. doi:10.2217/fmb.09.133. PMC 2851156. PMID 20210554.
- ^ Guiso N. 2009보데텔라 백일해 백신과 백일해 백신.클리닉. 감염. 디셉션 49:1565~15
- ^ "1.C.72 The Pertussis Toxin (PTX) Family". TCDB. Retrieved 21 March 2019.
- ^ Faruque, S. M.; Chowdhury, N; Khan, R; Hasan, M. R.; Nahar, J; Islam, M. J.; Yamasaki, S; Ghosh, A. N.; Nair, G. B.; Sack, D. A. (2003). "Shigella dysenteriae Type 1-Specific Bacteriophage from Environmental Waters in Bangladesh". Applied and Environmental Microbiology. 69 (12): 7028–7031. Bibcode:2003ApEnM..69.7028F. doi:10.1128/AEM.69.12.7028-7031.2003. PMC 310026. PMID 14660345.
- ^ Beutin, L; Miko, A; Krause, G; Pries, K; Haby, S; Steege, K; Albrecht, N (2007). "Identification of human-pathogenic strains of Shiga toxin-producing Escherichia coli from food by a combination of serotyping and molecular typing of Shiga toxin genes". Applied and Environmental Microbiology. 73 (15): 4769–75. Bibcode:2007ApEnM..73.4769B. doi:10.1128/AEM.00873-07. PMC 1951031. PMID 17557838.
- ^ a b c Paton, AW; Paton, JC (Feb 1, 2010). "Escherichia coli Subtilase Cytotoxin". Toxins. 2 (2): 215–228. doi:10.3390/toxins2020215. PMC 2943149. PMID 20871837.
- ^ a b Michelacci, V.; Tozzoli, R.; Caprioli, A.; Martínez, R.; Scheutz, F.; Grande, L.; Sánchez, S.; Morabito, S.; Allerberger, F. (2013). "A new pathogenicity island carrying an allelic variant of the Subtilase cytotoxin is common among Shiga toxin producing of human and ovine origin". Clinical Microbiology and Infection. 19 (3): E149–E156. doi:10.1111/1469-0691.12122. PMID 23331629.
- ^ Wang, Hui; Paton, James C.; Paton, Adrienne W. (October 2007). "Pathologic Changes in Mice Induced by Subtilase Cytotoxin, a Potent New AB Toxin That Targets the Endoplasmic Reticulum". The Journal of Infectious Diseases. 196 (7): 1093–1101. doi:10.1086/521364. PMID 17763334.
- ^ Paton, AW; Paton, JC (1 February 2010). "Escherichia coli Subtilase Cytotoxin". Toxins. 2 (2): 215–228. doi:10.3390/toxins2020215. PMC 2943149. PMID 20871837.
- ^ Morinaga, N; Yahiro, K; Matsuura, G; Watanabe, M; Nomura, F; Moss, J; Noda, M (January 2007). "Two distinct cytotoxic activities of subtilase cytotoxin produced by shiga-toxigenic Escherichia coli". Infection and Immunity. 75 (1): 488–96. doi:10.1128/IAI.01336-06. PMC 1828409. PMID 17101670.
- ^ Byres, E; Paton, AW; Paton, JC; Löfling, JC; Smith, DF; Wilce, MC; Talbot, UM; Chong, DC; Yu, H; Huang, S; Chen, X; Varki, NM; Varki, A; Rossjohn, J; Beddoe, T (4 December 2008). "Incorporation of a non-human glycan mediates human susceptibility to a bacterial toxin". Nature. 456 (7222): 648–52. Bibcode:2008Natur.456..648B. doi:10.1038/nature07428. PMC 2723748. PMID 18971931.
- ^ Finkel, Toren; Gutkind, J. Silvio, eds. (2003). Signal Transduction and Human Disease. Hoboken, NJ: John Wiley & Sons. ISBN 0471448370.
- ^ a b c d Lencer W, Saslowsky D (2005). "Raft trafficking of AB5 subunit bacterial toxins". Biochim Biophys Acta. 1746 (3): 314–21. doi:10.1016/j.bbamcr.2005.07.007. PMID 16153723.
- ^ Smith, Richard D.; Willett, Rose; Kudlyk, Tetyana; Pokrovskaya, Irina; Paton, Adrienne W.; Paton, James C.; Lupashin, Vladimir V. (October 2009). "The COG Complex, Rab6 and COPI Define a Novel Golgi Retrograde Trafficking Pathway that is Exploited by SubAB Toxin". Traffic. 10 (10): 1502–1517. doi:10.1111/j.1600-0854.2009.00965.x. PMC 2756830. PMID 19678899.
- ^ Teter, Ken (10 December 2013). "Toxin Instability and Its Role in Toxin Translocation from the Endoplasmic Reticulum to the Cytosol". Biomolecules. 3 (4): 997–1029. doi:10.3390/biom3040997. PMC 4030972. PMID 24970201. (PDI)
- ^ Thorpe, C. M. (1 May 2004). "Shiga Toxin--Producing Escherichia coli Infection". Clinical Infectious Diseases. 38 (9): 1298–1303. doi:10.1086/383473. PMID 15127344.
- ^ Backer, JM; Krivoshein, AV; Hamby, CV; Pizzonia, J; Gilbert, KS; Ray, YS; Brand, H; Paton, AW; Paton, JC; Backer, MV (Nov 2009). "Chaperone-targeting cytotoxin and endoplasmic reticulum stress-inducing drug synergize to kill cancer cells". Neoplasia. 11 (11): 1165–73. doi:10.1593/neo.09878. PMC 2767218. PMID 19881952.
- ^ Norton, E. B.; Lawson, L. B.; Mahdi, Z.; Freytag, L. C.; Clements, J. D. (23 April 2012). "The A Subunit of Escherichia coli Heat-Labile Enterotoxin Functions as a Mucosal Adjuvant and Promotes IgG2a, IgA, and Th17 Responses to Vaccine Antigens". Infection and Immunity. 80 (7): 2426–2435. doi:10.1128/IAI.00181-12. PMC 3416479. PMID 22526674.
- ^ Weltzin, R; Guy, B; Thomas WD, Jr; Giannasca, PJ; Monath, TP (May 2000). "Parenteral adjuvant activities of Escherichia coli heat-labile toxin and its B subunit for immunization of mice against gastric Helicobacter pylori infection". Infection and Immunity. 68 (5): 2775–82. doi:10.1128/iai.68.5.2775-2782.2000. PMC 97487. PMID 10768972.
- ^ Liang, XP; Lamm, ME; Nedrud, JG (Sep 1, 1988). "Oral administration of cholera toxin-Sendai virus conjugate potentiates gut and respiratory immunity against Sendai virus". Journal of Immunology. 141 (5): 1495–501. PMID 2842395.
- ^ Majoul, IV; Gao, L; Betzig, E; Onichtchouk, D; Butkevich, E; Kozlov, Y; Bukauskas, F; Bennett, MV; Lippincott-Schwartz, J; Duden, R (Oct 29, 2013). "Fast structural responses of gap junction membrane domains to AB5 toxins". Proceedings of the National Academy of Sciences of the United States of America. 110 (44): E4125–33. Bibcode:2013PNAS..110E4125M. doi:10.1073/pnas.1315850110. PMC 3816413. PMID 24133139.
- ^ Börner, S; Schwede, F; Schlipp, A; Berisha, F; Calebiro, D; Lohse, MJ; Nikolaev, VO (Apr 2011). "FRET measurements of intracellular cAMP concentrations and cAMP analog permeability in intact cells". Nature Protocols. 6 (4): 427–38. doi:10.1038/nprot.2010.198. PMID 21412271. S2CID 20671081.
외부 링크
- 세균 AB5 독소
- Held, Paul. "An Introduction to Fluorescence Resonance Energy Transfer (FRET) Technology and its Application in Bioscience". BioTek Instruments, Inc.