사산화수소
Dinitrogen tetroxide| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 사산화수소수소 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 체비 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.031.012 | ||
| EC 번호 |
| ||
| 2249 | |||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1067 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| 아니요24 | |||
| 몰 질량 | 92.011 g/g | ||
| 외모 | 무색 액체, 오렌지 가스 | ||
| 밀도 | 1.44246 g/cm3 (액체, 21 °C) | ||
| 녹는점 | -11.2°C(11.8°F, 261.9K)에서 NO로 분해2 | ||
| 비등점 | 21.69°C(71.04°F, 294.84K) | ||
| 반응하여 아질산 및 질산이 생성됨 | |||
| 증기압 | 96kPa(20°C)[1] | ||
자화율(δ) | - 23.0 · 10−6 cm3 / 세로 | ||
굴절률(nD) | 1.00112 | ||
| 구조. | |||
| 평면, D2h | |||
| 0이 아닌 소형 | |||
| 열화학 | |||
표준 어금니 엔트로피 (S | 304.29 J/KΩmol[2] | ||
표준 엔탈피/ 형성 (δHf⦵298) | +9.16 kJ/mol[2] | ||
| 위험 요소 | |||
| GHS 라벨링: | |||
     | |||
| 위험. | |||
| H270, , , , , , | |||
| P220, , , , , , , , , , , , , , , , , ,, | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | 불연성 | ||
| 안전 데이터 시트(SDS) | 외부 MSDS | ||
| 관련 화합물 | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
흔히 사산화질소(NTO)로 불리며 때로는 (전 USSR/러시아 로켓 기술자들 사이에서는) 아밀로 불리며, 화합물24 NO이다.그것은 화학 합성에 유용한 시약이다.그것은 이산화질소와 평형혼합물을 형성한다.그것의 몰 질량은 92.011 g/mol이다.
사산화수소수소(Dinitrogen Tetroxide)는 강력한 산화제로 다양한 형태의 히드라진과 접촉할 때 과당성(spontally reactions)을 일으켜 로켓의 일반적인 2중 추진제가 되었다.
구조 및 속성
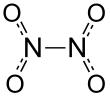
사산화수소수소(Dinitrogen Tetroxide)는 두 개의 니트로기(-NO2)가 결합되어 있는 것으로 볼 수 있다.그것은 [5]이산화질소와 평형혼합물을 형성한다.분자는 N-N 결합 거리가 1.78Ω이고 N-O 거리가 1.19Ω인 평면형이다.N-N 거리는 평균 N-N 단일 결합 [6]길이 1.45Ω보다 상당히 길기 때문에 약한 결합에 해당합니다.이 예외적으로 약한 δ 결합(두2 NO[7] 단위의 sp2 하이브리드 궤도 중첩에 해당)은 NO 분자 전체에서24 결합 전자쌍의 동시 탈국재화와 각 NO2 [8]단위의 이중 점유 분자 궤도의 상당한 정전적 반발로 인해 발생한다.
NO와 달리2 NO는24 짝이 없는 [9]전자를 가지고 있지 않기 때문에 반자성입니다.이 액체는 무색이지만 다음과 같은 평형에 따라 NO가2 존재하기 때문에 갈색이 도는 노란색 액체로 나타날 수 있습니다.
- NO24 2 2 NO2
온도가 높아지면 평형이 이산화질소로 향하게 된다.필연적으로 일부 사산화수소 디니트로겐은 이산화질소를 포함한 스모그의 성분이다.
생산.
사산화질소는 암모니아의 촉매 산화에 의해 만들어집니다. 증기는 연소 온도를 낮추기 위한 희석제로 사용됩니다.첫 번째 단계에서는 암모니아가 산화질소로 산화됩니다.
- 4 NH3 + 5 O2 → 4 NO + 6 HO2
대부분의 물은 응축되고 가스는 더욱 냉각됩니다. 생성된 일산화질소는 이산화질소로 산화되며, 이산화질소는 사산화질소로 이량화됩니다.
- 2 NO + O2 → 2 NO2
- 22 NO » NO24
나머지 물은 질산으로 제거된다.가스는 본질적으로 순수한 이산화질소로, 소금물로 냉각된 액상화기에서 [citation needed]사산화이질소로 응축됩니다.
농축 질산과 금속 구리의 반응을 통해 사산화수소도 만들 수 있다.이 합성은 실험실 환경에서 보다 실용적이며 학부 화학 [citation needed]실험실에서 시연 또는 실험으로 일반적으로[by whom?] 사용됩니다[when?].질산에 의한 구리의 산화는 다양한 안정성의 다양한 질소 산화물을 형성하는 복합 반응으로, 질산의 농도, 산소의 존재 및 기타 요인에 따라 달라집니다.불안정한 종은 더욱 반응하여 이산화질소를 형성하고, 이산화질소는 정제되고 응축되어 사산화수소(Dinitrogen Tetroxide)를 형성합니다.
로켓 추진제로 사용
사산화질소는 상온에서 액체로 저장될 수 있기 때문에 가장 중요한 로켓 추진제 중 하나에서 산화제로 사용된다.페루의 수학자인 페드로 폴렛은 1890년대에 점화용 스파크 플러그에 주기적으로 사산화질소와 석유 벤진을 도입하는 스프링식 노즐을 사용한 로켓 엔진으로 분당 [10][11]300회의 펄스 폭발을 발생시키는 실험을 했다고 보고했습니다.파울렛은 독일 로켓 협회인 Verein für Raumschiffahrt(VfR)를 방문하여 1928년 3월 15일 VfR 출판물인 Die Rakete에서 파울렛의 액체 추진 로켓 설계에 대해 "놀라운 파워"[12]라고 칭찬했다.폴렛은 도움을 거절했고 추진제의 [13]공식을 공유하지 않았지만 곧 나치 독일이 로켓 기술 개발을 돕기 위해 접근하게 될 것이다.
1944년 초, 독일 과학자들에 의해 로켓 연료의 산화제로서의 사산화수소 유용성에 대한 연구가 수행되었지만, 독일은 그것을 S-Stoff(연기 질산)의 첨가제로 매우 제한적으로만 사용했다.그것은 1950년대 후반까지 미국과 구소련의 많은 로켓에서 저장 가능한 산화제로 선택되었다.그것은 히드라진 기반의 로켓 연료와 결합된 초고압 추진제이다.이 조합의 초기 사용 중 하나는 원래 ICBM으로 사용되었고 그 후 많은 우주선의 발사체로 사용되었던 타이탄 계열의 로켓이었다.미국의 제미니, 아폴로 우주선, 그리고 우주왕복선에도 사용되는 이 우주선은 대부분의 정지궤도 위성과 많은 심우주 탐사선에서 우주 정거장을 유지하는 추진체로 계속 사용되고 있다.그것은 또한 러시아의 프로톤 로켓의 1차 산화제이다.
추진제로 사용될 때, 사산화수소수소(Dinitrogen Tetroxide)는 일반적으로 단순히 사산화질소(NTO)라고 불리며 약칭인 NTO가 널리 사용된다.또한 NTO는 티타늄 합금의 응력 부식 균열을 억제하는 소량의 산화질소를 첨가하여 자주 사용되며, 이 형태에서 추진제 등급의 NTO를 혼합 질소산화물(MON)이라고 한다.현재 대부분의 우주선은 NTO 대신 MON을 사용합니다. 예를 들어, 우주왕복선 반응 제어 시스템은 MON3(중량 [14]기준 3% NO를 포함하는 NTO)를 사용했습니다.
아폴로-소유즈 사고
1975년 7월 24일, NTO 중독은 아폴로-소유즈 시험 비행 후 지구로 최종 하강하던 3명의 미국 우주인에게 영향을 미쳤다.이는 실수로 잘못된 위치에 방치된 스위치로 인해 실내 외부 공기 흡입구가 열린 후 자세 컨트롤 스러스터가 작동하여 NTO 가스가 실내로 유입되었기 때문입니다.승무원 한 명이 하강 중에 의식을 잃었다.착륙하자마자 선원들은 화학성 폐렴과 [15][16]부종으로 5일간 입원했다.
NO를 사용한24 발전
NO가24 가역적으로 NO로2 분해되는 경향은 이른바 해리성 [17]가스로서 발전된 발전 시스템에서 NO가 사용되는 것에 대한 연구로 이어졌다."차가운" 사산화질소는 압축되고 가열되어 분자량의 절반에서 이산화질소로 분해됩니다.이 뜨거운 이산화질소는 터빈을 통해 팽창되어 냉각되고 압력을 낮춘 다음, 열제거원에서 더 냉각되어 원래의 분자량에서 사산화질소로 재결합합니다.그러면 전체 사이클을 다시 시작하기 위해 압축을 훨씬 쉽게 할 수 있습니다.이러한 해리성 가스 브레이튼 사이클은 전력 변환 [18]장치의 효율을 크게 높일 수 있는 잠재력을 가지고 있다.
화학 반응
질산 제조의 중간체
질산은 NO를 통해24 대규모로 제조된다.이 종은 물과 반응하여 아질산과 질산을 모두 생성합니다.
- NO242 + HO → HNO2 + HNO3
가열 시 발생하는2 HNO는 NO와 더 많은 질산과 불균형합니다.산소에 노출되면 NO는 다시 이산화질소로 변환됩니다.
- 2 NO + O2 → 2 NO2
생성된2 NO와24 NO는 사이클로 되돌려져 아질산과 질산의 혼합물을 다시 제공할 수 있습니다.
금속 질산염 합성
NO는24 분자 자가이온화를 통해+ [NO] [NO]를3− 생성하며, 이전의 니트로소늄 이온은 강력한 산화제이다.NO 및 [19]모재로부터 다양한24 무수 전이 금속 질산염 착체를 제조할 수 있다.
- 2 NO24 + M → 2 NO + M(NO3)2
금속질산염이 NO로부터 완전히24 무수상태로 제조되면 다수의 전이금속과 함께 다양한 공유가 금속질산염이 형성될 수 있다.이는 질산 이온이 이온 구조를 형성하기보다는 이러한 금속과 공유 결합하는 열역학적 선호가 있기 때문입니다.질산 이온은 물보다 배위자가 훨씬 약하고 물이 존재하면 단순 수화 질산염이 형성되기 때문에 이러한 화합물은 무수 조건에서 제조되어야 한다.관련된 무수질산염은 그 자체가 공유가이며, 많은 무수질산구리 등 상온에서 휘발성이 있다.무수 질산 티타늄은 40°C에서만 진공 상태에서 승화한다.무수 전이 금속 질산염의 대부분은 눈에 띄는 색을 가지고 있다.화학의 이 분과는 매우 효율적인 건조제와 드라이 박스가 나오기 시작한 1960년대와 1970년대에 영국 노팅엄 대학의 클리프 애디슨과 노먼 로건에 의해 개발되었다.
레퍼런스
- ^ 국제 화학 안전 카드 https://www.ilo.org/dyn/icsc/showcard.display?p_lang=en&p_card_id=0930&p_version=2
- ^ a b P.W. Atkins and J. de Paula, Physical Chemistry (제8호, W.H. Freeman, 2006년)p.999
- ^ "Chemical Datasheet: Nitrogen tetroxide". CAMEO Chemicals NOAA. Retrieved 8 September 2020.
- ^ "Compound Summary: Dinitrogen tetroxide". PubChem. Retrieved 8 September 2020.
- ^ Bent, Henry A. (1963). "Dimers of Nitrogen Dioxide. II. Structure and Bonding". Inorganic Chemistry. 2 (4): 747–752. doi:10.1021/ic50008a020.
- ^ Petrucci, Ralph H.; Harwood, William S.; Herring, F. Geoffrey (2002). General chemistry: principles and modern applications (8th ed.). Upper Saddle River, N.J: Prentice Hall. p. 420. ISBN 978-0-13-014329-7. LCCN 2001032331. OCLC 46872308.
- ^ Rayner-canham, Geoff (2013). Descriptive inorganic chemistry (6th ed.). p. 400. ISBN 978-1-319-15411-0. OCLC 1026755795.
- ^ Ahlrichs, Reinhart; Keil, Frerich (1974-12-01). "Structure and bonding in dinitrogen tetroxide (N2O4)". Journal of the American Chemical Society. 96 (25): 7615–7620. doi:10.1021/ja00832a002. ISSN 0002-7863.
- ^ Holleman, A. F., Wiberg, E. "유기화학" 학술 출판사: 샌디에이고, 2001.ISBN 978-0-12-352651-9.
- ^ Gonzales Obando, Diana (2021-07-22). "Pedro Paulet: el genio peruano que se adelantó a su época y fundó la era espacial". El Comercio (in Spanish). Retrieved 2022-03-13.
- ^ "Un peruano Pedro Paulet reclama la propiedad de su invento". El Comercio (in Spanish). 25 August 1927. Retrieved 2022-03-13.
- ^ Mejía, Álvaro (2017). Pedro Paulet, sabio multidisciplinario (in Spanish). Universidad Católica San Pablo. pp. 95–122.
- ^ "El peruano que se convirtió en el padre de la astronáutica inspirado por Julio Verne y que aparece en los nuevos billetes de 100 soles". BBC News (in Spanish). Retrieved 2022-03-11.
- ^ "Rocket Propellant Index". Archived from the original on 2008-05-11. Retrieved 2005-03-01.
- ^ "브랜드가 아폴로 가스 누출에 대해 책임을 진다", 플로렌스, AL - 타임즈 데일리 신문, 1975년 8월 10일
- ^ Sotos, John G., MD. "Astronaut and Cosmonaut Medical Historys", 2008년 5월 12일, 2011년 4월 1일에 액세스.
- ^ Stochl, Robert J. (1979). Potential performance improvement by using a reacting gas (nitrogen tetroxide) as the working fluid in a closed Brayton cycle (PDF) (Technical report). NASA. TM-79322.
- ^ Ragheb, R. "Nuclear Reactors Concepts and Thermodynamic Cycles" (PDF). Retrieved 1 May 2013.
- ^ Addison, C. Clifford (February 1980). "Dinitrogen tetroxide, nitric acid, and their mixtures as media for inorganic reactions". Chemical Reviews. 80 (1): 21–39. doi:10.1021/cr60323a002.