플루오린
Fluorine 액체 불소(극저온에서2 F) | |||||||||||||||||||||
| 플루오린 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 발음 | |||||||||||||||||||||
| 동소체 | 알파, 베타 (불소의 동소체 참조) | ||||||||||||||||||||
| 외모 | 가스: 매우 옅은 노란색 액체 : 밝은 노란색 솔리드: 알파는 불투명, 베타는 투명 | ||||||||||||||||||||
| 표준 원자량 Ar°(F) | |||||||||||||||||||||
| 주기율표의 불소 | |||||||||||||||||||||
| |||||||||||||||||||||
| 원자번호 (Z) | 9 | ||||||||||||||||||||
| 그룹. | 그룹 17 (할로겐) | ||||||||||||||||||||
| 기간 | 2교시 | ||||||||||||||||||||
| 블록 | p블록 | ||||||||||||||||||||
| 전자구성 | [He] 2s2 2p5[3] | ||||||||||||||||||||
| 포탄당 전자 | 2, 7 | ||||||||||||||||||||
| 물성 | |||||||||||||||||||||
| 단계 STP에서 | 가스의 | ||||||||||||||||||||
| 융점 | (F2) 53.48 K (−219.67 °C, −363.41 °F)[4] | ||||||||||||||||||||
| 끓는점 | (F2) 85.03 K (−188.11 °C, −306.60 °F)[4] | ||||||||||||||||||||
| 밀도 (STP에서) | 1.696g/L[5] | ||||||||||||||||||||
| 액체일 때에 | 1.505g/cm3[6] | ||||||||||||||||||||
| 삼중점 | 53.48 K, .252 kPa[7] | ||||||||||||||||||||
| 임계점 | 144.41 K, 5.1724 MPa[4] | ||||||||||||||||||||
| 기화열 | 6.51kJ/mol[5] | ||||||||||||||||||||
| 몰열용량 | Cp: 31 J/(mol·K)[6] (at 21.1 °C) Cv: 23 J/(mol·K)[6] (at 21.1 °C) | ||||||||||||||||||||
증기압
| |||||||||||||||||||||
| 원자적 성질 | |||||||||||||||||||||
| 산화상태 | -1[8], 0 (산소를 산화) | ||||||||||||||||||||
| 전기음성도 | 폴링 눈금: 3.98[3] | ||||||||||||||||||||
| 이온화 에너지 | |||||||||||||||||||||
| 공유반지름 | 오후[10] 64시 | ||||||||||||||||||||
| 반데르발스 반지름 | 오후[11] 135시 | ||||||||||||||||||||
| 기타속성 | |||||||||||||||||||||
| 자연발생 | 원시의 | ||||||||||||||||||||
| 결정구조 | 입방체의 | ||||||||||||||||||||
| 열전도율 | 0.02591 W/(m⋅K)[12] | ||||||||||||||||||||
| 자기순서 | 반자성체(-1.2x10−4)[13][14] | ||||||||||||||||||||
| CAS 번호 | 7782-41-4[3] | ||||||||||||||||||||
| 역사 | |||||||||||||||||||||
| 네이밍 | 광물 플루오라이트의 이름을 따서 라틴 플루오(흐르기 위해, 제련할 때)라는 이름이 붙었습니다. | ||||||||||||||||||||
| 디스커버리 | 앙드레 마리 앙페르 (1810) | ||||||||||||||||||||
| 1차 격리 | 앙리 모이산[3] (1886년 6월 26일) | ||||||||||||||||||||
| 이름자 | |||||||||||||||||||||
| 불소 동위 원소 | |||||||||||||||||||||
| |||||||||||||||||||||
불소는 화학 원소로 기호 F와 원자 번호 9를 가지고 있습니다. 가장 가벼운 할로겐이며[note 1] 독성이 강한 담황색 이원자 기체로 표준 조건에서 존재합니다. 불소는 가벼운 비활성 기체를 제외한 다른 모든 원소와 반응하기 때문에 반응성이 매우 높습니다.
원소 중 불소는 보편적 존재비 24위, 육상적 존재비 13위를 차지하고 있습니다. 플루오린의 주요 광물 공급원인 플루오린산염은 1529년에 처음 기술되었는데, 금속 광석에 첨가되어 제련을 위해 녹는점을 낮추면서 '흐르다'라는 뜻의 라틴어 동사 플루오(fluo)가 광물에 이름을 붙였습니다. 1810년에 원소로 제안된 플루오린은 화합물로부터 분리하기 어렵고 위험한 것으로 판명되었고, 몇몇 초기 실험자들은 그들의 시도로 죽거나 부상을 입었습니다. 1886년 프랑스의 화학자 앙리 무아상이 저온 전기분해를 이용해 플루오린 원소를 분리해낸 것이 지금도 현대적인 제조에 이용되고 있는 공정입니다. 우라늄 농축을 위한 불소 가스의 산업적 생산은 제2차 세계 대전의 맨하탄 프로젝트 중에 시작되었습니다.
순수한 불소를 정제하는 비용 때문에 대부분의 상업적 응용은 불소 화합물을 사용하며, 채굴된 플루오르라이트의 절반 정도가 제철에 사용됩니다. 플루오라이트의 나머지 부분은 부식성 불화수소로 변환되어 다양한 유기 플루오라이드로 이동하거나, 알루미늄 정제에 핵심적인 역할을 하는 크라이올라이트로 변환됩니다. 탄소-불소 결합을 포함하는 분자는 종종 매우 높은 화학적 및 열적 안정성을 갖는데, 이들의 주요 용도는 냉매, 전기 절연 및 조리기구, PTFE(테프론) 등입니다. 아토르바스타틴, 플루옥세틴과 같은 의약품에는 C-F 결합이 포함되어 있습니다. 용해된 불소염에서 나오는 불소 이온은 충치를 억제하기 때문에 치약과 물 불소화에 사용됩니다. 전 세계 형광화학 매출은 연간 미화 150억 달러 이상에 달합니다.[when?][citation needed]
플루오로카본 가스는 일반적으로 이산화탄소의 100~23,500배에 달하는 지구온난화 잠재력을 가진 온실가스로 SF는6 알려진 물질 중 가장 높은 지구온난화 잠재력을 가지고 있습니다. 유기 불소 화합물은 탄소-불소 결합의 강도로 인해 환경에 잔류하는 경우가 많습니다. 플루오린은 포유동물에서 알려진 대사 역할이 없습니다. 몇몇 식물과 해양 해면은 포식을 억제하는 데 도움이 되는 유기 플루오린 독(가장 자주 모노플루오로 아세테이트)을 합성합니다.[16]
특성.
전자구성
불소 원자는 네온보다 1개 적은 9개의 전자를 가지며, 전자의 구성 1s2s2p225: 내부 껍질에 2개의 전자가 채워지고 외부 껍질에 7개의 전자가 하나 더 채워져야 합니다. 외부 전자는 핵 차폐에 효과가 없고, 9 - 2 = 7의 높은 유효 핵전하를 가지며, 이것은 원자의 물리적 특성에 영향을 미칩니다.
불소의 첫 번째 이온화 에너지는 모든 원소 중에서 헬륨과 네온 다음으로 세 [17]번째로 높아 중성 불소 원자에서 전자를 제거하기가 복잡합니다. 또한 염소 다음으로 높은 전자 친화력을 가지고 있으며,[18] 전자를 포획하여 비활성 가스 네온과 등전자성을 갖는 경향이 있습니다.[3] 반응성 원소 중 가장 높은 전기 음성도를 가지고 있습니다.[19] 불소 원자는 60피코미터 정도의 작은 공유 반경을 가지고 있는데, 이는 그 시대의 산소, 네온과 유사합니다.[20][21][note 2]
반응성
| 외부영상 | |
|---|---|

디플루오린의 결합에너지는 Cl이나
2
2 Br보다 훨씬 낮고 쉽게 분해되는 과산화물 결합과 유사하며, 이는 높은 전기음성도와 함께 불소의 해리가 용이하고 반응성이 높으며, 비불소 원자와의 강한 결합을 설명합니다.[22][23] 반대로 불소의 높은 전기음성도 때문에 다른 원자와의 결합이 매우 강합니다. 차가운 불소가스는 분말강, 유리조각, 석면섬유 등의 반응성이 없는 물질로, 불소제트 아래에서 나무와 물이 자연적으로 연소됩니다.[5][24]
불소 원소와 금속의 반응은 다양한 조건을 필요로 합니다. 알칼리 금속은 폭발을 일으키고 알칼리 토금속은 대량으로 왕성한 활동을 보입니다. 금속 불화물 층이 형성되는 것을 방지하기 위해서는 알루미늄, 철과 같은 다른 대부분의 금속은 분말로 만들어야 [22]하며 귀금속은 300~450°C(575~850°F)의 순수한 불소 가스를 필요로 합니다.[25] 일부 고체 비금속(황, 인)은 액체 불소에서 격렬하게 반응합니다.[26] 황화수소와[26] 이산화황은[27] 플루오린과 쉽게 결합하고, 후자는 때때로 폭발적으로 결합합니다. 황산은 훨씬 적은 활성을 나타내므로 높은 온도를 필요로 합니다.[28]
수소는 알칼리 금속의 일부와 마찬가지로 불소와 폭발적으로 반응합니다.[29] 탄소는 램프 블랙으로서 실온에서 반응하여 테트라플루오로메탄을 생성합니다. 흑연은 400 °C (750 °F) 이상의 불소와 결합하여 비화학량론적 탄소 모노플루오라이드를 생성합니다. 고온에서는 가스 상태의 플루오로카본이 생성되며, 때로는 폭발이 발생하기도 합니다.[30] 이산화탄소와 일산화탄소는 실온 또는 바로 위에서 반응하는 [31]반면, 파라핀과 다른 유기 화학 물질은 강한 반응을 일으키며,[32] 사염화탄소와 같은 완전히 치환된 할로알칸(일반적으로 가연성이 아닌)도 폭발할 수 있습니다.[33] 삼불화질소는 안정적이지만 질소는 불소와 반응하기 위해 고온에서 전기 방전이 필요한데,[34] 이는 원소 질소의 삼중 결합이 매우 강하기 때문이며 암모니아는 폭발적으로 반응할 수 있습니다.[35][36] 산소는 주변 조건에서 불소와 결합하지 않지만 낮은 온도와 압력에서 전기 방전을 사용하여 반응할 수 있습니다. 제품은 가열되면 구성 요소로 분해되는 경향이 있습니다.[37][38][39] 무거운 할로겐은[40] 비활성기체 라돈과 마찬가지로 불소와 쉽게 반응하며,[41] 다른 비활성기체 중 크세논과 크립톤만 반응하며, 특별한 조건에서만 반응합니다.[42] 아르곤은 불소 가스와 반응하지 않지만 플루오르, 플루오로하이드라이드와 화합물을 형성합니다.
페이즈

2 있는 F 분자를 나타냅니다. 다른 분자들은 평면에 구속되어 있습니다.

실온에서 불소는 이원자 분자의 기체이며,[5] 순수할 때는 옅은 노란색(노란색-녹색으로 표현되기도 함)입니다.[43] 특징적인 할로겐과 같은 톡 쏘는 냄새와 20ppb에서 감지할 수 있습니다.[44] 불소는 산소 및 질소와 유사한 전이 온도인 -188°C(-306°F)에서 밝은 노란색 액체로 응축됩니다.[45]
불소는 α-와 β-불소의 두 가지 고체 형태를 가지고 있습니다. 후자는 -220 °C (-364 °F)에서 결정화되며, 다른 고체 할로겐의 정방정계와 [45][note 3]달리 새로 결정화된 고체 산소의 무질서한 입방정계 구조와 동일한 투명하고 부드럽습니다.[49][50] -228 °C(-378 °F)로 더 냉각하면 불투명하고 단단한 α-플루오린으로 상전이가 유도되며, 이는 분자의 조밀하고 각진 층을 가진 단사정계 구조를 가지고 있습니다. β-에서 α-플루오린으로의 전이는 불소의 축합보다 발열성이 강하며, 격렬할 수 있습니다.[49][50][note 4]
동위 원소
플루오린의 동위원소는 오직 하나, 즉 안정 동위원소 F만이 자연적으로 풍부하게 존재합니다.[51] 높은 자기비와[note 5] 자기장에 대한 민감도를 가지고 있으며, 유일한 안정 동위원소이기 때문에 자기공명영상에 사용됩니다.[53] 질량수가 13부터 31까지인 18개의 방사성동위원소가 합성되었는데, 이 중 F는 반감기가 109.77분으로 가장 안정적입니다. 18
F는 대기 중 아르곤의 우주선 분열과 양성자와 천연 산소의 반응에 의해 생성되는 천연 미량 방사성 동위원소입니다. 18O + p → 18F + n.[54] 다른 방사성 동위원소들은 반감기가 70초 미만이고, 대부분은 0.5초 이내에 붕괴됩니다.[55] F와 F 동위 원소는 β+ 붕괴와 전자 포획을 거치며, 양성자 방출에 의해 가벼운 동위 원소는 β− 붕괴를 거치며, F보다 무거운 동위 원소는 β 붕괴(중성자 방출이 지연된 가장 무거운 동위 원소)를 겪습니다.[55][56] 플루오린의 두 가지 준안정 이성질체, 즉, 162(7) 나노초의 반감기를 갖는 F와, 2.2(1) 밀리초의 반감기를 갖는 F가 알려져 있습니다.[57]
발생
유니버스
| 원자 번호 | 원소 | 관련있는 양 |
|---|---|---|
| 6 | 탄소 | 4,800 |
| 7 | 질소 | 1,500 |
| 8 | 산소 | 8,800 |
| 9 | 플루오린 | 1 |
| 10 | 네온 | 1,400 |
| 11 | 나트륨 | 24 |
| 12 | 마그네슘 | 430 |
가벼운 원소 중 불소의 존재비는 400ppb(10억분의 1)로 우주의 원소 중 24위로 매우 낮습니다. 탄소에서 마그네슘에 이르는 다른 원소들은 20배 이상 흔합니다.[59] 별의 핵합성 과정이 불소를 우회하고, 그렇지 않으면 생성된 불소 원자는 핵 단면이 높아 수소나 헬륨과 충돌하면 산소나 네온이 각각 생성되기 때문입니다.[59][60]
이러한 일시적인 존재 외에도 불소의 존재에 대한 세 가지 설명이 제안되었습니다.[59][61]
- II형 초신성에서 중성미자에 의한 네온 원자의 충격은 네온 원자를 불소로 변화시킬 수 있습니다.
- 울프-레이에 별의 태양풍은 수소나 헬륨 원자로부터 불소를 날려버릴 수 있습니다.
- 플루오린은 점근성 거대 가지 별의 융합에서 발생하는 대류에 의해 배출됩니다.
지구
불소는 질량 기준으로 600~700 ppm (ppm)으로 지구 지각에서 13번째로 흔한 원소입니다.[62] 플루오르 원소는 자연적으로 발생하지 않는다고 여겨지지만 플루오르화석의 변종인 앙투아나이트에 폐색으로 존재하는 것으로 나타났습니다.[63] 대부분의 불소는 불소 함유 광물로 존재합니다. 플루오라이트, 플루오라파타이트 및 크라이올라이트는 산업적으로 가장 중요합니다.[62][64] 불소(CaF
2)는 불소의 주요 공급원으로, 전 세계적으로 풍부합니다. 중국과 멕시코는 주요 공급업체입니다.[64][65][66][67][68] 전 세계 불소의 대부분을 함유하고 있는 플루오르아파타이트(Ca5(PO4)3F)는 비료 생산의 부산물로서 의도치 않은 불소 공급원입니다.[64] 알루미늄 생산에 사용되는 크라이올라이트(NaAlF
3
6)는 불소가 가장 풍부한 광물입니다. 경제적으로 실행 가능한 크라이올라이트의 천연 공급원은 소진되었으며 대부분은 현재 상업적으로 합성됩니다.[64]
- 플루오라이트: 수정면이 있는 분홍색 구상 덩어리
- 크라이올라이트: 이원자 분자가 2층으로 배열된 평행사변형 윤곽선
토파즈와 같은 다른 미네랄에는 불소가 포함되어 있습니다. 불소화물은 다른 할로겐화물과 달리 불용성이며 염수에서 상업적으로 유리한 농도로 발생하지 않습니다.[64] 화산 폭발과 지열 샘에서 기원이 불분명한 미량의 유기 불소가 검출되었습니다.[69] 2012년 연구에 따르면 앙투아나이트에 0.04% F의
2 중량이 존재하는 것으로 보고되었으며, 이는 소량의 우라늄이 포함된 방사선 때문입니다.[70][63][63]
역사
초기 발견

1529년, Georgius Agricola는 제련 과정에서 금속의 녹는점을 낮추는 데 사용되는 첨가제로 불철석을 설명했습니다.[71][72][note 6] 그는 불소석 암석에 대한 라틴어의 불소 ē(fluor, flow)를 썼습니다. 이 이름은 나중에 플루오르스파(아직도 일반적으로 사용됨)와 플루오르라이트(fluorite)로 진화했습니다.[65][76][77] 플루오르화석의 조성은 나중에 디플루오르화칼슘으로 결정되었습니다.[78]
불산은 1720년부터 유리 에칭에 사용되었습니다.[note 7] Andreas Sigismund Margraf는 1764년에 불화수소를 황산으로 가열하고 그 용액이 유리 용기를 부식시키면서 그것을 처음으로 특징지었습니다.[80][81] 스웨덴의 화학자 칼 빌헬름 셸레는 1771년에 이 실험을 반복하여 산성 생성물을 플루오르스파트시란(플루오르스파르산)이라고 이름 지었습니다.[81][82] 1810년, 프랑스의 물리학자 앙드레 마리 앙페르는 수소와 염소와 비슷한 원소가 불산을 구성한다고 제안했습니다.[83] 그는 또한 1812년 8월 26일자 험프리 데이비 경에게 보낸 편지에서 당시 알려지지 않은 이 물질을 플루오르산과 다른 할로겐의 -ine 접미사로부터 플루오르라고 이름 붙일지도 모른다고 제안했습니다.[84][85] 이 단어는 종종 수정되어 대부분의 유럽 언어에서 사용되지만, 나중에 앙페르의 제안에 따라 그리스어, 러시아어 및 일부 다른 언어에서는 그리스 φθόριος(phthorios, destructive)에서 파생된 ftor 또는 파생어라는 이름을 사용합니다. 새로운 라틴어 이름 플루오룸은 원소에 현재 기호 F를 부여했습니다; Fl은 초기 논문에서 사용되었습니다.[87][note 8]
고립

불소에 대한 초기 연구는 너무 위험해서 몇몇 19세기 실험가들이 불산에 대한 불운 후에 "불소 순교자"로 간주되었습니다.[note 9] 플루오린 원소 자체와 플루오린화수소 모두 부식성이 심하고 단순하고 적합한 전해질이 없어서 플루오린 원소의 분리가 방해되었습니다.[78][88] 에드몽 프레미는 순수 플루오르화수소를 전기분해하여 플루오르를 생성할 수 있다고 가정하고 산성화된 바이플루오르화칼륨에서 무수 샘플을 생성하는 방법을 고안했습니다. 대신 그는 생성된 (건조된) 플루오르화수소가 전기를 통하지 않는다는 것을 발견했습니다.[78][88][89] 프레미의 전 제자 앙리 무아산은 인내심을 가졌고, 많은 시행착오 끝에 중불화칼륨과 건조 플루오린화수소의 혼합물이 전도체라는 것을 발견하여 전기분해를 가능하게 했습니다. 그는 전기화학 전지에서 백금이 급속하게 부식되는 것을 막기 위해 특수 욕조에서 반응을 극도로 낮은 온도로 식히고 백금과 이리듐의 더 저항력이 강한 혼합물에서 세포를 위조했으며 플루오르라이트 마개를 사용했습니다.[88][90] 많은 화학자들의 74년의 노력 끝에 1886년, 모이산은 플루오린 원소를 분리했습니다.[89][91]
1906년 사망 2개월 전, 무아산은 다음과 같은 표창과 [92]함께 노벨 화학상을 받았습니다.[88]
[I]그의 연구와 플루오린 원소의 격리에 있어서의 그의 위대한 공적의 인정. 전 세계는 당신이 요소들 중 그 야만적인 짐승을 연구한 위대한 실험 기술에 감탄했습니다.[note 10]
나중에 사용하기

1920년대 후반 제너럴 모터스(GM)의 프리깃 사업부는 클로로플루오르카본 냉매를 실험했고, 키네틱 케미칼은 1930년 GM과 듀폰의 합작사로 프레온-12(CCLF
2
2)를 그러한 냉매 중 하나로 판매하기 위해 설립되었습니다. 1949년 듀폰은 키네틱을 인수하여 다른 프레온 화합물을 판매했습니다.[81][93][94][95] 폴리테트라플루오로에틸렌(테프론)은 1938년 로이 플런켓(Roy J. Plunkett)이 키네틱(Kinetic)에서 냉매를 연구하던 중 우연히 발견했으며, 그 최상의 화학적, 내열성으로 1941년까지 상업화와 대량 생산을 가속화했습니다.[81][93][94]
플루오린 원소의 대규모 생산은 제2차 세계 대전 중에 시작되었습니다. 독일은 고온 전기분해를 이용하여 계획된 3불화염소를[96] 수 톤으로 만들었고 맨해튼 프로젝트는 우라늄 농축을 위해 6불화우라늄을 생산하는 데 엄청난 양을 사용했습니다. UF는
6 불소만큼 부식성이 있기 때문에 기체 확산 공장에는 특수 재료가 필요했습니다: 막용 니켈, 밀봉용 플루오로폴리머, 냉각제 및 윤활제로서 액체 플루오로카본. 이처럼 급성장한 원자력 산업은 이후 전후 형광화학 발전을 이끌었습니다.[97]
컴파운드
불소는 유기와 무기 영역을 아우르는 풍부한 화학적 성질을 가지고 있습니다. 금속, 비금속, 메탈로이드 및 대부분의 비활성 기체와 결합하며 [98]거의 독점적으로 -1의 산화 상태를 가정합니다.[note 11] 불소는 높은 전자 친화성으로 인해 이온 결합을 선호하게 되는데, 이들은 공유 결합을 형성할 때 극성을 띠며, 거의 모든 경우 단일 결합을 형성합니다.[101][102][note 12]
금속
알칼리 금속은 이온성이고 용해도가 높은 모노플루오라이드를 형성합니다. 이들은 염화나트륨과 유사한 염화물의 입방정계 배열을 가지고 있습니다.[103][104] 디플루오르화 베릴륨을 제외하고,[87] 디플루오르화 알칼리토는 강한 이온 결합을 가지지만 물에는 녹지 않는 성질을 가지고 있으며, 또한 석영과 같은 구조를 가지고 있습니다.[105] 희토류 원소 및 기타 많은 금속은 대부분 이온성 삼불화물을 형성합니다.[106][107][108]
Covalent bonding first comes to prominence in the tetrafluorides: those of zirconium, hafnium[109][110] and several actinides[111] are ionic with high melting points,[112][note 13] while those of titanium,[115] vanadium,[116] and niobium are polymeric,[117] melting or decomposing at no more than 350 °C (660 °F).[118] 펜타플루오라이드는 선형 고분자와 올리고머 복합체로 이러한 추세를 이어갑니다.[119][120][121] 금속 육불화물 13종이 알려져 있으며 [note 14]모두 팔면체이며 대부분 휘발성 고체이지만 액체 MoF와
6 ReF
6, 기체 WF용입니다
6.[122][123][124] 헵타플루오라이드를 특징으로 하는 유일한 금속헵타플루오라이드인 레늄헵타플루오라이드는 5각 쌍쌍뿔 분자기하학을 가진 저융점 분자 고체입니다.[125] 불소 원자가 더 많은 금속 불소화물은 특히 반응성이 높습니다.[126]
| 금속불화물의 구조진행에 관한 연구 | ||
 |  |  |
| 플루오린화나트륨, 이온성 | 고분자형 5불화비스무트 | 헵타플루오라이드 레늄, 분자 |
수소

수소와 불소가 결합하여 불화수소가 되는데, 불화수소는 수소결합에 의해 별개의 분자가 클러스터를 형성하여 염화수소보다 물과 더 유사합니다.[127][128][129] 무거운 할로겐화수소보다 훨씬 높은 온도에서 끓고 물과 달리 혼화성입니다.[130] 플루오린화수소는 물과 접촉하면 쉽게 수화되어 플루오린화수소수, 일명 불산을 형성합니다. 강한 다른 할로겐화수소산과 달리, 불산은 농도가 낮은 약산입니다.[131][note 15] 그러나 다른 산이 할 수 없는 유리를 공격할 수 있습니다.[133]
기타 반응성 비금속

메탈로이드 및 p-블록 비금속의 2원 불소는 일반적으로 공유 및 휘발성이며 다양한 반응성을 갖습니다. 3기 이상의 무거운 비금속은 고가 불소를 형성할 수 있습니다.[135]
삼불화붕소는 평면이고 불완전한 옥텟을 가지고 있습니다. 루이스 산으로 작용하며 암모니아와 같은 루이스 염기와 결합하여 부가물을 형성합니다.[136] 사불화탄소는 사면체이며 비활성이고,[note 16] 그룹 유사체인 실리콘과 사불화 게르마늄도 사면체이지만[137] 루이스 산과 같이 작용합니다.[138][139] 질소 삼불화물은 가수분해에 저항하고 염기성이 아니지만, 높은 분자량으로 반응성과 염기성이 증가하는 삼불화물을 형성합니다.[140] 인, 비소, 안티몬의 오불화물은 각각의 삼불화물보다 반응성이 더 강하며, 오불화 안티몬은 금 오불화물 뒤에 있는 가장 강한 중성 루이스 산으로 알려져 있습니다.[119][141][142]
칼코겐은 다양한 플루오라이드를 가지고 있습니다: 불안정한 디플루오라이드는 산소(산화 상태가 +2인 유일한 산소 화합물), 황 및 셀레늄에 대해 보고되었습니다. 사불화물과 육불화물은 황, 셀레늄 및 텔루륨에 대해 존재합니다. 후자는 더 많은 불소 원자와 더 가벼운 중심 원자에 의해 안정화되므로 육불화황은 특히 비활성입니다. [143][144] 염소, 브롬 및 요오드는 각각 모노-, 트라이- 및 펜타플루오라이드를 형성할 수 있지만 가능한 인터할로겐 헵타플루오라이드 중에서 요오드 헵타플루오라이드만이 특징입니다.[145] 그 중 상당수는 불소 원자의 강력한 공급원이며, 삼불화염소를 사용하는 산업 응용에는 불소를 사용하는 것과 유사한 예방 조치가 필요합니다.[146][147]
비활성기체

1962년 닐 바틀렛이 육불화크소플라틴산 제논의 합성을 보고할 때까지 완전한 전자껍질을 가진 비활성 기체는 다른 원소와의 반응을 거부했습니다.[149] 육불화크소 제논, 사불화크소, 육불화크소, 그리고 다수의 옥시불화크소가 그 이후로 분리되었습니다.[150] 크립톤은 다른 비활성 기체 중에서도 디플루오라이드를 형성하고,[151] 라돈과 불소는 디플루오라이드로 의심되는 고체를 발생시킵니다.[152][153] 아르곤과 플루오르화수소가 극단적인 조건에서 결합하여 플루오르화수소를 생성하는, 더 가벼운 비활성 기체의 2가 플루오르화수소는 예외적으로 불안정합니다.[42] 헬륨에는 오래 지속되는 플루오르화물이 [154]없으며 플루오르화 네온도 관찰된 적이 없습니다.[155] 플루오르화 헬륨은 고압과 저온에서 밀리초 동안 검출되었습니다.[154]
유기화합물


탄소-불소 결합은 유기화학에서 가장 강력한 [157]것으로 유기불소에 안정성을 부여합니다.[158] 자연에는 거의 존재하지 않지만 인공 화합물에 사용됩니다. 이 분야의 연구는 일반적으로 상업적 응용에 의해 주도됩니다.[159] 관련된 화합물은 다양하고 유기 화학에 내재된 복잡성을 반영합니다.[93]
이산 분자
수소 원자를 점점 더 많은 불소 원자에 의해 알칸에 치환하는 것은 용융점과 끓는점이 낮아지고, 밀도가 높아지며, 탄화수소에 대한 용해도가 낮아지고, 전체적인 안정성이 높아지는 등의 여러 특성을 점진적으로 변화시킵니다. 모든 수소 원자가 치환된 [note 17]과불화탄소는 대부분의 유기 용매에서 불용성이며, 액체 암모니아의 나트륨과만 주변 조건에서 반응합니다.[160]
과불화 화합물이라는 용어는 작용기,[161][note 18] 종종 카르복실산의 존재가 아니라면 과불화탄소가 될 수 있는 것에 사용됩니다. 이들 화합물은 과불화탄소와 안정성, 소수성 등 많은 특성을 공유하는 [163]반면, 작용기는 반응성을 높여 표면에 부착하거나 계면활성제 역할을 합니다.[164] 특히 불소계 계면활성제는 탄화수소계 유사체보다 물의 표면장력을 더 낮출 수 있습니다. 기능기 근처에 일부 비불소 탄소 원자가 있는 플루오로텔로머도 과불소화된 것으로 간주됩니다.[163]
폴리머
폴리머는 이산 분자에서 불소 치환(수소에 대한)에 의해 제공되는 것과 동일한 안정성 증가를 나타내며, 일반적으로 용융점도 증가합니다.[165] 구조 단위 –CF-를
2 갖는 폴리에틸렌의 가장 단순한 플루오로폴리머 및 퍼플루오로 유사체인 PTFE는 예상대로 이러한 변화를 보여주지만 매우 높은 융점으로 인해 성형이 어렵습니다.[166] 다양한 PTFE 유도체는 온도에 덜 견디지만 성형하기가 더 쉽습니다: 불소화 에틸렌 프로필렌은 일부 불소 원자를 트리플루오로메틸기로 대체하고, 퍼플루오로알콕시 알칸은 트리플루오로메틸기로 대체하며,[166] Nafion은 설폰산기로 캡핑된 퍼플루오로에테르 측쇄를 포함합니다.[167][168] 다른 플루오로폴리머들은 수소 원자를 일부 보유하고 있는데, 폴리불화비닐리덴은 PTFE의 플루오린 원자의 절반을, 폴리불화비닐은 1/4을 가지고 있지만 둘 다 과불화폴리머와 매우 유사하게 행동합니다.[169]
생산.
플루오린 원소 및 사실상 모든 플루오린 화합물은 플루오린화수소 또는 플루오린화수소의 수용액인 불산으로부터 생성됩니다. 불화수소는 불화수소(CaF2)와 황산의 흡열 반응에 의해 가마에서 생성됩니다.[170]
- CaF + HSO → 2 HF(g) + CaSO
그런 다음 기체 HF를 물에 흡수하거나 액화할 수 있습니다.[171]
제조된 HF의 약 20%는 비료 생산의 부산물로 헥사플루오로규산(HSIF26)을 생산하며, 이는 열 및 가수분해에 의해 HF를 방출할 수 있습니다.
- H2SiF6 → 2 HF + SiF4
- SiF + 2 HO → 4 HF + SiO
F로2 가는 공업로

무아산의 방법은 2불화칼륨/불화수소 혼합물을 전기분해하여 공업적으로 다량의 불소를 생산하는 방법으로 강철 용기 양극에서 수소 이온을 환원시키고 탄소 블록 양극에서 불소 이온을 산화시켜 각각 수소와 불소 가스를 생성하는 방법입니다.[66][172] 온도가 상승하고 KF•2HF가 70°C(158°F)에서 용융되며 70–130°C(158–266°F)에서 전기분해됩니다. 순수한 HF는 사실상 비전도성이기 때문에 전기 전도성을 제공하는 역할을 하는 KF가 필수적입니다.[81][173][174] 불소는 내부가 패시베이션된 강철 실린더에 200°C(392°F) 미만의 온도에서 저장할 수 있으며, 그렇지 않은 경우 니켈을 사용할 수 있습니다.[81][175] 조절 밸브와 파이프 구조는 니켈로 만들어지며, 후자는 모넬을 대신 사용할 가능성이 있습니다.[176] 물과 기름을 엄격하게 배제하는 것과 함께 빈번한 패시베이션을 수행해야 합니다. 실험실에서 유리 제품은 저압 및 무수 조건에서 불소 가스를 운반할 수 있습니다.[176] 일부 소스는 니켈-모넬-PTFE 시스템을 권장합니다.[177]
실험실 경로
1986년 무아산의 업적 100주년을 기념하기 위한 컨퍼런스를 준비하는 동안, 칼 오. 크리스테는 일부 금속불화물 음이온은 안정적인 중성 반응물이 없기 때문에 화학적 불소 생성이 가능해야 한다고 생각했습니다. 대신 그들의 산성화는 산화를 유발할 수 있습니다. 그는 플루오린을 높은 수율과 대기압에서 진화시키는 방법을 고안했습니다.[178]
- 2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O2↑
- 2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑
Christe는 나중에 반응물들이 "100년 이상 알려져 있었고 심지어 Moissan도 이 계획을 생각해 냈을 수도 있다"고 말했습니다.[179] 2008년까지만 해도 일부 참고 문헌은 여전히 불소가 화학적 분리에 너무 반응성이 있다고 주장했습니다.[180]
산업용 애플리케이션
전 세계적으로 불소를 가장 많이 공급하는 플루오라이트 채굴은 1989년 560만 톤의 광석이 추출되면서 정점을 찍었습니다. 1994년 클로로플루오르카본 규제로 생산량이 360만 톤으로 줄었고, 이후 생산량이 증가하고 있습니다. 2003년에는 약 450만 톤의 광석과 5억 5천만 달러의 수익이 발생했으며, 이후 보고서는 2011년 전 세계 형광화학 매출을 150억 달러로 추정하고 2016-18년 생산 수치를 350만-590만 톤, 최소 200억 달러의 수익이 발생할 것으로 예측했습니다.[81][181][182][183][184] 프로스트 플로테이션은 채굴된 플루오르라이트를 동일한 비율의 두 가지 주요 야금 등급으로 분리합니다: 60-85%의 순수 메트스파르는 철 제련에 거의 사용되는 반면 97%+ 순수 산파르는 주로 주요 산업 중간 플루오르화 수소로 전환됩니다.[66][81][185]


6 변류기
매년 최소 17,000 미터톤의 불소가 생산됩니다. 우라늄이나 육불화황으로 1kg당 5~8달러밖에 들지 않지만, 문제를 다루기 때문에 원소로는 몇 배나 더 듭니다. 유리불소를 대량으로 사용하는 대부분의 공정은 수직계열화 하에서 in situ 생성을 사용합니다.[186]
연간 최대 7,000톤을 소비하는 불소 가스의 가장 큰 응용 분야는 핵 연료 사이클을 위한
6 UF 준비입니다. 플루오린은 이산화우라늄과 불산으로 형성된 사불화우라늄을 불소화하는 데 사용됩니다.[186] 플루오린은 단동성이므로 UF
6 분자 간의 질량 차이는 U 또는 U의 존재로 인해 기체 확산 또는 기체 원심분리기를 통해 우라늄 농축이 가능합니다.[5][66] 연간 약 6,000톤이 고압 변압기 및 차단기용 불활성 유전체 SF를
6 생산하는 데 사용되어 오일이 채워진 장치와 관련된 위험한 폴리염화 바이페닐이 필요하지 않습니다.[187] 화학 기상 증착에 사용되는 6불화 레늄과 텅스텐, 플라즈마 에칭에[188][189][190] 사용되는 테트라플루오로메탄, 세정 장비에 사용되는 삼불화 질소 등 여러 가지 불소 화합물이 있습니다.[66] 불소는 유기 플루오르화물의 합성에도 사용되지만, 그 반응성은 종종 먼저 더 부드러운 ClF
3, BrF
3 또는
5 IF로 전환되어야 하며, 이는 함께 보정된 플루오르화를 가능하게 합니다. 불소화 의약품은 사불화황을 대신 사용합니다.[66]
무기불화물
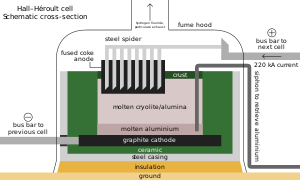
다른 철 합금과 마찬가지로 강철의 각 미터톤에 약 3kg(6.5lb)의 메트스파가 첨가됩니다. 불소 이온은 녹는점과 점도를 낮춥니다.[66][191] 에나멜 및 용접봉 코팅과 같은 재료에서 첨가제로서의 역할과 함께, 대부분의 산성 스파르는 황산과 반응하여 불산을 형성하며, 이는 강철 산세, 유리 에칭 및 알칸 크래킹에 사용됩니다.[66] HF의 3분의 1은 Cryolite와 삼불화알루미늄을 합성하는 데 사용되며, 둘 다 홀 안에 있는 플럭스입니다.알루미늄 추출을 위한 헤롤트 공정; 때때로 제련 장치와의 반응으로 보충이 필요합니다. 알루미늄의 각 미터톤에는 약 23kg(51lb)의 플럭스가 필요합니다.[66][192] 플루오로실리케이트는 두 번째로 많은 양을 소비하며, 소듐 플루오로실리케이트는 물 불소화 및 세탁 폐수 처리에 사용되며, 크라이올라이트 및 사불화규소의 중간체로 사용됩니다.[193] 다른 중요한 무기 불화물에는 코발트, 니켈 및 암모늄이 포함됩니다.[66][104][194]
유기불화물
유기플루오라이드는 채굴된 플루오르나이트의 20% 이상과 불산의 40% 이상을 소비하며, 냉매 가스가 지배하고 플루오르폴리머의 시장 점유율이 증가합니다.[66][195] 계면활성제는 사소한 용도이지만 연간 10억 달러 이상의 수익을 창출합니다.[196] -150 °C(-240 °F) 이상의 직접적인 탄화수소-불소 반응의 위험으로 인해 산업용 플루오로카본 생산은 주로 촉매 하에서 플루오로화수소에 의해 플루오로화수소로 클로로카본 염소가 대체되는 Swarts fluorination과 같은 할로겐 교환 반응을 통해 간접적으로 이루어집니다. 전기화학적 불소화는 탄화수소를 플루오린화수소에 전기분해시키고, 파울러 공정은 삼불화코발트와 같은 고체 불소 담체로 처리합니다.[93][197]
냉매가스
비공식적인 맥락에서 프레온이라고 불리는 할로겐화 냉매는 [note 19]불소, 염소, 탄소 및 수소의 양을 나타내는 R-숫자로 식별됩니다.[66][198] R-11, R-12, R-114와 같은 클로로플루오르카본(CFC)은 한때 유기불소를 지배하여 1980년대에 생산량이 정점에 이르렀습니다. 에어컨 시스템, 추진제 및 용제에 사용되는 이들의 생산량은 국제적으로 광범위한 금지 조치 이후인 2000년대 초반까지 이 피크의 10분의 1 미만이었습니다.[66] 대체품으로 하이드로클로로플루오르카본(HCFCs)과 하이드로플루오르카본(HFCs)이 설계되었으며, 이들의 합성은 유기 산업에서 불소의 90% 이상을 소비합니다. 중요한 HCFC에는 R-22, 클로로디플루오로메탄 및 R-141b가 포함됩니다. 주요 HFC는 HFC-134a에 비해 지구온난화 가능성이 1% 미만이어서 주목받는 HFO(Hydrofluorolefin)인 새로운 형태의 분자 HFO-1234yf를 가진 R-134a입니다[66].[199]
폴리머

2006년과 2007년에 약 18만 톤의 플루오로폴리머가 생산되어 연간 35억 달러 이상의 수익을 창출했습니다.[200] 2011년 세계 시장은 60억 달러에 조금 못 미치는 것으로 추산되었습니다.[201] 형광 고분자는 자유 라디칼을 중합해야만 형성될 수 있습니다.[165]
폴리테트라플루오로에틸렌(PTFE)은 때때로 듀폰(DuPont)이라는 이름으로 불리는데,[202] 세계 형광 고분자 생산량의 60~80질량%를 차지합니다.[200] PTFE는 우수한 유전체이기 때문에 가장 큰 응용 분야는 전기 절연입니다. 또한 내식성이 필요한 화학 산업, 코팅 파이프, 튜브 및 개스킷에 사용됩니다. 또 다른 주요 용도는 경기장 지붕용 PFTE 코팅 섬유 유리 천입니다. 주요 소비자 응용 프로그램은 끈적임이 없는 조리기구에 대한 것입니다.[202] 저커드 PTFE 필름은 확장 PTFE(ePTFE)가 되는데, 이는 때때로 고어텍스(Gore-Tex)라는 상표명으로 지칭되고 레인웨어, 보호 의류 및 필터에 사용되는 미세 기공 멤브레인이며, ePTFE 섬유는 밀봉 및 먼지 필터로 제조될 수 있습니다.[202] 불소화 에틸렌 프로필렌을 포함한 다른 불소 중합체는 PTFE의 특성을 모방하여 대체할 수 있으며, 성형성이 더 높지만 비용이 많이 들고 열적 안정성이 더 낮습니다. 두 가지 다른 형광 고분자의 필름이 태양 전지의 유리를 대체합니다.[202][203]
내화학성(그러나 고가의) 불소화 이오노머는 전기화학적 세포막으로 사용되며, 그 중 첫 번째이자 가장 두드러진 예는 Nafion입니다. 1960년대에 개발된 이 제품은 처음에는 우주선에서 연료전지 소재로 투입됐다가 수은 기반의 클로랄칼리 공정전지를 대체했습니다. 최근에는 자동차에 양성자 교환막 연료전지를 장착하려는 노력으로 연료전지 응용이 다시 대두되고 있습니다.[204][205][206] Viton과 같은 플루오로엘라스토머는 주로 O-링에 사용되는 가교된 플루오로폴리머 혼합물이며,[202] CF(perfluorobutane410)는 소화제로 사용됩니다.[207]
계면활성제
불소 계면활성제는 물과 얼룩을 퇴치하는 데 사용되는 작은 유기 불소 분자입니다. 가격은 비싸지만(kg당 200~2000달러의 의약품과 비슷한 수준), 2006년까지 연간 10억 달러 이상의 수익을 올렸습니다. 스카치가드는 2000년에만 3억 달러 이상의 수익을 올렸습니다.[196][208][209] 형광 계면활성제는 전체 계면활성제 시장에서 소수이며, 대부분은 훨씬 저렴한 탄화수소 기반 제품이 차지합니다. 페인트의 용도는 복합 비용으로 인해 부담이 되고 있습니다. 2006년에는 이 용도의 가치가 1억 달러에 불과했습니다.[196]
농약
농약의 약 30%는 불소를 함유하고 있으며,[210] 대부분은 제초제와 소수의 작물 조절제가 있는 살균제입니다. 보통 단일 원자 또는 기껏해야 트리플루오로메틸기의 불소 치환은 플루오르화된 의약품과 유사한 효과를 갖는 강력한 변형으로, 생물학적 체류 시간 증가, 막 교차 및 분자 인식 변경이 있습니다.[211] 트리플루랄린은 미국에서 제초제로 대규모 사용되는 등 대표적인 [211][212]예이지만 발암 의심 물질로 유럽 여러 나라에서 사용이 금지됐습니다.[213] 모노플루오로아세트산나트륨(1080)은 아세트산나트륨 수소 1개가 불소로 치환된 포유류의 독으로, 시트르산 회로에서 아세트산을 치환함으로써 세포 대사를 방해합니다. 19세기 후반에 처음 합성된 이 제품은 20세기 초에 살충제로 인식되었고, 이후 현재 사용되고 있습니다. 1080의 최대 소비자인 뉴질랜드는 침습적인 호주 커먼브러시테일 주머니쥐로부터 키위를 보호하기 위해 이 제품을 사용합니다.[214] 유럽과 미국은 1080을 금지했습니다.[215][216][note 20]
의약품 용도
치과진료

20세기 중반 이후의 인구 연구는 국소 불소가 치아 우식을 감소시킨다는 것을 보여줍니다. 이것은 처음에는 치아 에나멜 하이드록시아파타이트가 더 내구성이 있는 플루오라파타이트로 전환된 것에 기인했지만, 불소화 전 치아에 대한 연구들은 이 가설을 반박했고, 현재의 이론들은 작은 우식에서 에나멜 성장을 돕는 플루오린화물을 포함하고 있습니다.[217] 식수에 불소가 자연적으로 존재하는 지역의 어린이들을 대상으로 한 연구 이후, 1940년대부터 충치와[218] 싸우기 위해 조절된 공공 물 공급 불소화가 시작되었고, 현재는 미국인의 3분의 2를 포함하여 전 세계 인구의 6퍼센트를 공급하는 물에 적용되고 있습니다.[219][220] 2000년과 2007년의 학술 문헌에 대한 리뷰는 물 불소화와 어린이의 충치의 현저한 감소를 연관시켰습니다.[221] 대부분의 양성 치과용 불소 처리 이외에 부작용이 없다는 그러한 승인과 증거에도 불구하고,[222] 윤리적 및 안전상의 이유로 여전히 반대가 존재합니다.[220][223] 불소화의 이점은 아마도 다른 불소 공급원 때문에 감소했지만 저소득층에서는 여전히 측정 가능합니다.[224] 일플루오로인산나트륨, 때로는 나트륨 또는 주석()II) 불소는 불소 치약에서 종종 발견되는데, 1955년 미국에서 처음 소개되었고 현재 선진국에서 불소화 구강 세정제, 젤, 거품 및 바니쉬와 함께 널리 발견됩니다.[224][225]
의약품

현대 의약품의 20%는 불소를 함유하고 있습니다.[226] 이 중 하나인 콜레스테롤 감소제 아토르바스타틴(Lipitor)은 2011년 제네릭이 되기 전까지 다른 어떤 약물보다 많은 수익을 올렸습니다.[227] 2000년대 중반 매출 상위 10위의 의약품인 복합 천식 처방 세레타이드는 두 가지 유효성분을 함유하고 있으며, 그 중 하나인 플루티카손은 불소화되어 있습니다.[228] 탄소-불소 결합이 매우 안정적이기 때문에 많은 약물이 불활화를 지연시키고 복용량 기간을 늘리기 위해 불소화됩니다.[229] 불소화는 또한 결합이 탄소-수소 결합보다 더 소수성이기 때문에 친유성을 증가시키며, 이는 종종 세포막 침투 및 따라서 생체이용률에 도움이 됩니다.[228]
삼환식 및 1980년대 이전의 항우울제는 세로토닌 표적 이외의 신경전달물질에 대한 비선택적 간섭으로 인해 여러 부작용이 발생했으며 불소화 플루옥세틴은 선택적이었고 이러한 문제를 가장 먼저 방지한 것 중 하나였습니다. 선택적 세로토닌 재흡수 억제제인 시탈로프람, 그 거울상이성질체 에시탈로프람, 플루복사민과 파록세틴을 포함한 많은 현재 항우울제들이 이와 같은 치료를 받고 있습니다.[230][231] 퀴놀론은 효과를 높이기 위해 종종 불소화되는 인공 광범위 항생제입니다. 여기에는 시프로플록사신과 레보플록사신이 포함됩니다.[232][233][234][235] 플루오린은 스테로이드에도 사용됩니다:[236] 플루드로코르티손은 혈압을 상승시키는 미네랄로코르티코이드이고, 트리암시놀론과 덱사메타손은 강한 글루코코르티코이드입니다.[237] 흡입된 마취제의 대부분은 불소화가 심하며, 원형 할로탄은 동시대 제품보다 훨씬 더 불활성이고 강력합니다. 불소화 에테르인 세보플루란과 데스플루란과 같은 후기 화합물은 할로탄보다 더 낫고 혈액에 거의 녹지 않아 깨어나는 시간이 더 빠릅니다.[238][239]
PET 스캔

플루오린-18은 거의 2시간의 반감기가 생산 시설에서 이미징 센터로 운반할 수 있을 정도로 충분히 길기 때문에 양전자 방출 단층 촬영을 위한 방사성 추적기에서 종종 발견됩니다.[240] 가장 일반적인 추적자는 플루오로데옥시글루코스로[240] 정맥 주사 후 뇌 및 대부분의 악성 종양과 같은 포도당을 필요로 하는 조직에 의해 흡수되며,[241] 컴퓨터 보조 단층 촬영을 사용하여 자세한 영상을 촬영할 수 있습니다.[242]
산소 운반체
액체 플루오로카본은 혈액보다 많은 양의 산소 또는 이산화탄소를 보유할 수 있으며 인공 혈액 및 액체 호흡에 사용할 수 있기 때문에 주목을 받았습니다.[243] 플루오로카본은 보통 물과 섞이지 않기 때문에 혈액으로 사용하기 위해서는 에멀젼(물에 현탁된 과불화탄소의 작은 물방울)에 혼합되어야 합니다.[244][245] 그러한 제품 중 하나인 옥시사이테는 초기 임상 시험을 거쳤습니다.[246] 이러한 물질들은 지구력을 가진 운동선수들에게 도움을 줄 수 있고 운동을 금지합니다. 1998년 한 사이클 선수가 거의 죽을 뻔 하면서 그들의 학대에 대한 조사가 시작되었습니다.[247][248] 순수 과불화탄소 액체 호흡(물 에멀젼이 아닌 순수 과불화탄소 액체를 사용하는 것)의 적용에는 화상 피해자와 폐가 부족한 미숙아를 돕는 것이 포함됩니다. 부분적이고 완전한 폐 충전이 고려되었지만 전자만이 인간에게 중요한 테스트를 수행했습니다.[249] 얼라이언스 파마슈티컬스의 노력은 임상시험에 도달했지만 결과가 일반 치료법보다 좋지 않아 포기되었습니다.[250]
생물학적 역할
불소는 인간과 다른 포유동물에게 필수적이지는 않지만, 소량은 치아 에나멜(플루오르아파타이트의 형성이 박테리아의 박테리아 발효에 의해 생성된 산으로부터 에나멜을 더 공격에 저항하게 만드는 곳)의 강화에 도움이 되는 것으로 알려져 있습니다. 소량의 불소는 뼈의 힘에 도움이 될 수 있지만 후자는 확실하게 확립되지 않았습니다.[251] WHO와 미국 국립 아카데미 의학 연구소는 모두 권장 일일 허용량(RDA)과 불소의 상한 허용 섭취량을 발표하는데, 이는 나이와 성별에 따라 다릅니다.[252][253]
천연 유기 불소는 미생물, 식물[69] 및 최근 동물에서 발견되었습니다.[254] 가장 흔한 것은 플루오로아세테이트로 아프리카, 호주, 브라질에서 최소 40개의 식물이 초식동물에 대한 방어 수단으로 사용합니다.[215] 다른 예로는 말단 불소화 지방산, 플루오로아세톤 및 2-플루오로시트레이트가 있습니다.[255] 2002년 박테리아에서 불소를 탄소에 결합시키는 효소인 아데노실-플루오라이드 합성효소가 발견되었습니다.[256]
독성
불소 원소는 살아있는 유기체에 매우 독성이 강합니다. 인간에게 미치는 영향은 시안화수소의 50ppm보다[257] 낮은 농도에서 시작되며 염소의 영향과 유사합니다.[258] 눈과 호흡기의 상당한 자극, 간과 신장의 손상이 25ppm 이상 발생하여 불소는 생명과 건강에 즉시 위험합니다.[259] 눈과 코는 100ppm으로 심각하게 손상되고,[259] 플루오린 1,000ppm을 흡입하면 수 분 만에 사망에 이르게 되는데,[260] 시안화수소의 경우 270ppm에 달합니다.[261]
불산
| 유해성 | |
|---|---|
| GHS 라벨링: | |
      | |
| 위험 | |
| H270, H314, H330[262] | |
| NFPA704(파이어다이아몬드) | |

불산은 25°C에서 pKa가 3.2로 가장 약한 불산입니다.[264] 순수한 불화수소는 수소 결합의 존재로 인해 휘발성 액체이고, 다른 할로겐화수소는 기체입니다. 유리, 콘크리트, 금속 및 유기물을 공격할 수 있습니다.[265]
불산은 약하기는 하지만 황산과 같은 많은 강산보다 더 큰 위험성을 가진 접촉성 독입니다: 수용액에서 중성을 유지하기 때문에 흡입, 섭취, 피부를 통해서든 조직을 더 빨리 침투할 수 있고, 1984년부터 1994년까지 적어도 9명의 미국 노동자가 이러한 사고로 사망했습니다. 혈액 속의 칼슘, 마그네슘과 반응하여 저칼슘혈증이 발생하고 심장 부정맥을 통해 사망 가능성이 있습니다.[266] 불용성 불화칼슘 형성은 강한 통증을[267] 유발하고 160cm2(25인치2) 이상의 화상은 심각한 전신 독성을 유발할 수 있습니다.[268]
50% HF의 경우 8시간 동안 노출이 뚜렷하지 않을 수 있으며, 저농도의 경우 24시간까지 증가할 수 있으며, 불화물이 신경 기능에 영향을 미치므로 화상은 처음에는 통증이 없을 수 있습니다. 피부가 HF에 노출된 경우 10~15분 동안 물 분사로 헹구고 오염된 옷을 제거하여 손상을 줄일 수 있습니다.[269] 다음으로 글루코네이트 칼슘을 도포하여 불소와 결합하는 칼슘 이온을 제공합니다. 피부 화상은 2.5% 글루코네이트 칼슘 겔 또는 특수 헹굼 용액으로 치료할 수 있습니다.[270][271][272] 불산 흡수는 더 많은 의학적 치료가 필요합니다. 글루콘산칼슘을 주사하거나 정맥주사로 투여할 수 있습니다. 일반적인 실험실 시약인 염화칼슘을 글루콘산칼슘 대신 사용하는 것은 금지되며 심각한 합병증을 유발할 수 있습니다. 영향을 받는 부품의 절제 또는 절단이 필요할 수 있습니다.[268][273]
플루오린화이온
가용성 플루오라이드는 중간 정도의 독성이 있습니다: 체중 1kg당 5-10g의 플루오린화나트륨 또는 32-64mg의 플루오린화 이온은 성인에게 치명적인 양을 나타냅니다.[274] 치사량의 5분의 1은 건강에 악영향을 미칠 수 있으며,[275] 만성적인 과잉 섭취는 골격계 불소증으로 이어질 수 있으며, 이는 아시아와 아프리카에서 수백만 명에게 영향을 미칩니다.[275][276] 섭취한 불소는 장에서 쉽게 흡수되는 불산을 형성하고, 장에서 세포막을 통과하여 칼슘과 결합하여 각종 효소를 방해한 후 배뇨합니다. 노출 한계는 신체의 불소 이온 제거 능력에 대한 소변 검사에 의해 결정됩니다.[275][277]
역사적으로 불소 중독의 대부분의 사례는 무기 불소가 함유된 살충제를 우연히 섭취하여 발생해 왔습니다.[278] 현재 불소 중독 가능성에 대한 독극물 관리 센터에 전화하는 대부분의 전화는 불소 함유 치약의 섭취에서 비롯됩니다.[275] 물불화 장치가 오작동한 것도 또 다른 원인입니다. 알래스카에서 발생한 한 사건은 거의 300명에게 영향을 미쳤고 한 명이 사망했습니다.[279] 치약으로 인한 위험은 어린 아이들에게 가중되는데, 질병관리본부는 6세 미만의 아이들이 치약을 삼키지 않도록 양치질을 하는 것을 감독할 것을 권고하고 있습니다.[280] 한 지역 연구에서는 살충제 섭취로 인한 사망자 1명을 포함하여 총 87명의 10대 이전 불소 중독 보고를 1년 동안 조사했습니다. 대부분은 증상이 없었지만 30% 정도는 복통이 있었습니다.[278] 미국 전역의 대규모 연구에서도 비슷한 결과가 나왔습니다: 사례의 80%가 6세 미만의 어린이와 관련이 있고 심각한 사례는 거의 없었습니다.[281]
환경문제
대기.

1987년 체결된 몬트리올 의정서는 오존 손상 가능성(ODP) 때문에 클로로플루오르카본(CFCs)과 브로모플루오르카본에 대해 엄격한 규정을 두고 있습니다. 그들의 원래 용도에 적합한 높은 안정성은 또한 유리된 염소 및 브롬 원자가 오존 분자를 공격하는 더 높은 고도에 도달할 때까지 분해되지 않는다는 것을 의미했습니다.[283] 금지령과 초기 효과 징후에도 불구하고, 예측은 완전한 회복 전에 여러 세대가 지나갈 것이라고 경고했습니다.[284][285] CFC의 ODP의 10분의 1인 하이드로클로로플루오르카본(HCFC)은 현재 대체품이며,[286] 그 자체로 2030-2040년까지 염소와 ODP가 없는 하이드로플루오르카본(HFC)으로 대체될 예정입니다.[287] 2007년 이 날짜는 선진국의 경우 2020년으로 앞당겨졌습니다.[288] 환경 보호국은 이미 2003년에 HCFC 한 개의 생산을 금지하고 다른 두 개의 HCFC의 생산을 제한했습니다.[287] 플루오로카본 가스는 일반적으로 지구온난화 잠재량(GWP)이 약 100~10,000인 온실가스이며, 육불화황은 약 20,000의 값을 갖습니다.[289] 이상치는 HFO-1234yf로 Hydrofluorolefin(HFO)라 불리는 새로운 유형의 냉매로 현재 냉매 기준 HFC-134a의 1,430에 비해 GWP가 1 미만으로 세계적인 수요를 끌어 모았습니다.[199]
생물학적 지속성

유기불소는 탄소-불소 결합의 강도로 인해 생물학적 지속성을 나타냅니다. 퍼플루오로알킬산(PFAA)은 산성 작용기 때문에 수용성이 거의 없는 지속성 유기 오염 물질로 알려져 있으며,[291] 퍼플루오로옥탄술폰산(PFOS) 및 퍼플루오로옥탄산(PFOA)이 가장 많이 연구되고 있습니다.[292][293][294] PFAA는 북극곰에서 인간에 이르기까지 전 세계적으로 미량으로 발견되었으며 PFOS와 PFOA는 모유와 신생아의 혈액에 서식하는 것으로 알려져 있습니다. 2013년 검토에서는 지하수 및 토양 PFAA 수준과 인간 활동 사이에 약간의 상관관계가 있음을 보여주었는데, 하나의 화학물질이 지배하는 명확한 패턴은 없었으며, 더 많은 양의 PFOS는 더 많은 양의 PFOA와 상관관계가 있었습니다.[292][293][295] 체내에서, PFAA는 혈청 알부민과 같은 단백질과 결합합니다; 그들은 신장을 통해 배설되기 전에 간과 혈액에서 인간 내에 집중되는 경향이 있습니다. 체내 체류 시간은 종에 따라 크게 다르며, 설치류의 경우 반감기, 인간의 경우 수년간 지속됩니다.[292][293][296] 고용량의 PFOS와 PFOA는 신생아 설치류의 암과 사망을 유발하지만 인간 연구는 현재 노출 수준에서 효과를 입증하지 못했습니다.[292][293][296]
참고 항목
메모들
- ^ 수소가 할로겐으로 간주되지 않는다고 가정합니다.
- ^ 산소, 불소, 네온 원자의 반지름에 대해서는 출처가 다릅니다. 따라서 정확한 비교는 불가능합니다.
- ^ α-플루오린은 분자의 규칙적인 패턴을 가지고 있고 결정질 고체이지만 그 분자는 특정한 방향을 가지고 있지 않습니다. β-플루오린의 분자는 위치가 고정되어 있고 회전 불확실성이 최소입니다. α-불소에 대한 자세한 내용은 폴링의 1970년 구조를 참조하십시오.[46] 결정의 장애 개념에 대한 자세한 내용은 참조된 일반 리뷰를 참조하십시오.[47][48]
- ^ 큰 딸깍 소리가 납니다. 샘플이 깨지고 샘플 창이 꺼질 수 있습니다.
- ^ 각운동량과 자기모멘트의 비율을 자이로율이라고 합니다. "어떤 핵들은 여러 가지 목적으로 지구처럼 또는 꼭대기처럼 축을 중심으로 회전하는 것으로 생각될 수 있습니다. 일반적으로 스핀은 그들에게 각운동량과 자기모멘트를 부여합니다; 첫 번째는 그들의 질량 때문이고, 두 번째는 그들의 전하의 전부 또는 일부가 질량과 함께 회전할 수 있기 때문입니다."[52]
- ^ 바실리우스 발렌티누스는 15세기 후반에 불화석을 기술한 것으로 추정되지만, 그의 저작이 200년 후에 밝혀졌기 때문에 이 작품의 진위는 의심스럽습니다.[73][74][75]
- ^ 아니면 빠르면 1670년 이후부터인가요; 파팅턴과[79] 위크는[78] 서로 다른 설명을 합니다.
- ^ Fl은 2012년부터 플레로븀에 사용됩니다.
- ^ 데이비, 게이뤼삭, 테나드 그리고 아일랜드의 화학자 토마스와 조지 녹스가 부상을 입었습니다. 벨기에 화학자 폴랭 루예와 프랑스 화학자 제롬 니클레스가 했습니다 무이산은 심각한 불화수소 중독도 겪었습니다.[78][88]
- ^ 또한 전기 아크로를 발명한 것도 영광입니다.
- ^ F의
2 불소는 산화 상태가 0인 것으로 정의됩니다. 약 40 K에서 분해되는 불안정한 종 F와−
2 F는−
3 중간 산화 상태를 가지며,[99] F와+
4 몇몇 관련 종들은 안정적일 것으로 예상됩니다.[100] - ^ 준안정 붕소와 질소 일불화물은 고차의 불소 결합을 가지며, 일부 금속 복합체는 가교 리간드로 사용합니다. 수소 결합은 또 다른 가능성입니다.
- ^ ZrF는
4 932°C(1710°F)에서,[113] HfF는
4
4 968°C(1774°F)에서,[110] UF는 1036°C(1897°F)에서 녹습니다.[114] - ^ 이들 13개는 몰리브덴, 테크네튬, 루테늄, 로듐, 텅스텐, 레늄, 오스뮴, 이리듐, 백금, 폴로늄, 우라늄, 넵투늄, 플루토늄입니다.
- ^ 클락의 설명도 참고하세요.[132]
- ^ 사불화탄소는 형식적으로는 유기이지만 SiF
4 및 GeF와
4 비교하기 위해 더 복잡한 탄소-불소 화합물이 논의되는 유기불소 화학 섹션에 포함되지 않고 여기에 포함됩니다. - ^ 과불화탄소와 플루오로카본은 탄소와 플루오린만을 포함하는 분자에 대한 IUPAC 동의어이지만, 구어적 및 상업적 맥락에서 후자의 용어는 탄소와 플루오린을 포함하는 분자를 지칭할 수 있으며, 아마도 다른 원소를 포함할 수 있습니다.
- ^ 이 용어는 정확하지 않으며 과불소 물질도 사용됩니다.[162]
- ^ 이 DuPont 상표는 CFC, HFC 또는 HCFC에 더 오용되기도 합니다.
- ^ 미국의 양과 소의 칼라는 코요테와 같은 포식자에 대해 1080을 사용할 수 있습니다.
원천
인용
- ^ "Standard Atomic Weights: Fluorine". CIAAW. 2021.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; et al. (4 May 2022). "Standard atomic weights of the elements 2021 (IUPAC Technical Report)". Pure and Applied Chemistry. doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ a b c d e f Jaccaud et al. 2000, 381쪽
- ^ a b c 헤인즈 2011, 페이지 4.121
- ^ a b c d e Jaccaud et al. 2000, 382쪽
- ^ a b c 압축가스 협회 1999, 페이지 365.
- ^ "Triple Point The Elements Handbook at KnowledgeDoor". KnowledgeDoor.
- ^ Himmel, D.; Riedel, S. (2007). "After 20 Years, Theoretical Evidence That 'AuF7' Is Actually AuF5·F2". Inorganic Chemistry. 46 (13). 5338–5342. doi:10.1021/ic700431s.
- ^ 딘 1999, 페이지 4.6.
- ^ 딘 1999, 페이지 4.35
- ^ Matsui 2006, 257쪽.
- ^ Jaws & Braker 2001, 페이지 385.
- ^ Mackay, Mackay & Henderson, 2002, 72쪽.
- ^ 청 외 1999.
- ^ Chisté & Bé 2011.
- ^ 이 외 2014.
- ^ 딘 1999, 564쪽.
- ^ 슬라이드 2004, 10.137–10.138쪽.
- ^ Moore, Stanitski & Jurs 2010, 페이지 156.
- ^ Cordero et al. 2008.
- ^ Pyykö & Atsumi 2009.
- ^ a b Greenwood & Ernshaw 1998, 804쪽.
- ^ 1996년 10월 230페이지
- ^ 넬슨 1947년
- ^ 리딘, Molochko & Andreeva 2000, 페이지 442–455.
- ^ a b Wiberg, Wiberg & Hollleman 2001, 404쪽.
- ^ Patnaik 2007, p. 472.
- ^ Aigupeers et al. 2000, 400쪽.
- ^ Greenwood & Earnshaw 1998, 페이지 76, 804.
- ^ Kuriakose & Margrave 1965.
- ^ Hassegawa et al. 2007.
- ^ Lagow 1970, 페이지 64–78.
- ^ 리딘, Molochko & Andreeva 2000, 252쪽.
- ^ 태너 인더스트리 2011.
- ^ Morrow, Perry & Cohen 1959.
- ^ 에멜레우스 & 샤프 1974, 페이지 111.
- ^ Wiberg, Wiberg & Hollleman 2001, 페이지 457.
- ^ 브랜틀리 1949, 26쪽
- ^ Jaccaud et al. 2000, 383쪽
- ^ 1975년 피처.
- ^ a b Khriachchev et al. 2000.
- ^ 버든, 엠슨 & 에드워즈 1987.
- ^ 2004, 페이지 4.12
- ^ a b 딘 1999, 523쪽.
- ^ 폴링, 키베니 & 로빈슨 1970.
- ^ 뷔르기 2000.
- ^ 뮐러 2009.
- ^ a b 1975년 젊은, 10쪽.
- ^ a b 바렛, 마이어 & 와서먼 1967.
- ^ National Nuclear Data Center & NuDat 2.1, 불소-19.
- ^ 비구뢰 1961년.
- ^ Meusinger, Chippendale & Fairhurst 2012, 페이지 752, 754.
- ^ SCOPE 50 - 체르노빌 이후의 방사선 생태학, Wayback Machine, Scientific Committee on Problem of Environment (SCOPE), 1993. 섹션 1.4.5.2의 표 1.9를 참조합니다.
- ^ a b National Nuclear Data Center & NuDat 2.1.
- ^ NUBASE 2016, pp. 030001-23–030001-27.
- ^ NUBASE 2016, pp. 030001–24.
- ^ 카메론 1973.
- ^ a b c 크로스웰 2003.
- ^ 클레이튼 2003, 페이지 101–104.
- ^ Renda et al. 2004.
- ^ a b Jaccaud et al. 2000, 384쪽
- ^ a b c Schmedt, Mangstl & Kraus 2012.
- ^ a b c d e Greenwood & Ernshaw 1998, 795쪽.
- ^ a b 노우드 & 포스 1907, 페이지 52.
- ^ a b c d e f g h i j k l m n 비얄바, 에어스 & 슈로더 2008.
- ^ Kelly & Miller 2005.
- ^ Lusty et al. 2008.
- ^ a b 그리블 2002.
- ^ Richter, Hahn & Fuchs 2001, 3쪽.
- ^ Greenwood & Ernshaw 1998, 790쪽.
- ^ 2007년 7월 149쪽
- ^ 스틸맨 1912.
- ^ Principe 2012, pp. 140, 145.
- ^ 아그리콜라, 후버 & 후버 1912, 각주 및 해설, pp. xxx, 38, 409, 430, 461, 608.
- ^ Greenwood & Ernshaw 1998, 페이지 109.
- ^ Agricola, Hoover & Hoover 1912, 서문, pp. 380–381.
- ^ a b c d e 1932년 몇 주.
- ^ 1923년 파팅턴
- ^ 1770년 마르그라프
- ^ a b c d e f g h Kirsch 2004, 3-10쪽.
- ^ 셸레 1771년.
- ^ 앙페르 1816.
- ^ Tressaud, Alain (6 October 2018). Fluorine: A Paradoxical Element. Academic Press. ISBN 9780128129913.
- ^ Davy 1813, p. 278.
- ^ 뱅크스 1986, 11쪽.
- ^ a b 1864년, 278~280쪽.
- ^ a b c d e 2011년 툰.
- ^ a b 아시모프 1966, 162쪽.
- ^ Greenwood & Ernshaw 1998, pp. 789–791.
- ^ 모이산 1886년.
- ^ Viel & Goldwhite 1993, 35쪽.
- ^ a b c d 오카조에 2009.
- ^ a b Hunshell & Smith 1988, 156-157쪽.
- ^ DuPont 2013a.
- ^ 마이어 1977, 페이지 111.
- ^ Kirsch 2004, pp. 60–66.
- ^ 리델 & 카우프 2009.
- ^ Wiberg, Wiberg & Hollleman 2001, 422쪽.
- ^ Schlöder & Riedel 2012.
- ^ 하비슨 2002.
- ^ Edwards 1994, 515쪽
- ^ Katakuse et al. 1999, p. 267.
- ^ a b Aigupeers et al. 2000, 420~422쪽.
- ^ 월시 2009, 페이지 99–102, 118–119.
- ^ 에멜레우스 & 샤프 1983, 89-97쪽.
- ^ Babel & Tressaud 1985, 페이지 91–96.
- ^ 아인슈타인 외 1967.
- ^ 브라운 외 2005, 페이지 144.
- ^ a b 페리 2011, p. 193
- ^ Kern et al. 1994.
- ^ Lide 2004, pp. 4.60, 4.76, 4.92, 4.96.
- ^ 2004, 페이지 4.96.
- ^ 2004, 페이지 4.92.
- ^ Greenwood & Ernshaw 1998, 964쪽.
- ^ 베커 & 뮐러 1990.
- ^ Greenwood & Ernshaw 1998, 990쪽.
- ^ Lide 2004, pp. 4.72, 4.91, 4.93.
- ^ a b Greenwood & Ernshaw 1998, 561–563쪽.
- ^ 에멜레우스 & 샤프 1983, pp. 256–277.
- ^ Mackay, Mackay & Henderson 2002, 페이지 355–356.
- ^ Greenwood & Ernshaw 1998, (각각의 장에서 금속별로 다양한 페이지).
- ^ Lide 2004, pp. 4.71, 4.78, 4.92.
- ^ 드류스 외 2006.
- ^ Greenwood & Ernshaw 1998, 819쪽.
- ^ 바틀렛 1962.
- ^ 폴링 1960, 페이지 454–464.
- ^ Atkins & Jones 2007, pp. 184–185.
- ^ 엠슬리 1981년
- ^ Greenwood & Ernshaw 1998, 812-816쪽.
- ^ Wiberg, Wiberg & Hollleman 2001, 페이지 425.
- ^ 클락 2002.
- ^ Chambers & Holiday 1975, 328-329쪽.
- ^ 항공 제품 및 화학제품 2004, 페이지 1.
- ^ Nury, Silvi & Gillespie 2002.
- ^ Chang & Golds by 2013, 페이지 706.
- ^ 엘리스 2001, 69쪽.
- ^ Aigupeers et al. 2000, 423쪽
- ^ Wiberg, Wiberg & Hollleman 2001, 페이지 897.
- ^ Raghavan 1998, pp. 164–165.
- ^ Godfrey et al. 1998, 페이지 98.
- ^ Aigupeers et al. 2000년, 432쪽.
- ^ Murthy, Mehdi Ali & Ashok 1995, pp. 180–182, 206–208.
- ^ Greenwood & Ernshaw 1998, pp. 638–640, 683–689, 767–778.
- ^ Wiberg, Wiberg & Hollleman 2001, 페이지 435–436.
- ^ Greenwood & Ernshaw 1998, 828-830쪽.
- ^ Patnaik 2007, pp. 478–479.
- ^ Moeller, Bailar & Kleinberg 1980, 236쪽.
- ^ Wiberg, Wiberg & Hollleman 2001, 페이지 392–393.
- ^ Wiberg, Wiberg & Hollleman 2001, 페이지 395–397, 400.
- ^ Lewars 2008, 68쪽.
- ^ 피처 1993, 페이지 111
- ^ Lewars 2008, 67쪽.
- ^ a b 바이하리, 채반 & 거버 2002.
- ^ Lewars 2008, 71쪽.
- ^ 후거즈 2002, 4-12쪽.
- ^ O'Hagan 2008.
- ^ Siegemund et al. 2005, p. 444.
- ^ 샌포드 2000, 455쪽.
- ^ Siegemund et al. 2005, pp. 451–452.
- ^ Barbee, McCormack & Vartanian 2000, 116쪽.
- ^ Posner et al. 2013, pp. + hydrocarbons + what + fully + fluorated + for + one + functional + group% 22&pg=PA187 187–190.
- ^ a b 포스너 2011, 페이지 27.
- ^ Salager 2002, p. 45.
- ^ a b 칼슨 & 슈미겔 2000, 페이지 3.
- ^ a b 칼슨 & 슈미겔 2000, 3-4쪽.
- ^ Rhoades 2008, p. 2.
- ^ 오카다 외 1998.
- ^ 칼슨 & 슈미겔 2000, 페이지 4.
- ^ Aigupeers et al. 2000.
- ^ Norris Shreve; Joseph Brink, Jr. (1977). Chemical Process Industries (4 ed.). McGraw-Hill. p. 321. ISBN 0070571457.
- ^ Jaccaud et al. 2000, 386쪽.
- ^ Jaccaud et al. 2000, pp. 384–285.
- ^ Greenwood & Ernshaw 1998, 페이지 796–797.
- ^ Jaccaud et al. 2000, pp. 384–385.
- ^ a b Jaccaud et al. 2000, pp. 390–391.
- ^ Shriver & Atkins 2010, 427쪽
- ^ 1986년 그리스도.
- ^ Christe Research Group n.d.
- ^ 캐리 2008, 페이지 173.
- ^ 밀러 2003b.
- ^ 2012년 홍보 웹.
- ^ 2012년 봄부르.
- ^ TMR 2013.
- ^ Fulton & Miller 2006, 페이지 471.
- ^ a b Jaccaud et al. 2000, 페이지 392.
- ^ Aigupeers et al. 2000년, 430쪽.
- ^ Jaccaud et al. 2000, pp. 391–392.
- ^ El-Kareh 1994, p. 317.
- ^ Arana et al. 2007.
- ^ 밀러 2003a.
- ^ Energyics, Inc. 1997, pp. 41, 50.
- ^ Aigupeers et al. 2000년, 428쪽.
- ^ Willie 2007, 페이지 113.
- ^ 홍보 웹 2010.
- ^ a b c 레너 2006.
- ^ Green et al. 1994, pp. 91–93.
- ^ DuPont 2013b.
- ^ a b 월터 2013.
- ^ a b Buznik 2009.
- ^ PR 웹 2013.
- ^ a b c d e 마틴 2007, 187-194쪽.
- ^ 드베르갈리스 2004.
- ^ Grot 2011, pp. 1~10.
- ^ Ramkumar 2012, p. 567.
- ^ 버니 1999, 페이지 111.
- ^ Slye 2012, 10쪽.
- ^ Kissa 2001, pp. 516–551.
- ^ Ullmann 2008, pp. 538, 543–547.
- ^ ICIS 2006.
- ^ a b 테오도리디스 2006.
- ^ EPA 1996.
- ^ DG Environment 2007.
- ^ 비즐리 2002.
- ^ a b '프라우드풋', '브래드베리 & 베일' 2006.
- ^ 아이슬러 1995.
- ^ Pizzo et al. 2007.
- ^ CDC 2001.
- ^ 리파 1993.
- ^ a b Cheng, Chalmers & Sheldon 2007.
- ^ NHMRC 2007; 요약은 영 2008을 참조하십시오.
- ^ Marya 2011, 페이지 343.
- ^ 암필드 2007.
- ^ a b Baelum, Sheiham & Burt 2008, 518쪽.
- ^ Cracher 2012, p. 12.
- ^ 엠슬리 2011, 178쪽.
- ^ 존슨 2011.
- ^ a b 스윈슨 2005.
- ^ 하그만 2008.
- ^ 미첼 2004, 37-39쪽.
- ^ Preskorn 1996, chap. 2.
- ^ Werner et al. 2011.
- ^ 브로디 2012.
- ^ Nelson et al. 2007.
- ^ 킹, 말론 & 릴리 2000.
- ^ 부모님 2001, 40쪽.
- ^ Raj & Erdine 2012, 페이지 58.
- ^ 필러 & 사하 2009.
- ^ Bégué & Bonnet-Delpon 2008, 페이지 335–336.
- ^ a b Schmitz et al. 2000.
- ^ 1977년 부스타만테 & 페데르센
- ^ Alavi & Huang 2007, 41쪽.
- ^ 가브리엘 외 1996.
- ^ Sarkar 2008.
- ^ 쉬마이어 2002.
- ^ 데이비스 2006.
- ^ 1998년 증가.
- ^ 테이버 1999.
- ^ Shaffer, Wolfson & Clark 1992, 102쪽.
- ^ Kacmarek et al. 2006.
- ^ 닐슨 2009.
- ^ Olivares & Uauy 2004.
- ^ 식품영양위원회.
- ^ Xiao-Hua, Xu; Guang-Min, Yao; Yan-Ming, Li; Jian-Hua, Lu; Chang-Jiang, Lin; Xin, Wang; Chui-Hua, Kong (4 January 2003). "5-Fluorouracil Derivatives from the Sponge Phakellia fusca". J. Nat. Prod. 2 (66): 285–288. doi:10.1021/np020034f. PMID 12608868.
- ^ 머피, 샤프라스 & 오하건 2003
- ^ O'Hagan et al. 2002.
- ^ 국립 산업 안전 보건 연구소 1994a.
- ^ 국립 산업 안전 보건 연구소 1994b.
- ^ a b 1968년 케플링거 & 수지사
- ^ 엠슬리 2011, 179쪽
- ^ 빌러 2007, 939쪽.
- ^ "Fluorine. Safety data sheet" (PDF). Airgas. Archived from the original (PDF) on 19 April 2015.
- ^ 1997년에 먹어요.
- ^ 게리 L의 "무기화학". Miessler와 Donald A. 타르, 제4판 피어슨
- ^ 슈라이버, 웰러, 오버턴, 루크와 암스트롱의 "무기화학", 제6판, 프리먼
- ^ 블로젯, 수루다 & 크라우치 2001.
- ^ Hoffman et al. 2007, p. 1333.
- ^ a b HSM 2006.
- ^ Fishman 2001, pp. 458–459.
- ^ El Saadi et al. 1989.
- ^ Roblin et al. 2006.
- ^ Hulten et al. 2004.
- ^ Zorich 1991, pp. 182–183.
- ^ Liteplo et al. 2002, p. 100.
- ^ a b c d Shin & Silverberg 2013.
- ^ 레디 2009.
- ^ 바에즈, 바에즈 & 마탈러 2000.
- ^ a b Augenstein et al. 1991.
- ^ 게스너 외 1994.
- ^ CDC 2013.
- ^ 슐먼 & 웰스 1997.
- ^ Beck et al. 2011.
- ^ Aucamp & Björn 2010, pp. 4–6, 41, 46–47.
- ^ 미첼 크로우 2011.
- ^ 배리 & 필립스 2006.
- ^ EPA 2013a.
- ^ a b EPA 2013b.
- ^ 맥코이 2007.
- ^ Forster et al. 2007, pp. 212-213.
- ^ Schwarcz 2004, p. 37.
- ^ Giesy & Kannan 2002.
- ^ a b c d Steenland, Fletcher & Savitz 2010.
- ^ a b c d 베츠 2007.
- ^ EPA 2012.
- ^ Zareitalabad et al. 2013.
- ^ a b Lau et al. 2007.
색인화된 참조
- Agricola, Georgius; Hoover, Herbert Clark; Hoover, Lou Henry (1912). De Re Metallica. London: The Mining Magazine.
- Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, R. E.; Cue, J. P. (2000). "Fluorine Compounds, Inorganic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 397–441. doi:10.1002/14356007. ISBN 978-3527306732.
- Air Products and Chemicals (2004). "Safetygram #39 Chlorine Trifluoride" (PDF). Air Products and Chemicals. Archived from the original (PDF) on 18 March 2006. Retrieved 16 February 2014.
- Alavi, Abbas; Huang, Steve S. (2007). "Positron Emission Tomography in Medicine: An Overview". In Hayat, M. A. (ed.). Cancer Imaging, Volume 1: Lung and Breast Carcinomas. Burlington: Academic Press. pp. 39–44. ISBN 978-0-12-370468-9.
- Ampère, André-Marie (1816). "Suite d'une classification naturelle pour les corps simples". Annales de chimie et de physique (in French). 2: 1–5.
- Arana, L. R.; Mas, N.; Schmidt, R.; Franz, A. J.; Schmidt, M. A.; Jensen, K. F. (2007). "Isotropic Etching of Silicon in Fluorine Gas for MEMS Micromachining". Journal of Micromechanics and Microengineering. 17 (2): 384–392. Bibcode:2007JMiMi..17..384A. doi:10.1088/0960-1317/17/2/026. S2CID 135708022.
- Armfield, J. M. (2007). "When Public Action Undermines Public Health: A Critical Examination of Antifluoridationist Literature". Australia and New Zealand Health Policy. 4: 25. doi:10.1186/1743-8462-4-25. PMC 2222595. PMID 18067684.
- Asimov, Isaac (1966). The Noble Gases. New York: Basic Books. ISBN 978-0-465-05129-8.
- Atkins, Peter; Jones, Loretta (2007). Chemical Principles: The Quest for Insight (4th ed.). New York: W. H. Freeman. ISBN 978-1-4292-0965-6.
- Aucamp, Pieter J.; Björn, Lars Olof (2010). "Questions and Answers about the Environmental Effects of the Ozone Layer Depletion and Climate Change: 2010 Update" (PDF). United Nations Environmental Programme. Archived from the original (PDF) on 3 September 2013. Retrieved 14 October 2013.
- Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). "The NUBASE2016 evaluation of nuclear properties" (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001..
- Augenstein, W. L.; et al. (1991). "Fluoride Ingestion in Children: A Review of 87 cases". Pediatrics. 88 (5): 907–912. doi:10.1542/peds.88.5.907. PMID 1945630. S2CID 22106466.
- Babel, Dietrich; Tressaud, Alain (1985). "Crystal Chemistry of Fluorides". In Hagenmuller, Paul (ed.). Inorganic Solid Fluorides: Chemistry And Physics. Orlando: Academic Press. pp. 78–203. ISBN 978-0-12-412490-5.
- Baelum, Vibeke; Sheiham, Aubrey; Burt, Brian (2008). "Caries Control for Populations". In Fejerskov, Ole; Kidd, Edwina (eds.). Dental Caries: The Disease and Its Clinical Management (2nd ed.). Oxford: Blackwell Munksgaard. pp. 505–526. ISBN 978-1-4051-3889-5.
- Baez, Ramon J.; Baez, Martha X.; Marthaler, Thomas M. (2000). "Urinary Fluoride Excretion by Children 4–6 Years Old in a South Texas Community". Revista Panamericana de Salud Pública. 7 (4): 242–248. doi:10.1590/S1020-49892000000400005. PMID 10846927.
- Banks, R. E. (1986). "Isolation of fluorine by Moissan: Setting the scene". Journal of Fluorine Chemistry. 33 (1–4): 3–26. doi:10.1016/S0022-1139(00)85269-0.
- Barbee, K.; McCormack, K.; Vartanian, V. (2000). "EHS Concerns with Ozonated Water Spray Processing". In Mendicino, L. (ed.). Environmental Issues in the Electronics and Semiconductor Industries. Pennington, NJ: The Electrochemical Society. pp. 108–121. ISBN 978-1-56677-230-3.
- Barrett, C. S.; Meyer, L.; Wasserman, J. (1967). "Argon—Fluorine Phase Diagram". The Journal of Chemical Physics. 47 (2): 740–743. Bibcode:1967JChPh..47..740B. doi:10.1063/1.1711946.
- Barry, Patrick L.; Phillips, Tony (26 May 2006). "Good News and a Puzzle". National Aeronautics and Space Administration. Retrieved 6 January 2012.
- Bartlett, N. (1962). "Xenon Hexafluoroplatinate (V) Xe+[PtF6]−". Proceedings of the Chemical Society (6): 218. doi:10.1039/PS9620000197.
- Beasley, Michael (August 2002). Guidelines for the safe use of sodium fluoroacetate (1080) (PDF). Wellington: Occupational Safety & Health Service, Department of Labour (New Zealand). ISBN 0-477-03664-3. Archived from the original (PDF) on 11 November 2013. Retrieved 11 November 2013.
- Beck, Jefferson; Newman, Paul; Schindler, Trent L.; Perkins, Lori (2011). "What Would have Happened to the Ozone Layer if Chlorofluorocarbons (CFCs) had not been Regulated?". National Aeronautics and Space Administration. Archived from the original on 4 August 2020. Retrieved 15 October 2013.
- Becker, S.; Müller, B. G. (1990). "Vanadium Tetrafluoride". Angewandte Chemie International Edition in English. 29 (4): 406–407. doi:10.1002/anie.199004061.
- Bégué, Jean-Pierre; Bonnet-Delpon, Danièle (2008). Bioorganic and Medicinal Chemistry of Fluorine. Hoboken: John Wiley & Sons. ISBN 978-0-470-27830-7.
- Betts, K. S. (2007). "Perfluoroalkyl Acids: What is the Evidence Telling Us?". Environmental Health Perspectives. 115 (5): A250–A256. doi:10.1289/ehp.115-a250. PMC 1867999. PMID 17520044.
- Bihary, Z.; Chaban, G. M.; Gerber, R. B. (2002). "Stability of a Chemically Bound Helium Compound in High-pressure Solid Helium". The Journal of Chemical Physics. 117 (11): 5105–5108. Bibcode:2002JChPh.117.5105B. doi:10.1063/1.1506150.
- Biller, José (2007). Interface of Neurology and Internal Medicine (illustrated ed.). Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-7817-7906-7.
- Blodgett, D. W.; Suruda, A. J.; Crouch, B. I. (2001). "Fatal Unintentional Occupational Poisonings by Hydrofluoric Acid in the U.S" (PDF). American Journal of Industrial Medicine. 40 (2): 215–220. doi:10.1002/ajim.1090. PMID 11494350. Archived from the original (PDF) on 17 July 2012.
- Bombourg, Nicolas (4 July 2012). "World Fluorochemicals Market, Freedonia". Reporterlinker. Retrieved 20 October 2013.
- Brantley, L. R. (1949). Squires, Roy; Clarke, Arthur C. (eds.). "Fluorine". Pacific Rockets: Journal of the Pacific Rocket Society. South Pasadena: Sawyer Publishing/Pacific Rocket Society Historical Library. 3 (1): 11–18. ISBN 978-0-9794418-5-1.
- Brody, Jane E. (10 September 2012). "Popular Antibiotics May Carry Serious Side Effects". The New York Times Well Blog. Retrieved 18 October 2013.
- Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam (2005). Chemical Thermodynamics of Zirconium. Amsterdam: Elsevier B. V. ISBN 978-0-444-51803-3.
- Burdon, J.; Emson, B.; Edwards, A. J. (1987). "Is Fluorine Gas Really Yellow?". Journal of Fluorine Chemistry. 34 (3–4): 471–474. doi:10.1016/S0022-1139(00)85188-X.
- Bürgi, H. B. (2000). "Motion and Disorder in Crystal Structure Analysis: Measuring and Distinguishing them". Annual Review of Physical Chemistry. 51: 275–296. Bibcode:2000ARPC...51..275B. doi:10.1146/annurev.physchem.51.1.275. PMID 11031283.
- Burney, H. (1999). "Past, Present and Future of the Chlor-Alkali Industry". In Burney, H. S.; Furuya, N.; Hine, F.; Ota, K.-I. (eds.). Chlor-Alkali and Chlorate Technology: R. B. MacMullin Memorial Symposium. Pennington: The Electrochemical Society. pp. 105–126. ISBN 1-56677-244-3.
- Bustamante, E.; Pedersen, P. L. (1977). "High Aerobic Glycolysis of Rat Hepatoma Cells in Culture: Role of Mitochondrial Hexokinase". Proceedings of the National Academy of Sciences. 74 (9): 3735–3739. Bibcode:1977PNAS...74.3735B. doi:10.1073/pnas.74.9.3735. PMC 431708. PMID 198801.
- Buznik, V. M. (2009). "Fluoropolymer Chemistry in Russia: Current Situation and Prospects". Russian Journal of General Chemistry. 79 (3): 520–526. doi:10.1134/S1070363209030335. S2CID 97518401.
- Cameron, A. G. W. (1973). "Abundance of the Elements in the Solar System" (PDF). Space Science Reviews. 15 (1): 121–146. Bibcode:1973SSRv...15..121C. doi:10.1007/BF00172440. S2CID 120201972. Archived from the original (PDF) on 21 October 2011.
- Carey, Charles W. (2008). African Americans in Science. Santa Barbara: ABC-CLIO. ISBN 978-1-85109-998-6.
- Carlson, D. P.; Schmiegel, W. (2000). "Fluoropolymers, Organic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 495–533. doi:10.1002/14356007.a11_393. ISBN 978-3527306732.
- Centers for Disease Control and Prevention (2001). "Recommendations for Using Fluoride to Prevent and Control Dental Caries in the United States". MMWR Recommendations and Reports. 50 (RR–14): 1–42. PMID 11521913. Retrieved 14 October 2013.
- Centers for Disease for Control and Prevention (10 July 2013). "Community Water Fluoridation". Retrieved 25 October 2013.
- Chambers, C.; Holliday, A. K. (1975). Modern Inorganic Chemistry: An Intermediate Text (PDF). London: Butterworth & Co. ISBN 978-0-408-70663-6. Archived from the original (PDF) on 23 March 2013.
- Chang, Raymond; Goldsby, Kenneth A. (2013). Chemistry (11th ed.). New York: McGraw-Hill. ISBN 978-0-07-131787-0.
- Cheng, H.; Fowler, D. E.; Henderson, P. B.; Hobbs, J. P.; Pascolini, M. R. (1999). "On the Magnetic Susceptibility of Fluorine". The Journal of Physical Chemistry A. 103 (15): 2861–2866. Bibcode:1999JPCA..103.2861C. doi:10.1021/jp9844720.
- Cheng, K. K.; Chalmers, I.; Sheldon, T. A. (2007). "Adding Fluoride to Water Supplies" (PDF). BMJ. 335 (7622): 699–702. doi:10.1136/bmj.39318.562951.BE. PMC 2001050. PMID 17916854. Archived from the original (PDF) on 3 March 2016. Retrieved 26 March 2012.
- Chisté, V.; Bé, M. M. (2011). "F-18" (PDF). In Bé, M. M.; Coursol, N.; Duchemin, B.; Lagoutine, F.; et al. (eds.). Table de radionucléides (Report). CEA (Commissariat à l'énergie atomique et aux énergies alternatives), LIST, LNE-LNHB (Laboratoire National Henri Becquerel/Commissariat à l'Energie Atomique). Archived from the original (PDF) on 11 August 2020. Retrieved 15 June 2011.
- Christe, Karl O. (1986). "Chemical Synthesis of Elemental Fluorine". Inorganic Chemistry. 25 (21): 3721–3722. doi:10.1021/ic00241a001.
- Christe Research Group (n.d.). "Chemical Synthesis of Elemental Fluorine". Archived from the original on 4 March 2016. Retrieved 12 January 2013.
- Clark, Jim (2002). "The Acidity of the Hydrogen Halides". chemguide.co.uk. Retrieved 15 October 2013.
- Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. New York: Cambridge University Press. ISBN 978-0-521-82381-4.
- Compressed Gas Association (1999). Handbook of Compressed Gases (4th ed.). Boston: Kluwer Academic Publishers. ISBN 978-0-412-78230-5.
- Cordero, B.; Gómez, V.; Platero-Prats, A. E.; Revés, M.; Echeverría, J.; Cremades, E.; Barragán, F.; Alvarez, S. (2008). "Covalent Radii Revisited". Dalton Transactions (21): 2832–2838. doi:10.1039/b801115j. PMID 18478144.
- Cracher, Connie M. (2012). "Current Concepts in Preventive Dentistry" (PDF). dentalcare.com. Archived from the original (PDF) on 14 October 2013. Retrieved 14 October 2013.
- Croswell, Ken (September 2003). "Fluorine: An element–ary Mystery". Sky and Telescope. Retrieved 17 October 2013.
- Mitchell Crow, James (2011). "First signs of ozone-hole recovery spotted". Nature. doi:10.1038/news.2011.293.
- Davis, Nicole (November 2006). "Better than blood". Popular Science. Archived from the original on 4 June 2011. Retrieved 20 October 2013.
- Davy, Humphry (1813). "Some experiments and observations on the substances produced in different chemical processes on fluor spar". Philosophical Transactions of the Royal Society. 103: 263–279. doi:10.1098/rstl.1813.0034. S2CID 186214745.
- Dean, John A. (1999). Lange's Handbook of Chemistry (15th ed.). New York: McGraw-Hill. ISBN 0-07-016190-9.
- DeBergalis, Michael (2004). "Fluoropolymer films in the photovoltaic industry". Journal of Fluorine Chemistry. 125 (8): 1255–1257. doi:10.1016/j.jfluchem.2004.05.013.
- Directorate-General for the Environment (European Commission) (2007). Trifluralin (PDF) (Report). European Commission. Retrieved 14 October 2013.
- Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. (2006). "Solid State Molecular Structures of Transition Metal Hexafluorides". Inorganic Chemistry. 45 (9): 3782–3788. doi:10.1021/ic052029f. PMID 16634614.
- DuPont (2013a). "Freon". Archived from the original on 21 February 2015. Retrieved 17 October 2013.
- DuPont (2013b). "Understanding the Refrigerant 'R' Nomenclature". Retrieved 17 October 2013.
- Eaton, Charles (1997). "Figure hfl". E-Hand.com: The Electronic Textbook of Hand Surgery. The Hand Center (former practice of Dr. Eaton). Retrieved 28 September 2013.
- Edwards, Philip Neil (1994). "Use of Fluorine in Chemotherapy". In Banks, R. E.; Smart, B. E.; Tatlow, J. C. (eds.). Organofluorine Chemistry: Principles and Commercial Applications. New York: Plenum Press. pp. 501–542. ISBN 978-0-306-44610-8.
- Einstein, F. W. B.; Rao, P. R.; Trotter, J.; Bartlett, N. (1967). "The Crystal Structure of Gold Trifluoride". Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 4: 478–482. doi:10.1039/J19670000478.
- Eisler, Ronald (1995). Sodium Monofluoroacetate (1080) Hazards to Fish, Wildlife and Invertebrates: A Synoptic Review (PDF) (Report). Patuxent Environmental Science Center (U.S. National Biological Service). Retrieved 5 June 2011.
- Ellis, Brian (2001). Scientific Essentialism. Cambridge: Cambridge University Press. ISBN 978-0-521-80094-5.
- El-Kareh, Badih (1994). Fundamentals of Semiconductor Processing Technology. Norwell and Dordrecht: Kluwer Academic Publishers. ISBN 978-0-7923-9534-8.
- El Saadi, M. S.; Hall, A. H.; Hall, P. K.; Riggs, B. S.; Augenstein, W. L.; Rumack, B. H. (1989). "Hydrofluoric Acid Dermal Exposure". Veterinary and Human Toxicology. 31 (3): 243–247. PMID 2741315.
- Emeléus, H. J.; Sharpe, A. G. (1974). Advances in Inorganic Chemistry and Radiochemistry. Vol. 16. New York: Academic Press. ISBN 978-0-08-057865-1.
- Emeléus, H. J.; Sharpe, A. G. (1983). Advances in Inorganic Chemistry and Radiochemistry. Vol. 27. Academic Press. ISBN 0-12-023627-3.
- Emsley, John (1981). "The Hidden Strength of Hydrogen". New Scientist. 91 (1264): 291–292.
- Emsley, John (2011). Nature's Building Blocks: An A–Z Guide to the Elements (2nd ed.). Oxford: Oxford University Press. ISBN 978-0-19-960563-7.
- Energetics, Inc. (1997). Energy and Environmental Profile of the U.S. Aluminum Industry (PDF) (Report). Retrieved 15 October 2013.
- Filler, R.; Saha, R. (2009). "Fluorine in Medicinal Chemistry: A Century of Progress and a 60-year Retrospective of Selected Highlights" (PDF). Future Medicinal Chemistry. 1 (5): 777–791. doi:10.4155/fmc.09.65. PMID 21426080. Archived from the original (PDF) on 22 October 2013.
- Fischman, Michael L. (2001). "Semiconductor Manufacturing Hazards". In Sullivan, John B.; Krieger, Gary R. (eds.). Clinical Environmental Health and Toxic Exposures (2nd ed.). Philadelphia: Lippincott Williams & Wilkins. pp. 431–465. ISBN 978-0-683-08027-8.
- Food and Nutrition Board. "Dietary Reference Intakes (DRIs): Recommended Dietary Allowances and Adequate Intakes, Elements" (PDF). Institute of Medicine, National Academies. Archived from the original (PDF) on 13 November 2018. Retrieved 2 January 2019.
- Forster, P.; Ramaswamy, V.; Artaxo, P.; Berntsen, T.; Betts, R.; Fahey, D. W.; Haywood, J.; Lean, J.; Lowe, D. C.; Myhr e, G.; Nganga, J.; Prinn, R.; Raga, G.; Schulz, M.; Van Dorland, R. (2007). "Changes in Atmospheric Constituents and in Radiative Forcing". In Solomon, S.; Manning, M.; Chen, Z.; Marquis, M.; Averyt, K. B.; Tignor, M.; Miller, H. L. (eds.). Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University. pp. 129–234. ISBN 978-0-521-70596-7.
- Fulton, Robert B.; Miller, M. Michael (2006). "Fluorspar". In Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M.; Krukowski, Stanley T. (eds.). Industrial Minerals & Rocks: Commodities, Markets, and Uses. Littleton: Society for Mining, Metallurgy, and Exploration (U.S.). pp. 461–473. ISBN 978-0-87335-233-8.
- Gabriel, J. L.; Miller, T. F. Jr.; Wolfson, M. R.; Shaffer, T. H. (1996). "Quantitative Structure-Activity Relationships of Perfluorinated Hetero-Hydrocarbons as Potential Respiratory Media". ASAIO Journal. 42 (6): 968–973. doi:10.1097/00002480-199642060-00009. PMID 8959271. S2CID 31161098.
- Gains, Paul (18 October 1998). "A New Threat in Blood Doping". The New York Times. Retrieved 18 October 2013.
- Gessner, B. D.; Beller, M.; Middaugh, J. P.; Whitford, G. M. (1994). "Acute Fluoride Poisoning from a Public Water System". New England Journal of Medicine. 330 (2): 95–99. doi:10.1056/NEJM199401133300203. PMID 8259189.
- Giesy, J. P.; Kannan, K. (2002). "Perfluorochemical Surfactants in the Environment". Environmental Science & Technology. 36 (7): 146A–152A. Bibcode:2002EnST...36..146G. doi:10.1021/es022253t. PMID 11999053.
- Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. (1998). "Inorganic Derivatives of the Elements". In Norman, Nicholas C. (ed.). Chemistry of Arsenic, Antimony and Bismuth. London: Blackie Academic & Professional. pp. 67–158. ISBN 978-0-7514-0389-3.
- Green, S. W.; Slinn, D. S. L.; Simpson, R. N. F.; Woytek, A. J. (1994). "Perfluorocarbon Fluids". In Banks, R. E.; Smart, B. E.; Tatlow, J. C. (eds.). Organofluorine Chemistry: Principles and Applications. New York: Plenum Press. pp. 89–119. ISBN 978-0-306-44610-8.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Oxford: Butterworth Heinemann. ISBN 0-7506-3365-4.
- Gribble, G. W. (2002). "Naturally Occurring Organofluorines". In Neison, A. H. (ed.). Organofluorines. The Handbook of Environmental Chemistry. Vol. 3N. Berlin: Springer. pp. 121–136. doi:10.1007/10721878_5. ISBN 3-540-42064-9.
- Grot, Walter (2011). Fluorinated Ionomers (2nd ed.). Oxford and Waltham: Elsevier. ISBN 978-1-4377-4457-6.
- Hagmann, W. K. (2008). "The Many Roles for Fluorine in Medicinal Chemistry". Journal of Medicinal Chemistry. 51 (15): 4359–4369. doi:10.1021/jm800219f. PMID 18570365.
- Harbison, G. S. (2002). "The Electric Dipole Polarity of the Ground and Low-lying Metastable Excited States of NF". Journal of the American Chemical Society. 124 (3): 366–367. doi:10.1021/ja0159261. PMID 11792193.
- Hasegawa, Y.; Otani, R.; Yonezawa, S.; Takashima, M. (2007). "Reaction Between Carbon Dioxide and Elementary Fluorine". Journal of Fluorine Chemistry. 128 (1): 17–28. doi:10.1016/j.jfluchem.2006.09.002. hdl:10098/1665. S2CID 95754841.
- Haxel, G. B.; Hedrick, J. B.; Orris, G. J. (2005). Stauffer, P. H.; Hendley II, J. W. (eds.). Rare Earth Elements—Critical Resources for High Technology, Fact Sheet 087-02 (Report). U.S. Geological Survey. Retrieved 31 January 2014.
- Haynes, William M., ed. (2011). Handbook of Chemistry and Physics (92nd ed.). Boca Raton: CRC Press. ISBN 978-1-4398-5511-9.
- Hoffman, Robert; Nelson, Lewis; Howland, Mary; Lewin, Neal; Flomenbaum, Neal; Goldfrank, Lewis (2007). Goldfrank's Manual of Toxicologic Emergencies. New York: McGraw-Hill Professional. ISBN 978-0-07-144310-4.
- Honeywell (2006). Recommended medical treatment for hydrofluoric acid exposure (PDF). Morristown: Honeywell International. Archived from the original (PDF) on 8 October 2013. Retrieved 9 January 2014.
- Hoogers, G. (2002). "Fuel Cell Components and Their Impact on Performance". In Hoogers, G. (ed.). Fuel Cell Technology Handbook. Boca Raton: CRC Press. pp. 4-1–4-27. ISBN 0-8493-0877-1.
- Hounshell, David A.; Smith, John Kelly (1988). Science and Corporate Strategy: DuPont R & D, 1902–1980. Cambridge: Cambridge University Press. ISBN 0-521-32767-9.
- Hultén, P.; Höjer, J.; Ludwigs, U.; Janson, A. (2004). "Hexafluorine vs. Standard Decontamination to Reduce Systemic Toxicity After Dermal Exposure to Hydrofluoric Acid". Clinical Toxicology. 42 (4): 355–361. doi:10.1081/CLT-120039541. PMID 15461243. S2CID 27090208.
- ICIS (2 October 2006). "Fluorine's Treasure Trove". Reed Business Information. Retrieved 24 October 2013.
- Jaccaud, M.; Faron, R.; Devilliers, D.; Romano, R. (2000). "Fluorine". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 381–395. doi:10.1002/14356007.a11_293. ISBN 978-3527306732.
- Johnson, Linda A. (28 December 2011). "Against Odds, Lipitor Became World's Top Seller". The Boston Globe. Retrieved 24 October 2013.
- Kacmarek, Robert M.; Wiedemann, Herbert P.; Lavin, Philip T.; Wedel, Mark K.; Tütüncü, Ahmet S.; Slutsky, Arthur S. (2006). "Partial Liquid Ventilation in Adult Patients with Acute Respiratory Distress Syndrome". American Journal of Respiratory and Critical Care Medicine. 173 (8): 882–9. doi:10.1164/rccm.200508-1196OC. PMID 16254269.
- Katakuse, Itsuo; Ichihara, Toshio; Ito, Hiroyuki; Sakurai, Tohru; Matsuo, Takekiyo (1999). "SIMS Experiment". In Arai, T.; Mihama, K.; Yamamoto, K.; Sugano, S. (eds.). Mesoscopic Materials and Clusters: Their Physical and Chemical Properties. Tokyo: Kodansha. pp. 259–273. ISBN 4-06-208635-2.
- Kelly, T. D.; Miller, M. M. (2005). "Historical Fluorspar Statistics". U.S. Geological Service. Retrieved 10 February 2014.
- Keplinger, M. L.; Suissa, L. W. (1968). "Toxicity of Fluorine Short-Term Inhalation". American Industrial Hygiene Association Journal. 29 (1): 10–18. doi:10.1080/00028896809342975. PMID 5667185.
- Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M.; Hoisington, D.; Lander, G. A. (1994). "Temperature Variation of the Structural Parameters in Actinide Tetrafluorides". The Journal of Chemical Physics. 101 (11): 9333–9337. Bibcode:1994JChPh.101.9333K. doi:10.1063/1.467963.<
- Khriachtchev, L.; Pettersson, M.; Runeberg, N.; Lundell, J.; Räsänen, M. (2000). "A Stable Argon Compound". Nature. 406 (6798): 874–876. Bibcode:2000Natur.406..874K. doi:10.1038/35022551. PMID 10972285. S2CID 4382128.
- King, D. E.; Malone, R.; Lilley, S. H. (2000). "New Classification and Update on the Quinolone Antibiotics". American Family Physician. 61 (9): 2741–2748. PMID 10821154. Retrieved 8 October 2013.
- Kirsch, Peer (2004). Modern Fluoroorganic Chemistry: Synthesis, Reactivity, Applications. Weinheim: Wiley-VCH. ISBN 978-3-527-30691-6.
- Kissa, Erik (2001). Fluorinated Surfactants and Repellents (2nd ed.). New York: Marcel Dekker. ISBN 978-0-8247-0472-8.
- Kuriakose, A. K.; Margrave, J. L. (1965). "Kinetics of the Reactions of Elemental Fluorine. IV. Fluorination of Graphite". Journal of Physical Chemistry. 69 (8): 2772–2775. doi:10.1021/j100892a049.
- Lagow, R. J. (1970). The Reactions of Elemental Fluorine; A New Approach to Fluorine Chemistry (PDF) (PhD, Rice University, TX). Ann Arbor: UMI.
- Lau, C.; Anitole, K.; Hodes, C.; Lai, D.; Pfahles-Hutchens, A.; Seed, J. (2007). "Perfluoroalkyl Acids: A Review of Monitoring and Toxicological Findings". Toxicological Sciences. 99 (2): 366–394. doi:10.1093/toxsci/kfm128. PMID 17519394.
- Lee, Stephen; et al. (2014). "Monofluoroacetate-Containing Plants That Are Potentially Toxic to Livestock". Journal of Agricultural and Food Chemistry. ACS Publications. 62 (30): 7345–7354. doi:10.1021/jf500563h. PMID 24724702.
- Lewars, Errol G. (2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Dordrecht: Springer. ISBN 978-1-4020-6972-7.
- Lide, David R. (2004). Handbook of Chemistry and Physics (84th ed.). Boca Raton: CRC Press. ISBN 0-8493-0566-7.
- Lidin, R.; Molochko, V. A.; Andreeva, L. L. (2000). Химические свойства неорганических веществ [Chemical Properties of Inorganic Substances] (in Russian). Moscow: Khimiya. ISBN 5-7245-1163-0.
- Liteplo, R.; Gomes, R.; Howe, P.; Malcolm, H. (2002). Environmental Health Criteria 227 (Fluoride). Geneva: United Nations Environment Programme; International Labour Organization; World Health Organization. ISBN 92-4-157227-2. Retrieved 14 October 2013.
- Lusty, P. A. J.; Brown, T. J.; Ward, J.; Bloomfield, S. (2008). "The Need for Indigenous Fluorspar Production in England". British Geological Survey. Retrieved 13 October 2013.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (6th ed.). Cheltenham: Nelson Thornes. ISBN 0-7487-6420-8.
- Macomber, Roger (1996). Organic chemistry. Vol. 1. Sausalito: University Science Books. ISBN 978-0-935702-90-3.
- Marggraf, Andreas Sigismun (1770). "Observation concernant une volatilisation remarquable d'une partie de l'espece de pierre, à laquelle on donne les noms de flosse, flüsse, flus-spaht, et aussi celui d'hesperos; laquelle volatilisation a été effectuée au moyen des acides" [Observation of a remarkable volatilization of part of a type of stone to which one gives the name flosse, flüsse, flus-spaht, as well as that of hesperos; which volatilization was effected by means of acids]. Mémoires de l'Académie royale des sciences et belles-lettres (in French). XXIV: 3–11.
- Martin, John W., ed. (2007). Concise Encyclopedia of the Structure of Materials. Oxford and Amsterdam: Elsevier. ISBN 978-0-08-045127-5.
- Marya, C. M. (2011). A Textbook of Public Health Dentistry. New Delhi: Jaypee Brothers Medical Publishers. ISBN 978-93-5025-216-1.
- Matsui, M. (2006). "Fluorine-containing Dyes". In Kim, Sung-Hoon (ed.). Functional dyes. Orlando: Academic Press. pp. 257–266. ISBN 978-0-12-412490-5.
- Meusinger, Reinhard; Chippendale, A. Margaret; Fairhurst, Shirley A. (2012). "Nuclear Magnetic Resonance and Electron Spin Resonance Spectroscopy". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 609–660. doi:10.1002/14356007.b05_471. ISBN 978-3527306732.
- Meyer, Eugene (1977). Chemistry of Hazardous Materials. Englewood Cliffs: Prentice Hall. ISBN 978-0-13-129239-0.
- Miller, M. Michael (2003a). "Fluorspar" (PDF). U.S. Geological Survey Minerals Yearbook. U.S. Geological Survey. pp. 27.1–27.12.
- Miller, M. Michael (2003b). "Mineral Resource of the Month, Fluorspar" (PDF). U.S. Geological Survey. Retrieved 24 October 2013.
- Mitchell, E. Siobhan (2004). Antidepressants. New York: Chelsea House Publishers. ISBN 978-1-4381-0192-7.
- Moeller, T.; Bailar, J. C.; Kleinberg (1980). Chemistry, with Inorganic Qualitative Analysis (3rd ed.). New York: Academic Press. ISBN 0-12-503350-8.
- Moissan, Henri (1886). "Action d'un courant électrique sur l'acide fluorhydrique anhydre". Comptes rendus hebdomadaires des séances de l'Académie des sciences (in French). 102: 1543–1544. Retrieved 9 October 2013.
- McCoy, M. (2007). "SURVEY Market Challenges Dim the Confidence of the World's Chemical CEOs". Chemical & Engineering News. 85 (23): 11. doi:10.1021/cen-v085n023.p011a.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2010). Principles of Chemistry: The Molecular Science. Belmont: Brooks/Cole. ISBN 978-0-495-39079-4.
- Morrow, S. I.; Perry, D. D.; Cohen, M. S. (1959). "The Formation of Dinitrogen Tetrafluoride in the Reaction of Fluorine and Ammonia". Journal of the American Chemical Society. 81 (23): 6338–6339. doi:10.1021/ja01532a066.
- Müller, Peter (2009). "5.067 Crystal Structure Refinement" (PDF). Cambridge: MIT OpenCourseWare. Retrieved 13 October 2013.
- Murphy, C. D.; Schaffrath, C.; O'Hagan, D. (2003). "Fluorinated Natural Products: The Biosynthesis of Fluoroacetate and 4-Fluorothreonine in Streptomyces cattleya". Chemosphere. 52 (2): 455–461. Bibcode:2003Chmsp..52..455M. doi:10.1016/S0045-6535(03)00191-7. PMID 12738270.
- Murthy, C. Parameshwara; Mehdi Ali, S. F.; Ashok, D. (1995). University Chemistry. Vol. I. New Delhi: New Age International. ISBN 978-81-224-0742-6.
- National Health and Medical Research Council (2007). A Systematic Review of the Efficacy and Safety of Fluoridation, Part A: Review of Methodology and Results (PDF). Canberra: Australian Government. ISBN 978-1-86496-421-9. Archived from the original (PDF) on 13 January 2012. Retrieved 8 October 2013.
- The National Institute for Occupational Safety and Health (1994). "Fluorine". Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Retrieved 15 January 2014.
- The National Institute for Occupational Safety and Health (1994). "Chlorine". Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Retrieved 13 July 2014.
- National Nuclear Data Center. "NuDat 2.1 Database". Brookhaven National Laboratory. Retrieved 25 October 2013.
- National Oceanic and Atmospheric Administration. "UN/NA 1045 (United Nations/North America Fluorine Data Sheet)". Retrieved 15 October 2013.
- Navarrini, Walter; Venturini, Francesco; Tortelli, Vito; Basak, Soubir; Pimparkar, Ketan P.; Adamo, Andrea; Jensen, Klavs F. (2012). "Direct fluorination of carbon monoxide in microreactors". Journal of Fluorine Chemistry. 142: 19–23. doi:10.1016/j.jfluchem.2012.06.006.
- Nelson, Eugene W. (1947). "'Bad Man' of The Elements". Popular Mechanics. 88 (2): 106–108, 260.
- Nelson, J. M.; Chiller, T. M.; Powers, J. H.; Angulo, F. J. (2007). "Food Safety: Fluoroquinolone-ResistantCampylobacterSpecies and the Withdrawal of Fluoroquinolones from Use in Poultry: A Public Health Success Story" (PDF). Clinical Infectious Diseases. 44 (7): 977–980. doi:10.1086/512369. PMID 17342653.
- Nielsen, Forrest H. (2009). "Micronutrients in Parenteral Nutrition: Boron, Silicon, and Fluoride". Gastroenterology. 137 (5): S55–60. doi:10.1053/j.gastro.2009.07.072. PMID 19874950.
- Norwood, Charles J.; Fohs, F. Julius (1907). Kentucky Geological Survey, Bulletin No. 9: Fluorspar Deposits of Kentucky. Kentucky Geological Survey.
- Noury, S.; Silvi, B.; Gillespie, R. J. (2002). "Chemical Bonding in Hypervalent Molecules: Is the Octet Rule Relevant?" (PDF). Inorganic Chemistry. 41 (8): 2164–2172. doi:10.1021/ic011003v. PMID 11952370. Retrieved 23 May 2012.
- O'Hagan, D. (2008). "Understanding Organofluorine Chemistry. An Introduction to the C–F Bond". Chemical Society Reviews. 37 (2): 308–319. doi:10.1039/b711844a. PMID 18197347.
- O'Hagan, D.; Schaffrath, C.; Cobb, S. L.; Hamilton, J. T. G.; Murphy, C. D. (2002). "Biochemistry: Biosynthesis of an Organofluorine Molecule". Nature. 416 (6878): 279. Bibcode:2002Natur.416..279O. doi:10.1038/416279a. PMID 11907567. S2CID 4415511.
- Okada, T.; Xie, G.; Gorseth, O.; Kjelstrup, S.; Nakamura, N.; Arimura, T. (1998). "Ion and Water Transport Characteristics of Nafion Membranes as Electrolytes". Electrochimica Acta. 43 (24): 3741–3747. doi:10.1016/S0013-4686(98)00132-7.
- Okazoe, T. (2009). "Overview on the History of Organofluorine Chemistry from the Viewpoint of Material Industry". Proceedings of the Japan Academy, Series B. 85 (8): 276–289. Bibcode:2009PJAB...85..276O. doi:10.2183/pjab.85.276. PMC 3621566. PMID 19838009.
- Olivares, M.; Uauy, R. (2004). Essential Nutrients in Drinking Water (Draft) (PDF) (Report). World Health Organization (WHO). Archived from the original (PDF) on 19 October 2012. Retrieved 14 October 2013.
- Parente, Luca (2001). "The Development of Synthetic Glucocorticoids". In Goulding, Nicolas J.; Flower, Rod J. (eds.). Glucocorticoids. Basel: Birkhäuser. pp. 35–53. ISBN 978-3-7643-6059-7.
- Partington, J. R. (1923). "The early history of hydrofluoric acid". Memoirs and Proceedings of the Manchester Literary and Philosophical Society. 67 (6): 73–87.
- Patnaik, Pradyot (2007). A Comprehensive Guide to the Hazardous Properties of Chemical Substances (3rd ed.). Hoboken: John Wiley & Sons. ISBN 978-0-471-71458-3.
- Pauling, Linus (1960). The Nature of the Chemical Bond (3rd ed.). Ithaca: Cornell University Press. ISBN 978-0-8014-0333-0.
- Pauling, L.; Keaveny, I.; Robinson, A. B. (1970). "The Crystal Structure of α-Fluorine". Journal of Solid State Chemistry. 2 (2): 225–227. Bibcode:1970JSSCh...2..225P. doi:10.1016/0022-4596(70)90074-5.
- Perry, Dale L. (2011). Handbook of Inorganic Compounds (2nd ed.). Boca Raton: CRC Press. ISBN 978-1-4398-1461-1.
- Pitzer, K. S. (1975). "Fluorides of Radon and Element 118". Journal of the Chemical Society, Chemical Communications (18): 760b–761. doi:10.1039/C3975000760B.
- Pitzer, Kenneth S., ed. (1993). Molecular Structure and Statistical Thermodynamics: Selected Papers of Kenneth S. Pitzer. Singapore: World Scientific Publishing. ISBN 978-981-02-1439-5.
- Pizzo, G.; Piscopo, M. R.; Pizzo, I.; Giuliana, G. (2007). "Community Water Fluoridation and Caries Prevention: A Critical Review" (PDF). Clinical Oral Investigations. 11 (3): 189–193. doi:10.1007/s00784-007-0111-6. PMID 17333303. S2CID 13189520.
- Posner, Stefan (2011). "Perfluorinated Compounds: Occurrence and Uses in Products". In Knepper, Thomas P.; Large, Frank T. (eds.). Polyfluorinated Chemicals and Transformation Products. Heidelberg: Springer Science+Business Media. pp. 25–40. ISBN 978-3-642-21871-2.
- Posner, Stefan; et al. (2013). Per- and Polyfluorinated Substances in the Nordic Countries: Use Occurrence and Toxicology (PDF). Copenhagen: Nordic Council of Ministers. doi:10.6027/TN2013-542. ISBN 978-92-893-2562-2.
- Preskorn, Sheldon H. (1996). Clinical Pharmacology of Selective Serotonin Reuptake Inhibitors. Caddo: Professional Communications. ISBN 978-1-884735-08-0.
- Principe, Lawrence M. (2012). The Secrets of Alchemy. Chicago: University of Chicago Press. ISBN 978-0-226-68295-2.
- Proudfoot, A. T.; Bradberry, S. M.; Vale, J. A. (2006). "Sodium Fluoroacetate Poisoning". Toxicological Reviews. 25 (4): 213–219. doi:10.2165/00139709-200625040-00002. PMID 17288493. S2CID 29189551.
- PRWeb (28 October 2010). "Global Fluorochemicals Market to Exceed 2.6 Million Tons by 2015, According to a New Report by Global Industry Analysts, Inc". prweb.com. Retrieved 24 October 2013.
- PRWeb (23 February 2012). "Global Fluorspar Market to Reach 5.94 Million Metric Tons by 2017, According to New Report by Global Industry Analysts, Inc". prweb.com. Retrieved 24 October 2013.
- PRWeb (7 April 2013). "Fluoropolymers Market is Poised to Grow at a CAGR of 6.5% & to Reach $9,446.0 Million by 2016 – New report by MarketsandMarkets". prweb.com. Archived from the original on 3 April 2023. Retrieved 24 October 2013.
- Pyykkö, Pekka; Atsumi, Michiko (2009). "Molecular Double-Bond Covalent Radii for Elements Li–E112". Chemistry: A European Journal. 15 (46): 12770–9. doi:10.1002/chem.200901472. PMID 19856342.
- Raghavan, P. S. (1998). Concepts and Problems in Inorganic Chemistry. Delhi: Discovery Publishing House. ISBN 978-81-7141-418-5.
- Raj, P. Prithvi; Erdine, Serdar (2012). Pain-Relieving Procedures: The Illustrated Guide. Chichester: John Wiley & Sons. ISBN 978-0-470-67038-5.
- Ramkumar, Jayshree (2012). "Nafion Perfluorosulphonate Membrane: Unique Properties and Various Applications". In Banerjee, S.; Tyagi, A. K. (eds.). Functional Materials: Preparation, Processing and Applications. London and Waltham: Elsevier. pp. 549–578. ISBN 978-0-12-385142-0.
- Reddy, D. (2009). "Neurology of Endemic Skeletal Fluorosis". Neurology India. 57 (1): 7–12. doi:10.4103/0028-3886.48793. hdl:1807/56250. PMID 19305069.
- Renda, Agostino; Fenner, Yeshe; Gibson, Brad K.; Karakas, Amanda I.; Lattanzio, John C.; Campbell, Simon; Chieffi, Alessandro; Cunha, Katia; Smith, Verne V. (2004). "On the origin of fluorine in the Milky Way". Monthly Notices of the Royal Astronomical Society. 354 (2): 575–580. arXiv:astro-ph/0410580. Bibcode:2004MNRAS.354..575R. doi:10.1111/j.1365-2966.2004.08215.x. S2CID 12330666.
- Renner, R. (2006). "The Long and the Short of Perfluorinated Replacements". Environmental Science & Technology. 40 (1): 12–13. Bibcode:2006EnST...40...12R. doi:10.1021/es062612a. PMID 16433328.
- Rhoades, David Walter (2008). Broadband Dielectric Spectroscopy Studies of Nafion (PhD dissertation). Ann Arbor: University of Southern Mississippi, MS. ISBN 978-0-549-78540-8.
- Richter, M.; Hahn, O.; Fuchs, R. (2001). "Purple Fluorite: A Little Known Artists' Pigment and Its Use in Late Gothic and Early Renaissance Painting in Northern Europe". Studies in Conservation. 46 (1): 1–13. doi:10.1179/sic.2001.46.1.1. JSTOR 1506878. S2CID 191611885.
- Riedel, Sebastian; Kaupp, Martin (2009). "The highest oxidation states of the transition metal elements". Coordination Chemistry Reviews. 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
- Ripa, L. W. (1993). "A Half-century of Community Water Fluoridation in the United States: Review and Commentary" (PDF). Journal of Public Health Dentistry. 53 (1): 17–44. doi:10.1111/j.1752-7325.1993.tb02666.x. PMID 8474047. Archived from the original (PDF) on 4 March 2009.
- Roblin, I.; Urban, M.; Flicoteau, D.; Martin, C.; Pradeau, D. (2006). "Topical Treatment of Experimental Hydrofluoric Acid Skin Burns by 2.5% Calcium Gluconate". Journal of Burn Care & Research. 27 (6): 889–894. doi:10.1097/01.BCR.0000245767.54278.09. PMID 17091088. S2CID 3691306.
- Salager, Jean-Louis (2002). Surfactants: Types and Uses (PDF). FIRP Booklet # 300-A. Laboratory of Formulation, Interfaces, Rheology, and Processes, Universidad de los Andes. Retrieved 13 October 2013.
- Sandford, Graham (2000). "Organofluorine Chemistry". Philosophical Transactions. 358 (1766): 455–471. Bibcode:2000RSPTA.358..455S. doi:10.1098/rsta.2000.0541. S2CID 202574641.
- Sarkar, S. (2008). "Artificial Blood". Indian Journal of Critical Care Medicine. 12 (3): 140–144. doi:10.4103/0972-5229.43685. PMC 2738310. PMID 19742251.
- Scheele, Carl Wilhelm (1771). "Undersŏkning om fluss-spat och dess syra" [Investigation of Fluorite and Its Acid]. Kungliga Svenska Vetenskapsademiens Handlingar [Proceedings of the Royal Swedish Academy of Science] (in Swedish). 32: 129–138.
- Schimmeyer, S. (2002). "The Search for a Blood Substitute". Illumin. Columbia: University of Southern Carolina. 15 (1). Archived from the original on 2 October 2011. Retrieved 15 October 2013.
- Schlöder, T.; Riedel, S. (2012). "Investigation of Heterodimeric and Homodimeric Radical Cations of the Series: [F2O2]+, [F2Cl2]+, [Cl2O2]+, [F4]+, and [Cl4]+". RSC Advances. Royal Society of Chemistry. 2 (3): 876–881. Bibcode:2012RSCAd...2..876S. doi:10.1039/C1RA00804H.
- Schmedt Auf Der Günne, Jörn; Mangstl, Martin; Kraus, Florian (2012). "Occurrence of Difluorine F2 in Nature-In Situ Proof and Quantification by NMR Spectroscopy". Angewandte Chemie International Edition. 51 (31): 7847–7849. doi:10.1002/anie.201203515. ISSN 1521-3773. PMID 22763992.
- Schmitz, A.; Kälicke, T.; Willkomm, P.; Grünwald, F.; Kandyba, J.; Schmitt, O. (2000). "Use of Fluorine-18 Fluoro-2-deoxy-D-glucose Positron Emission Tomography in Assessing the Process of Tuberculous Spondylitis" (PDF). Journal of Spinal Disorders. 13 (6): 541–544. doi:10.1097/00002517-200012000-00016. PMID 11132989. Retrieved 8 October 2013.
- Schulze-Makuch, D.; Irwin, L. N. (2008). Life in the Universe: Expectations and Constraints (2nd ed.). Berlin: Springer-Verlag. ISBN 978-3-540-76816-6.
- Schwarcz, Joseph A. (2004). The Fly in the Ointment: 70 Fascinating Commentaries on the Science of Everyday Life. Toronto: ECW Press. ISBN 1-55022-621-5.
- Senning, A. (2007). Elsevier's Dictionary of Chemoetymology: The Whies and Whences of Chemical Nomenclature and Terminology. Amsterdam and Oxford: Elsevier. ISBN 978-0-444-52239-9.
- Shaffer, T. H.; Wolfson, M. R.; Clark, L. C. Jr. (1992). "Liquid Ventilation". Pediatric Pulmonology. 14 (2): 102–109. doi:10.1002/ppul.1950140208. PMID 1437347. S2CID 222167378.
- Shin, Richard D.; Silverberg, Mark A. (2013). "Fluoride Toxicity". Medscape. Retrieved 15 October 2013.
- Shriver, Duward; Atkins, Peter (2010). Solutions Manual for Inorganic Chemistry. New York: W. H. Freeman. ISBN 978-1-4292-5255-3.
- Shulman, J. D.; Wells, L. M. (1997). "Acute Fluoride Toxicity from Ingesting Home-use Dental Products in Children, Birth to 6 Years of Age". Journal of Public Health Dentistry. 57 (3): 150–158. doi:10.1111/j.1752-7325.1997.tb02966.x. PMID 9383753.
- Siegemund, G. N.; Schwertfeger, W.; Feiring, A.; Smart, B.; Behr, F.; Vogel, H.; McKusick, B. (2000). "Fluorine Compounds, Organic". Ullmann's Encyclopedia of Industrial Chemistry. Vol. 15. Weinheim: Wiley-VCH. doi:10.1002/14356007.a11_349. ISBN 978-3527306732.
- Slye, Orville M. (2012). "Fire Extinguishing Agents". In Ullmann, Franz (ed.). Ullmann's Encyclopedia of Industrial Chemistry. Vol. 15. Weinheim: Wiley-VCH. pp. 1–11. doi:10.1002/14356007.a11_113.pub2. ISBN 978-3527306732.
- Steenland, K.; Fletcher, T.; Savitz, D. A. (2010). "Epidemiologic Evidence on the Health Effects of Perfluorooctanoic Acid (PFOA)". Environmental Health Perspectives. 118 (8): 1100–1108. doi:10.1289/ehp.0901827. PMC 2920088. PMID 20423814.
- Stillman, John Maxson (December 1912). "Basil Valentine, A Seventeenth Century Hoax". Popular Science Monthly. 81. Retrieved 14 October 2013.
- Storer, Frank H. (1864). First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge: Sever and Francis.
- Swinson, Joel (June 2005). "Fluorine – A Vital Element in the Medicine Chest" (PDF). PharmaChem. Pharmaceutical Chemistry: 26–27. Archived from the original (PDF) on 8 February 2012. Retrieved 9 October 2013.
- Taber, Andrew (22 April 1999). "Dying to ride". Salon. Retrieved 18 October 2013.
- Tanner Industries (January 2011). "Anhydrous Ammonia: (MSDS) Material Safety Data Sheet". tannerind.com. Retrieved 24 October 2013.
- Theodoridis, George (2006). "Fluorine-Containing Agrochemicals: An Overview of Recent Developments". In Tressaud, Alain (ed.). Fluorine and the Environment: Agrochemicals, Archaeology, Green Chemistry & Water. Amsterdam and Oxford: Elsevier. pp. 121–176. ISBN 978-0-444-52672-4.
- Toon, Richard (1 September 2011). "The discovery of fluorine". Education in Chemistry. Vol. 48, no. 5. Royal Society of Chemistry. pp. 148–151. ISSN 0013-1350.
- Transparency Market Research (17 May 2013). "Fluorochemicals Market is Expected to Reach USD 21.5 Billion Globally by 2018: Transparency Market Research". Transparency Market Research Blog. Archived from the original on 22 February 2014. Retrieved 15 October 2013.
- Ullmann, Fritz (2008). Ullmann's Fibers (2 volumes). Weinheim: Wiley-VCH. ISBN 978-3-527-31772-1.
- United States Environmental Protection Agency (1996). "R.E.D. Facts: Trifluralin" (PDF). Archived from the original (PDF) on 18 October 2013. Retrieved 17 October 2013.
- United States Environmental Protection Agency (2012). "Emerging Contaminants – Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoic Acid (PFOA)" (PDF). Archived from the original (PDF) on 29 October 2013. Retrieved 4 November 2013.
- United States Environmental Protection Agency (2013a). "Class I Ozone-depleting Substances". Archived from the original on 10 December 2010. Retrieved 15 October 2013.
- United States Environmental Protection Agency (2013b). "Phaseout of HCFCs (Class II Ozone-Depleting Substances)". Retrieved 15 October 2013.
- Viel, Claude; Goldwhite, Harold (1993). "1906 Nobel Laureate: Henri Moissan, 1852–1907". In Laylin, K. James (ed.). Nobel Laureates in Chemistry, 1901–1992. Washington: American Chemical Society; Chemical Heritage Foundation. pp. 35–41. ISBN 978-0-8412-2690-6.
- Vigoureux, P. (1961). "The Gyromagnetic Ratio of the Proton". Contemporary Physics. 2 (5): 360–366. Bibcode:1961ConPh...2..360V. doi:10.1080/00107516108205282. S2CID 5092147.
- Villalba, Gara; Ayres, Robert U.; Schroder, Hans (2008). "Accounting for Fluorine: Production, Use, and Loss". Journal of Industrial Ecology. 11: 85–101. doi:10.1162/jiec.2007.1075. S2CID 153740615.
- Walsh, Kenneth A. (2009). Beryllium Chemistry and Processing. Materials Park: ASM International. ISBN 978-0-87170-721-5.
- Walter, P. (2013). "Honeywell Invests $300m in Green Refrigerant". Chemistry World.
- Weeks, M. E. (1932). "The Discovery of the Elements. XVII. The Halogen Family". Journal of Chemical Education. 9 (11): 1915–1939. Bibcode:1932JChEd...9.1915W. doi:10.1021/ed009p1915.
- Werner, N. L.; Hecker, M. T.; Sethi, A. K.; Donskey, C. J. (2011). "Unnecessary use of Fluoroquinolone Antibiotics in Hospitalized Patients". BMC Infectious Diseases. 11: 187–193. doi:10.1186/1471-2334-11-187. PMC 3145580. PMID 21729289.
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- Willey, Ronald R. (2007). Practical Equipment, Materials, and Processes for Optical Thin Films. Charlevoix: Willey Optical. ISBN 978-0-615-14397-2.
- Yaws, Carl L.; Braker, William (2001). "Fluorine". Matheson Gas Data Book (7th ed.). Parsippany: Matheson Tri-Gas. ISBN 978-0-07-135854-5.
- Yeung, C. A. (2008). "A Systematic Review of the Efficacy and Safety of Fluoridation". Evidence-Based Dentistry. 9 (2): 39–43. doi:10.1038/sj.ebd.6400578. PMID 18584000.
- Young, David A. (1975). Phase Diagrams of the Elements (Report). Lawrence Livermore Laboratory. Retrieved 10 June 2011.
- Zareitalabad, P.; Siemens, J.; Hamer, M.; Amelung, W. (2013). "Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater – A review on concentrations and distribution coefficients". Chemosphere. 91 (6): 725–32. Bibcode:2013Chmsp..91..725Z. doi:10.1016/j.chemosphere.2013.02.024. PMID 23498059.
- Zorich, Robert (1991). Handbook of Quality Integrated Circuit Manufacturing. San Diego: Academic Press. ISBN 978-0-323-14055-3.
외부 링크
 Wikimedia Commons의 불소 관련 미디어
Wikimedia Commons의 불소 관련 미디어







