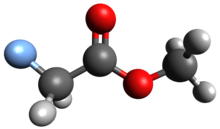
메틸플루오로아세테이트
Methyl fluoroacetate | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 메틸플루오로아세테이트 | |
| 기타 이름 MFA, TL-551 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.006.563 |
| EC 번호 |
|
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C3H5FO2 | |
| 어금질량 | 92.069 g·1998−1 |
| 외관 | 무색액 |
| 녹는점 | -40°C(-40°F, 233K) |
| 비등점 | 104 °C(219 °F, 377 K) |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 극독성 |
| GHS 라벨 표시: | |
    | |
| 위험 | |
| H226, H300, H315, H319, H335, H400 | |
| P210, P233, P240, P241, P242, P243, P261, P264, P270, P271, P273, P280, P301+P310, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P312, P321, P330, P332+P313, P337+P313, P362, P370+P378, P391, P403+P233, P403+P235, P405, P501 | |
| 플래시 포인트 | -32°C(-26°F, 241K) |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 6 mg/kg (마약) |
| 관련 화합물 | |
관련 화합물 | 플루오로아세트산 형광산나트륨 플루오로아세타미드 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
MFA(Methyl fluoroacetate, Methyl fluoroacetate, MFA)는 플루오로아세트산의 매우 독성이 강한 메틸 에스테르다. 상온에서 무색 무취의 액체다. 그것은 실험실 화학물질과 설치류 살충제로 사용된다. 그것의 극도의 독성 때문에, MFA는 화학 무기로 사용될 수 있도록 연구되었다.[1] 일반 인구는 메틸 플루오로아세테이트에 노출되지 않을 것 같다. 그러나 MFA를 업무에 사용하는 사람들은 숨을 들이마시거나 물질과 직접적인 피부 접촉을 할 수 있다.[2]
역사
MFA는 1896년 벨기에의 화학자 스와트에 의해 처음으로 이오도아세테이트 메틸을 은불화물로 반응시켜 합성되었다. 또한 플루오르화칼륨과[1] 클로로아세테이트 메틸을 반응시켜 합성할 수 있다.그 독성 때문에, MFA는 제2차 세계 대전 동안 화학 무기로서의 잠재적 사용에 대해 연구되었다. 무색무취로 상수도를 독성화시켜 인구의 상당 부분을 죽일 수 있어 좋은 물독으로 여겨졌다. 전쟁이 끝날 무렵, 몇몇 국가들은 적을 약화시키거나 죽이기 위해 메틸 플루오로아세테이트를 만들기 시작했다. [2]
합성
메틸 플루오로아세테이트의 합성은 두 단계로 구성된다.
- 플루오르화칼륨과 촉매가 원자로 내의 용매에 첨가되고, 이를 교반하여 가열한다. 이 단계에서 언급한 촉매는 위상 전달 촉매로, 도데실 트리메틸 암모늄, 염화 테트라부틸람모늄, 염화 테트라부틸람모늄, 브롬화 테트라부틸람모늄 또는 염화 테트라메틸람모늄이 될 수 있다. 이 단계에서 불소칼륨과 촉매의 질량비는 0.5~1 : 0.02~0.03이다. 이 단계에서 언급한 용제는 질량 비율이 1.4~1.6:1인 디메틸포름아미드와 아세타미드 혼합물이다. 용매와 불소칼륨의 질량비율은 1.1~2.0 : 0.5~1이다.
- 반응온도 100~160°C에 도달하면 원자로에서 5~10kg/min의 속도로 지속적으로 메틸 클로로아세테이트와 불소칼륨의 질량비율이 1:0.5~1이다. 이 화학 물질들 사이의 반응은 가스 혼합물을 생성하며, 이 혼합물 안에 있는 가스는 응축 온도에 따라 두 개의 콘덴서 사이에 분할된다. 메틸 클로로아세테이트는 100~105℃로 설정된 응축기 내에서 응축된 후 원자로로 복귀하여 화학반응에 계속 참여한다. 다른 응축기의 메틸 플루오로아세테이트가 20~25℃의 온도에서 2단계의 질화 응결로 들어가 메틸 플루오로아세테이트가 액체로 응축되어 이 반응의 산물이 된다.[3]
구조 및 반응도
Methyl fluoroacetate는 Methyl 에스테르다. 그 구조는 기능 그룹으로서의 카르복실산과 불소 원자로 구성되어 있다. MFA는 액체인데, 냄새가 없거나 희미하고 과일 냄새가 날 수 있다. MFA의 비등점은 104.5℃이고 녹는점은 -35.0℃이다. 물(25°C에서 1.17X10+5mg/L)에 용해되며, 석유 에테르에 약간 용해된다.[2]
MFA는 핵소체에 의한 불소 변위에 내성이 있으므로 다른 할로겐(Cl, Br)에 비해 C-F 본드의 안정성이 높다. 다른 후광 아세테이트들은 -SH 단백질 그룹과 반응하는 보다 강력한 알킬링제다. 그러나 이것은 MFA에게는 일어나지 않으며 독성 작용을 한다. [2] 또한 MFA는 독성만큼 독성이 있고 MFA와 유사한 생물역조성을 갖는 형광산염(FA) 화합물의 파생물이다.
작용과 신진대사의 메커니즘
일반적으로 형광산염은 형광산염 코엔자임 A에서 형광산염으로 전환되기 때문에 독성이 있다. 플루오르산염은 경쟁 억제에 의해 구연산 전환에 필요한 아콘산염 하이드라타제를 억제할 수 있다.[4] 이것은 구연산 순환을 방해하고 또한 구연산염이 조직과 결국 혈장에 축적되게 한다. MFA는 주로 글루타티온 전달효소 효소에 의해 2상 생물역전 형성 과정에서 형성되는 생물역전이다. GSH에 의존하는 효소는 글루타티온을 MFA에 결합시켜 MFA를 분해한다. 그 결과 불소 음이온과 S-카복시메틸 글루타티온 등이 생성된다. 불소의 디커플링은 형광산염 특유의 디플루오린화효소에 의해 매개된다. 간에는 주로 탈수 활동이 존재하지만 신장, 폐, 심장, 고환 등도 활동을 나타낸다. 뇌에는 용해된 흔적이 없다. 결국 주 독성 화합물인 불소산화물(FC)이 형성된다. 아코니타아제 효소를 매우 높은 친화력으로 묶어 TCA 사이클에 개입시킨다. 정상적인 상황에서 구연산염은 굴복하도록 전환되지만 그 과정은 억제된다. NADH, FADH2 및 굴복은 TCA 사이클로부터 요구되기 때문에 사이클이 정지하고 산화 인산화가 방지된다. 호흡은 곧 멎고 독은 해독제가 없는 매우 빨리 작용한다. 결과적으로, 포유류는 MFA에 대해 편협성이 없다. 그러나 호주 종(예: 솔꼬리 주머니쥐)은 글루타티온-스-전달효소를 사용하여 형광산염을 대사함으로써 형광산염에 대한 내성을 보이는 종은 거의 없다.[5] 플루오르화물은 플루오르아세트산염이나 플루오르산염에서 제거할 수 있다. 아릴과 알킬 집단을 글루타티온 접합체로 바꾸어 해독하는 일에 관여한다. C-F 결합은 S-카르복시메틸 글루타티온의 형성을 초래하는 탄소의 핵포필적 공격 때문에 갈라진다. 이것은 나중에 S-카복시메틸시스테인의 형태로 배설될 수 있다.[5] 생물학적 형성 MFA의 반감기는 약 2일이다. 투여할 때 MFA는 주로 혈장 내에 존재하지만 간, 신장, 근육 조직에서도 추적할 수 있다.[6]
독성
MFA는 경련성 독물질이다. 독에 중독된 피해자들에게 심한 경련을 일으킨다.[7] 사망은 호흡기 장애로 인한 것이다.[6] 다양한 동물의 경우, 메틸 플루오로아세테이트의 독성이 경구적으로 그리고 피하주사를 통해 결정되었다. 복용량은 개의 경우 0.1mg/kg에서 원숭이의 경우 10~12mg/kg까지 다양하며 상당한 변화를 나타낸다. 이러한 동물들 안에서 민감성을 감소시키는 순서가 결정되었다: 개, 기니피그, 고양이, 토끼, 염소, 그리고 아마도 말, 쥐, 그리고 원숭이일 것이다. 쥐와 쥐의 경우 흡입에 의한 독성이 다른 동물보다 더 완전하게 조사되었다. 랫드와 생쥐의 LD50은 각각 450mg./cu.이고 5분 동안 1,000mg./cu.를 초과한다. 개, 기니피그, 고양이, 토끼, 염소, 말, 쥐, 쥐, 원숭이 등에서는 이 물질의 약리학적 효과를 입과 주사를 통해 조사해 왔다. 메틸 플루오로아세테이트는 대부분의 동물에서 호흡의 점진적인 우울증을 유발하며 경련성 독물질이다. 피부에 바르면 독성은 없지만 흡입, 주사, 입으로 바르면 독성이 있다. 쥐, 고양이, 붉은털원숭이의 경우, 니코틴, 스트리치닌, 렙타졸, 피크로톡신, 전기 유발 경련과 유사한 메틸 플루오로아세테이트의 영향이 결정되었다. 경련 패턴은 렙타졸과 유사한 것으로 간주된다. 이 동물들에서는 사후에 질식사 흔적이 거의 발견되지 않는다. 혈당, 헤모글로빈, 혈장단백질, 비단백질질소, 혈청 칼륨, 칼슘, 염화물, 무기인산염에 대한 추정치가 소수의 토끼, 개, 염소 등에서 이루어졌다. 혈액 변화에는 헤모글로빈 20~60% 증가, 혈당 최대 90% 증가, 무기인산염 70~130% 증가, 비단백질 질소 및 칼륨의 말기 상승으로 혈청 칼륨의 유의미하지 않은 증가가 포함된다. 중추신경계 전체가 렙타졸과 마찬가지로 메틸 플루오로아세테이트에 의해 영향을 받으며, 높은 중심은 낮은 중심보다 민감하다. 소량의 메틸 플루오로아세테이트가 혈압에 거의 영향을 미치지 않지만 다량의 메틸은 니코틴과 유사한 작용을 한다. 그것은 호흡의 속도와 양을 더욱 자극하고, 그리고 나서 호흡의 장애를 일으키는데, 아마도 그래픽 기록을 통해 본 바와 같이 근원의 중심일 것이다. 무릎 저크 반응은 자극의 방사선으로 인해 경련이 일어날 때까지 메틸 플루오로아세테이트를 통해 강조되는 것으로 보인다. 척수 고양이의 반사 아크에서 신경 전도가 증가하고 문턱 자극이 줄어든다. 메틸 형광산염은 쥐에서 전기 경련 임계값을 약 10배 감소시킨다. 메틸 플루오로아세테이트가 강력한 경련제와 호흡기억제제 모두지만 인간에게 치료제 제안을 하는 등 치료의 어려움이 강조되고 있다. 메틸 플루오로아세테이트는 설치류 및 기타 해충에 대한 독으로 사용되는 경우 식품 및 수질오염물질로서 심각한 위험을 나타내며, 이는 쉽게 검출되거나 파괴되지 않고 구강과 주입에 의해 동일하게 독성이 있기 때문이다.[6]
환경 노출
메틸 플루오로아세테이트가 생산되어 화학 시약으로 사용되며 여러 개의 폐기물 흐름을 통해 환경에 방출될 수 있다. 설치류 살충제로 쓰였을 때 공중에서 분해될 환경에 직접 방출했다. 공기 중으로 방출될 경우, 25℃에서 31 mmHg로 추정된 증기 압력은 대기 중에 오직 증기로만 메틸 플루오로아세테이트가 존재할 것임을 나타낸다.[2] 증기 위상 메틸 플루오로아세테이트는 광화학적으로 생산된 수산화기와 반응하여 대기 중에 저하될 것이다. 공기 중 이 반응의 반감기는 98일로 추정된다. MFA는 290nm 이상의 파장에서 흡수되는 색소포체를 함유하지 않기 때문에 햇빛에 의한 직접적인 광분해에 취약하지 않을 것으로 예상된다.[2]
동물에 미치는 영향
동물에 대한 영향은 매우 빠르고 강하게 동물에게 발생하며, 모두 죽음을 초래한다. 고농도 MFA 증기에 노출되면 30~60분이 지나야 동물에서 증상이 나타난다.[6] 그 후 격렬한 반응과 사망이 몇 시간 만에 일어났다는 연구 결과가 나왔다. 정맥주사 쥐부터 쥐와 기니피그는 15분에서 2시간 정도 지나면 증상이 나타난다. 동물들은 조용해지고 절룩거린다. 토끼는 비슷한 잠복기와 근육 약화를 보인다.[6] 개는 과잉행동 증상을 보인다. 신진대사의 비율이 높아 더욱 민감하게 반응하고, 결국 호흡도 제대로 하지 못한다. 생선은 신진대사가[4] 느리기 때문에 내성이 강하기 때문에 이 물질이 생선에 쌓일 것으로 예상되지 않는다. 또한, 형광산염의 흔적이 있는 식물로 구성된 서식지에서 사는 호주 초식동물(예: 주머니쥐와 씨앗을 먹는 새)은 어느 정도 내성이 있다. 이것은 GSH가 있는 곳에서 플루오르옥시트로이트에 대한 아코니타제의 더 많은 저항성을 해독함으로써 발생할 수 있다. 어떤 곤충들은 독소를 독소에 저장하고 나중에 그것을 사용할 수 있다.[4] 게다가, 매우 위험한 MFA는 인간의 생명을 위태롭게 하지 않고 동물들을 중독시키는 데 사용될 수 없다는 것을 주목할 필요가 있다.
금주요법
MFA에 대한 해독제는 없지만, MFA 중독 치료와 관련하여 몇 가지 제안이 있다. 중독 후 바로 빠르게 반응하는 마취제의 정맥주사를 사용하는 것이 좋다. 마취제는 펜토탈 나트륨 또는 에피판 나트륨이어야 하며, 이어 페노바르비톤 나트륨 또는 직장 아베르틴과 같은 장기간 작용하는 피질 억제제를 근육 내 주입해야 한다. 이후 BLB 마스크, 인공호흡 사용 등과 함께 산소 공급에 대한 세심한 관리가 필요하다. 아마도 간질병 상태와 마찬가지로 정맥주사로 고음질 포도당을 사용해야 할 것이다. 마지막으로 경련을 억제하기 위해 염화관로폰테를 신중하게 사용해야 한다.[6] 구토가 발생하면 환자를 앞으로 기울여 열린 기도를 유지하십시오. 또는 불소산염 합성의 방지, 미토콘드리아 내 아코니타아제 차단, 미토콘드리아로부터의 구연산유출 등을 목적으로 하는 요법이 있어 TCA 사이클이 계속 유지되도록 한다. 현재로선 에탄올이 FC 구성에 가장 효과적인 것으로 입증됐다. 에탄올이 산화되면 혈중 아세테이트 수치가 높아져 FC 생산을 억제한다. 인간의 경우 40~60mL 96% 에탄올 경구 투여 후 첫 시간에는 1.0~1.5g/kg의 에탄올 5-10% 에탄올, 이후 6~8시간 동안은 0.1g/kg이 권장된다. 이 치료법은 MFA와 높은 관련성 화합물인 형광산염(FA) 중독을 위한 것이므로, MFA를 목표로 하는 이 치료법은 다른 결과를 초래할 수 있다.[8] 게다가, 모노아세틴 치료는 FA 중독에 대항하는 데 도움을 주었다. 그것은 혈액의 아세테이트 수치를 증가시키는데 도움을 주고 심장, 뇌, 신장의 구연산 수치를 감소시킨다. 그러나 이것은 실험적으로만 시험된다. 원숭이의 경우, 모노아세틴은 심지어 모든 생물학적 영향이 정상화되는 FA의 효과를 역전시킨다.[8] 에탄올과 마찬가지로 모노아세틴은 FA 중독에 효과가 있다. 지금까지 MFA에 대해 입증된 치료법은 없다. 다만 FA와 MFA는 밀접한 관련성이 있는 화합물이기 때문에 앞에서 언급한 치료법은 MFA를 겨냥한 치료의 출발점을 제공할 수 있다.[8]
참고 항목
참조
- ^ a b Gribble, Gordon W. (July 1973). "Fluoroacetate toxicity" (PDF). Journal of Chemical Education. 50 (7): 460–2. Bibcode:1973JChEd..50..460G. doi:10.1021/ed050p460. PMID 4711243.
- ^ a b c d e f 국립생명공학정보센터 PubChem 데이터베이스. 메틸 플루오로아세테이트, CID=9959, https://pubchem.ncbi.nlm.nih.gov/compound/Methyl-fluoroacetate (2020년 3월 20일 발표)
- ^ a b 侯红军杨华春司腾飞薛旭金杨明霞师玉萍邹英武贺志荣姚超 (2015). 특허 식별자 번호 CN104292104B. 위치: 구글 특허
- ^ a b c Long, L, Khan, S, Davis, C. K, Denman, S. E, & McSweeney, C. S. (2017). 식물의 형광산염 - 가축에 대한 분포, 독성 및 미생물 해독에 대한 검토. 동물학 및 생명공학 저널, 8, 55
- ^ a b Mead, R. J., Oliver, A. J., & King, D. R. (1979) 붓꼬리 주머니쥐(Trichosurus vulpecula)에서 형광산염의 대사 및 용액 제거. 호주의 생물학 저널, 32(1), 15-26.
- ^ a b c d e f Foss, G. L. (June 1948). "The toxicology and pharmacology of methyl fluoroacetate (mfa) in animals, with some notes on experimental therapy". British Journal of Pharmacology and Chemotherapy. 3 (2): 118–127. doi:10.1111/j.1476-5381.1948.tb00362.x. PMC 1509813. PMID 18866990.
- ^ Saunders, B. C.; Stacey, G. J. (1948). "358. Toxic fluorine compounds containing the C–F link. Part I. Methyl Fluoroacetate and Related Compounds". J. Chem. Soc. 70: 1773–1779. doi:10.1039/jr9480001773. PMID 18106001.
- ^ a b c 곤차로프, N. V. 젠킨스, R. O., & Radilov, A. S. (2006) 형광산염의 독성학: 치료 연구를 위한 가능한 방향과 함께 검토. 적용된 독성학 저널: 국제 저널 26(2), 148-161.