f-contracture (조영역)
f-ratio (oceanography)
| 시리즈의 일부 |
| 플랑크톤 |
|---|
 |
해양 생물 지구 화학에서 f-비율은 질산염에 의해 연료 공급되는 총 1차 생산량의 비율이다(암모늄과 같은 다른 질소 화합물에 의해 연료 공급되는 비율과 반대).이 비율은 리처드 에플리와 브루스 피터슨이 세계 해양생산을 [1]추정하는 최초의 논문 중 하나에서 처음 정의했습니다.이 분율은 생물 펌프에 의해 표면 해양에서 유기 해양 눈의 침하(수출) 플럭스와 직접 관련이 있는 것으로 보여 당초 유의한 것으로 여겨졌다.그러나 이 해석은 병렬 프로세스의 강력한 깊이 분할, 질화라는 가정에 의존했으며, 이는 보다 최근의 측정이 의문을 [2]제기하였다.
개요
유기체의 중력 침하(또는 유기체의 잔해)는 미립자 유기 탄소를 바다의 표면수에서 깊은 내부로 옮깁니다.이 과정은 생물학적 펌프라고 알려져 있고, 지구의 탄소 순환의 중요한 측면이기 때문에 그것을 정량화하는 것은 과학자들에게 흥미롭다.본질적으로, 이것은 깊은 바다로 운반되는 탄소가 대기로부터 격리되어 바다가 탄소 저장고 역할을 할 수 있게 하기 때문이다.이 생물학적 메커니즘은 용해성 펌프라고 알려진 물리 화학 메커니즘과 함께 동반되는데, 이것은 또한 해양의 깊은 내부로 탄소를 이동시키는 역할을 한다.
침하 물질(해상 눈)의 플럭스 측정은 일반적으로 침하물이 물기둥 아래로 가라앉을 때 재료를 차단하고 저장하는 침전물 트랩을 배치함으로써 이루어집니다.그러나 트랩은 전개 또는 복구가 어려울 수 있으며 싱크 플럭스를 통합하기 위해 장기간 방치해야 하기 때문에 이것은 비교적 어려운 프로세스입니다.또한,[3][4] 그들은 물살에 의해 편향을 경험하고 수평 및 수직 플럭스를 통합하는 것으로 알려져 있다.이러한 이유로, 과학자들은 더 쉽게 측정할 수 있고 가라앉는 플럭스의 대용물 역할을 하는 해양 특성에 관심이 있다.f-ratio는 이러한 프록시 중 하나입니다.
'신규' 및 '재생산'
생물 이용 가능한 질소는 질산염3−(NO), 아질산염2−(NO), 암모늄(NH4+)과 같은 단순한 이온 형태와 요소(NH2)2 CO와 같은 보다 복잡한 유기 형태를 포함한 여러 가지 형태로 바다에서 발생한다.이러한 형태는 아미노산과 같은 유기 분자를 합성하기 위해 자기영양 식물성 플랑크톤에 의해 사용됩니다.동물성 플랑크톤과 더 큰 유기체에 의한 식물성 플랑크톤 방목은 이 유기 질소를 먹이사슬과 해양 식품 거미줄로 옮깁니다.
질소 유기 분자가 최종적으로 유기물에 의해 대사될 때, 그것들은 암모늄(또는 암모늄으로 대사되는 더 복잡한 분자)으로 물기둥으로 돌아간다.암모늄은 식물성 플랑크톤에 의해 사용될 수 있고 다시 먹이줄로 들어갈 수 있기 때문에 이것은 재생이라고 알려져 있습니다.이러한 방식으로 암모늄을 연료로 하는 1차 생산을 재생 [5]생산이라고 합니다.
그러나 암모늄은 질화 과정에 의해 (아질산염을 통해) 질산염으로 산화될 수도 있다.이는 두 단계로 서로 다른 박테리아에 의해 수행됩니다.
- NH3 + O2 → NO2− + 3H+ + 2e−
- NO2−2 + HO → NO3− + 2H+ + 2e−
결정적으로, 이 과정은 빛이 없을 때(또는 깊이의 다른 기능으로서)에만 일어나는 것으로 여겨진다.바다에서는 질화 작용이 1차 생산에서 수직 분리되어 무호흡대에 국한된다.이로 인해 물기둥의 질산염은 반드시 무증기대에서 나온 것이며 침하로 인해 그곳으로 운반된 유기물질에서 유래한 것이어야 하는 상황으로 이어진다.따라서 질산염에 의해 연료 공급되는 주요 생산은 재생 영양소보다는 "신선한" 영양소원을 사용하는 것이다.질산염에 의한 생산을 [5]신생산이라고 한다.
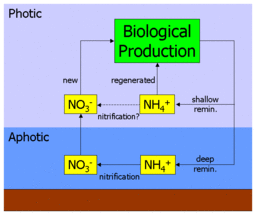
이 섹션의 선두에 있는 그림은 이를 나타내고 있습니다.질산염과 암모늄은 1차 생산자에 의해 흡수되어 먹이사슬을 통해 가공된 후 암모늄으로 재생됩니다.이 리턴 플럭스의 일부는 표면 해양으로 방출되고(그곳에서 다시 흡수할 수 있음) 일부는 깊이로 반환됩니다.깊이에서 되돌아온 암모늄은 질화되어 질산염이 되고, 최종적으로 섞이거나 표면 바다로 올라와 순환을 반복한다.
따라서 신규 생산의 의의는 침하 재료와의 관련성에 있다.평형상태에서는 질산염의 상승속도에 의해 아포틱존으로 침하하는 유기물질의 수출속도가 균형을 이룬다.재생 암모늄에 비해 1차 생산의 질산염 소비량을 측정함으로써 간접적으로 수출 플럭스를 추정할 수 있을 것이다.
한편, f-ratio는 또한 지역 [6]생태계 기능의 중요한 측면을 드러낼 수 있다.높은 f 비율 값은 일반적으로 큰 동물성 플랑크톤(그리고 어류와 같은 더 큰 유기체)에 의해 방목되는 크고 진핵생물인 식물성 플랑크톤(디아톰 등)이 지배하는 생산적 생태계와 관련이 있다.반면, 낮은 f-ratio 값은 일반적으로 마이크로동물 플랑크톤에 의해 억제되는 작은 원핵생물 식물성 플랑크톤([7][8]프로클로로코커스 등)으로 구성된 저바이오매스, 근영양 식품 거미줄과 관련이 있다.
전제 조건
이러한 f-ratio 해석에서 기본적인 가정은 1차 생산과 질화의 공간적 분리이다.실제로 Eppley & Peterson은 원본 논문에서 "새로운 생산을 수출과 관련짓는 것은 유포틱존의 질화 처리를 무시할 [1]수 있어야 한다"고 언급했다.그러나 질화 분포에 대한 후속 관찰 연구에서는 질화가 더 낮은 깊이에서, 그리고 심지어 광대 [2][9][10]내에서 발생할 수 있다는 것이 밝혀졌다.
인접한 도표에서 알 수 있듯이 암모늄이 실제로 해양 표층수에서 질산염으로 질화되면 기본적으로 질산염의 깊은 경로를 단락시킵니다.실제로, 표면상으로는 새로운 생산량 중 일부는 표면상 해양을 떠난 적이 없는 최근 질화 질산염에 의해 실제로 연료가 공급되기 때문에, 이것은 새로운 생산량의 과대평가와 높은 f 비율로 이어질 것이다.매개 변수화에 질화 측정을 포함시킨 후, 과영양 아열대 환류 지역(특히 BATS 사이트)의 생태계 모델은 연간 기준으로 표면 질산염의 약 40%가 최근에 질화되었음을 발견했다(여름 [11]동안 거의 90%까지 상승).지리적으로 다양한 질화 측정을 합성한 추가 연구에서는 변동성은 높지만 깊이와의 관계는 없는 것으로 밝혀졌으며, 이를 글로벌 스케일 모델에 적용하여 표면 질산염의 절반까지 [12]상승이 아닌 표면 질화로부터 공급되는 것으로 추정했다.
질화 속도 측정은 여전히 비교적 드물지만, f-ratio가 한 때 생각했던 것처럼 생물학적 펌프의 대용물이 아니라는 것을 시사한다.이러한 이유로 일부 근로자들은 1차 생산 대비 미립자 수출 비율(pe-ratio)[8]을 구별할 것을 제안했다.pe-ratio는 f-ratio와 양적으로는 다르지만 높은 생산성/높은 바이오매스/높은 수출 체제와 낮은 생산성/낮은 바이오매스/낮은 수출 체제 간에 유사한 질적 변동을 보인다.
또한 "신규" 및 "재생산"을 추정하기 위해 잠재적으로 f-ratio의 사용을 복잡하게 하는 또 다른 과정은 암모늄(DNRA)에 대한 이산화 질산 환원이다.산소 최소 영역과 해저 퇴적물과 같은 저산소 환경에서, 화학 유기 영양 미생물은 [13]질산염을 호흡용 전자 수용체로 사용하여 질산염을 아질산염으로, 그리고 암모늄으로 환원합니다.질화와 마찬가지로 DNRA는 질산염과 암모늄의 가용성에 있어서 균형을 변화시키기 때문에 계산된 f-ratio에 부정확성을 가져올 가능성이 있다.그러나 DNRA의 발생은 혐기적인 [14]상황으로 한정되기 때문에 1차 생산자와 [15][16]함께 발생할 수 있지만 질화보다는 그 중요성이 덜 확산된다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b Eppley, R.W.; Peterson, B.J. (1979). "Particulate organic matter flux and planktonic new production in the deep ocean". Nature. 282 (5740): 677–680. Bibcode:1979Natur.282..677E. doi:10.1038/282677a0. S2CID 42385900.
- ^ a b Dore, J.E.; Karl, D.M. (1996). "Nitrification in the euphotic zone as a source for nitrite, nitrate, and nitrous oxide at Station ALOHA". Limnol. Oceanogr. 41 (8): 1619–1628. Bibcode:1996LimOc..41.1619D. doi:10.4319/lo.1996.41.8.1619. JSTOR 00243590.
- ^ Thomas, S.; Ridd, P.V. (2004). "Review of methods to measure short time scale sediment accumulation". Marine Geology. 207 (1–4): 95–114. Bibcode:2004MGeol.207...95T. doi:10.1016/j.margeo.2004.03.011.
- ^ Buesseler, K.O.; et al. (2007). "An assessment of the use of sediment traps for estimating upper ocean particle fluxes" (PDF). J. Mar. Res. 65 (3): 345–416. doi:10.1357/002224007781567621. hdl:1912/1803. ISSN 0022-2402.
- ^ a b Dugdale, R.C.; Goering, J.J. (1967). "Uptake of new and regenerated forms of nitrogen in primary productivity". Limnol. Oceanogr. 12 (2): 196–206. Bibcode:1967LimOc..12..196D. doi:10.4319/lo.1967.12.2.0196.
- ^ Allen, A.E.; Howard-Jones, M.H.; Booth, M.G.; Frischer, M.E.; Verity, P.G.; Bronk, D.A.; Sanderson, M.P. (2002). "Importance of heterotrophic bacterial assimilation of ammonium and nitrate in the Barents Sea during summer". Journal of Marine Systems. 38 (1–2): 93–108. Bibcode:2002JMS....38...93A. doi:10.1016/s0924-7963(02)00171-9.
- ^ Laws, E.A.; Falkowski, P.G.; Smith, W.O.; Ducklow, H.; McCarthy, J.J. (2000). "Temperature effects on export production in the open ocean". Global Biogeochemical Cycles. 14 (4): 1231–1246. Bibcode:2000GBioC..14.1231L. doi:10.1029/1999GB001229.
- ^ a b Dunne, J.P.; Armstrong, R.A.; Gnanadesikan, A.; Sarmiento, J.L. (2005). "Empirical and mechanistic models for the particle export ratio". Global Biogeochemical Cycles. 19 (4): GB4026. Bibcode:2005GBioC..19.4026D. doi:10.1029/2004GB002390. S2CID 9019774.
- ^ Raimbault, P.; Slawyk, G.; Boudjellal, B.; Coatanoan, C.; Conan, P.; Coste, B.; Garcia, N.; Moutin, T.; Pujo-Pay, M. (1999). "Carbon and nitrogen uptake and export in the equatorial Pacific at 150°W: Evidence of an efficient regenerated production cycle". J. Geophys. Res. 104 (C2): 3341–3356. Bibcode:1999JGR...104.3341R. doi:10.1029/1998JC900004. S2CID 55579865.
- ^ Diaz, F.; Raimbault, P. (2000). "Nitrogen regeneration and dissolved organic nitrogen release during spring in a NW Mediterranean coastal zone (Gulf of Lions): implications for the estimation of new production". Mar. Ecol. Prog. Ser. 197: 51–65. Bibcode:2000MEPS..197...51D. doi:10.3354/meps197051.
- ^ Martin, A.P.; Pondaven, P. (2006). "New primary production and nitrification in the western subtropical North Atlantic: a modelling study". Global Biogeochemical Cycles. 20 (4): n/a. Bibcode:2006GBioC..20.4014M. doi:10.1029/2005GB002608.
- ^ Yool, A.; Martin, A.P.; Fernández, C.; Clark, D.R. (2007). "The significance of nitrification for oceanic new production". Nature. 447 (7147): 999–1002. Bibcode:2007Natur.447..999Y. doi:10.1038/nature05885. PMID 17581584. S2CID 4416535.
- ^ Kraft, B. Strous, M. and Tegetmeyer, H. E. (2011). "Microbial nitrate respiration – Genes, enzymes and environmental distribution". Journal of Biotechnology. 155 (1): 104–117. doi:10.1016/j.jbiotec.2010.12.025. PMID 21219945.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Lam, Phyllis and Kuypers, Marcel M. M. (2011). "Microbial Nitrogen Processes in Oxygen Minimum Zones". Annual Review of Marine Science. 3: 317–345. Bibcode:2011ARMS....3..317L. doi:10.1146/annurev-marine-120709-142814. hdl:21.11116/0000-0001-CA25-2. PMID 21329208.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ Kamp, Anja; Beer, Dirk de; Nitsch, Jana L.; Lavik, Gaute; Stief, Peter (2011-04-05). "Diatoms respire nitrate to survive dark and anoxic conditions". Proceedings of the National Academy of Sciences. 108 (14): 5649–5654. Bibcode:2011PNAS..108.5649K. doi:10.1073/pnas.1015744108. ISSN 0027-8424. PMC 3078364. PMID 21402908.
- ^ Kamp, Anja; Stief, Peter; Knappe, Jan; Beer, Dirk de (2013-12-02). "Response of the Ubiquitous Pelagic Diatom Thalassiosira weissflogii to Darkness and Anoxia". PLOS ONE. 8 (12): e82605. Bibcode:2013PLoSO...882605K. doi:10.1371/journal.pone.0082605. ISSN 1932-6203. PMC 3846789. PMID 24312664.