에텐오네
Ethenone | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 에텐오네[1] | |
| 기타 이름 케틴 카보메테인 케토에틸렌 | |
| 식별자 | |
3D 모델(JSmol) | |
| 1098282 | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.006.671 |
| EC 번호 |
|
펍켐 CID | |
| RTECS 번호 |
|
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| C2H2O | |
| 어금질량 | 42.037 g/190 |
| 외관 | 무색 가스 |
| 냄새 | 통찰력 있는 |
| 밀도 | 1.93 g/cm3 |
| 녹는점 | -150.5°C(-238.9°F; 122.6K) |
| 비등점 | -56.1°C(-69.0°F, 217.1K) |
| 부패하다 | |
| 용해성 | 아세톤에 녹는 에탄올 에틸 에테르 방향제 할로겐화탄소 |
| 증기압 | >1 atm (20°C)[2] |
굴절률(nD) | 1.4355 |
| 열화학 | |
열 용량 (C) | 51.75 J/K mol |
의 성 엔탈피 대형화 (ΔfH⦵298) | -87.24 kJ/mol |
| 위험 | |
| NFPA 704(화재 다이아몬드) | |
| 플래시 포인트 | -107°C(-161°F, 166K) |
| 폭발 한계 | 5.5-18% |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 1300mg/kg(도덕, 랫드) |
LC50(중간농도) | 17ppm (190, 10분)[3] |
LCLo(최저공표) | 23ppm(mouse, 30분) 53ppm (1950, 2시간) 53ppm(돼지 1마리, 2시간) 750ppm(고양이, 10분) 200ppm (190, 10분) 50ppm (190, 10분) 1000ppm (10분, 10분)[3] |
| NIOSH(미국 건강 노출 제한): | |
PEL(허용) | TWA 0.5ppm(0.9mg/m3)[2] |
REL(권장) | TWA 0.5ppm(0.9mg/m3) ST 1.5ppm(3mg/m3)[2] |
IDLH(즉시 위험) | 5ppm[2] |
| 안전 데이터 시트(SDS) | 외부 MSDS |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
Etenone은 CHO22 또는 HC2=C=O라는 공식을 가진 유기 화합물인 케틴의 공식 명칭이다. 케틴계급의 가장 단순한 구성원이다. 그것은 아세틸레이션을 위한 중요한 시약이다.[4]
특성.
Etenone은 (표준 조건에서) 반응성이 매우 높은 기체로 자극적인 악취가 심하다. 저온(-80°C)에서만 합리적으로 안정적이다. 따라서 항상 각 용도에 대해 준비하고 즉시 처리해야 하며 그렇지 않으면 디케틴에 대한 조광화가 발생하거나 취급하기 어려운 폴리머에 반응한다. 예를 들어, 케틴 가스에 아황산가스를 첨가함으로써, 준비 과정에서 형성된 고분자 함량이 감소한다.[5] 누적된 이중 결합 때문에, etenone은 반응성이 매우 높으며 해당 아세트산 유도체에 대한 추가 반응 H-acidic 화합물에서 반응한다. 예를 들어, 아세트산에 대한 물과 반응하거나 해당 아세트아미드에 대한 1차 아민 또는 2차 아민에 반응한다.
준비
산업 화학에서 케틴은 아세트산의 탈수 반응]]]에 의해 생성된다.[4]
역사
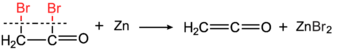
이황화탄소가 존재하는 500~600℃에서 가열된 파이프나 전기 가열 금속(동) 와이어를 통과할 때 아세톤은 메탄과 에덴으로 분해되며 수율은 95%이다.[6][7] 에덴은 헤르만 스토우딩거에 의해 동시에 발견되었다(브로모아세틸 브로마이드의 금속 아연 반응에 의해).[8][9] 아세트산의 탈수는 1910년에 보고되었다.[10]<
아세트산 무수화물 열분해도 기술했다.[11]
자연발생
Etenone은 성간 매체의 일부로 우주, 혜성 또는 기체에서 발생하는 것으로 관찰되었다.[12]
사용하다
에데논은 아세트산으로 무수화물을 만드는 데 사용된다. 일반적으로 화학성분들의 아세틸화에 사용된다.[13]
에데논은 루이스산(AlCl3, ZnCl2 또는 BF3)과 같은 촉매가 있는 곳에서 메탄올과 반응하여 β-프로피올락톤을 투여한다.[14] 기술적으로 가장 중요한 etenone의 사용은 롱체인 카복실산 아연염의 존재에서 톨루엔에 2-부텐알데히드(크로톤알데히드)와 반응하여 소르브산을 합성하는 것이다. 이것은 3-hydroxy-4-hexenoic acid의 폴리에스테르를 생산하는데, 이것은 열적으로[15] 또는 수력적으로 소르브산에 고화된다.
Etenone은 매우 반응적이어서 아세틸 그룹을 형성하기 위해 핵소포체와 반응하는 경향이 있다. 예를 들어, 그것은 물과 반응하여 아세트산을 형성한다;[16] 아세트산을 형성하기 위해 아세트산을 사용한다; 아세트산을 형성하기 위해 아세트산을 형성하기 위해 아세트산을 형성하기 위해 아세트산을 형성하기 위해 아세트산을 형성하기 위해, 암모니아와 아민산을 가지고, 그리고 건조한 수소를 할로겐화하여 아세틸 할로겐을 형성한다.[17][18]
아세트산의 형성은 1,1-디하이드록시메테네의 초기 형성에 의해 발생하며, 그 후에 최종 제품을 주기 위해 tautomerize한다.[19]
에덴은 또한 디케틴으로 알려진 주기적 조광기를 형성하기 위해 [2 + 2] 광섬유화를 통해 자신과 반응할 것이다. 이 때문에 장기간 보관해서는 안 된다.[20]
위험
집중된 수준에 노출되면 인간은 눈, 코, 목, 폐와 같은 신체 부위의 자극을 경험하게 된다. 생쥐, 쥐, 기니피그 및 토끼에 대한 장기 독성 실험 결과, 새로 생성된 etenone의 농도에 10분간 노출되면 작은 동물에서 사망률이 높은 것으로 나타났다. 이 발견들은 etenone이 독성학적으로 포스겐과 동일하다는 것을 보여준다.[21][13]
일부 e-액질 제품의 첨가제인 비타민E 아세테이트의 열분해에서 케틴의 형성은 전자담배 사용으로 인한 보고된 폐손상의[22] 한 가지 가능한 메커니즘이다.[23] 다수의 특허는 다양한 금속이나 세라믹을 사용하여 카복실산과 아세테이트에서 케틴의 촉매 형성을 설명하고 있으며, 그 중 일부는 전자담배 또는 제품 사용 관련 폐손상(EEGALI) 환자들의 전자담배 장치에서 발생하는 것으로 알려져 있다.[24][25]
직업상 노출 한계는 8시간의 시간 가중 평균에 대해 0.5ppm(0.9mg/m3)으로 설정된다.[26] IDLH 한계는 5ppm으로 설정되는데, 이는 인체에서 임상적으로 관련되는 생리학적 반응의 최저 농도였기 때문이다.[27]
참조
- ^ "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 723. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0367". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Ketene". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Miller, Raimund; Abaecherli, Claudio; Said, Adel; Jackson, Barry (2001). "Ketenes". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_063.
- ^ EP 0377438, R. Bergamin 외, 1990-06-11을 발행하여 Lonza AG에 할당
- ^ K.-H. 로텐슐레거, W. 슈뢰터, A. 워닝어, "타센부치 데르 케미" 20세 2006년, ISBN 978-3-8171-1761-1.
- ^ "Ketene". Organic Syntheses. doi:10.15227/orgsyn.004.0039.
- ^ H. Staudinger H. W. Klever(1908) : "케텐. Bemerkung jur Abhandlung jur Abhandlung der HHrn. V.T. Wilsmore und A. W. Stewart". Berichte der Deutschen Chemischen Gesellschaft, 제41권, 발행 번호 1, 1516-1517. doi:10.1002/cber.1904101275
- ^ 티드웰, T. T. (2005) "에인 자흐룬더트 케틴 (1905년–2005년): 엔트데쿵 아이너 비엘세이티겐 클라세지겐 리액트 중간". Angelwandte Chemie, 117권, 페이지 5926–5933. doi:10.1002/ange.2005,00098
- ^ J. Schmidlin, M. Bergman(1910): 베리히테 데르 도이체첸 게셀샤프트, 제43권 2821쪽 도이:10.1002/cber.19100430340.
- ^ Norman Thomas Mortimer Wilsmore (1907): "Keten" 화학학회지, 거래, 제91권, CLXXVIII(188), 1938-1941페이지. 도이:10.1039/ct9079101938
- ^ Hudson, Reggie L.; Loeffler, Mark J. (31 July 2013). "Ketene Formation in Interstellar Ices: A Laboratory Study". The Astrophysical Journal. 773 (2): 109. Bibcode:2013ApJ...773..109H. doi:10.1088/0004-637x/773/2/109. hdl:2060/20140010162.
- ^ a b Diketen에 대한 입장: Römpp 온라인. 게오르크 티에메 베를라크, 16을 되찾았다. 준이 2014.
- ^ 한스 위르겐 아르페, "인더스트리엘 조직 화학", 6. 2007년 아우플, WALIY-VCH Verlag, 웨인하임, ISBN 978-3-527-31540-6.
- ^ EP 1295860, D. 데커 외 연구진, 26호 발급 Merrz 2003-03-26, Nutrinova Gmb에 할당됨h
- ^ 티드웰, 페이지 11.
- ^ 티드웰, 560페이지.
- ^ ChemSpider http://www.chemspider.com/Chemical-Structure.9643.html
- ^ Nguyen, Minh Tho; Raspoet, Greet (1999). "The hydration mechanism of ketene: 15 years later". Can. J. Chem. 77 (5–6): 817–829. doi:10.1139/v99-090.
- ^ Christop Taeschler:Ketenes, Ketene Dimers 및 관련 물질, Kirk-Othmer 화학 기술 백과사전, John Wiley & Sons, New York, 2010
- ^ H. A. Wooster; C. C. Lushbaugh; C. E. Redeman (1946). "The Inhalation Toxicity of Ketene and of Ketene Dimer". J. Am. Chem. Soc. 68 (12): 2743. doi:10.1021/ja01216a526.
- ^ "The Vaping-Related Lung Disease Outbreak May be Coming to an End".
- ^ Wu, Dan; O’Shea, Donal F. (24 March 2020). "Potential for release of pulmonary toxic ketene from vaping pyrolysis of vitamin E acetate". Proceedings of the National Academy of Sciences. 117 (12): 6349–6355. doi:10.1073/pnas.1920925117. PMC 7104367. PMID 32156732.
- ^ Attfield, Kathleen R.; Chen, Wenhao; Cummings, Kristin J.; Jacob, Peyton; O’Shea, Donal F.; Wagner, Jeff; Wang, Ping; Fowles, Jefferson (15 October 2020). "Potential of Ethenone (Ketene) to Contribute to Electronic Cigarette, or Vaping, Product Use–associated Lung Injury". American Journal of Respiratory and Critical Care Medicine. 202 (8): 1187–1189. doi:10.1164/rccm.202003-0654LE. PMID 32551843. S2CID 219919028.
- ^ 미국 특허 5475144호. 카복실산으로부터 케틴을 합성하기 위한 촉매와 공정. 1995년 12월 12일. https://patents.google.com/patent/US5475144A/en
- ^ Centers for Disease Control and Prevention (4 April 2013). "Ketene". NIOSH Pocket Guide to Chemical Hazards. Retrieved 13 November 2013.
- ^ Centers for Disease Control and Prevention (May 1994). "Ketene". Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Retrieved 13 November 2013.
문학
- 티드웰, 토마스 T. 케테네, 2판. 존 와일리 & 선즈, 2006 ISBN 978-0-471-69282-9
외부 링크
 위키미디어 커먼스의 Etenone 관련 미디어
위키미디어 커먼스의 Etenone 관련 미디어