내정 칼륨 채널
Inward-rectifier potassium channel| 내부 정류기 칼륨 채널 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 내부 정류자 칼륨 채널의 결정 구조 | |||||||||
| 식별자 | |||||||||
| 기호 | IRK | ||||||||
| Pfam | PF01007 | ||||||||
| Pfam 씨 | CL0030 | ||||||||
| 인터프로 | IPR013521 | ||||||||
| SCOP2 | 1n9p / SCOPe / SUPFAM | ||||||||
| TCDB | 1.A.2 | ||||||||
| OPM 슈퍼 패밀리 | 8 | ||||||||
| OPM단백질 | 3SPG | ||||||||
| |||||||||
내향정정화 칼륨 채널ir(K, IRK)은 칼륨 채널의 특정 지질 게이트 서브셋이다.현재까지 7개의 하위 가족이 다양한 포유류 세포 유형,[1] 식물,[2] 박테리아에서 확인되었다.[3]그들은 4,5-비스인산염(PIP)에 의해 활성화된다.2채널의 오작동이 여러 질병에 연루되었다.[4][5]IRK 채널은 모공 영역을 가지며, 전압 게이트 이온 채널과 동일하며, 측면 투과형 세그먼트(TMS)가 있다.이들은 호모나 이성질체로서 세포막 내에 존재할 수 있으며, 각각의 모노머는 2~4개의 TMS를 가지고 있다. 기능면에서 이 단백질들은 K 수출보다+ K 흡수+ 경향이 더 큰 칼륨(K+)을 운반한다.[3]내적정치의 과정은 1960년대 심장근육세포에서 데니스 노블이, 골격근세포에서 1970년 리처드 애드리안과 앨런 호지킨이 발견했다.[6]
내향적 시정 개요
"상향적으로 보정"되는 채널은 (셀 바깥) 바깥쪽 방향보다 안쪽 방향(셀 안)으로 전류(양전하)를 더 쉽게 전달하는 채널이다.이 전류는 세포의 휴식막 전위를 안정화시키는 데 도움을 줌으로써 신경 활동을 조절하는 데 중요한 역할을 할 수 있다고 생각된다.
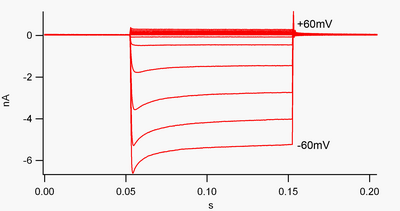
관례에 따라 내부 전류(셀로 이동하는 양의 전하)는 전압 클램프에 하향 편향으로 표시되며, 외부 전류(셀 밖으로 이동하는 양의 전하)는 상향 편향으로 표시된다.칼륨의 역전 전위에 음의 막 전위에서, 내적으로 정류된+ K 채널은 양극으로 충전된 K+ 이온의 흐름을 지지하여 막 전위를 다시 정지 전위로 밀어 넣는다.이는 그림 1에서 확인할 수 있다: 막 전위가 채널의 휴식 전위(예: -60mV)에 음극으로 고정될 때 내부 전류가 흐른다(즉, 양극 전하가 셀로 흐른다).그러나, 막 전위가 채널의 휴식 전위(예: +60 mV)에 양성으로 설정되었을 때, 이러한 채널은 거의 전류를 통과하지 못한다.간단히 말해서, 이 채널은 작동 전압 범위에서 바깥쪽 채널보다 안쪽 방향으로 훨씬 더 많은 전류를 전달한다.이들 채널은 정지 전위보다 약 30mV 높은 전압 범위에서 일부 외부 전류를 전달할 수 있기 때문에 완벽한 정류기가 아니다.
이러한 채널은 지연 정류기 및 A형 칼륨 채널과 같이 작용 전위에 따른 셀의 재분할을 담당하는 칼륨 채널과 다르다.그러한 "일반적인" 칼륨 채널은 탈극화된 막 전위에서 칼륨 전류를 (내부가 아닌) 바깥쪽으로 우선적으로 전달하며, "밖으로 정류"라고 생각할 수 있다.처음 발견되었을 때, 내적 정정은 외적 칼륨 전류와 구별하기 위해 "열성 정류"로 명명되었다.[7]
내부 정류기는 또한 탠덤 모공 영역 칼륨 채널과 다르며, K+ 전류의 "유출"을 크게 담당한다.[8]"약한 내부 정류기"라고 불리는 일부 내부 정류기는 K+ 역방향 전위에 양수 전압으로 측정 가능한 바깥쪽+ K 전류를 전달한다(그림 1의 0nA 라인 위의 작은 전류에 대응하지만 그보다 큼).그들은 "낙하" 채널과 함께 세포의 휴식막 전위를 확립한다."강력한 내부 정류기"라고 불리는 다른 내부 정류 채널은 외부 전류를 전혀 전달하지 않으며 주로 내부+ 전류(그림 1의 0nA 라인보다 훨씬 큰 전류)를 전달하는 K 역전 전위에 음의 전압에서 활성화된다.[9]
내향적 정류 메커니즘
Kir 채널의 내향적 정류 현상은 내생 폴리아민, 즉 정조세포에 의한 고선위 블록과 마그네슘 이온에 의한 채널 공극이 양전위로 플러그를 꽂아 외부 전류의 감소를 초래한 결과다.폴리아민에 의한 이 전압 의존적 블록은 내부 방향으로만 전류의 효율적인 전도를 초래한다.폴리아민 블록의 주요 아이디어는 이해되지만, 구체적인 메커니즘은 여전히 논쟁의 여지가 있다.[10]
PIP에2 의한 활성화
모든 Kir 채널은 활성화를 위해 인산염 4,5-비스인산염(PIP)2이 필요하다.[11]PIP는2 작용제 같은 성질로 K 2.2에 바인딩하여 직접ir 활성화한다.[12]이와 관련하여 Kir 채널은 PIP2 리간드 게이트 이온 채널이다.
K채널의ir 역할
Kir 채널은 대식세포, 심장과 신장세포, 백혈구, 뉴런, 내피세포 등 다세포 유형에서 발견된다.음극막 전위로 소량의 탈분극 K+ 전류를 매개함으로써 휴식막 전위 확립에 도움을 주며, K3ir 그룹의 경우 억제 신경전달물질 반응을 중재하는 데 도움을 주지만 세포생리학에서의 역할은 세포유형에 따라 다음과 같다.
| 위치 | 함수 |
|---|---|
| 심장 근세포 | Kir 채널은 탈극화에 가깝고, 막 재극화를 늦추고, 심장 작용 잠재력을 더 오래 유지할 수 있도록 돕는다.이러한 유형의 내적정착 채널은 작용 전위 후 신경과 근육 세포를 재극화하는 데 도움을 주는 지연 정류기+ K 채널, 그리고 휴식 막 전위의 많은 기초를 제공하는 칼륨 누출 채널과 구별된다. |
| 내피 세포 | Kir 채널은 질소산화물 싱타아제 규제에 관여한다. |
| 신장 | K는ir 여분의 칼륨을 소변에서 제거하기 위해 관절을 수집하기 위해 수출하거나 또는 또는 칼륨이 다시 체내로 흡수되는 것과 관련이 있을 수 있다. |
| 뉴런과 심장 세포에 있는 | G-단백질 활성 IRK(K3ir)는 신경전달물질에 의해 변조되는 중요한 규제기관이다.GIRK2 채널의 돌연변이는 위버 마우스 돌연변이로 이어진다."위버" 돌연변이 생쥐는 아탁스성이며 도파민성 뉴런의 신경인플레이션 매개 변이를 나타낸다.[13]위버 돌연변이는 비아택스적 조절에 비해 운동 조정 및 지역 뇌 대사 변화에 결함이 있다.[14]위버 생쥐는 신경 발달과 질병에 관심이 있는 실험실에서 30년 넘게 검사를 받아왔다. |
| 췌장 베타 세포 | KATP 채널(K6ir.2 및 SUR1 서브유닛의 조합)은 인슐린 방출을 제어한다. |
규정
전압 의존성은 외부 K+, 내부 Mg2+, 내부 ATP 및/또는 G-단백질에 의해 조절될 수 있다.IRK 채널의 P 영역은 VIC 계열의 영역과 제한된 시퀀스 유사성을 보인다.내부 정류기는 세포막 전위를 설정하는 역할을 하며, 탈극화 시 이러한 채널의 폐쇄는 고원상에서의 장기 작용 전위의 발생을 허용한다.내부 정류기는 많은 VIC 제품군 채널에서 발견되는 고유 전압 감지 헬리컬이 부족하다.예를 들어, Kir1.1a, Kir6.1 및 Kir6.2의 경우 ABC 슈퍼 패밀리의 구성원과의 직접적 상호작용을 제안하여 ATP에 대한 민감도를 포함한 이질적 복합체에 고유한 기능적 및 규제적 특성을 부여하였다.이러한 ATP 민감 채널은 많은 신체 조직에서 발견된다.이들은 세포질 ATP/ADP 비율에 반응하는 채널 활동을 렌더링한다(증가된 ATP/ADP는 채널을 닫는다).인간 SUR1 수용체와 SUR2 설포닐루라 수용체(각각 spQ09428 및 Q15527)는 ATP에 대응하여 Kir6.1과 Kir6.2 채널을 모두 조절하는 ABC 단백질이며, CFTR(TC #3.A.1.208.4)은 Kir1.1a를 조절할 수 있다.[15]
구조
IRK-C 계열의 박테리아 구성원의 결정 구조와[16] 기능이[17] 결정되었다.Burkholderia pseudomallei 출신의 KirBac1.1은 길이 333개의 아미노아실 잔류물(aas)이며, 2개의 N-단자 TMS가 P-루프(리소스 1-150) 옆에 있고, 단백질의 C-단자 절반은 친수성분이다.선택성과 함께 모노밸런트 양이온을 운송한다: K ≈ Rb ≈ Cs ≫ Li ≈ Na ≈ NMGM(프로토네이션 N-메틸-D-글루카민).활동은 Ba2+, Ca2+ 및 낮은 pH에 의해 억제된다.[17]
K채널ir 분류
Kirir 채널의 하위 패밀리는 7개로 K1 - K7로ir 표시된다.[1]각 하위 제품군에는 알려진 포유류 종에 걸쳐 거의 동일한 아미노산 시퀀스를 갖는 다중 멤버(예: K2ir.1, K2ir.2, K2ir.3 등)가 있다.
Kir 채널은 호모테트라메릭 막 단백질로 형성된다.4개의 동일한 단백질 서브유닛은 각각 2개의 멤브레인 스패닝 알파 헬리코(M1과 M2)로 구성된다.헤테로테트레이머는 채널이 과도하게 눌렸을 때 동일한 하위 패밀리의 멤버(예: K2ir.1과 K2ir.3) 사이에서 형성될 수 있다.
다양성
| 유전자 | 단백질 | 별칭 | 관련 하위 유니트 |
|---|---|---|---|
| KCNJ1 | Kir1.1 | ROMK1 | NHERF2 |
| KCNJ2 | Kir2.1 | IRK1 | Kir2.2, Kir4.1, PSD-95, SAP97, AKAP79 |
| KCNJ12 | Kir2.2 | IRK2 | 이질 채널을 형성하기 위한 K2ir.1 및 K2ir.3, 보조 서브 유닛: SAP97, Veli-1, Veli-3, PSD-95 |
| KCNJ4 | Kir2.3 | IRK3 | 이형ir 채널을 형성하기 위한ir K2.1 및 K2.3, PSD-95, Chapsyn-110/PSD-93 |
| KCNJ14 | Kir2.4 | IRK4 | K2ir.1 이형 채널을 형성하는 방법 |
| KCNJ3 | Kir3.1 | GIRK1, KGA | K3ir.2, K3ir.4, K3ir.5, K3ir.1은 그 자체로 기능하지 않는다. |
| KCNJ6 | Kir3.2 | GIRK2 | 이질ir 채널을 형성하기 위한ir K3.1, K3.3, K3ir.4 |
| KCNJ9 | Kir3.3 | GIRK3 | 이질ir 채널을 형성하기 위한ir K3.1, K3.2 |
| KCNJ5 | Kir3.4 | GIRK4 | Kir3.1, Kir3.2, Kir3.3 |
| KCNJ10 | Kir4.1 | Kir1.2 | 이형ir 채널을 형성하기 위한ir K4.2, K5.1 및 K2ir.1 |
| KCNJ15 | Kir4.2 | Kir1.3 | |
| KCNJ16 | Kir5.1 | BIR 9 | |
| KCNJ8 | Kir6.1 | KATP | SUR2B |
| KCNJ11 | Kir6.2 | KATP | SUR1, SUR2A 및 SUR2B |
| KCNJ13 | Kir7.1 | Kir1.4 |
- 유아기의 지속적인 고혈당성 저혈당증은 K6ir.2의 자가 열성 돌연변이와 관련이 있다.이 유전자의 특정한 돌연변이는 인슐린 분비를 조절하는 채널의 능력을 떨어뜨려 저혈당증을 유발한다.
- 바터 증후군은 Kir 채널의 돌연변이에 의해 발생할 수 있다.이 상태는 신장이 칼륨을 재활용할 수 없어 체내에 칼륨의 수치가 낮다는 특징이 있다.
- 안데르센 증후군은 K2ir.1의 다중 돌연변이에 의해 발생하는 희귀 질환이다.돌연변이에 따라 지배적이거나 열성적일 수 있다.주기적인 마비, 심장 부정맥, 이상형 특징 등이 특징이다.(KCNJ2 참조)
- 바륨 중독은 K채널ir 차단 능력 때문으로 보인다.
- 아테롬성 동맥경화증(심장질환)은 Kir 채널과 관련이 있을 수 있다.내피세포에서 Kir 전류의 상실은 최초로 알려진 무테로젠시스(심장질환의 시작)의 지표 중 하나이다.
- Tyrotoxic hypokalaic period mapability는 K2ir.6 기능의 변경과 연관되어 있다.[18]
- East/SeSame 증후군은 KCNJ10의 돌연변이에 의해 발생한다.[19]
참고 항목
참조
- ^ a b Kubo Y, Adelman JP, Clapham DE, Jan LY, Karschin A, Kurachi Y, et al. (December 2005). "International Union of Pharmacology. LIV. Nomenclature and Molecular Relationships of Inwardly Rectifying Potassium Channels". Pharmacological Reviews. 57 (4): 509–26. doi:10.1124/pr.57.4.11. PMID 16382105. S2CID 11588492.
- ^ Hedrich R, Moran O, Conti F, Busch H, Becker D, Gambale F, et al. (1995). "Inward rectifier potassium channels in plants differ from their animal counterparts in response to voltage and channel modulators". European Biophysics Journal. 24 (2): 107–15. doi:10.1007/BF00211406. PMID 8582318. S2CID 12718513.
- ^ a b "1.A.2 Inward Rectifier K Channel (IRK-C) Family". TCDB. Retrieved 2016-04-09.
- ^ Hansen SB (May 2015). "Lipid agonism: The PIP2 paradigm of ligand-gated ion channels". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1851 (5): 620–8. doi:10.1016/j.bbalip.2015.01.011. PMC 4540326. PMID 25633344.
- ^ Abraham MR, Jahangir A, Alekseev AE, Terzic A (November 1999). "Channelopathies of inwardly rectifying potassium channels". FASEB Journal. 13 (14): 1901–10. doi:10.1096/fasebj.13.14.1901. PMID 10544173. S2CID 22205168.
- ^ Adrian RH, Chandler WK, Hodgkin AL (July 1970). "Slow changes in potassium permeability in skeletal muscle". The Journal of Physiology. 208 (3): 645–68. doi:10.1113/jphysiol.1970.sp009140. PMC 1348790. PMID 5499788.
- ^ 버틸 힐(2001년).흥분성 막의 이온 통로 3부(Sinauer:선덜랜드, MA), 페이지 151. ISBN 0-87893-321-2.
- ^ 힐, 155페이지
- ^ 힐, 153쪽
- ^ Lopatin AN, Makhina EN, Nichols CG (November 1995). "The mechanism of inward rectification of potassium channels: "long-pore plugging" by cytoplasmic polyamines". The Journal of General Physiology. 106 (5): 923–55. doi:10.1085/jgp.106.5.923. PMC 2229292. PMID 8648298.
- ^ Tucker SJ, Baukrowitz T (May 2008). "How highly charged anionic lipids bind and regulate ion channels". The Journal of General Physiology. 131 (5): 431–8. doi:10.1085/jgp.200709936. PMC 2346576. PMID 18411329.
- ^ Hansen SB, Tao X, MacKinnon R (August 2011). "Structural basis of PIP2 activation of the classical inward rectifier K+ channel Kir2.2". Nature. 477 (7365): 495–8. Bibcode:2011Natur.477..495H. doi:10.1038/nature10370. PMC 3324908. PMID 21874019.
- ^ Peng J, Xie L, Stevenson FF, Melov S, Di Monte DA, Andersen JK (November 2006). "Nigrostriatal dopaminergic neurodegeneration in the weaver mouse is mediated via neuroinflammation and alleviated by minocycline administration". The Journal of Neuroscience. 26 (45): 11644–51. doi:10.1523/JNEUROSCI.3447-06.2006. PMC 6674792. PMID 17093086.
- ^ Strazielle C, Deiss V, Naudon L, Raisman-Vozari R, Lalonde R (October 2006). "Regional brain variations of cytochrome oxidase activity and motor coordination in Girk2(Wv) (Weaver) mutant mice". Neuroscience. 142 (2): 437–49. doi:10.1016/j.neuroscience.2006.06.011. PMID 16844307. S2CID 33064439.
- ^ WO 애플리케이션 0190360, Wei MH, Chaturvedi K, Guegler K, Webster M, Ketchum KA, Di Francesco V, Beasley E, "절연된 인간 트랜스포터 단백질, 인간 트랜스포터 단백질을 인코딩하는 핵산 분자 및 그 사용" 2001년 11월 29일자에 배정되었다.
- ^ Kuo A, Gulbis JM, Antcliff JF, Rahman T, Lowe ED, Zimmer J, et al. (June 2003). "Crystal structure of the potassium channel KirBac1.1 in the closed state". Science. 300 (5627): 1922–6. Bibcode:2003Sci...300.1922K. doi:10.1126/science.1085028. PMID 12738871. S2CID 2703162.
- ^ a b Enkvetchakul D, Bhattacharyya J, Jeliazkova I, Groesbeck DK, Cukras CA, Nichols CG (November 2004). "Functional characterization of a prokaryotic Kir channel". The Journal of Biological Chemistry. 279 (45): 47076–80. doi:10.1074/jbc.C400417200. PMC 8629170. PMID 15448150.
- ^ Ryan DP, da Silva MR, Soong TW, Fontaine B, Donaldson MR, Kung AW, et al. (January 2010). "Mutations in potassium channel Kir2.6 cause susceptibility to thyrotoxic hypokalemic periodic paralysis". Cell. 140 (1): 88–98. doi:10.1016/j.cell.2009.12.024. PMC 2885139. PMID 20074522.
- ^ Bockenhauer D, Feather S, Stanescu HC, Bandulik S, Zdebik AA, Reichold M, et al. (May 2009). "Epilepsy, ataxia, sensorineural deafness, tubulopathy, and KCNJ10 mutations". The New England Journal of Medicine. 360 (19): 1960–70. doi:10.1056/NEJMoa0810276. PMC 3398803. PMID 19420365.
추가 읽기
- Hille B (2001). Ion Channels of Excitable Membranes (3rd ed.). Sunderland, MA: Sinauer. pp. 149–154. ISBN 0-87893-321-2.
외부 링크
- 미국 국립 의학 도서관의 Inside+Recifier+Potalium+Channels(MeSH)
- "Inwardly Recifying Potassium Channels". IUPHAR Database of Receptors and Ion Channels. International Union of Basic and Clinical Pharmacology.
- 막군/막군 내 단백질 UMICH 방향-85 - 막내 내부 정류 칼륨 채널의 공간 위치