뉴런
Neuron| 뉴런 | |
|---|---|
 다극성 뉴런의 해부학 | |
| 식별자 | |
| MeSH | D009474 |
| NeuroLex ID | sao1417703748 |
| TA98 | A14.0.00.002 |
| TH | H2.00.06.1.00002 |
| FMA | 54527 |
| 신경해부학의 해부학적 용어 [위키데이터 편집] | |
신경계 내에서 뉴런, 뉴런 또는 신경 세포는 신경 네트워크를 통해 활동 전위라고 불리는 전기 신호를 발사하는 전기적으로 흥분 가능한 세포입니다. 뉴런은 시냅스를 통해 다른 세포와 통신하는데, 시냅스는 일반적으로 미세한 양의 화학적 신경전달물질을 사용하여 시냅스 전 뉴런에서 시냅스 갭을 통해 표적 세포로 전기 신호를 전달하는 특화된 연결입니다.
뉴런은 해면동물과 태반동물을 제외한 모든 동물에서 신경조직의 주성분입니다. 식물이나 곰팡이와 같은 비동물은 신경 세포를 가지고 있지 않습니다. 분자적 증거에 따르면 전기 신호를 생성하는 능력은 약 7~8억 년 전 토니안 시대에 진화 과정에서 처음 나타났습니다. 뉴런의 전신은 펩티데르지틱 분비 세포였습니다. 그들은 결국 세포가 빠른 전기 신호를 생성하는 시냅스 후 스캐폴드와 이온 채널을 만들 수 있게 해주는 새로운 유전자 모듈을 얻었습니다. 전기 신호를 생성하는 능력은 신경계 진화의 핵심적인 혁신이었습니다.[1]
뉴런은 일반적으로 기능에 따라 세 가지 유형으로 분류됩니다. 감각신경세포는 감각기관의 세포에 영향을 주는 촉각, 소리, 빛 등의 자극에 반응하여 척수나 뇌에 신호를 보냅니다. 운동 뉴런은 뇌와 척수로부터 신호를 받아 근육 수축부터[2] 선 출력까지 모든 것을 조절합니다. 인터뉴론은 뉴런을 뇌나 척수의 같은 부위 내의 다른 뉴런과 연결합니다. 여러 개의 뉴런들이 기능적으로 함께 연결되면, 그들은 신경 회로라고 불리는 것을 형성합니다.
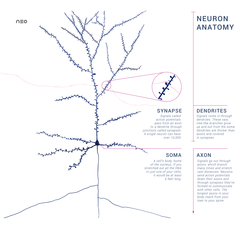
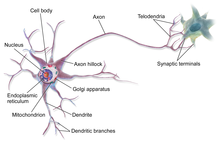
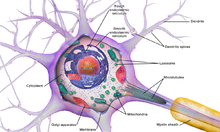
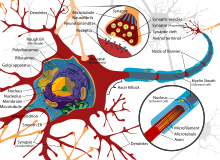
뉴런은 세포체(소마), 핵, 매끄럽고 거친 소포체, 골지체, 미토콘드리아 및 기타 세포 구성 요소와 같은 다른 모든 진핵 세포에 공통적인 일부 구조로 구성된 특수 세포입니다.[3] 또한 뉴런은 하나의 축삭뿐만 아니라 수상돌기와 같은 다른 독특한 구조를 가지고 있습니다.[3] 소마는 조밀한 구조이고 축삭과 수상돌기는 소마에서 튀어나온 필라멘트입니다. 수지상돌기는 일반적으로 가지가 무성하고 소마에서 수백 마이크로미터까지 뻗어 있습니다. 축삭은 축삭 언덕이라고 불리는 부종에서 소마를 떠나 다른 종에서는 1미터 이상을 이동합니다. 가지를 치지만 보통 직경을 일정하게 유지합니다. 축삭돌기의 가장 끝에는 축삭돌기 말단이 있는데, 여기서 뉴런은 시냅스를 가로질러 다른 세포로 신호를 전송할 수 있습니다. 뉴런은 수상돌기가 부족하거나 축삭이 없을 수 있습니다. 뉴라이트라는 용어는 특히 세포가 미분화될 때 덴드라이트 또는 축삭을 설명하는 데 사용됩니다.
대부분의 뉴런은 수상돌기와 소마를 통해 신호를 받고 축삭 아래로 신호를 보냅니다. 시냅스의 대부분에서 신호는 한 뉴런의 축삭에서 다른 뉴런의 덴드라이트로 교차합니다. 그러나 시냅스는 축삭을 다른 축삭에 연결하거나 덴드라이트를 다른 덴드라이트에 연결할 수 있습니다.
신호 전달 과정은 부분적으로는 전기적이고 부분적으로는 화학적입니다. 뉴런은 막을 가로질러 전압 구배를 유지하기 때문에 전기적으로 흥분할 수 있습니다. 짧은 간격 동안 전압이 충분히 많이 변하면 뉴런은 활동전위라고 불리는 올 오어 낫아웃(All or Nothing) 전기화학 펄스를 발생시킵니다. 이 전위는 축삭을 따라 빠르게 이동하고 축삭에 도달하면 시냅스 연결을 활성화합니다. 시냅스 신호는 흥분성 또는 억제성일 수 있으며 소마에 도달하는 순 전압을 증가시키거나 감소시킵니다.
대부분의 경우 뉴런은 뇌 발달과 어린 시절에 신경 줄기세포에 의해 생성됩니다. 신경생성은 대부분의 뇌 영역에서 성인기 동안 대부분 중단됩니다.
신경계
신경계의 주요 구성 요소는 신경교세포와 함께 구조적, 대사적 지원을 제공하는 신경교세포입니다.[4] 신경계는 뇌와 척수를 포함하는 중추신경계와 자율신경계와 체성신경계를 포함하는 말초신경계로 구성되어 있습니다.[5] 척추동물에서 뉴런은 대부분 중추신경계에 속하지만, 일부는 말초신경절에 존재하며, 감각신경세포는 망막, 달팽이관 등 감각기관에 많이 존재합니다.
축삭은 말초신경계의 신경을 구성하는 근막으로 묶일 수 있습니다. 중추신경계에 있는 축삭 다발을 트랙이라고 합니다.
해부학과 조직학
뉴런은 세포 신호의 처리와 전달에 매우 특화되어 있습니다. 신경계의 여러 부분에서 수행되는 기능의 다양성을 고려할 때, 그 형태, 크기, 전기화학적 특성에 있어서 매우 다양합니다. 예를 들어, 뉴런의 소마는 직경이 4에서 100 마이크로미터까지 다양할 수 있습니다.[6]
- 소마는 뉴런의 몸입니다. 핵을 포함하고 있기 때문에 대부분의 단백질 합성이 여기서 일어납니다. 핵의 직경은 3~18마이크로미터입니다.[7]
- 뉴런의 수상돌기는 가지가 많은 세포 확장물입니다. 이 전체적인 모양과 구조를 비유적으로 수지상 나무라고 합니다. 여기서 뉴런에 대한 대부분의 입력은 수지상 척추를 통해 이루어집니다.
- 축삭은 소마 지름의 수십, 수백, 심지어 수만 배까지 연장할 수 있는 더 미세하고 케이블 같은 돌기입니다. 축삭은 주로 소마에서 신경 신호를 전달하고 몇 가지 종류의 정보를 소마로 다시 전달합니다. 많은 뉴런들은 축삭 하나만을 가지고 있지만, 이 축삭은 광범위한 분기를 거쳐 많은 표적 세포들과 통신할 수 있습니다. 축삭 중 소마에서 나오는 부분을 축삭 언덕이라고 합니다. 축삭 언덕은 해부학적 구조 외에도 전압에 의존하는 나트륨 채널의 밀도가 가장 높습니다. 이것은 뉴런의 가장 쉽게 흥분되는 부분과 축삭의 스파이크 개시 영역을 만듭니다. 전기 생리학적인 측면에서 가장 음의 역치 전위를 가지고 있습니다.
- 축삭과 축삭 언덕은 일반적으로 정보 유출에 관여하지만, 이 영역은 다른 뉴런으로부터 입력을 받을 수도 있습니다.
- 축삭 말단은 소마에서 가장 멀리 떨어진 축삭 끝에서 발견되며 시냅스를 포함합니다. 시냅스 부톤은 신경전달물질 화학물질이 방출되어 표적 뉴런과 소통하는 특수 구조물입니다. 축삭 말단에 있는 시냅스 부톤 외에도 뉴런은 축삭의 길이를 따라 위치한 통과 부톤을 가질 수 있습니다.
뉴런에 대한 일반적인 견해는 전용 기능을 다양한 해부학적 구성 요소에 기인하지만, 수상돌기와 축삭은 종종 소위 주 기능과 반대되는 방식으로 작용합니다.[8]
중추신경계의 축삭과 수상돌기는 일반적으로 약 1마이크로미터 두께에 불과하고, 말초신경계의 일부는 훨씬 두껍습니다. 소마는 보통 지름이 약 10-25 마이크로미터이고 종종 그것이 포함하고 있는 세포핵보다 훨씬 크지 않습니다. 인간 운동 뉴런의 가장 긴 축삭은 척추의 아래 부분부터 발끝까지 1미터 이상의 길이를 가질 수 있습니다.
감각신경세포는 성인의 경우 1.5미터가 넘는 척수 뒷기둥에서 발끝까지 이어지는 축삭을 가질 수 있습니다. 기린은 목의 전체 길이를 따라 수 미터 길이의 하나의 축삭을 가지고 있습니다. 축삭 기능에 대해 알려진 많은 것들은 오징어 거대 축삭을 연구하는 데서 비롯되는데, 오징어 거대 축삭은 비교적 거대한 크기(두께 0.5~1mm, 길이 수 센티미터) 때문에 이상적인 실험 준비물입니다.
완전히 분화된 뉴런은 영구적으로 유사분열[9] 후이지만, 성인 뇌에 존재하는 줄기세포는 유기체의 일생 동안 기능적 뉴런을 재생할 수 있습니다(신경 발생 참조). 성상세포는 별 모양의 신경교 세포입니다. 그들은 줄기세포와 같은 다능성의 특성으로 인해 신경세포로 변하는 것으로 관찰되었습니다.
멤브레인
모든 동물 세포와 마찬가지로 모든 뉴런의 세포체는 원형질막으로 둘러싸여 있는데, 원형질막에는 여러 종류의 단백질 구조가 내재되어 있습니다.[10] 지질 이중층은 강력한 전기 절연체이지만 뉴런에서는 막에 내장된 많은 단백질 구조가 전기적으로 활성화되어 있습니다. 여기에는 전기로 대전된 이온이 막을 가로질러 흐를 수 있도록 하는 이온 채널과 이온을 화학적으로 멤브레인 한쪽에서 다른 쪽으로 운반하는 이온 펌프가 포함됩니다. 대부분의 이온 채널은 특정 유형의 이온에만 투과됩니다. 일부 이온 채널은 전압 게이트로, 막 전체의 전압 차이를 변경하여 개방 상태와 폐쇄 상태 사이에서 전환할 수 있습니다. 다른 것들은 화학적으로 게이트되어 있는데, 이것은 세포외액을 통해 확산되는 화학물질과의 상호작용에 의해 열린 상태와 닫힌 상태 사이에서 전환될 수 있다는 것을 의미합니다. 이온 물질에는 나트륨, 칼륨, 염화물, 칼슘이 포함됩니다. 이온 채널과 이온 펌프 사이의 상호작용은 막을 가로질러 전압 차이를 발생시키며, 일반적으로 기준선에서 전압의 1/10보다 약간 적습니다. 이 전압은 두 가지 기능을 가지고 있습니다: 첫째, 막에 내장된 다양한 전압 의존적 단백질 기계의 전원을 제공하고, 둘째, 막의 다른 부분들 사이에서 전기적 신호 전달을 위한 기초를 제공합니다.
조직학 및 내부구조
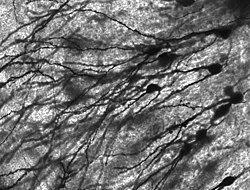

신경세포체를 호염성(염기를 좋아하는) 염료로 염색하면 니슬체(또는 니슬체)라고 불리는 미세한 덩어리가 많이 보입니다. 이 구조는 거친 소포체와 관련된 리보솜 RNA로 이루어져 있습니다. 독일의 정신과 의사이자 신경병리학자인 프란츠 니슬(Franz Nissl, 1860~1919)의 이름을 따서 명명된 이들은 단백질 합성에 관여하며, 신경세포가 대사적으로 매우 활발하다는 사실로 그 중요성을 설명할 수 있습니다. 아닐린 또는 (약하게[11]) 헤마톡실린과 같은 호염성 염료는 음전하를 띤 성분을 강조하여 리보솜 RNA의 인산염 골격에 결합합니다.
뉴런의 세포체는 신경섬유(neurofilament)라고 불리는 구조 단백질의 복잡한 그물망에 의해 지지되고, 신경세뇨관(neurotubule)과 함께 더 큰 신경섬유로 조립됩니다.[12] 일부 뉴런에는 나이가 들면서 축적되는 뉴로멜라닌(카테콜아민 합성의 부산물인 갈색-검은색 색소)과 리포푸신(노란색-갈색 색소)과 같은 색소 과립도 포함되어 있습니다.[13][14][15] 신경 기능에 중요한 다른 구조 단백질은 액틴과 미세소관의 튜불린입니다. 클래스 III β-튜불린은 거의 독점적으로 뉴런에서 발견됩니다. 액틴은 신경 발달 중 축삭과 수지상돌기의 끝에서 주로 발견됩니다. 여기서 액틴 역학은 미세소관과의 상호 작용을 통해 조절될 수 있습니다.[16]
축삭과 수지상 조직 사이에는 서로 다른 내부 구조적 특성이 있습니다. 일반적인 축삭은 초기 부분의 일부를 제외하고는 리보솜을 거의 포함하지 않습니다. 수지상 조직은 과립상 소포체 또는 리보솜을 포함하며, 세포체로부터 거리가 멀어짐에 따라 그 양이 감소합니다.
분류
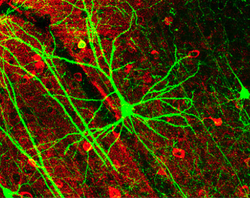
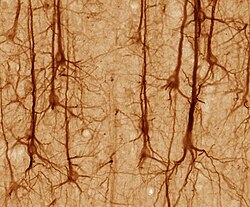
뉴런은 모양과 크기가 다양하며 형태와 기능에 따라 구분할 수 있습니다.[18] 해부학자 카밀로 골지는 뉴런을 두 가지 유형으로 분류했습니다: 긴 축삭을 가진 I형과 짧은 축삭을 가진 I형으로 종종 수지상 조직과 혼동될 수 있는 짧은 축삭을 가진 II형입니다. I형 세포는 소마의 위치에 따라 더 분류될 수 있습니다. 척추 운동 뉴런으로 대표되는 I형 뉴런의 기본 형태는 소마라는 세포체와 수초로 덮인 길고 가는 축삭으로 구성됩니다. 수지상 나무는 세포체를 감싸고 다른 뉴런으로부터 신호를 받습니다. 축삭의 말단에는 신경전달물질을 다음 뉴런의 말단과 수상돌기 사이의 시냅스 간극이라고 불리는 틈으로 방출하는 가지 축삭 말단이 있습니다.[citation needed]
구조구분
극성
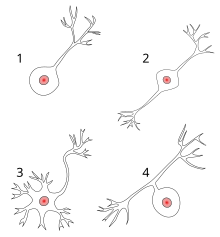
1 단극성 뉴런
2양극성 뉴런
3 다극성 뉴런
4 의사단극성 뉴런
대부분의 뉴런은 해부학적으로 다음과 같이 특징지어질 수 있습니다.[19]
- 단극성: 단일 공정. 단극성 세포는 전적으로 감각 뉴런입니다. 그들의 수상돌기는 때때로 자극 자체로부터 직접적으로 감각 정보를 받고 있습니다. 단극성 뉴런의 세포체는 항상 신경절에서 발견됩니다. 감각 수신은 말초 기능이므로 세포체는 신경절에서 중추신경계에 더 가깝지만 말초에 있습니다. 축삭은 수지상 말단에서 나와 신경절의 세포체를 지나 중추신경계로 돌출됩니다.
- 양극성: 축삭 1개와 수지상 1개. 그들은 주로 후각 상피와 망막의 일부에서 발견됩니다.
- 다극: 축삭 1개 및 수지상 2개 이상
- 아낙소닉: 축삭이 덴드라이트와 구별될 수 없는 경우
- Pseudunipolar: 축삭과 덴드라이트의 역할을 하는 1가지 과정
다른.
일부 독특한 신경세포 유형은 신경계에서의 위치와 독특한 모양에 따라 식별할 수 있습니다. 몇 가지 예는 다음과 같습니다.[citation needed]
- 소뇌 피질과 소뇌에서 발견되는, 표적 세포의 소마 주위에 촘촘한 말단의 플렉스를 형성하는 소엽 세포, 인터뉴론
- Betz 세포, 큰 운동 뉴런
- 루가로 세포(Lugaro cells), 소뇌의 내경막
- 중간 가시 뉴런, 대부분의 신경세포는 말뭉치에 있습니다.
- 골지I 다극성 뉴런의 일종인 소뇌의 거대한 뉴런인 푸르킨제 세포
- Pyramidal 세포, Golgi I의 일종인 삼각형 소마를 가진 뉴런
- Rosehip cells, Pyramidal cells와 상호 연결되는 독특한 인간 억제 뉴런
- 렌쇼 세포, 양쪽 끝이 알파 운동 뉴런과 연결된 뉴런
- 단극성 브러시 세포, 독특한 덴드라이트가 브러시 모양의 터프트로 끝나는 인터뉴런
- Golgi II 뉴런의 일종인 과립세포
- 척수에 위치한 전각세포, 운동신경세포
- 뇌의 광범위하게 분리된 부분을 연결하는 뇌간 세포인 방추세포
기능구분
방향
- 구심성 뉴런은 조직과 기관에서 중추신경계로 정보를 전달하며 감각 뉴런이라고도 합니다.
- 원심성 뉴런(운동 뉴런)은 중추신경계에서 이펙터 세포로 신호를 전달합니다.
- 인터뉴론은 중추신경계의 특정 영역 내에서 뉴런을 연결합니다.
구심력과 구심력은 일반적으로 각각 뇌에 정보를 가져오거나 뇌에서 정보를 보내는 뉴런을 말합니다.
다른 뉴런에 대한 작용
뉴런은 화학 수용체에 결합하는 신경 전달 물질을 방출함으로써 다른 뉴런에 영향을 미칩니다. 시냅스 후 뉴런에 대한 효과는 시냅스 전 뉴런이나 신경 전달 물질이 아니라 활성화되는 수용체의 종류에 따라 결정됩니다. 하나의 신경전달물질은 열쇠라고 생각할 수 있고, 하나의 수용체는 자물쇠라고 생각할 수 있습니다. 같은 신경전달물질이 여러 종류의 수용체를 활성화시킬 수 있습니다. 수용체는 크게 흥분성(발화율 증가 유발), 억제성(발화율 감소 유발), 조절성(발화율과 직접적인 관련이 없는 장기 효과 유발)으로 분류할 수 있습니다.[citation needed]
뇌에서 가장 흔한 두 가지(90%+) 신경전달물질인 글루타메이트와 GABA는 대체로 일관된 작용을 합니다. 글루타메이트는 여러 종류의 수용체에 작용하며, 흥분성 이온성 수용체와 대사성 수용체에서 조절 효과가 있습니다. 이와 유사하게 GABA는 여러 종류의 수용체에 작용하지만, 이들 모두는 (적어도 성체 동물에서는) 억제 효과를 가지고 있습니다. 이런 일관성 때문에 신경과학자들은 글루타메이트를 방출하는 세포를 '흥분성 뉴런'으로, GABA를 방출하는 세포를 '억제성 뉴런'으로 지칭하는 것이 일반적입니다. 다른 종류의 뉴런들은 일관된 효과를 가지고 있는데, 예를 들면, 척수에서 아세틸콜린을 방출하는 "흥분적인" 운동 뉴런과 글리신을 방출하는 "억제적인" 척추 뉴런이 있습니다.[citation needed]
흥분성 신경전달물질과 억제성 신경전달물질의 구분이 절대적인 것은 아닙니다. 오히려 시냅스 후 뉴런에 존재하는 화학 수용체의 종류에 따라 다릅니다. 원칙적으로, 단일 신경전달물질을 방출하는 단일 신경세포는 일부 표적에 흥분 효과를, 다른 표적에는 억제 효과를, 다른 표적에는 여전히 조절 효과를 가질 수 있습니다. 예를 들어, 망막에 있는 광수용체 세포는 빛이 없을 때 신경전달물질인 글루타메이트를 끊임없이 방출합니다. 소위 OFF 바이폴라 세포는 대부분의 뉴런과 마찬가지로 방출된 글루타메이트에 의해 흥분됩니다. 그러나 ON 양극성 세포라고 불리는 이웃 표적 뉴런은 전형적인 이온성 글루타메이트 수용체가 부족하고 대신 억제성 대사성 글루타메이트 수용체 부류를 발현하기 때문에 글루타메이트에 의해 억제됩니다.[20] 빛이 존재하면 광수용체는 글루타메이트의 방출을 중단하여 ON 바이폴라 세포의 억제를 완화시켜 활성화시키고, 동시에 OFF 바이폴라 세포에서 흥분을 제거하여 침묵시킵니다.[citation needed]
프리시냅틱 뉴런이 발현하는 단백질을 기반으로 프리시냅틱 뉴런이 포스트시냅틱 뉴런에 어떤 억제 효과를 가질지 확인할 수 있습니다. 파르발부민 발현 뉴런은 일반적으로 시냅스 후 뉴런의 출력 신호를 시각 피질에서 감쇠시키는 반면, 소마토스타틴 발현 뉴런은 일반적으로 시냅스 후 뉴런에 대한 수지상 입력을 차단합니다.[21]
방전패턴
뉴런은 고유한 막횡단 전압 진동 패턴과 같은 고유한 전기 반응 특성을 가지고 있습니다.[22] 따라서 뉴런은 전기생리학적 특성에 따라 분류할 수 있습니다.
- 강장제 또는 일반 스파이킹. 일부 뉴런은 일반적으로 일정한 주파수로 발사되며, 일반적으로 지속적으로 (음향적으로) 활성화됩니다. 예를 들어, 신경증에 있는 인터뉴런들.
- 단계적이거나 터지거나. 폭발적으로 발사되는 뉴런을 위상이라고 합니다.
- 빠른 스파이킹. 일부 뉴런은 높은 발사율로 유명합니다. 예를 들어, 일부 유형의 피질 억제 인터뉴론, 글로버스 팔리두스 세포, 망막 신경절 세포.[23][24]
신경전달물질
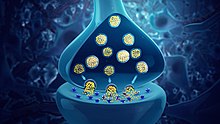
신경전달물질은 한 뉴런에서 다른 뉴런으로, 또는 근육세포나 선세포로 전달되는 화학적 메신저입니다.
- 콜린성 뉴런 – 아세틸콜린. 아세틸콜린은 시냅스 전 뉴런에서 시냅스 틈새로 방출됩니다. 리간드-게이트 이온 채널과 대사성(GPCR) 무스카린 수용체 모두에 대한 리간드 역할을 합니다. 니코틴 수용체는 니코틴을 결합하는 알파 소단위와 베타 소단위로 구성된 5량체 리간드-게이트 이온 채널입니다. 리간드 결합은 Na+ 탈분극의 유입을 유발하는 채널을 열고 시냅스 전 신경전달물질 방출 확률을 높입니다. 아세틸콜린은 콜린과 아세틸 조효소 A로부터 합성됩니다.
- 아드레날린 신경세포 – 노르아드레날린. 노르아드레날린(노레피네프린)은 교감신경계의 대부분의 신경절 후 신경절 후 신경세포에서 알파 아드레날린 수용체와 베타 아드레날린 수용체라는 두 세트의 GPCR로 방출됩니다. 노르아드레날린은 3대 카테콜아민 신경전달물질 중 하나로 말초신경계에 가장 많이 존재하며, 다른 카테콜아민과 마찬가지로 티로신으로부터 합성됩니다.
- GABAergic 뉴런 – 감마 아미노부티르산. GABA는 글리신과 함께 중추신경계의 두 가지 신경억제제 중 하나입니다. GABA는 ACh와 상동적인 기능을 가지고 있으며−, 이는 Cl 이온이 시냅스 후 뉴런으로 들어갈 수 있도록 하는 음이온 채널을 게이트합니다. Cl은− 뉴런 내에서 과분극을 일으켜 전압이 음이 될수록 활동 전위가 발사될 확률을 낮춥니다(활동 전위가 발사되려면 양의 전압 임계값에 도달해야 합니다). GABA는 글루타메이트 탈탄산효소에 의해 글루타메이트 신경전달물질로부터 합성됩니다.
- 글루타메이트 신경세포 – 글루타메이트. 글루타메이트는 아스파르테이트와 함께 두 가지 주요 흥분성 아미노산 신경전달물질 중 하나입니다. 글루타메이트 수용체는 4가지 분류 중 하나로, 그 중 3가지는 리간드-게이트 이온 채널이고 그 중 1가지는 G-단백질 결합 수용체(GPCR이라고도 함)입니다.
- 도파민 신경세포—도파민. 도파민은 cAMP와 PKA를 증가시키는 D1형(D1, D5) Gs 결합 수용체와 cAMP와 PKA를 감소시키는 Gi 결합 수용체를 활성화시키는 D2형(D2, D3, D4) 수용체에 작용하는 신경전달물질입니다. 도파민은 기분과 행동에 연결되어 시냅스 전, 후 신경 전달을 모두 조절합니다. 실질 니그라의 도파민 신경세포 손실은 파킨슨병과 관련이 있습니다. 도파민은 아미노산 티로신으로부터 합성됩니다. 티로신은 티로신 수산화효소에 의해 레보도파(또는 L-DOPA)로 촉매되고, 레보도파는 방향족 아미노산 탈탄산효소에 의해 도파민으로 전환됩니다.
- 세로토닌 신경세포—세로토닌. 세로토닌(5-Hydroxytryptamine, 5-HT)은 흥분성 또는 억제성 역할을 할 수 있습니다. 4개의 5-HT 수용체 그룹 중 3개는 GPCR이고 1개는 리간드-게이트 양이온 채널입니다. 세로토닌은 트립토판 하이드록실화효소에 의해 트립토판으로부터 합성되고, 그리고 나서 탈카르복실화효소에 의해 더 합성됩니다. 시냅스 후 뉴런에서 5-HT의 부족은 우울증과 관련이 있습니다. 프로작이나 졸로프트처럼 시냅스 전 세로토닌 수송체를 차단하는 약물이 치료에 사용됩니다.
- 퓨린 신경세포-ATP. ATP는 리간드-게이트 이온 채널(P2X 수용체)과 GPCR(P2Y) 수용체 모두에서 작용하는 신경전달물질입니다. 그러나 ATP는 공동 전달체로 가장 잘 알려져 있습니다. 이러한 퓨린성 신호전달은 특히 P2Y 수용체에서 작용하는 아데노신과 같은 다른 퓨린에 의해 매개될 수도 있습니다.
- 히스타민 신경세포-히스타민. 히스타민은 모노아민 신경 전달 물질이자 신경 조절제입니다. 히스타민을 생성하는 뉴런은 시상하부의 결핵성 유핵에서 발견됩니다.[25] 히스타민은 각성 및 수면/잠 깨기 행동에 관여합니다.
다모델구분
2012년부터 세포 및 계산 신경 과학계로부터 뇌의 모든 뉴런뿐만 아니라 종에 걸쳐 적용될 보편적인 뉴런 분류를 제안하기 위한 압력이 있었습니다. 이는 모든 뉴런의 세 가지 필수 특성인 전기생리학, 형태학, 세포의 개별 전사체를 고려하여 수행됩니다. 이 분류는 보편적일 뿐만 아니라 성상교세포도 분류할 수 있다는 장점이 있습니다. 세 가지 품질을 한 번에 측정할 수 있는 패치-시퀀싱(patch-sequencing)이라고 불리는 방법은 앨런 뇌 과학 연구소에서 광범위하게 사용되고 있습니다.[26] 2023년에는 최첨단 분자생물학 접근법을 이용한 연구자들의 국제적 협업을 통해 전사, 후성유전학, 기능 수준의 인간 뇌를 발달시키는 성인의 포괄적인 세포 지도를 만들었습니다.[27]
커넥티비티
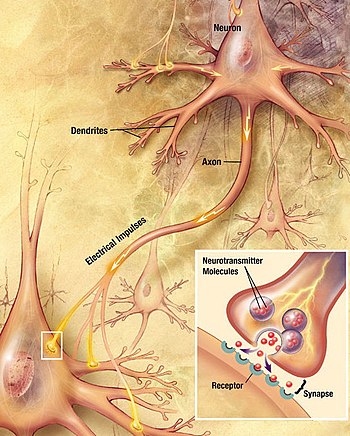

뉴런은 시냅스를 통해 서로 의사소통하며, 여기서 한 세포의 축삭 말단은 다른 뉴런의 덴드라이트, 소마 또는 덜 일반적으로 축삭과 접촉합니다. 소뇌의 푸르킨제 세포와 같은 뉴런은 1000개 이상의 수지상 가지를 가지고 있어 수만 개의 다른 세포와 연결될 수 있고, 다른 뉴런들, 예를 들어 광상핵의 자기세포 뉴런은 1~2개의 수지상 가지를 가지고 있으며, 각각은 수천 개의 시냅스를 받습니다.
시냅스는 자극적이거나 억제적일 수 있으며, 표적 뉴런의 활동을 증가시키거나 감소시킵니다. 일부 뉴런은 또한 세포 사이의 직접적인 전기 전도 접합인 전기 시냅스를 통해 통신합니다.[28]
활동전위가 축삭단자에 도달하면 전압으로 연결된 칼슘 채널을 열어 칼슘 이온이 단자로 들어갈 수 있습니다. 칼슘은 신경전달물질 분자로 채워져 있는 시냅스 소포체를 막과 융합시켜 그 내용물을 시냅스 틈새로 방출합니다. 신경전달물질은 시냅스 틈새를 가로질러 확산되고 시냅스 후 뉴런의 수용체를 활성화합니다. 축삭 말단의 높은 세포질 칼슘은 미토콘드리아 칼슘 흡수를 유발하고, 이는 차례로 미토콘드리아 에너지 대사를 활성화하여 ATP를 생성하여 지속적인 신경 전달을 지원합니다.[29]
시냅스는 뉴런의 축삭이 자신의 수상돌기에 연결되는 시냅스입니다.
인간의 뇌는 약 8.6 x 1010 (80억 개)의 뉴런을 가지고 있습니다.[30][31] 각 뉴런은 평균적으로 7,000개의 다른 뉴런과 시냅스 연결을 합니다. 세 살짜리 아이의 뇌는 약 10개의15 시냅스(1경분의 1)를 가지고 있는 것으로 추정되었습니다. 이 숫자는 나이가 들수록 감소하고, 성인이 되면 안정됩니다. 성인의 추정치는 1014 ~ 5 x 1014 시냅스(100 ~ 500조)로 다양합니다.[32]
전기화학적 신호 없음
연구에 따르면 건강한 인간 뇌의 뉴런은 전기적, 화학적 신호 전달 외에도 다음을 통해 의사소통을 할 수 있다고 합니다.
그들은 또한 환경으로부터의 입력과 유기체의 다른 부분으로부터 방출된 호르몬에 의해 조절될 수 있는데,[36] 이는 뉴런에 의해 다소 직접적인 영향을 받을 수 있습니다. 이는 BDNF와 같은 뉴로트로핀에도 적용됩니다. 장내 마이크로바이옴은 뇌와도 연결되어 있습니다.[37] 뉴런은 또한 "체성 접합부"라고 불리는 특수한 접촉 부위를 통해 뇌의 주요 면역 세포인 미세아교세포와 소통합니다. 이러한 연결을 통해 미세아교세포는 신경 기능을 지속적으로 모니터링하고 조절할 수 있으며, 필요할 때 신경 보호 기능을 발휘할 수 있습니다.[38]
활동전위를 전파하는 메커니즘
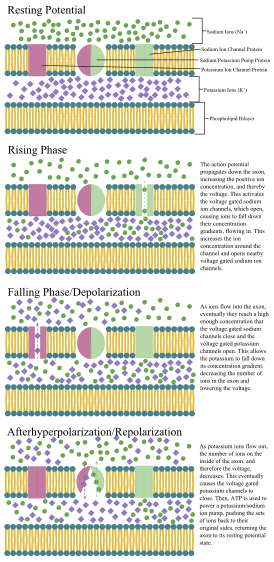
1937년 존 재커리 영은 오징어 거대 축삭이 신경 전기적 특성을 연구하는 데 사용될 수 있다고 제안했습니다.[39] 크기는 인간의 뉴런보다 크지만 비슷해서 공부하기 편합니다. 오징어 거대 축삭에 전극을 삽입하여 막 전위를 정확하게 측정했습니다.
축삭과 소마의 세포막에는 뉴런이 전기적 신호(활동전위)를 생성하고 전파할 수 있도록 하는 전압 개폐 이온 채널이 포함되어 있습니다. 일부 뉴런은 역치 이하의 막 전위 진동도 발생시킵니다. 이러한 신호는 나트륨(Na+), 칼륨(K+), 염화물(Cl−) 및 칼슘(Ca2+)을 포함한 전하 운반 이온에 의해 생성되고 전파됩니다.
압력, 스트레치, 화학적 전달, 세포막에 걸친 전위의 변화를 포함한 여러 자극이 전기적 활동으로 이어지는 뉴런을 활성화시킬 수 있습니다.[40] 자극은 세포막 내의 특정 이온 채널을 열어 세포막을 통한 이온의 흐름으로 이어져 막 전위를 변화시킵니다. 뉴런은 뉴런의 유형을 정의하는 특정한 전기적 특성을 유지해야 합니다.[41]
얇은 뉴런과 축삭은 활동 전위를 생성하고 운반하는 데 대사 비용이 적게 들지만, 두꺼운 축삭은 자극을 더 빠르게 전달합니다. 빠른 전도를 유지하면서 대사 비용을 최소화하기 위해 많은 뉴런은 축삭 주위에 수초의 절연 피복을 가지고 있습니다. 신경초는 신경교세포, 즉 중추신경계의 올리고덴드로세포와 말초신경계의 슈반세포에 의해 형성됩니다. 칼집을 사용하면 에너지를 덜 사용하면서 동일한 직경의 밀릴화되지 않은 축삭보다 활동 전위가 더 빠르게 이동할 수 있습니다. 말초신경의 미엘린 피복은 일반적으로 축삭을 따라 약 1 mm 길이의 섹션으로 진행되며, 고밀도의 전압 개폐 이온 채널을 포함하는 Ranvier의 피복되지 않은 노드에 의해 구멍이 뚫립니다. 다발성 경화증은 중추신경계의 축삭이 탈수초화되어 발생하는 신경학적 장애입니다.
일부 뉴런은 활동전위를 생성하지 않고 등급화된 전기신호를 생성하여 등급화된 신경전달물질을 방출합니다. 그러한 스파이킹을 하지 않는 뉴런은 먼 거리에서 신호를 전달할 수 없기 때문에 감각 뉴런이나 인터뉴런인 경향이 있습니다.
뉴럴 코딩
신경 코딩은 감각 및 기타 정보가 뉴런에 의해 뇌에서 어떻게 표현되는지에 관한 것입니다. 신경 코딩을 연구하는 주요 목표는 자극과 개별 또는 앙상블 뉴런 반응 사이의 관계, 앙상블 내 뉴런의 전기적 활동 사이의 관계를 특성화하는 것입니다.[42] 뉴런은 디지털 정보와 아날로그 정보를 모두 인코딩할 수 있다고 생각됩니다.[43]
올 오어 낫 원론
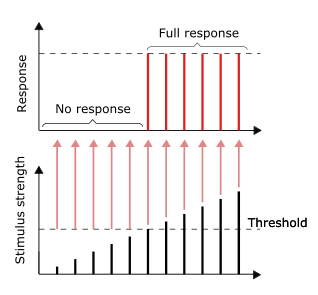
신경 자극의 전도는 모두 혹은 전혀 반응이 없는 예입니다. 다시 말해서, 뉴런이 반응을 하면, 그것은 완전히 반응을 해야만 합니다. 더 밝은 이미지/더 큰 소리처럼 더 큰 자극 강도는 더 강한 신호를 생성하지 않지만 발사 주파수를 증가시킬 수 있습니다.[44]: 31 수용체는 자극에 대해 다른 방식으로 반응합니다. 천천히 적응하는 오르토닉 수용체는 꾸준한 자극에 반응하여 꾸준한 발사 속도를 냅니다. 강직성 수용체는 대개 초당 충동에 대해 표시된 자극의 멱함수로서 발사 빈도를 증가시킴으로써 자극의 강도 증가에 가장 자주 반응합니다. 이것은 광자가 특정 주파수에 대해 "더 강해질" 수 없기 때문에 특정 주파수(컬러)의 강도가 높을수록 더 많은 광자가 필요한 빛의 고유한 특성에 비유될 수 있습니다.
다른 수용체 유형에는 빠른 적응 또는 단계적 수용체가 포함되며, 꾸준한 자극으로 발사가 감소하거나 중단됩니다. 예를 들어, 만지면 뉴런이 발사되지만 물체가 균일한 압력을 유지하면 뉴런이 발사를 중단하는 피부가 포함됩니다. 압력과 진동에 반응하는 피부와 근육의 뉴런은 기능을 돕는 여과 부속 구조를 가지고 있습니다.
pacinian corpuscular가 그러한 구조 중 하나입니다. 그것은 축삭 말단 주위에 형성되는 양파와 같은 동심원 층을 가지고 있습니다. 압력이 가해져서 말뭉치가 변형되면 기계적인 자극이 축삭으로 전달되고, 축삭은 발사됩니다. 압력이 일정하면 자극이 끝납니다. 따라서 일반적으로 이 뉴런들은 초기 변형 동안 일시적인 탈분극으로 반응하고 압력이 제거되면 다시 분자의 모양이 변합니다. 다른 유형의 적응은 여러 다른 뉴런의 기능을 확장하는 데 중요합니다.[45]
어원과 철자
독일의 해부학자 하인리히 빌헬름 발데이어는 고대 그리스 νεῦρον 뉴런의 정강이, 제대, 신경에 기초하여 1891년에 뉴런이라는 용어를 도입했습니다.
이 단어는 프랑스어에서 철자 뉴론과 함께 채택되었습니다. 그 철자법은 영어권의 많은 작가들에 의해서도 사용되었지만,[48] 지금은 미국의 사용법에서는 드물고 영국의 사용법에서는 흔하지 않게 되었습니다.[49][47]
역사
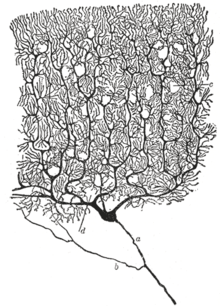
신경계의 주요 기능 단위로서 뉴런의 위치는 19세기 후반 스페인 해부학자 산티아고 라모니 카할의 연구를 통해 처음 인식되었습니다.[50]
라모니 카할은 각각의 뉴런의 구조를 가시적으로 만들기 위해 카밀로 골지에 의해 개발된 은 염색 과정을 개선했습니다.[50] 개선된 공정에는 "이중 함침"이라는 기술이 포함되어 있으며 현재도 사용되고 있습니다.
1888년에 Ramóny Cajal은 새의 소뇌에 관한 논문을 발표했습니다. 이 논문에서 그는 축삭과 수상돌기 사이의 문합에 대한 증거를 찾을 수 없다며 각각의 신경 요소를 "절대적으로 자율적인 칸톤"이라고 말했습니다.[50][46] 이것은 현대 신경과학의 중심 신조 중 하나인 뉴런 독트린으로 알려지게 되었습니다.[50]
1891년 독일의 해부학자 하인리히 빌헬름 발데이어는 신경계의 해부학적, 생리학적 단위를 설명하기 위해 뉴런이라는 용어를 도입한 뉴런 교리에 대한 매우 영향력 있는 리뷰를 썼습니다.[51][52]
은 함침 얼룩은 알려지지 않은 이유로 조직 내 세포의 극히 일부만을 염색하여 개별 뉴런의 완전한 미세 구조를 다른 세포와 크게 겹치지 않고 노출시키기 때문에 신경해부학적 연구에 유용한 방법입니다.[53]
뉴런 독트린

뉴런 교리는 뉴런이 신경계의 기본적인 구조적, 기능적 단위라는 지금의 기본적인 생각입니다. 이 이론은 19세기 후반 산티아고 라모니 카할에 의해 제시되었습니다. 그것은 뉴런이 (메쉬워크로 연결되지 않은) 별개의 세포이며, 대사적으로 구별되는 단위로 작용한다고 주장했습니다.
나중에 발견된 것들은 그 교리에 대한 개선점을 산출했습니다. 예를 들어, 신경세포가 아닌 신경교세포는 정보처리에 필수적인 역할을 합니다.[54] 또한 전기적 시냅스는 뉴런 사이의 직접적인 세포질 연결을 [55]포함하여 이전에 생각했던 것보다 더 일반적입니다. 사실, 뉴런은 훨씬 더 긴밀한 결합을 형성할 수 있습니다: 오징어 거대 축삭은 여러 축삭의 융합에서 비롯됩니다.[56]
라모니 카할(Ramóny Cajal)은 또한 뉴런이 수지상과 세포체에서 신호를 받아 축삭을 따라 세포체에서 한 방향으로 신호를 전달한다는 동적 분극의 법칙을 가정했습니다.[57] 동적 분극의 법칙은 중요한 예외를 가지고 있습니다. 덴드라이트는 뉴런의[58] 시냅스 출력 사이트 역할을 하고 축삭은 시냅스 입력을 받을 수 있습니다.[59]
뉴런의 구획 모델링
뉴런은 종종 뇌의 "근본적인 단위"로 묘사되지만, 그들은 내부 계산을 수행합니다. 뉴런은 수지상 조직 내에서 입력을 통합하고, 이 복잡성은 뉴런을 기본 단위로 가정하는 모델에서 손실됩니다. 수지상 가지는 수동 막 특성으로 인해 활성이 관련된 공간 구획으로 모델링될 수 있지만 시냅스로부터의 입력에 따라 다를 수도 있습니다. 덴드라이트의 구획 모델링은 Drosophila melanogaster의 경우처럼 전극으로 기록하기에는 너무 작은 뉴런의 행동을 이해하는 데 특히 도움이 됩니다.[60]
뇌의 뉴런
뇌의 뉴런 수는 종에 따라 극적으로 다릅니다.[61] 인간의 경우 대뇌 피질에는 100억에서 200억 개의 뉴런이, 소뇌에는 55억에서 700억 개의 뉴런이 있는 것으로 추정됩니다.[62] 대조적으로, 선충충인 예쁜꼬마선충은 단지 302개의 뉴런을 가지고 있어서, 과학자들이 모든 뉴런의 지도를 만들 수 있었기 때문에 이상적인 모델 유기체입니다. 생물학적 실험에서 흔히 볼 수 있는 초파리는 약 10만 개의 뉴런을 가지고 있으며 많은 복잡한 행동을 보입니다. 이온 채널 구성에 사용되는 신경 전달 물질의 유형부터 이온 채널 구성에 이르기까지 뉴런의 많은 특성이 종에 걸쳐 유지되므로 과학자들은 훨씬 더 간단한 실험 시스템에서 더 복잡한 유기체에서 발생하는 과정을 연구할 수 있습니다.
신경학적 장애
샤르코트-마리-치아질환(CMT)은 이질적인 유전성 신경질환(neurophathy)으로, 주로 진행된 단계에서 손과 팔로 이어지는 발과 다리에 근육 조직의 손실과 촉각을 특징으로 합니다. 현재 치료가 불가능한 이 질병은 10만 명 중 36명이 발병할 정도로 가장 흔한 유전성 신경 질환 중 하나입니다.[63]
알츠하이머병(Alzheimer's disease, AD)은 단순히 알츠하이머병으로 알려져 있으며, 일상생활의 활동이 감소하고 신경정신과적 증상이나 행동의 변화와 함께 점진적인 인지 기능의 저하를 특징으로 하는 신경퇴행성 질환입니다.[64] 가장 두드러진 초기 증상은 단기 기억 상실(기억상실증)이며, 보통 질병 진행에 따라 점점 더 뚜렷해지는 경미한 건망증으로 나타나며, 오래된 기억이 상대적으로 보존됩니다. 장애가 진행됨에 따라 인지(지적) 장애는 언어(아파시아), 숙련된 동작(아프락시아), 인식(아그노시아)의 영역으로 확장되며 의사결정 및 계획과 같은 기능이 손상됩니다.[65][66]
파킨슨병(Parkinsons)은 파킨슨병(Parkinsons)이라고도 알려진 중추신경계의 퇴행성 질환으로, 운동 능력과 언어 능력을 종종 손상시킵니다.[67] 파킨슨병은 운동장애라고 불리는 질환군에 속합니다.[68] 근육의 경직, 떨림, 신체적 움직임의 둔화(bradykinesia), 극단적인 경우에는 신체적 움직임의 상실(akinesia)이 특징입니다. 주요 증상은 기저 신경절에 의한 운동 피질의 자극 감소의 결과로, 일반적으로 뇌의 도파민 신경세포에서 생성되는 도파민의 형성과 작용이 불충분하기 때문에 발생합니다. 이차적인 증상으로는 높은 수준의 인지 기능 장애와 미묘한 언어 문제가 있을 수 있습니다. PD는 만성적이면서도 진보적입니다.
근위축증은 단순한 활동 중에 요동치는 근육 약화와 피로감으로 이어지는 신경근육 질환입니다. 허약은 일반적으로 시냅스 후 신경근육 접합부에서 아세틸콜린 수용체를 차단하는 항체를 순환시켜 신경전달물질인 아세틸콜린의 자극 효과를 억제함으로써 발생합니다. 근감소증은 면역억제제, 콜린에스테라제 억제제 및 선택된 경우 흉선 절제술로 치료됩니다.
디멜리네이션

탈수초란 신경을 절연하는 수초피의 소실, 즉 탈수초피의 소실을 말합니다. 미엘린이 저하되면 신경을 따라 신호가 전달되는 것이 손상되거나 소실될 수 있고, 결국 신경은 시들해집니다. 이것은 다발성 경화증과 만성 염증성 탈수초성 다발성 신경병증과 같은 특정 신경 퇴행성 질환으로 이어집니다.
축삭변성
대부분의 손상 반응에는 절단된 부분의 재봉입을 촉진하는 칼슘 유입 신호가 포함되지만 축삭 손상은 초기에 급성 축삭 변성으로 이어지는데, 이는 손상 후 30분 이내에 발생합니다.[69] 축삭종이 붓는 것과 함께 변성이 뒤따르고, 결국 구슬과 같은 형성으로 이어집니다. 축삭 세포골격과 내부 소기관의 과립 분해는 축삭막 분해 후에 발생합니다. 초기 변화에는 부상 부위의 파라노달 영역에 미토콘드리아가 축적되는 것이 포함됩니다. 소포체가 분해되고 미토콘드리아가 부풀어 올라 결국 분해됩니다. 분해는 유비퀴틴과 칼페인 단백질분해효소(칼슘 이온의 유입으로 인해 발생)에 의존하며, 축삭 변성은 완전한 단편화를 생성하는 활성 과정임을 시사합니다. 이 과정은 PNS에서는 약 24시간이 걸리고 CNS에서는 더 오래 걸립니다. 액솔종 변성으로 이어지는 신호 전달 경로는 알려져 있지 않습니다.
신경발생학
신경줄기세포가 분열해 분화된 신경세포를 만들어내는 신경생성 과정을 통해 뉴런이 탄생합니다. 완전히 분화된 뉴런이 형성되면 더 이상 유사분열을 겪을 수 없습니다. 신경발생은 대부분의 유기체의 배아에서 주로 발생합니다.
성인 신경 발생이 일어날 수 있으며 인간 뉴런의 나이에 대한 연구에 따르면 이러한 과정은 소수의 세포에서만 발생하며, 신피질의 대다수 뉴런은 태어나기 전에 형성되어 교체 없이 지속됩니다. 성인 신경 발생이 인간에게 어느 정도 존재하는지, 인지에 대한 기여는 2018년 상반된 보고서가 발표되는 등 논란이 되고 있습니다.[70]
몸 안에는 신경세포로 분화할 수 있는 능력을 가진 다양한 줄기세포가 들어 있습니다. 연구원들은 "세포들이 새로운 정체성을 채택하도록 강요받는" 전환분화를 이용하여 인간의 피부 세포를 신경 세포로 변형시키는 방법을 발견했습니다.[71]
포유류의 뇌에서 신경 발생 동안 전구 세포와 줄기 세포는 증식 분열에서 분화 분열로 진행됩니다. 이 진행은 피질층을 채우는 뉴런과 신경교로 이어집니다. 후성유전학적 변형은 신경줄기세포를 분화시키는 데 있어 유전자 발현을 조절하는 데 핵심적인 역할을 하며, 발달 중인 포유류 뇌와 성체 뇌의 세포 운명 결정에 중요합니다. 후생유전학적 변형은 DNA 시토신 메틸화를 포함하여 5-메틸시토신을 형성하고 5-메틸시토신 탈메틸화를 형성합니다.[72] 이러한 변형은 발달 중인 포유류 뇌와 성체의 세포 운명을 결정하는 데 중요합니다. DNA 시토신 메틸화는 DNA 메틸트랜스퍼라제(DNMT)에 의해 촉매됩니다. 메틸사이토신 탈메틸화는 산화 반응(예: 5-메틸사이토신에서 5-하이드록시메틸사이토신으로의 5-메틸사이토신)을 수행하는 TET 효소 및 DNA 염기 절제 복구(BER) 경로의 효소에 의해 여러 단계에서 촉매됩니다.[72]
포유류 신경계 발달의 다른 단계에서 DNA 이중 가닥 파손의 복구에 두 가지 DNA 복구 과정이 사용됩니다. 이러한 경로는 신경 전구 세포의 증식에 사용되는 상동 재조합 복구(homologous recombination repair)이며, 비-상동 말단 접합(non-homologous end jointing)은 주로 후기 발달[73] 단계에서 사용됨
발달 중인 뉴런과 미세아교세포 사이의 세포간 의사소통은 적절한 신경생성과 뇌발달에도 필수불가결합니다.[74]
신경재생
말초 축삭은 잘리면 다시 자랄 수 있지만,[75] 하나의 뉴런은 기능적으로 다른 종류의 뉴런으로 대체될 수 없습니다(Linás' law).[22]
참고 항목
참고문헌
- ^ https://www.cell.com/cell/fulltext/S0092-8674(23)00917-0
- ^ Zayia LC, Tadi P. 신경해부학, 운동신경세포. [2022년 7월 25일 업데이트] 인: 통계분석 진주 [인터넷]. 보물섬(FL): 스탯펄스 출판; 2023년 1월-. 사용처: https://www.ncbi.nlm.nih.gov/books/NBK554616/
- ^ a b 제달리스 J. and Eggebrecht J. (2018, 3월 8일) AP® 과정 26.1 신경세포 및 신경교세포를 위한 생물학. OpenStax https://openstax.org/books/biology-ap-courses/pages/26-1-neurons-and-glial-cells (2023년 8월 15일 접속).
- ^ Moore, Keith; Dalley, Arthur (2005). Clinically Oriented Anatomy (5th ed.). LWW. pp. 47. ISBN 0-7817-3639-0.
A bundle of nerve fibers (axons) connecting neighboring or distant nuclei of the CNS is a tract.
- ^ "What are the parts of the nervous system?". October 2018. Retrieved 2022-07-08.
- ^ Davies, Melissa (2002-04-09). "The Neuron: size comparison". Neuroscience: A journey through the brain. Retrieved 2009-06-20.
- ^ Chudler EH. "Brain Facts and Figures". Neuroscience for Kids. Retrieved 2009-06-20.
- ^ "16.7: Nervous System". Biology LibreTexts. 2021-01-14. Retrieved 2022-02-28.
- ^ Herrup K, Yang Y (May 2007). "Cell cycle regulation in the postmitotic neuron: oxymoron or new biology?". Nature Reviews. Neuroscience. 8 (5): 368–78. doi:10.1038/nrn2124. PMID 17453017. S2CID 12908713.
- ^ Giménez, C. (February 1998). "[Composition and structure of the neuronal membrane: molecular basis of its physiology and pathology]". Revista de Neurologia. 26 (150): 232–239. ISSN 0210-0010. PMID 9563093.
- ^ State Hospitals Bulletin. State Commission in Lunacy. 1897. p. 378.
- ^ "Medical Definition of Neurotubules". www.merriam-webster.com.
- ^ Zecca L, Gallorini M, Schünemann V, Trautwein AX, Gerlach M, Riederer P, Vezzoni P, Tampellini D (March 2001). "Iron, neuromelanin and ferritin content in the substantia nigra of normal subjects at different ages: consequences for iron storage and neurodegenerative processes". Journal of Neurochemistry. 76 (6): 1766–73. doi:10.1046/j.1471-4159.2001.00186.x. PMID 11259494. S2CID 31301135.
- ^ Herrero MT, Hirsch EC, Kastner A, Luquin MR, Javoy-Agid F, Gonzalo LM, Obeso JA, Agid Y (1993). "Neuromelanin accumulation with age in catecholaminergic neurons from Macaca fascicularis brainstem". Developmental Neuroscience. 15 (1): 37–48. doi:10.1159/000111315. PMID 7505739.
- ^ Brunk UT, Terman A (September 2002). "Lipofuscin: mechanisms of age-related accumulation and influence on cell function". Free Radical Biology & Medicine. 33 (5): 611–9. doi:10.1016/s0891-5849(02)00959-0. PMID 12208347.
- ^ Zhao B, Meka DP, Scharrenberg R, König T, Schwanke B, Kobler O, Windhorst S, Kreutz MR, Mikhaylova M, Calderon de Anda F (August 2017). "Microtubules Modulate F-actin Dynamics during Neuronal Polarization". Scientific Reports. 7 (1): 9583. Bibcode:2017NatSR...7.9583Z. doi:10.1038/s41598-017-09832-8. PMC 5575062. PMID 28851982.
- ^ Lee WC, Huang H, Feng G, Sanes JR, Brown EN, So PT, Nedivi E (February 2006). "Dynamic remodeling of dendritic arbors in GABAergic interneurons of adult visual cortex". PLOS Biology. 4 (2): e29. doi:10.1371/journal.pbio.0040029. PMC 1318477. PMID 16366735.
- ^ Al, Martini, Frederic Et (2005). Anatomy and Physiology' 2007 Ed.2007 Edition. Rex Bookstore, Inc. p. 288. ISBN 978-971-23-4807-5.
{{cite book}}: CS1 maint: 다중 이름: 저자 목록 (링크) - ^
 이 문서에는 CC BY 4.0 라이센스에 따라 사용 가능한 텍스트가 포함되어 있습니다. Betts, J Gordon; Desaix, Peter; Johnson, Eddie; Johnson, Jody E; Korol, Oksana; Kruse, Dean; Poe, Brandon; Wise, James; Womble, Mark D; Young, Kelly A (June 8, 2023). Anatomy & Physiology. Houston: OpenStax CNX. 12.2 Nervous tissue. ISBN 978-1-947172-04-3.
이 문서에는 CC BY 4.0 라이센스에 따라 사용 가능한 텍스트가 포함되어 있습니다. Betts, J Gordon; Desaix, Peter; Johnson, Eddie; Johnson, Jody E; Korol, Oksana; Kruse, Dean; Poe, Brandon; Wise, James; Womble, Mark D; Young, Kelly A (June 8, 2023). Anatomy & Physiology. Houston: OpenStax CNX. 12.2 Nervous tissue. ISBN 978-1-947172-04-3. - ^ Gerber U (January 2003). "Metabotropic glutamate receptors in vertebrate retina". Documenta Ophthalmologica. Advances in Ophthalmology. 106 (1): 83–7. doi:10.1023/A:1022477203420. PMID 12675489. S2CID 22296630.
- ^ Wilson NR, Runyan CA, Wang FL, Sur M (August 2012). "Division and subtraction by distinct cortical inhibitory networks in vivo". Nature. 488 (7411): 343–8. Bibcode:2012Natur.488..343W. doi:10.1038/nature11347. hdl:1721.1/92709. PMC 3653570. PMID 22878717.
- ^ a b Llinás RR (2014-01-01). "Intrinsic electrical properties of mammalian neurons and CNS function: a historical perspective". Frontiers in Cellular Neuroscience. 8: 320. doi:10.3389/fncel.2014.00320. PMC 4219458. PMID 25408634.
- ^ Kolodin YO, Veselovskaia NN, Veselovsky NS, Fedulova SA. Ion conductances related to shaping the repetitive firing in rat retinal ganglion cells. Acta Physiologica Congress. Archived from the original on 2012-10-07. Retrieved 2009-06-20.
- ^ "Ionic conductances underlying excitability in tonically firing retinal ganglion cells of adult rat". Ykolodin.50webs.com. 2008-04-27. Retrieved 2013-02-16.
- ^ Scammell TE, Jackson AC, Franks NP, Wisden W, Dauvilliers Y (January 2019). "Histamine: neural circuits and new medications". Sleep. 42 (1). doi:10.1093/sleep/zsy183. PMC 6335869. PMID 30239935.
- ^ "Patch-seq technique helps depict the variation of neural cells in the brain". News-medical.net. 3 December 2020. Retrieved 26 August 2021.
- ^ Science AAAS. "BRAIN CELL CENSUS". Retrieved 2023-10-17.
- ^ Macpherson, Gordon (2002). Black's Medical Dictionary (40 ed.). Lanham, MD: Scarecrow Press. pp. 431–434. ISBN 0810849844.
- ^ Ivannikov MV, Macleod GT (June 2013). "Mitochondrial free Ca²⁺ levels and their effects on energy metabolism in Drosophila motor nerve terminals". Biophysical Journal. 104 (11): 2353–61. Bibcode:2013BpJ...104.2353I. doi:10.1016/j.bpj.2013.03.064. PMC 3672877. PMID 23746507.
- ^ Herculano-Houzel S (November 2009). "The human brain in numbers: a linearly scaled-up primate brain". Frontiers in Human Neuroscience. 3: 31. doi:10.3389/neuro.09.031.2009. PMC 2776484. PMID 19915731.
- ^ "Why is the human brain so difficult to understand? We asked 4 neuroscientists". Allen Institute. Retrieved 17 October 2023.
- ^ Drachman DA (June 2005). "Do we have brain to spare?". Neurology. 64 (12): 2004–5. doi:10.1212/01.WNL.0000166914.38327.BB. PMID 15985565. S2CID 38482114.
- ^ Ucar, Hasan; Watanabe, Satoshi; Noguchi, Jun; Morimoto, Yuichi; Iino, Yusuke; Yagishita, Sho; Takahashi, Noriko; Kasai, Haruo (December 2021). "Mechanical actions of dendritic-spine enlargement on presynaptic exocytosis". Nature. 600 (7890): 686–689. Bibcode:2021Natur.600..686U. doi:10.1038/s41586-021-04125-7. ISSN 1476-4687. PMID 34819666. S2CID 244648506.
요약 표시:
"Forceful synapses reveal mechanical interactions in the brain". Nature. 24 November 2021. doi:10.1038/d41586-021-03516-0. Retrieved 21 February 2022. - ^ "Researchers discover new type of cellular communication in the brain". The Scripps Research Institute. Retrieved 12 February 2022.
- ^ Schiapparelli, Lucio M.; Sharma, Pranav; He, Hai-Yan; Li, Jianli; Shah, Sahil H.; McClatchy, Daniel B.; Ma, Yuanhui; Liu, Han-Hsuan; Goldberg, Jeffrey L.; Yates, John R.; Cline, Hollis T. (25 January 2022). "Proteomic screen reveals diverse protein transport between connected neurons in the visual system". Cell Reports. 38 (4): 110287. doi:10.1016/j.celrep.2021.110287. ISSN 2211-1247. PMC 8906846. PMID 35081342.
- ^ Levitan, Irwin B.; Kaczmarek, Leonard K. (2015). "Electrical Signaling in Neurons". The Neuron. Oxford University Press. pp. 41–62. doi:10.1093/med/9780199773893.003.0003. ISBN 978-0-19-977389-3.
- ^ O’Leary, Olivia F.; Ogbonnaya, Ebere S.; Felice, Daniela; Levone, Brunno R.; C. Conroy, Lorraine; Fitzgerald, Patrick; Bravo, Javier A.; Forsythe, Paul; Bienenstock, John; Dinan, Timothy G.; Cryan, John F. (1 February 2018). "The vagus nerve modulates BDNF expression and neurogenesis in the hippocampus". European Neuropsychopharmacology. 28 (2): 307–316. doi:10.1016/j.euroneuro.2017.12.004. ISSN 0924-977X. PMID 29426666. S2CID 46819013.
- ^ Cserép C, Pósfai B, Lénárt N, Fekete R, László ZI, Lele Z (January 2020). "Microglia monitor and protect neuronal function through specialized somatic purinergic junctions". Science. 367 (6477): 528–537. Bibcode:2020Sci...367..528C. doi:10.1126/science.aax6752. PMID 31831638. S2CID 209343260.
- ^ Chudler EH. "Milestones in Neuroscience Research". Neuroscience for Kids. Retrieved 2009-06-20.
- ^ Patlak J, Gibbons R (2000-11-01). "Electrical Activity of Nerves". Action Potentials in Nerve Cells. Archived from the original on August 27, 2009. Retrieved 2009-06-20.
- ^ Harris-Warrick, RM (October 2011). "Neuromodulation and flexibility in Central Pattern Generator networks". Current Opinion in Neurobiology. 21 (5): 685–92. doi:10.1016/j.conb.2011.05.011. PMC 3171584. PMID 21646013.
- ^ Brown EN, Kass RE, Mitra PP (May 2004). "Multiple neural spike train data analysis: state-of-the-art and future challenges". Nature Neuroscience. 7 (5): 456–61. doi:10.1038/nn1228. PMID 15114358. S2CID 562815.
- ^ Thorpe SJ (1990). "Spike arrival times: A highly efficient coding scheme for neural networks" (PDF). In Eckmiller R, Hartmann G, Hauske G (eds.). Parallel processing in neural systems and computers. North-Holland. pp. 91–94. ISBN 9780444883902. Archived from the original (PDF) on 2012-02-15.
- ^ a b Kalat, James W (2016). Biological psychology (12 ed.). Australia: Cengage Learning. ISBN 9781305105409. OCLC 898154491.
- ^ Eckert R, Randall D (1983). Animal physiology: mechanisms and adaptations. San Francisco: W.H. Freeman. p. 239. ISBN 978-0-7167-1423-1.
- ^ a b Finger, Stanley (1994). Origins of neuroscience : a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Ramon y Cajal's first paper on the Golgi stain was on the bird cerebellum, and it appeared in the Revista in 1888. He acknowledged that he found the nerve fibers to be very intricate, but stated that he could find no evidence for either axons or dendrites undergoing anastomosis and forming nets. He called each nervous element 'an absolutely autonomous canton.'
- ^ a b 옥스포드 영어사전, 2003년 3판, s.v.
- ^ Mehta AR, Mehta PR, Anderson SP, MacKinnon BL, Compston A (January 2020). "Grey Matter Etymology and the neuron(e)". Brain. 143 (1): 374–379. doi:10.1093/brain/awz367. PMC 6935745. PMID 31844876.
- ^ "Google Books Ngram Viewer". books.google.com. Retrieved 19 December 2020.
- ^ a b c d López-Muñoz F, Boya J, Alamo C (October 2006). "Neuron theory, the cornerstone of neuroscience, on the centenary of the Nobel Prize award to Santiago Ramón y Cajal". Brain Research Bulletin. 70 (4–6): 391–405. doi:10.1016/j.brainresbull.2006.07.010. PMID 17027775. S2CID 11273256.
- ^ Finger, Stanley (1994). Origins of neuroscience : a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
... a man who would write a highly influential review of the evidence in favor of the neuron doctrine two years later. In his paper, Waldeyer (1891), ... , wrote that nerve cells terminate freely with end arborizations and that the 'neuron' is the anatomical and physiological unit of the nervous system. The word 'neuron' was born this way.
- ^ "Whonamedit - dictionary of medical eponyms". www.whonamedit.com.
Today, Wilhelm von Waldeyer-Hartz is remembered as the founder of the neurone theory, coining the term "neurone" to describe the cellular function unit of the nervous system and enunciating and clarifying that concept in 1891.
- ^ Grant G (October 2007). "How the 1906 Nobel Prize in Physiology or Medicine was shared between Golgi and Cajal". Brain Research Reviews. 55 (2): 490–8. doi:10.1016/j.brainresrev.2006.11.004. PMID 17306375. S2CID 24331507.
- ^ Witcher MR, Kirov SA, Harris KM (January 2007). "Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus". Glia. 55 (1): 13–23. CiteSeerX 10.1.1.598.7002. doi:10.1002/glia.20415. PMID 17001633. S2CID 10664003.
- ^ Connors BW, Long MA (2004). "Electrical synapses in the mammalian brain". Annual Review of Neuroscience. 27 (1): 393–418. doi:10.1146/annurev.neuro.26.041002.131128. PMID 15217338.
- ^ Guillery RW (June 2005). "Observations of synaptic structures: origins of the neuron doctrine and its current status". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 360 (1458): 1281–307. doi:10.1098/rstb.2003.1459. PMC 1569502. PMID 16147523.
- ^ Sabbatini RM (April–July 2003). "Neurons and Synapses: The History of Its Discovery". Brain & Mind Magazine: 17.
- ^ Djurisic M, Antic S, Chen WR, Zecevic D (July 2004). "Voltage imaging from dendrites of mitral cells: EPSP attenuation and spike trigger zones". The Journal of Neuroscience. 24 (30): 6703–14. doi:10.1523/JNEUROSCI.0307-04.2004. hdl:1912/2958. PMC 6729725. PMID 15282273.
- ^ Cochilla AJ, Alford S (March 1997). "Glutamate receptor-mediated synaptic excitation in axons of the lamprey". The Journal of Physiology. 499 (Pt 2): 443–57. doi:10.1113/jphysiol.1997.sp021940. PMC 1159318. PMID 9080373.
- ^ Gouwens NW, Wilson RI (2009). "Signal propagation in Drosophila central neurons". Journal of Neuroscience. 29 (19): 6239–6249. doi:10.1523/jneurosci.0764-09.2009. PMC 2709801. PMID 19439602.
- ^ Williams RW, Herrup K (1988). "The control of neuron number". Annual Review of Neuroscience. 11 (1): 423–53. doi:10.1146/annurev.ne.11.030188.002231. PMID 3284447.
- ^ von Bartheld CS, Bahney J, Herculano-Houzel S (December 2016). "The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting". The Journal of Comparative Neurology. 524 (18): 3865–3895. doi:10.1002/cne.24040. PMC 5063692. PMID 27187682.
- ^ Krajewski KM, Lewis RA, Fuerst DR, Turansky C, Hinderer SR, Garbern J, Kamholz J, Shy ME (July 2000). "Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A". Brain. 123 (7): 1516–27. doi:10.1093/brain/123.7.1516. PMID 10869062.
- ^ "About Alzheimer's Disease: Symptoms". National Institute on Aging. Archived from the original on 15 January 2012. Retrieved 28 December 2011.
- ^ Burns A, Iliffe S (February 2009). "Alzheimer's disease". BMJ. 338: b158. doi:10.1136/bmj.b158. PMID 19196745. S2CID 8570146.
- ^ Querfurth HW, LaFerla FM (January 2010). "Alzheimer's disease". The New England Journal of Medicine. 362 (4): 329–44. doi:10.1056/NEJMra0909142. PMID 20107219. S2CID 205115756.
- ^ "Parkinson's Disease Information Page". NINDS. 30 June 2016. Archived from the original on 4 January 2017. Retrieved 18 July 2016.
- ^ "Movement Disorders". The International Neuromodulation Society.
- ^ Kerschensteiner M, Schwab ME, Lichtman JW, Misgeld T (May 2005). "In vivo imaging of axonal degeneration and regeneration in the injured spinal cord". Nature Medicine. 11 (5): 572–7. doi:10.1038/nm1229. PMID 15821747. S2CID 25287010.
- ^ Kempermann G, Gage FH, Aigner L, Song H, Curtis MA, Thuret S, Kuhn HG, Jessberger S, Frankland PW, Cameron HA, Gould E, Hen R, Abrous DN, Toni N, Schinder AF, Zhao X, Lucassen PJ, Frisén J (July 2018). "Human Adult Neurogenesis: Evidence and Remaining Questions". Cell Stem Cell. 23 (1): 25–30. doi:10.1016/j.stem.2018.04.004. PMC 6035081. PMID 29681514.
- ^ Callaway, Ewen (26 May 2011). "How to make a human neuron". Nature. doi:10.1038/news.2011.328.
By transforming cells from human skin into working nerve cells, researchers may have come up with a model for nervous-system diseases and perhaps even regenerative therapies based on cell transplants. The achievement, reported online today in Nature, is the latest in a fast-moving field called transdifferentiation, in which cells are forced to adopt new identities. In the past year, researchers have converted connective tissue cells found in skin into heart cells, blood cells, and liver cells.
- ^ a b Wang Z, Tang B, He Y, Jin P (March 2016). "DNA methylation dynamics in neurogenesis". Epigenomics. 8 (3): 401–14. doi:10.2217/epi.15.119. PMC 4864063. PMID 26950681.
- ^ Orii KE, Lee Y, Kondo N, McKinnon PJ (June 2006). "Selective utilization of nonhomologous end-joining and homologous recombination DNA repair pathways during nervous system development". Proceedings of the National Academy of Sciences of the United States of America. 103 (26): 10017–22. Bibcode:2006PNAS..10310017O. doi:10.1073/pnas.0602436103. PMC 1502498. PMID 16777961.
- ^ Cserép, Csaba; Schwarcz, Anett D.; Pósfai, Balázs; László, Zsófia I.; Kellermayer, Anna; Környei, Zsuzsanna; Kisfali, Máté; Nyerges, Miklós; Lele, Zsolt; Katona, István (September 2022). "Microglial control of neuronal development via somatic purinergic junctions". Cell Reports. 40 (12): 111369. doi:10.1016/j.celrep.2022.111369. PMC 9513806. PMID 36130488. S2CID 252416407.
- ^ Yiu G, He Z (August 2006). "Glial inhibition of CNS axon regeneration". Nature Reviews. Neuroscience. 7 (8): 617–27. doi:10.1038/nrn1956. PMC 2693386. PMID 16858390.
더보기
- Bullock TH, Bennett MV, Johnston D, Josephson R, Marder E, Fields RD (November 2005). "Neuroscience. The neuron doctrine, redux". Science. 310 (5749): 791–3. doi:10.1126/science.1114394. PMID 16272104. S2CID 170670241.
- Kandel ER, Schwartz JH, Jessell TM (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. ISBN 0-8385-7701-6.
- Peters A, Palay SL, Webster HS (1991). The Fine Structure of the Nervous System (3rd ed.). New York: Oxford University Press. ISBN 0-19-506571-9.
- Ramón y Cajal S (1933). Histology (10th ed.). Baltimore: Wood.
- Roberts A, Bush BM (1981). Neurones without Impulses. Cambridge: Cambridge University Press. ISBN 0-521-29935-7.
- Snell RS (2010). Clinical Neuroanatomy. Lippincott Williams & Wilkins. ISBN 978-0-7817-9427-5.
외부 링크
- 컬리의 신경생물학
- IBRO(국제 뇌 연구 기구). 특히 자금 사정이 좋지 않은 국가에서 신경과학 연구를 장려합니다.
- 뉴런 뱅크(NeuronBank)는 뉴런 유형 및 시냅스 연결을 카탈로그화하기 위한 온라인 신경학 도구입니다.
- 영장류와 비 영장류 뇌의 고해상도 신경해부학적 이미지.
- Wikiversity의 신경과학과는 현재 다음과 같은 두 가지 과정을 제공하고 있습니다. 신경과학과 비교신경과학의 기초.
- NIF 검색 – 신경과학 정보 프레임워크를 통해 웨이백 기계에 보관된 뉴런 2015-01-22
- Cell Centered Database – 뉴런
- NeuroLex에서 Petilla 협약에 따른 뉴런 유형의 전체 목록.
- 뉴로모르포.신경 형태학의 디지털 재구성에 대한 온라인 데이터베이스.
- 면역조직화학 이미지 갤러리: 뉴런
- 칸 아카데미: 뉴런의 해부학
- 뉴런 영상


