콕콜리소포어
Coccolithophore| 콕콜리소포어 시간 범위: | |
|---|---|
 | |
| 콕콜리소스펠라지쿠스 | |
| 과학적 분류 | |
| 도메인: | |
| (순위 미지정): | |
| (순위 미지정): | |
| (순위 미지정): | |
| 클래스: | |
| 주문: | |

콕콜리소포(혹은 형용사에서는[1] 콕콜리소포리드)는 단세포 진핵 식물성 플랑크톤(조류)이다.로버트 휘태커의 오왕국 분류에 따르면 콕콜리소포체는 프로티스타 왕국에 속하거나 새로운 생물학적 분류 체계에 따르면 하크로비아 분지군에 속합니다.하크로비아 내에서, 콕콜리소포는 문 또는 분할 합토피타, 프림네시오파이스아강(또는 콕콜리소피체아)[2]에 있습니다.콕콜리소포어는 또한 중요한 미세화석인 콕콜리스라고 불리는 기능이 불확실한 특별한 탄산칼슘 판에 의해 구별됩니다.그러나 콕석(예를 들어 콕석)이 결여된 콕석(Primnesiophyceae) 종도 있기 때문에 콕석식세포가 모두 콕석([3]Primnesiophyceae)인 것은 아니다.콕콜리소포는 거의 전적으로 해양이고 광합성이며 바다의 햇빛 영역 전체에 다량으로 존재한다.
콕콜리소포어의 가장 풍부한 종인 Emiliania huxleyi는 이소크라이시달레목과 노엘라하브다과에 속한다.[2]그것은 온대,[4] 아열대, 그리고 열대 바다에서 발견됩니다.이것은 E. huxleyi를 많은 양의 해양 먹이 거미줄의 플랑크톤 베이스의 중요한 부분으로 만듭니다.그것은 또한 실험실 [5]문화에서 가장 빠르게 성장하는 콕콜리소포체이다.여름 열전선의 [6][7]재형성 후 영양분이 고갈된 물에서 광범위하게 꽃을 피우기 위해 연구되었다.그리고 지구과학자들이 과거 해수면 [8]온도를 추정하는 수단으로 흔히 사용하는 알케논으로 알려진 분자의 생산을 위해.콕콜리소포어는 해양 산성도가 높아짐에 따라 [9]탄소 흡수원으로서 더욱 중요해질 수 있기 때문에 지구 기후 변화를 연구하는 사람들에게 특히 관심이 있습니다.또한 [10]부영양화 관련 콕콜리소포(Coccolithophore)의 발생을 방지하기 위한 관리전략이 강구되고 있다.
개요
콕콜리소포어는 "코코스피어"라고 불리는 탄산칼슘 껍데기로 스스로를 덮는 200여 종의 해양 식물성 플랑크톤으로 이루어진 중요한 그룹입니다.콕콜리소포어는 생태학적으로나 생물지리화학적으로 중요하지만 석회화 된 이유는 아직 밝혀지지 않았다.한 가지 중요한 기능은 구덩이권이 [12]해양에서 식물성 플랑크톤 사망의 주요 원인 중 하나인 미세동물 플랑크톤 포식으로부터 보호를 제공한다는 것이다.
콕콜리소포어는 작은 탄산칼슘 비늘(CaCO)을3 생성하는 단세포 식물성 플랑크톤으로, 콕코스피어라고 불리는 구형 코팅의 형태로 세포 표면을 덮습니다.그들은 [13][14]쥐라기 이후 해양 플랑크톤 군집의 필수적인 일부였다.오늘날 콕콜리소포어는 표면 해양에서 1차 생산에 1~10%, 원양 CaCO3 [16]퇴적물에 50%까지 기여합니다.그들의 석회질 껍질은 [17][18]유기물을 밸러스트함으로써 광합성적으로 고정된2 이산화탄소가 심해로 가라앉는 속도를 증가시킨다.이와 함께 코크리스 형성 중 탄산칼슘의 생물학적 침전에 의해 바닷물의 총알칼리도가 저하되어 [19][20]CO가 방출된다2.따라서, 콕콜리소포어는 생물학적 탄소 펌프의 효율과 대기의2 CO [12]흡수에 영향을 미침으로써 해양 탄소 순환에 중요한 역할을 한다.
2021년 현재, 콕콜리소포어가 왜 석회화되는지, 그리고 콕콜리스를 생성하는 능력이 생태학적 [21][22][23][24][25]성공과 어떻게 관련이 있는지는 알려지지 않았다.구덩이권을 갖는 것의 가장 그럴듯한 이점은 포식자나 [26][24]바이러스로부터 보호하는 것으로 보인다.바이러스 감염은 [27]해양에서 식물성 플랑크톤 사망의 중요한 원인이며, 석회화가 콕콜리소포어와 [28][29]그 바이러스 사이의 상호작용에 영향을 줄 수 있다는 것이 최근 밝혀졌다.해양 식물성 플랑크톤의 주요 포식자는 섬모충류나 디노플라겔류 같은 미세동물성 플랑크톤이다.이것들은 바다에서 1차 생산량의 약 3분의 2를 소비하는 것으로 추정되며, 마이크로동물플랭크톤은 콕콜리소포어 [31]개체군에 강한 방목 압력을 가할 수 있다.석회화가 포식자를 막는 것은 아니지만, 콕코스피어가 포식자가 콕석식세포의 [32]유기성분을 이용하기 어렵게 만들어 방목효율을 떨어뜨린다는 주장이 제기돼 왔다.이종영양성 원생동물들은 크기나 모양, 화학신호에 따라 선택적으로 먹이를 선택할 수 있으며, 따라서 [12]구석류에 의해 보호되지 않고 이용 가능한 다른 먹이를 선호할 수 있다.
구조.
콕콜리소포어는 지름 5-100마이크로미터의 구형 세포로, 약 2-25마이크로미터의 콕콜리스라고 불리는 석회질 판으로 둘러싸여 있습니다.각각의 세포는 [37]핵을 둘러싸고 있는 두 개의 갈색 엽록체를 포함합니다.
각 구덩이권에는 세포막으로 둘러싸인 세포들이 있다.갈색 색소를 가진 두 개의 큰 엽록체가 세포의 양쪽에 위치하고 핵, 미토콘드리아, 골지 기구, 소포체, 그리고 다른 세포들을 둘러싸고 있다.각 세포는 또한 운동성뿐만 아니라 세포 [38]골격의 유사분열과 형성에 관여하는 2개의 편모 구조를 가지고 있다.일부 종에서는 기능성 또는 퇴적 합톤종도 존재한다.[39]이 구조는 환경 자극에 반응하여 합토피, 코일 및 코일을 풀 수 있는 독특한 구조입니다.잘 이해되지 않지만, 먹이 [38]포획에 관여하는 것이 제안되었다.
생태학
라이프 히스토리 전략
콕콜리소포어의 라이프 사이클은 이배체와 반배체상의 교대로 특징지어진다.그들은 반수체에서 이승아미를 거쳐 이배체로, 감수분열을 통해 이배체에서 반수체로 번갈아 나타난다.교대로 생명주기를 가진 대부분의 유기체와 대조적으로, 유사분열로 인한 무성생식은 생명주기의 [40]두 단계에서 모두 가능하다.비생물적 요소와 생물적 요소 모두 각 단계가 발생하는 [41]빈도에 영향을 미칠 수 있습니다.
콕콜리소포어는 2차 핵분열을 통해 무성생식을 한다.이 과정에서 부모 세포로부터의 콕코리스를 두 개의 딸 세포로 나눈다.콕석식세포의 이배체 단계로 인해 성적 생식 과정이 있을 수 있다는 제안이 있었지만,[42] 이 과정은 관찰된 적이 없다.K 또는 r-선택된 콕콜리소포어의 전략은 수명 주기 단계에 따라 달라진다.콕콜리소포어가 이배체일 경우 r-선택된다.이 단계에서는 다양한 영양성분을 견딜 수 있습니다.반수체일 경우 K-선택되며, 안정적이고 저영양 환경에서 [42]더 경쟁력이 있는 경우가 많다.대부분의 콕콜리소포체는 K 스트래티지스트이며 보통 영양분이 부족한 지표수에서 발견됩니다.그들은 다른 식물성 플랑크톤과 비교했을 때 낮은 경쟁자이며 다른 식물성 플랑크톤이 살아남지 [43]못할 서식지에서 번성합니다.콕콜리소포체의 라이프 사이클에서 이 두 단계는 계절에 따라 발생하는데, 따뜻한 계절에는 더 많은 영양분을 섭취할 수 있고 차가운 계절에는 더 적은 영양분을 섭취할 수 있습니다.이러한 유형의 라이프 사이클은 복잡한 이형 라이프 [42]사이클로 알려져 있습니다.
글로벌 디스트리뷰션
콕석식세포는 전 세계 바다에서 발생한다.이들의 분포는 해양의 성층층에 따라 수직적으로 다르며 지리적으로 시간대에 [44]따라 다르다.대부분의 현대의 콕콜리소포어는 연관된 계층화된 희소영양 상태에 위치할 수 있지만, 가장 풍부한 콕콜리소포 지역은 온대 [45]기후의 아열대 지역에 위치하고 있습니다.수온과 수면에 들어오는 빛의 양이 종의 위치를 결정하는 데 더 큰 영향을 미치는 요소인 반면, 해류는 또한 특정 종의 콕콜리소포가 [46]발견되는 위치를 결정할 수 있다.
운동성과 콜로니 형성은 서로 다른 콕콜리소포어의 라이프 사이클에 따라 다르지만, 종종 운동성, 반수상 및 비운동성 이배상 사이에 교대가 있다.두 단계에서, 이 유기체의 분산은 주로 해류와 [47]순환 패턴에 기인한다.
태평양 내에서는 약 90종이 서로 다른 태평양 해류와 관련된 6개의 분리된 구역으로 확인되었으며, 이들은 서로 다른 종의 콕석식세포의 [48]고유한 그룹을 포함하고 있다.태평양에서 구석류의 다양성이 가장 높았던 지역은 중앙 북대라고 불리는 바다의 지역으로, 북적도 해류와 적도 대류로 이루어진 30 N에서 5 N 사이의 지역이었다.이 두 해류는 동쪽과 서쪽의 반대 방향으로 이동하기 때문에 물이 강하게 섞일 수 있고 다양한 종들이 그 [48]지역에 서식할 수 있다.
대서양에서 가장 풍부한 종은 E. 헉슬레이와 Florisphaera profunda이며, Umbellospaera rerularis, Umbellospaera tenuis 및 다른 종의 Gephyrocapsa가 [48]더 적은 농도로 분포하고 있습니다.깊은 곳에 사는 콕콜리소포어 종의 풍부함은 뉴트리클린과 열전라인 깊이의 영향을 크게 받는다.이러한 콕콜리소포어는 너트리클라인과 열전선이 깊으면 풍부하게 증가하고 [49]얕으면 감소합니다.
콕콜리소포어의 완전한 분포는 현재 알려져 있지 않으며 인도양과 같은 일부 지역은 태평양과 대서양의 다른 지역만큼 잘 연구되지 않는다.또한 연안 및 적도 융기, 전방 시스템, 해저 환경, 독특한 해양 지형, 고립된 높은 수온 또는 낮은 [51]수온의 포켓과 같은 해양 특성과 관련된 여러 지속적으로 변화하는 요소들로 인해 분포를 설명하기가 매우 어렵습니다.
상부 광대는 영양소 농도가 낮고, 광강도와 투과도가 높으며, 일반적으로 온도가 높습니다.하부 광대는 영양소 농도가 높고, 광강도와 투과율이 낮으며, 비교적 시원하다.중간 포토존은 하부 포토존과 상부 포토존 [45]사이에 동일한 값을 포함하는 영역입니다.
그레이트 칼사이트 벨트
남양의 그레이트칼사이트 벨트는 규조류가 우세한 것으로 알려져 있음에도 불구하고 콕콜리소포어에서 유래한 여름철 상층 해양칼사이트 농도가 높은 지역이다.이 지역의 동적 전방 시스템에서 두 개의 주요 식물성 플랑크톤 그룹인 콕콜리소포어와 디아톰의 중첩은 이러한 분류 그룹 내 [54]다른 종의 분포에 대한 환경적 영향을 연구하기에 이상적인 환경을 제공한다.
대칼사이트 [55]벨트는 남극해에서 호주 봄과 여름에 계절적으로 증가하는 엽록소 a와 함께 발생하는 높은 입자 무기 탄소(PIC) 특성으로 정의되며, 남해 지역(30-60°S)[58]의 60% 이상을 차지할 정도로 기후 [56][57]변동에 중요한 역할을 한다.30°와 50°S 사이의 지역은 북대서양과 [59]북태평양을 따라 인공 이산화탄소(CO2)의 흡수가 가장 높다.
지구 기후 변화가 분배에 미치는 영향
최근의 연구는 기후 변화가 콕콜리소포어의 분포와 생산성에 직간접적인 영향을 미친다는 것을 보여준다.지구 온난화가 콕석식세포의 순증 또는 감소를 가져올지는 분명하지 않지만, 그들은 해양의 꼭대기 층의 온도 상승과 열적 성층화의 영향을 받을 수밖에 없다.석회화 유기체이기 때문에 이산화탄소의 증가로 인한 해양 산성화가 [49]콕콜리소포체에 심각한 영향을 미칠 수 있다는 주장이 제기되어 왔다.최근2 CO의 증가는 콕석식세포의 [60]개체수가 급격히 증가하고 있다.
먹이사슬에서의 역할

콕콜리소포는 바다에서 가장 풍부한 1차 생산지 중 하나이다.이와 같이, 그것들은 열대 및 아열대 해양의 1차 생산성에 큰 기여를 하고 있지만, 정확히 얼마나 많은 양이 [64]아직 기록되지 않았다.
영양소에 대한 의존
바다의 특정 지역에서 질소, 인, 규산염의 농도 사이의 비율은 식물성 플랑크톤 군집 내에서 경쟁 우위를 결정한다.각 비율은 기본적으로 규조류 또는 콕콜리소포체와 같은 식물성 플랑크톤의 다른 그룹에 유리한 확률을 높입니다.규산염 대 질소 및 인 비율이 낮으면 콕콜리소포가 다른 식물성 플랑크톤종을 능가할 수 있지만, 규산염 대 인 대 질소 비율이 높을 때는 규산염 대 인의 비율이 높을 경우 규산염이 규산염보다 우세하다.농업 공정의 증가는 물의 부영양화로 이어지며, 따라서 이러한 고질소, 인, 저규산염 환경에서 [10]콕콜리소포가 꽃을 피웁니다.
물기둥 생산성에 미치는 영향
탄산칼슘의 칼사이트는 콕콜리스를 흡수하는 것보다 더 많은 빛을 산란하게 한다.이것은 두 가지 중요한 결과를 낳는다: 1) 표면수가 밝아지는 것은 알베도가 높다는 것을 의미하고 2) 광합성 생산이 과잉으로 감소한다는 것을 의미한다.1)의 경우 고농도의 콕석류는 지표수 온도 상승과 심층수 온도 저하를 동시에 일으킨다.이는 물기둥의 층화를 증가시키고 영양소의 수직 혼합을 감소시킨다.그러나 최근 연구에 따르면 바다의 복사력 증가에 대한 콕석소체의 전체적인 영향은 인위적 [65]요인보다 적다.따라서 콕석식세포의 큰 꽃은 지구온난화에 기여하기보다는 물기둥 생산성의 저하로 나타난다.
프레데터-프라이 상호작용
그들의 포식자는 작은 물고기, 동물성 플랑크톤,[43][66] 조개 유충을 포함한 모든 식물성 플랑크톤의 일반적인 포식자를 포함합니다.이 종에 특화된 바이러스는 전 세계 여러 곳에서 분리되었고 봄꽃의 역동성에 중요한 역할을 하는 것으로 보인다.
독성
콕콜리소포 독성의 환경적 증거는 보고되지 않았지만, 독성이 있는 종을 포함하는 콕콜리소포 독성에 속하는 콕콜리소포 독성의 환경적 증거는 보고되지 않았다.독성이 있는 종은 프림네시움 마사르트와 크리소크로물리나 라키에서 발견되었다.프림네슘속은 독성을 일으키는 물질인 용혈성 화합물을 생성하는 것으로 밝혀졌다.이 독성종들 중 일부는 큰 물고기를 죽이는 원인이 되고 조개류와 같은 유기체에 축적될 수 있습니다; 먹이사슬을 통해 그것을 옮깁니다.해양 콕리소포어속 Emiliania, Gephyrocapsa, Calcidiscus 및 Coccolisus의 독성 구성원에 대한 실험실 테스트에서 연안 콕리소포어속 Hymenomonas의 종과 마찬가지로 독성이 없는 것으로 나타났지만, 두 해안 콕리소포어속은 모두 [66]Artemia에 독성이 있었다.
커뮤니티의 상호작용
콕콜리소포리드는 주로 단일 자유 유동 반배체 또는 이중배체 [44]세포로 발견된다.
경쟁.
대부분의 식물성 플랑크톤은 살아남기 위해 바다에서 나오는 햇빛과 영양분을 필요로 하기 때문에, 그들은 바다의 낮은 곳에서 솟아오르는 영양분이 풍부한 물의 많은 투입물이 있는 지역에서 번성합니다.대부분의 콕콜리소포어는 에너지 생산을 위해서만 햇빛을 필요로 하며 암모늄 흡수에 비해 질산염 흡수의 비율이 높다(질소는 성장에 필요하며 암모늄이 아닌 질산염에서 직접 사용될 수 있다).이것 때문에 그들은 다른 식물성 플랑크톤이 [67]굶주리고 있는 영양분이 부족한 환경에서 여전히 잘 자란다.이러한 빠른 성장률과 관련된 트레이드오프에는 다른 유형의 식물성 플랑크톤보다 더 작은 세포 반지름과 더 낮은 세포 부피가 포함된다.
바이러스 감염과 공진화
거대 DNA를 포함한 바이러스는 콕콜리소포, 특히 E. 헉슬레이를 용균으로 감염시키는 것으로 알려져 있다.E. Huxleyi 바이러스(EhVs)로 알려진 이 바이러스들은 거의 전적으로 구균권 코팅 이배체를 감염시키는 것으로 보인다.반수체 유기체는 감염되지 않아 바이러스의 영향을 받지 않기 때문에 콕석식세포와 이들 바이러스 사이의 공진화적인 "군비 경쟁"은 전형적인 레드퀸의 진화 체계를 따르지 않고 대신 "체셔 고양이" 생태 역학을 [68]따른다는 주장이 제기되었다.보다 최근의 연구는 스핑고지질의 바이러스 합성과 프로그램된 세포사의 유도가 적어도 콕콜리소바이러스와 이배체 [41]유기체 사이의 레드퀸과 같은 공동진화 군비경쟁을 연구하기 위한 보다 직접적인 연결고리를 제공한다고 제안했다.
진화와 다양성
콕콜리소포체는 합티스타에 [69]있는 센트로헬리다와 자매 분지인 합토피타 분지군의 일원입니다.가장 오래된 것으로 알려진 콕석식세포는 트라이아스기 후기, 노리안-래티아의 [70]경계 부근에서 알려져 있다.중생대를 거치면서 다양성이 꾸준히 증가하여 백악기 후기에 최고조에 달했다.그러나 콕석식물의 90% 이상이 멸종한 백악기-팔레오겐 멸종 사건 때 급격한 감소가 있었다.구석류는 고생세-에오세 열 극대기 동안 다양성이 더 낮은 또 다른 정점에 도달했지만, 지구 온도 감소로 인해 올리고세 이후 감소했고, 크고 심하게 석회화된 구석류를 생산하는 [24]종들이 가장 큰 영향을 받았다.

콕콜리소포각류
| 관련된 시리즈의 일부 |
| 바이오미네랄화 |
|---|
 |
- 외골격: 구균구 및 구균석
각각의 콕석소체는 외골격이나 [71]콕코스피어를 구성하는 석회화된 비늘인 콕코리스로 이루어진 보호 껍데기에 둘러싸여 있습니다.콕콜리스는 콕콜리소포 세포 안에서 생성되며, 어떤 종들은 세포가 성장하면서 새로운 콕콜리스를 생성하기만 하는 반면, 다른 종들은 지속적으로 콕콜리스를 생산하고 떨어뜨립니다.
구성.
코코리스의 주요 성분은 탄산칼슘, 즉 분필이다.탄산칼슘은 투명하기 때문에 구균권에서의 [43]캡슐화에 의해 유기체의 광합성 활동이 저해되지 않는다.
형성
콕석류는 [37]콕석형성이라고 알려진 생미네랄화 과정에 의해 생산된다.일반적으로 콕석석은 빛이 있을 때 석회화가 일어나며, 이러한 비늘은 정상기보다 기하급수적인 성장기 [72]동안 훨씬 더 많이 생성된다.아직 완전히 이해되지는 않았지만, 생물미네랄화 과정은 칼슘 시그널링에 의해 엄격하게 조절된다.Calcite 형성은 단백질 템플릿이 CaCO3 결정의 형성을 핵으로 만들고 복잡한 산성 다당류가 이러한 [47]결정의 모양과 성장을 제어하는 골지 복합체에서 시작됩니다.각 비늘이 생성될 때 골지유래 베시클에 수출되어 구덩이권 내면에 첨가된다.이것은 가장 최근에 생성된 콕콜리스가 오래된 [40]콕콜리스 아래에 있을 수 있다는 것을 의미한다.식물성 플랑크톤의 라이프 사이클 단계에 따라, 두 가지 다른 형태의 구석이 형성될 수 있습니다.홀로코크 결석은 반수체 단계에서만 생성되며 반지름 대칭이 결여되어 있으며 수백에서 수천 개의 유사한 미세(ca 0.1μm) 마름모꼴 석회암 결정으로 구성되어 있습니다.이 결정들은 적어도 부분적으로 세포 밖에서 형성되는 것으로 생각된다.헤테로코커스 결석은 이배체상에서만 발생하며 반지름 대칭을 가지며 비교적 소수의 복잡한 결정 단위(100개보다 작음)로 구성되어 있다.비록 드물지만, 콕석식세포의 수명 주기 변화를 기록하는 플랑크톤에서 홀로코크리스와 헤테로코크리스 결석을 모두 포함하는 결합 콕코스피어가 관찰되었습니다.마지막으로, 일부 종의 구균권은 특화된 [51]구균석으로 이루어진 다양한 부속물에 의해 고도로 변형된다.
기능.
구덩이권의 정확한 기능은 불분명하지만, 많은 잠재적 기능들이 제안되어 왔다.가장 명백하게 구석은 포식자로부터 식물성 플랑크톤을 보호할 수 있다.또한 보다 안정적인 pH를 만드는 데 도움이 되는 것으로 보입니다.광합성을 하는 동안 이산화탄소는 물에서 제거되어 더욱 염기성이 높아집니다.또한 석회화는 이산화탄소를 제거하지만, 그 뒤의 화학 작용은 반대되는 pH 반응을 초래한다; 그것은 물을 더 산성으로 만든다.따라서 광합성과 석회화의 조합은 pH [73]변화에 대해 서로 균등하게 한다.또한, 이러한 외골격은 콕콜리시스 형성이 광합성과 매우 관련이 있는 것처럼 보이기 때문에 에너지 생산에서 이점을 줄 수 있다.중탄산염 용액에서 탄산칼슘이 유기적으로 침전되면 조류의 세포체 내에서 자유 이산화탄소가 생성되고, 이 추가적인 가스 공급원은 광합성을 위해 콕콜리소포어에 이용될 수 있습니다.그들이 세포 내 화학 물질을 해양 [74]환경으로부터 분리하기 위해 세포벽과 같은 장벽을 제공할 수도 있다는 제안이 제기되어 왔다.좀 더 구체적으로, 구석의 방어 특성은 삼투압 변화, 화학적 또는 기계적 충격, 단파장 [39]빛으로부터 보호하는 것을 포함할 수 있다.또한 여러 층의 코크리스 층의 추가 중량은 유기체가 물의 영양분이 풍부한 층으로 가라앉게 하고 반대로 코크리스 층이 부력을 더해 세포가 위험한 [75]깊이로 가라앉는 것을 막게 한다는 제안도 있다.콕콜리스 부속물은 또한 동물성 플랑크톤에 [51]의한 방목을 억제하는 것과 같은 몇 가지 기능을 하기 위해 제안되었다.
사용하다
코콜리스는 백악기 후기 암석층인 초크(Check)의 주요 성분으로 영국 남부에서 널리 퍼져 도버의 백벽을 형성하고 있으며,[7] 다른 많은 지역에서 이와 유사한 암석들을 형성하고 있다.오늘날 퇴적된 구석류는 해저의 35%를 덮고 있는 석회질 삼출액의 주요 성분이며, [47]군데군데 두께는 킬로미터이다.그 풍부함과 넓은 지리적 범위로 인해, 이 액체의 층을 구성하는 콕콜리스와 그것이 압축되면서 형성된 분필 모양의 퇴적물은 귀중한 미세 화석의 역할을 한다.
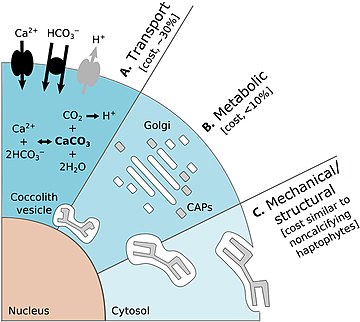
탄산칼슘(CaCO3)의 생물학적 생산인 석회화는 해양 탄소 순환의 핵심 과정이다.콕콜리소포어는 원양성 CaCO3 [76][77]생성을 담당하는 주요 플랑크톤 그룹입니다.오른쪽 다이어그램은 콕콜리소포어 석회화의 에너지 비용을 보여줍니다.
- (A) 1차 석회화 기판2 Ca+ 및 HCO-3(흑색 화살표)의 주변 해수에서 셀로의 수송 및 셀로부터의 최종 생성물 H+의 제거(회색 화살표)를 포함한다.Ca+가2 세포질을 통해 CV로 운반되는 것은 [24]석회화와 관련된 주요 비용이다.
- (B) CaCO3 결정의 핵형성과 기하학적 구조를 조절하는 골지복합체(흰색 직사각형)에 의한 CAP(회색 직사각형)의 합성을 대사 과정으로 한다.완성된 콕석(회색판)은 복잡하게 배열된 CAP와 CaCO3 [24]결정으로 이루어진 복잡한 구조입니다.
- (C) 기계적 및 구조적인 과정은 완성된 콕코리스를 핵에 인접한 원위치에서 세포주위로 운반하여 세포표면으로 운반하는 것을 설명한다.이러한 과정과 관련된 비용은 비석회화합물조류의 [24]유기적 규모의 세포외출증과 비슷할 것이다.
왼쪽 그림은 콕콜리소포 석회화의 이점을 나타내고 있다. (A) 광합성 가속은 CCM (1)을 포함하고 (A) 심층거주종에 대한 희소한 광자의 산란을 통한 광흡수 강화(2) (B) 자외선(UV)과 광합성 활성방사선(PAR)으로부터 햇빛 가리개를 보호하는 것을 포함한다 (B)고광도 조건에서의 에너지 소산(2). (C) 갑옷 보호는 바이러스/세균 감염 (1)에 대한 보호와 선택적인 (2) 및 비선택적인 (3) 방목에 [24]의한 방목을 포함한다.
석회화가 해양 산성화에 적응할 수 있는 정도는 현재 알려져 있지 않다.세포 생리학적 검사에서 전기화학적 H+ 내부 구배가 감소하고 수동적 양성자 유출이 [78]방해됨에 따라 해양 산성화가 진행됨에 따라 필수 H+ 유출(세포 내 석회화에 HCO-3 사용을 억제) 비용이 더 많이 드는 것으로 나타났다.적응 세포는 양성자 채널을 더 자주 활성화하고 막 전위를 조정하거나 내부 [79]pH를 낮춰야 한다.세포 내 pH의 감소는 전체 세포 조직에 심각한 영향을 미치며 H+ 유출을 [80][81]지속시키기 위해 다른 과정(예: 광합성)이 공존해야 한다.탄산염 화학 조건의 변화로 비록 진화 적응할 가능성이 재치는 의무적으로 H+유출 석회화와 관련된 그러므로[82][83]채택에서 왜"석회화 위기"이 가능하다면 어쩌면 오래(수천년)CO2교란 사건 중에 설명할 수 있는 근본적인 제약을 가할 수 있다.한 hin이러한 [82][83]근본적인 제약과 적응의 한계를 푸는 것은 미래의 콕콜리소포어 연구에서 초점이 되어야 한다. 왜냐하면 그것들을 아는 것이 탄산염 화학 섭동에 대한 석회화 반응이 [84]진화에 의해 어느 정도까지 보상될 수 있는지를 이해하는 데 필요한 핵심 정보이기 때문이다.
규산염 또는 셀룰로오스로 무장한 관능기(예: 디아톰 및 디노플라겔레이트)는 석회화 관련 H+ 유출을 지속할 필요가 없다.따라서 구조 요소 생산 비용을 낮추기 위해 적응할 필요가 없을 것이다.반대로, 디노플라겔레이트(석회화 [85]종 제외; 일반적으로 CO 고정성이2 낮은 RuBs)CO 효소는 셀룰로오스 형태의 구조 요소로서의 광합성 탄소 고정은 해양 산성화와 관련된2 CO [87][88]수정에 의해 촉진되어야 하기 때문에 화학적 변화로부터 이익을 얻을 수도 있다.어떤 형태의 셸/외골격이라도 포식 비석회암기로부터 식물성 플랑크톤을 보호한다는 가정 하에 미래 바다에서 [84]보호를 실현하기 위한 바람직한 솔루션이 될 수 있다.

오른쪽 그림은 디아톰, 다이노플라겔레이트 및 콕콜리소포어에서의 갑옷 건설에 대한 비교적 에너지적인 노력이 어떻게 작동하는지를 나타낸 것입니다.규산염이 있을 때 규조류가 일반적으로 다른 모든 군을 능가하기 때문에 모든 상황에서 가장 저렴한 갑옷으로 보입니다.기질이 포화 상태이고 양성자가 [78]바닷물로 쉽게 방출되기 때문에 충분한 [CO2], 높은 [HCO-3], 낮은 [H+] 하에서는 공극권이 상대적으로 저렴하다.이와는 대조적으로, 쌍편모충 껍질을 구성하는 유기(셀룰로오스) 판인 테칼 원소의 구성은 대개 높은2 [CO]와 일치하기 때문에 오히려 높은 H+ 농도로 선호되어야 한다.이러한 조건에서 다이노플라겔라테스는 탄소 농축 메커니즘의 에너지 소비 작동을 하향 조정하여 껍데기용 유기 원료 생산에 연료를 공급할 수 있습니다.따라서 탄산염 화학 조건이 높은 [CO2]로 이동하면 콕콜리소포어에 대한 경쟁력을 높일 수 있다.그러나 탄산염 화학 조건의 변화에 따른 이러한 가상적인 경쟁력 향상은 탄산염 화학 이외의 많은 요소들이 [84]종 구성에 영향을 미치기 때문에 자동적으로 쌍편모충 우위로 이어지지 않을 것이다.
- Xu, K., Hutchins, D. 및 Gao, K. (2018) "코콜리스 배열은 코콜리스포어 에밀리아니아 헉슬레이의 오일러식 수학을 따른다."PeerJ, 6: e4608.doi:10.1126/science.aaa7378.
포식자에 대한 방어
현재 포식자에 대한 구덩이 보호 기능을 뒷받침하거나 반박하는 증거는 제한적이다.일부 연구자들은 콕석식세포 에밀리아니아 [89][90]헉슬레이의 개화 기간 동안 전반적인 마이크로동물 플랑크톤 포식율이 감소했다는 것을 발견했고, 다른 연구자들은 천연 콕석식세포 [91]군집에서의 마이크로동물 플랑크톤 방목율이 높다는 것을 발견했다.2020년에 연구자들은 E. 헉슬레이에 대한 마이크로동물 플랑크톤의 현장 섭취 속도가 유사한 크기의 비석회화 식물 플랑크톤에 [92]대한 섭취 속도와 유의미한 차이가 없다는 것을 발견했다.실험실 실험에서 헤테로영양성 쌍편모충 옥시리스 마리나는 석회화된 세포가 석회화되지 [93]않은 E. 헉슬레이보다 크기 선택적인 섭식 행동에 의한 것으로 가정된 E. 헉슬레이의 비석회화 세포보다 석회화된 것을 선호했다.2015년 Harvey 등은 석회화 [94]정도가 다른 석회화 균주와 비석회화성 E. 헉슬레이의 다양한 유전자형에 대한 다이노플라주 O. 마리나의 포식성을 조사했다.그들은 O. 마리나의 섭취율이 석회화 정도보다는 제공된 E. 헉슬레이의 유전자형에 따라 결정된다는 것을 발견했다.그러나 같은 연구에서 저자들은 석회화되지 않는 유전자형을 먹이로 삼은 포식자들이 석회화 세포를 [94]먹인 포식자들보다 더 빨리 성장한다는 것을 발견했다.2018년 스트롬 외 연구진은 석회화된 E. 헉슬레이 먹이와 비교하여 구균권이 방목자의 [95]섭취를 방해한다는 증거를 발견하지 못했다.대신, 섭취 속도는 제공된 E. huxleyi [95]유전자형에 따라 달라졌다.이 두 가지 연구는 유전자형이 마이크로동물플랭크톤 종의 섭취에 강한 영향을 미치지만 석회화가 마이크로동물플랭크톤 포식으로부터 콕콜리소포어를 보호하는 경우와 방법은 완전히 [12]규명되지 않았다.
지구 기후 변화에 있어서의 중요성
| 시리즈의 일부 |
| 플랑크톤 |
|---|
 |
탄소 순환에 미치는 영향
콕콜리소포어는 탄소 순환에 장단기적인 영향을 미친다.코코리스를 생산하기 위해서는 용해된 무기 탄소와 칼슘의 흡수가 필요하다.탄산칼슘과 이산화탄소는 다음과 같은 화학 반응에 의해 칼슘과 중탄산염에서 생성됩니다.
- Ca2+ + 2HCO3− ca3 CaCO + CO22 + HO.[96]
콕콜리소포어는 광합성 유기체이기 때문에, 그들은 광합성을 [97]위해 석회화 반응에서 방출되는 이산화탄소의2 일부를 사용할 수 있다.
그러나 탄산칼슘의 생성은 표면 알칼리도를 낮추며, 낮은 알칼리도 조건에서는 CO가2 대기 [98]중으로 방출됩니다.그 결과, 연구자들은 콕석식세포의 큰 꽃들이 단기적으로 [99]지구 온난화의 원인이 될 수 있다고 가정했다.그러나 보다 널리 받아들여지는 생각은 장기적으로 콕콜리소포가 대기 중 CO2 농도의 전반적인 감소에 기여한다는 것이다.석회화 중에 두 개의 탄소 원자가 흡수되고 그 중 하나가 탄산칼슘으로 갇힙니다.이 탄산칼슘은 코크리스 형태로 해저로 가라앉아 침전물의 일부가 된다.따라서, 코크리스토포어는 배출된 탄소를 위한 싱크대를 제공하여 온실가스 [99]배출의 영향을 매개한다.
해양 산성화에 대한 진화적 반응
또한 대기 중 CO 농도의2 증가로 인한 해양 산성화가 콕석식세포의 석회화 기계에 영향을 미칠 수 있다는 연구 결과도 있다.이는 개체수 증가나 콕콜리스 생산과 같은 즉각적인 사건에 영향을 미칠 수 있을 뿐만 아니라 장기간에 걸친 콕콜리소포어 종의 진화적 적응을 유도할 수도 있다.예를 들어, 콕콜리소포어는 에서 H 이온 채널을 사용하여 콕콜리스를 생성하는+ 동안 지속적으로 H 이온을 세포 밖으로 내보냅니다+.이것은 그들이 산성증을 피할 수 있게 해주는데, 그렇지 않으면 콕콜리스를 생성하면 H 이온의+ 독성 과잉이 생성되기 때문이다.이러한 이온 채널의 기능이 저하되면, 콕콜리소포어는 산성증을 피하기 위해 석회화 과정을 중지하여 피드백 [100]루프를 형성한다.해양의 낮은 알칼리도는 이온 채널 기능을 손상시키고 따라서 콕콜리소포에 진화적 선택압력을 가하여 해양 [101]산성화에 취약하게 만듭니다.2008년, 콕콜리소포어를 포함한 새로 형성된 해양 퇴적물의 석회화 증가를 나타내는 현장 증거는 해양2 CO 농도의 증가가 이러한 유기체의 석회화 증가를 초래한다는 것을 보여주는 최초의 실험 데이터를 뒷받침했다.콕석질량의 감소는 전 세계 해양의 CO농도2 증가와 CO농도32– 감소와 관련이 있다.이 낮은 석회화는 콕석식세포를 생태학적으로 불리하게 만드는 것으로 추정됩니다.그러나 Calcidiscus 렙토포루스와 같은 일부 종은 이러한 방식으로 영향을 받지 않는 반면, 가장 풍부한 콕석식세포 종인 E. 헉슬레이는 영향을 받을 수 있습니다(연구 결과는 [100][102]혼합되어 있습니다).또한 [9]예측과는 달리 CaCO 포화도가 낮은3 조건에서 고석회화 콕콜리소포리드가 발견되었다.해양 산성화가 콕콜리소포어종에 미치는 영향을 이해하는 것은 바다의 미래 화학 성분, 특히 탄산염 화학을 예측하는 데 절대적으로 필요합니다.실행 가능한 보존 및 관리 조치는 이 분야의 향후 연구에서 나올 것이다.유럽에 본부를[103] 둔 CALMARO와 같은 단체들은 다양한 pH에 대한 콕콜리소포 개체군의 반응을 감시하고 환경적으로 건전한 제어 수단을 결정하기 위해 노력하고 있다.
게피로캅사오세니카
스케일바 = 1.0μm
미세화석 기록에 미치는 영향
콕석석 화석은 눈에 띄는 석회질 미세화석이다.그것들은 생물학적 탄산칼슘의 가장 큰 전지구적 공급원이며, 전지구적 탄소 [104]순환에 크게 기여합니다.그들은 도버의 하얀 절벽과 같은 분필 퇴적물의 주요 성분이다.
특히 관심을 끄는 것은 5천 5백만 년 전 팔레오세-에오세 온열 극대기로 거슬러 올라가는 화석들이다.이 기간은 바다의 [105]현재 이산화탄소2 수치와 가장 직접적으로 일치하는 것으로 생각됩니다.마지막으로, 암석에 있는 콕콜리소포 화석에 대한 현장 증거는 심해 화석 기록이 육지 화석 [106]기록에 영향을 미치는 것으로 널리 받아들여지는 것과 유사한 암석 기록 편향을 가지고 있다는 것을 보여주기 위해 사용되었다.
바다에 대한 영향
콕콜리소포리드는 바다의 온도를 조절하는 데 도움을 준다.그들은 따뜻한 바다에서 번성하고,[107] 핵이 태양을 차단하기 위해 두꺼운 구름을 만들어내는 것을 돕는 황화디메틸을 공기 중으로 방출한다.바다가 차가워지면 콕콜리소포리드 수가 줄어들고 구름의 양도 감소한다.태양을 가리고 있는 구름이 적을 때, 온도도 상승합니다.그러므로 이것은 [108][109]자연의 균형과 균형을 유지한다.
「 」를 참조해 주세요.
레퍼런스
- ^ "International Nanoplankton Association".
- ^ a b 를 클릭합니다Hay, W.W.; Mohler, H.P.; Roth, P.H.; Schmidt, R.R.; Boudreaux, J.E. (1967), "Calcareous nannoplankton zonation of the Cenozoic of the Gulf Coast and Caribbean-Antillean area, and transoceanic correlation", Transactions of the Gulf Coast Association of Geological Societies, 17: 428–480.
- ^ Schaechter, Moselio (2012). Eukaryotic Microbes. Academic Press. p. 239. ISBN 978-0-12-383876-6. Retrieved 30 January 2015.
- ^ "Biogeography and dispersal of micro-organisms: a review emphasizing protists", Acta Protozoologica, 45 (2): 111–136, 2005
- ^ Buitenhuis, Erik T.; Pangerc, Tanja; Franklin, Daniel J.; Le Quéré, Corinne; Malin, Gill (2008), "Growth Rates of Six Coccolithoripd Strains as a Function of Temperature", Limnology and Oceanography, 53 (3): 1181–1185, Bibcode:2008LimOc..53.1181B, doi:10.4319/lo.2008.53.3.1181, S2CID 16601834
- ^ Egge, JK; Aksnes, DL (1992), "Silicate as regulating nutrient in phytoplankton competition", Marine Ecology Progress Series, 83 (2): 281–289, Bibcode:1992MEPS...83..281E, doi:10.3354/meps083281
- ^ a b "Life at the Edge of Sight — Scott Chimileski, Roberto Kolter Harvard University Press". www.hup.harvard.edu. Retrieved 2018-01-26.
- ^ 를 클릭합니다Bentaleb, I.; et al. (1999), "Silicate as regulating nutrient in phytoplankton competition", Marine Chemistry, 64 (4): 301–313, doi:10.1016/S0304-4203(98)00079-6.
- ^ a b Smith, H.E.K.; et al. (2012), "Predominance of heavily calcified coccolithophores at low CaCO3 saturation during winter in the Bay of Biscay", Proceedings of the National Academy of Sciences, 109 (23): 8845–8849, Bibcode:2012PNAS..109.8845S, doi:10.1073/pnas.1117508109, PMC 3384182, PMID 22615387
- ^ a b Yunev, O.A.; et al. (2007), "Nutrient and phytoplankton trends on the western Black Sea shelf in response to cultural eutrophication and climate changes", Estuarine, Coastal and Shelf Science, 74 (1–2): 63–67, Bibcode:2007ECSS...74...63Y, doi:10.1016/j.ecss.2007.03.030
- ^ Young, J. R.; Geisen, M.; Probert, I. (2005). "A review of selected aspects of coccolithophore biology with implications for paleobiodiversity estimation" (PDF). Micropaleontology. 51 (4): 267–288. doi:10.2113/gsmicropal.51.4.267.
- ^ a b c d Haunost, 마티아스, Riebesell, 울프, D'Amore, 프란체스코, Kelting, 올레, 바흐, 레나트 T.(6월 30일 2021년)."그 칼슘 카보네이트 쉘 Coccolithophores의 Ingestion에 미치는 영향과 와 편모충류 프레데터의 성장".해양 과학에 국경.둔 미디어 SA.8.doi:10.3389/fmars.2021.664269.ISSN 2296-7745.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Bown, Paul R.; Lees, Jackie A.; Young, Jeremy R. (2004). "Calcareous nannoplankton evolution and diversity through time". Coccolithophores. pp. 481–508. doi:10.1007/978-3-662-06278-4_18. ISBN 978-3-642-06016-8.
- ^ Hay, William W. (2004). "Carbonate fluxes and calcareous nannoplankton". Coccolithophores. pp. 509–528. doi:10.1007/978-3-662-06278-4_19. ISBN 978-3-642-06016-8.
- ^ Poulton, Alex J.; Adey, Tim R.; Balch, William M.; Holligan, Patrick M. (2007). "Relating coccolithophore calcification rates to phytoplankton community dynamics: Regional differences and implications for carbon export". Deep Sea Research Part II: Topical Studies in Oceanography. 54 (5–7): 538–557. Bibcode:2007DSRII..54..538P. doi:10.1016/j.dsr2.2006.12.003.
- ^ Broecker, Wallace; Clark, Elizabeth (2009). "Ratio of coccolith CaCO3to foraminifera CaCO3in late Holocene deep sea sediments". Paleoceanography. 24 (3). Bibcode:2009PalOc..24.3205B. doi:10.1029/2009PA001731.
- ^ Klaas, Christine; Archer, David E. (2002). "Association of sinking organic matter with various types of mineral ballast in the deep sea: Implications for the rain ratio". Global Biogeochemical Cycles. 16 (4): 1116. Bibcode:2002GBioC..16.1116K. doi:10.1029/2001GB001765. S2CID 34159028.
- ^ Honjo, Susumu; Manganini, Steven J.; Krishfield, Richard A.; Francois, Roger (2008). "Particulate organic carbon fluxes to the ocean interior and factors controlling the biological pump: A synthesis of global sediment trap programs since 1983". Progress in Oceanography. 76 (3): 217–285. Bibcode:2008PrOce..76..217H. doi:10.1016/j.pocean.2007.11.003.
- ^ Frankignoulle, Michel; Canon, Christine; Gattuso, Jean-Pierre (1994). "Marine calcification as a source of carbon dioxide: Positive feedback of increasing atmospheric CO2". Limnology and Oceanography. 39 (2): 458–462. Bibcode:1994LimOc..39..458F. doi:10.4319/lo.1994.39.2.0458. hdl:2268/246251.
- ^ Rost, Björn; Riebesell, Ulf (2004). "Coccolithophores and the biological pump: Responses to environmental changes". Coccolithophores. pp. 99–125. doi:10.1007/978-3-662-06278-4_5. ISBN 978-3-642-06016-8.
- ^ 영, J. R.(1987년)구개석 형태학의 가능한 기능적 해석.뉴욕: 스프링거-발락, 305-313.
- ^ 영, J. R. (1994년)"Coccolithophores"의 "Coccolithophores"는 eds A.Winter 및 W.G. Siesser (캠브리지:케임브리지 대학 출판부), 63~82.
- ^ Raven, JA; Crawfurd, K. (2012). "Environmental controls on coccolithophore calcification". Marine Ecology Progress Series. 470: 137–166. Bibcode:2012MEPS..470..137R. doi:10.3354/meps09993.
- ^ a b c d e f g h i j Monteiro, Fanny M.; Bach, Lennart T.; Brownlee, Colin; Bown, Paul; Rickaby, Rosalind E. M.; Poulton, Alex J.; Tyrrell, Toby; Beaufort, Luc; Dutkiewicz, Stephanie; Gibbs, Samantha; Gutowska, Magdalena A.; Lee, Renee; Riebesell, Ulf; Young, Jeremy; Ridgwell, Andy (2016). "Why marine phytoplankton calcify". Science Advances. 2 (7): e1501822. Bibcode:2016SciA....2E1822M. doi:10.1126/sciadv.1501822. PMC 4956192. PMID 27453937.
- ^ Müller, Marius N. (2019). "On the Genesis and Function of Coccolithophore Calcification". Frontiers in Marine Science. 6. doi:10.3389/fmars.2019.00049.
- ^ a b Hamm, Christian; Smetacek, Victor (2007). "Armor: Why, when, and How". Evolution of Primary Producers in the Sea. pp. 311–332. doi:10.1016/B978-012370518-1/50015-1. ISBN 9780123705181.
- ^ Brussaard, Corina P. D. (2004). "Viral Control of Phytoplankton Populations-a Review1". The Journal of Eukaryotic Microbiology. 51 (2): 125–138. doi:10.1111/j.1550-7408.2004.tb00537.x. PMID 15134247. S2CID 21017882.
- ^ Johns, Christopher T.; Grubb, Austin R.; Nissimov, Jozef I.; Natale, Frank; Knapp, Viki; Mui, Alwin; Fredricks, Helen F.; Van Mooy, Benjamin A. S.; Bidle, Kay D. (2019). "The mutual interplay between calcification and coccolithovirus infection". Environmental Microbiology. 21 (6): 1896–1915. doi:10.1111/1462-2920.14362. PMC 7379532. PMID 30043404.
- ^ Haunost, Mathias; Riebesell, Ulf; Bach, Lennart T. (2020). "The Calcium Carbonate Shell of Emiliania huxleyi Provides Limited Protection Against Viral Infection". Frontiers in Marine Science. 7. doi:10.3389/fmars.2020.530757.
- ^ Calbet, Albert; Landry, Michael R. (2004). "Phytoplankton growth, microzooplankton grazing, and carbon cycling in marine systems". Limnology and Oceanography. 49 (1): 51–57. Bibcode:2004LimOc..49...51C. doi:10.4319/lo.2004.49.1.0051. hdl:10261/134985. S2CID 22995996.
- ^ Mayers, K.M.J.; Poulton, A.J.; Daniels, C.J.; Wells, S.R.; Woodward, E.M.S.; Tarran, G.A.; Widdicombe, C.E.; Mayor, D.J.; Atkinson, A.; Giering, S.L.C. (2019). "Growth and mortality of coccolithophores during spring in a temperate Shelf Sea (Celtic Sea, April 2015)". Progress in Oceanography. 177: 101928. Bibcode:2019PrOce.17701928M. doi:10.1016/j.pocean.2018.02.024. S2CID 135347218.
- ^ 영, J. R. (1994) "구석류의 기능"삽입: 구석류, Eds A.Winter 및 W.G. Siesser (캠브리지:케임브리지 대학 출판부), 63~82.
- ^ Tillmann, Urban (2004). "Interactions between Planktonic Microalgae and Protozoan Grazers1". The Journal of Eukaryotic Microbiology. 51 (2): 156–168. doi:10.1111/j.1550-7408.2004.tb00540.x. PMID 15134250. S2CID 36526359.
- ^ Breckels, M. N.; Roberts, E. C.; Archer, S. D.; Malin, G.; Steinke, M. (2011). "The role of dissolved infochemicals in mediating predator-prey interactions in the heterotrophic dinoflagellate Oxyrrhis marina". Journal of Plankton Research. 33 (4): 629–639. doi:10.1093/plankt/fbq114.
- ^ Aloisi, G. (6 August 2015). "Covariation of metabolic rates and cell size in coccolithophores". Biogeosciences. Copernicus GmbH. 12 (15): 4665–4692. Bibcode:2015BGeo...12.4665A. doi:10.5194/bg-12-4665-2015. ISSN 1726-4189. S2CID 6227548.
- ^ Henderiks, Jorijntje (2008). "Coccolithophore size rules — Reconstructing ancient cell geometry and cellular calcite quota from fossil coccoliths". Marine Micropaleontology. Elsevier BV. 67 (1–2): 143–154. Bibcode:2008MarMP..67..143H. doi:10.1016/j.marmicro.2008.01.005. ISSN 0377-8398.
- ^ a b Moheimani, N.R.; Webb, J.P.; Borowitzka, M.A. (2012), "Bioremediation and other potential applications of coccolithophorid algae: A review. . Bioremediation and other potential applications of coccolithophorid algae: A review", Algal Research, 1 (2): 120–133, doi:10.1016/j.algal.2012.06.002
- ^ a b 를 클릭합니다Billard, Chantal; Inouye, Isoa (August 17, 2004). "What is new in coccolithophore biology?". In Thierstein, Hans R.; Young, Jeremy R. (eds.). Coccolithophores-from molecular processes to global impact. Berlin: Springler. pp. 1–29. ISBN 9783540219286..
- ^ a b Jordan, R.W. (2012), "Haptophyta", eLS, doi:10.1002/9780470015902.a0001981.pub2, ISBN 978-0470016176
- ^ a b Young, J.R.; Karen, H. (2003). "Biomineralization Within Vesicles: The Calcite of Coccoliths". In Dove, P.M.; Yoreo, J.J.; Weiner, S. (eds.). Reviews in Mineralogy and Geochemistry. Washington, D.C.: Mineralogical Society of America. pp. 189–216.
- ^ a b Vardi, A.; et al. (2012), "Host–virus dynamics and subcellular controls of cell fate in a natural coccolithophore population", Proceedings of the National Academy of Sciences, 109 (47): 19327–19332, Bibcode:2012PNAS..10919327V, doi:10.1073/pnas.1208895109, PMC 3511156, PMID 23134731
- ^ a b c Houdan; Probert, I; Zatylny, C; Véron, B; Billard, C; et al. (2006), ". Ecology of oceanic coccolithophores. I. Nutritional preferences of the two stages in the life cycle of Coccolithus braarudii and Calcidiscus leptoporus", Aquatic Microbial Ecology, 44: 291–301, doi:10.3354/ame044291
- ^ a b c Hogan, M.C. ""Coccolithophores"". In Cleveland, Cutler J. (ed.). Encyclopedia of Earth. Washington, D.C.: Environmental Information Coalition, National Council for Science and the Environment.
- ^ a b 를 클릭합니다Geisen, M.; et al. (August 17, 2004). "Species level variation in coccolithophores=". In Thierstein, Hans R.; Young, Jeremy R. (eds.). Coccolithophores-from molecular processes to global impact. Berlin: Springler. pp. 1–29. ISBN 9783540219286..
- ^ a b Jordan, R. W.; Chamberlain, A.H.L. (1997), "Biodiversity among haptophyte algae", Biodiversity & Conservation, 6 (1): 131–152, doi:10.1023/A:1018383817777, S2CID 9564456
- ^ Boeckel; Baumann, Karl-Heinz; Henrich, Rüdiger; Kinkel, Hanno; et al. (2006), "Coccolith distribution patterns in South Atlantic and Southern Ocean surface sediments in relation to environmental gradients", Deep-Sea Research Part I: Oceanographic Research Papers, 53 (6): 1073–1099, Bibcode:2006DSRI...53.1073B, doi:10.1016/j.dsr.2005.11.006
- ^ a b c de Vargas, C.; Aubrey, M.P.; Probert, I.; Young, J. (2007). "From coastal hunters to oceanic farmers.". In Falkowski, P.G.; Knoll, A.H. (eds.). Origin and Evolution of Coccolithophores. Boston: Elsevier. pp. 251–285.
- ^ a b c Okada; Honjo, Susumu; et al. (1973), "The distribution of oceanic coccolithophores in the Pacific", Deep-Sea Research and Oceanographic Abstracts, 20 (4): 355–374, Bibcode:1973DSROA..20..355O, doi:10.1016/0011-7471(73)90059-4
- ^ a b Kinkel, H.; et al. (2000), "Coccolithophores in the equatorial Atlantic Ocean: response to seasonal and Late Quaternary surface water variability", Marine Micropaleontology, 39 (1–4): 87–112, Bibcode:2000MarMP..39...87K, doi:10.1016/s0377-8398(00)00016-5
- ^ 가파, 뉴저지, 에어, B.D. 및 슐츠, K.G.(2019) "해양 식물성 플랑크톤 석회화에서 빛과 탄산염 화학의 변화에 대한 종별 민감도 비교"자연: Scientific Reports, 9 (1) : 1~12.doi : 10.1038/s41598-019-38661-0.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ a b c Young, J.R.; et al. (2009), "Coccolith function and morphogenesis: insights from appendage-bearing coccolithophores of the family syracosphaeraceae (haptophyta)", Journal of Phycology, 45 (1): 213–226, doi:10.1111/j.1529-8817.2008.00643.x, PMID 27033659
- ^ Daniels, C.J., Sheward, R.M. 및 Pouldon, A.J.(2014) "에밀리안니아 헉슬레이와 코코리서스 종의 비교 성장률에 대한 생물 지구 화학적 영향"생물지리과학, 11(23): 6915-6925.doi: 10.5194/bg-11-6915-2014.
- ^ Durak, G.M., Taylor, A.R, Walker, C.E., Probert, I., De Vargas, C., Audic, S., Schroeder, D., Brownlee, C. 및 Wheeler, G.L. (2016) 규소 유사 수송기의 역할.네이처 커뮤니케이션 7시 10543분doi:10.1038/ncomms10543.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ 스미스, 헬렌은 E.K.;Poulton, 알렉스는 J.;Garley, 레베카, 홉킨스, 제이슨, Lubelczyk, 로라 C;Drapeau, 데이브 T.;라우션 버그, 새라, Twining, 벤 S.;베이츠, 니콜라스 R.;볼치, 윌리엄 M.(2017년)."환경 변이성 coccolithophores과 가진 규조류의 생물 지리학에서 거대 방해석 벨트에 영향은".Biogeosciences.14(21):4905–4925.Bibcode:2017BGeo...14.4905S. doi:10.5194/bg-14-4905-2017.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Balch, W. M.; Gordon, Howard R.; Bowler, B. C.; Drapeau, D. T.; Booth, E. S. (2005). "Calcium carbonate measurements in the surface global ocean based on Moderate-Resolution Imaging Spectroradiometer data". Journal of Geophysical Research. 110 (C7): C07001. Bibcode:2005JGRC..110.7001B. doi:10.1029/2004JC002560.
- ^ Sarmiento, Jorge L.; Hughes, Tertia M. C.; Stouffer, Ronald J.; Manabe, Syukuro (1998). "Simulated response of the ocean carbon cycle to anthropogenic climate warming". Nature. 393 (6682): 245–249. Bibcode:1998Natur.393..245S. doi:10.1038/30455. S2CID 4317429.
- ^ Sarmiento, J. L.; Slater, R.; Barber, R.; Bopp, L.; Doney, S. C.; Hirst, A. C.; Kleypas, J.; Matear, R.; Mikolajewicz, U.; Monfray, P.; Soldatov, V.; Spall, S. A.; Stouffer, R. (2004). "Response of ocean ecosystems to climate warming". Global Biogeochemical Cycles. 18 (3): n/a. Bibcode:2004GBioC..18.3003S. doi:10.1029/2003GB002134. hdl:1912/3392. S2CID 15482539.
- ^ Balch, W. M.; Drapeau, D. T.; Bowler, B. C.; Lyczskowski, E.; Booth, E. S.; Alley, D. (2011). "The contribution of coccolithophores to the optical and inorganic carbon budgets during the Southern Ocean Gas Exchange Experiment: New evidence in support of the "Great Calcite Belt" hypothesis". Journal of Geophysical Research. 116 (C4): C00F06. Bibcode:2011JGRC..116.0F06B. doi:10.1029/2011JC006941.
- ^ Sabine, C. L.; Feely, R. A.; Gruber, N.; Key, R. M.; Lee, K.; Bullister, J. L.; Wanninkhof, R.; Wong, C. S.; Wallace, D. W.; Tilbrook, B.; Millero, F. J.; Peng, T. H.; Kozyr, A.; Ono, T.; Rios, A. F. (2004). "The Oceanic Sink for Anthropogenic CO2" (PDF). Science. 305 (5682): 367–371. Bibcode:2004Sci...305..367S. doi:10.1126/science.1097403. PMID 15256665. S2CID 5607281.
- ^ Gitau, Beatrice (28 November 2015). "What's fueling the rise of coccolithophores in the oceans?". www.csmonitor.com. The Christian Science Monitor. Retrieved 30 November 2015.
- ^ "Viral Zone". ExPASy. Retrieved 15 June 2015.
- ^ ICTV. "Virus Taxonomy: 2014 Release". Retrieved 15 June 2015.
- ^ 알려진 가장 큰 바이러스 게놈 Giantviruses.org.접속일 : 2020년 6월 11일
- ^ Rost, B.; Riebesell, U. (2004), "Coccolithophores and the biological pump: responses to environmental changes" (PDF), Coccolithophores, 2: 99–125, CiteSeerX 10.1.1.455.2864, doi:10.1007/978-3-662-06278-4_5, ISBN 978-3-642-06016-8
- ^ Morrissey, J.F.; Sumich, J.L. (2012). Introduction to the Biology of Marine Life. p. 67.
- ^ a b Houdan, A.; et al. (2004), "Toxicity of coastal coccolithophores (Prymnesiophyceae, Haptophyta)", Journal of Plankton Research, 26 (8): 875–883, doi:10.1093/plankt/fbh079
- ^ Litchman, E.; et al. (2007), "The role of functional traits and trade-offs in structuring phytoplankton communities: scaling from cellular to ecosystem level", Ecology Letters, 10 (12): 1170–1181, doi:10.1111/j.1461-0248.2007.01117.x, PMID 17927770
- ^ Frada, M.; et al. (2008), "The "Cheshire Cat" escape strategy of the coccolithophore Emiliania huxleyi in response to viral infection", Proceedings of the National Academy of Sciences, 105 (41): 15944–15949, Bibcode:2008PNAS..10515944F, doi:10.1073/pnas.0807707105, PMC 2572935, PMID 18824682
- ^ Taylor, Alison R.; Brownlee, Colin; Wheeler, Glen (2017-01-03). "Coccolithophore Cell Biology: Chalking Up Progress" (PDF). Annual Review of Marine Science. Annual Reviews. 9 (1): 283–310. Bibcode:2017ARMS....9..283T. doi:10.1146/annurev-marine-122414-034032. ISSN 1941-1405. PMID 27814031.
- ^ Gardin, Silvia; Krystyn, Leopold; Richoz, Sylvain; Bartolini, Annachiara; Galbrun, Bruno (October 2012). "Where and when the earliest coccolithophores?: Where and when the earliest coccolithophores?". Lethaia. 45 (4): 507–523. doi:10.1111/j.1502-3931.2012.00311.x.
- ^ Falkowski, P.G.; Knoll, A.H. (August 29, 2007). Evolution of Primary Producers in the Sea. Amsterdam, Boston: Elsevier Academic Press. ISBN 9780123705181.
- ^ Linschooten, Cornelis; et al. (1991), "Role of the light-dark cycle and medium composition on the production of coccoliths by Emiliania huxleyi (haptophyceae)", Journal of Phycology, 27 (1): 82–86, doi:10.1111/j.0022-3646.1991.00082.x, S2CID 84368830
- ^ "Microscopic marine plants bioengineer their environment to enhance their own growth - The Conversation".
- ^ Westbroek, P.; et al. (1983), "Calcification in Coccolithophoridae: Wasteful or Functional?", Ecological Bulletins: 291–299
- ^ Irie, Takahiro; et al. (2010), "Increasing costs due to ocean acidification drives phytoplankton to be more heavily calcified: optimal growth strategy of coccolithophores", PLOS ONE, 5 (10): e13436, Bibcode:2010PLoSO...513436I, doi:10.1371/journal.pone.0013436, PMC 2955539, PMID 20976167
- ^ Krumhardt, Kristen M.; Lovenduski, Nicole S.; Iglesias-Rodriguez, M. Debora; Kleypas, Joan A. (2017). "Coccolithophore growth and calcification in a changing ocean". Progress in Oceanography. 159: 276–295. Bibcode:2017PrOce.159..276K. doi:10.1016/j.pocean.2017.10.007.
- ^ 대니얼스, 크리스 J.;Poulton, 알렉스는 J.;볼치, 윌리엄 M.;Marañón, 에밀리오?Adey, 팀;보울러, 브루스 C;Cermeño, 페드로;Charalampopoulou, 아나스타샤, 크로포드, 데이비드 안스, Drapeau, 데이브, 펑, Yuanyuan, 페르난데스, 어록, 페르난데스, 에밀리오, Fragoso, 글 라우키아:Scamander의 딸. M., 곤살레스, 나탈리아;그라지아누, 리사는 M.;Heslop, 레이첼, Holligan, 패트릭 M., 홉킨스, 제이슨, Huete-Ortega, 마리아, 허친스, 데이비드 A.;램, 피비 J.;Lipsen, 마이클 S.,.López-Sandoval, Daffne C;Loucaides, 소크라테스 학도.;마체티, Adrian은, 외교관, 카일은 M.J.;리스, 앤드류 P., 제분소, 크리스티나,(알.(2018년)."coccolithophore 석회화율 주는 전 세계의 컴파일".지구 시스템 과학 데이터. 10(4):1859–1876. Bibcode:2018ESSD...10.1859D. doi:10.5194/essd-10-1859-2018.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ a b Taylor, Alison R.; Chrachri, Abdul; Wheeler, Glen; Goddard, Helen; Brownlee, Colin (2011). "A Voltage-Gated H+ Channel Underlying pH Homeostasis in Calcifying Coccolithophores". PLOS Biology. 9 (6): e1001085. doi:10.1371/journal.pbio.1001085. PMC 3119654. PMID 21713028.
- ^ Taylor, Alison R.; Brownlee, Colin; Wheeler, Glen L. (2012). "Proton channels in algae: Reasons to be excited". Trends in Plant Science. 17 (11): 675–684. doi:10.1016/j.tplants.2012.06.009. PMID 22819465.
- ^ Benner, Ina; Diner, Rachel E.; Lefebvre, Stephane C.; Li, Dian; Komada, Tomoko; Carpenter, Edward J.; Stillman, Jonathon H. (2013). "Emiliania huxleyi increases calcification but not expression of calcification-related genes in long-term exposure to elevated temperature and p CO 2". Philosophical Transactions of the Royal Society B: Biological Sciences. 368 (1627). doi:10.1098/rstb.2013.0049. PMC 3758179. PMID 23980248.
- ^ Lohbeck, Annette; Tietjens, Maike; Bund, Andreas (2014). "Das physische Selbstkonzept, die individuell präferierte Bezugsnormorientierung und die Zielorientierung bei Grundschulkindern der zweiten und vierten Jahrgangsstufe". Zeitschrift für Sportpsychologie. 21: 1–12. doi:10.1026/1612-5010/a000109.
- ^ a b Erba, Elisabetta; Tremolada, Fabrizio (2004). "Nannofossil carbonate fluxes during the Early Cretaceous: Phytoplankton response to nutrification episodes, atmospheric CO2, and anoxia". Paleoceanography. 19 (1): n/a. Bibcode:2004PalOc..19.1008E. doi:10.1029/2003PA000884.
- ^ a b Erba, Elisabetta (2006). "The first 150 million years history of calcareous nannoplankton: Biosphere–geosphere interactions". Palaeogeography, Palaeoclimatology, Palaeoecology. 232 (2–4): 237–250. Bibcode:2006PPP...232..237E. doi:10.1016/j.palaeo.2005.09.013.
- ^ a b c d 바흐, 레나트 토마스, Riebesell, 울프, Gutowska, 마그달레나 A;.Federwisch, 루이사, 슐츠, 카이 게오르크(2015년)."탄산 화학을 바꾸는 것이coccolithophore 대한 단결된 개념 생태학적 틀 속에 들어 있어".진보 해양에. 135:125–138.Bibcode:2015PrOce.135..125B. doi:10.1016/j.pocean.2015.04.012.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ Van De Waal, Dedmer B.; John, Uwe; Ziveri, Patrizia; Reichart, Gert-Jan; Hoins, Mirja; Sluijs, Appy; Rost, Björn (2013). "Ocean Acidification Reduces Growth and Calcification in a Marine Dinoflagellate". PLOS ONE. 8 (6): e65987. Bibcode:2013PLoSO...865987V. doi:10.1371/journal.pone.0065987. PMC 3679017. PMID 23776586.
- ^ Tortell, Philippe D. (2000). "Evolutionary and ecological perspectives on carbon acquisition in phytoplankton". Limnology and Oceanography. 45 (3): 744–750. Bibcode:2000LimOc..45..744T. doi:10.4319/lo.2000.45.3.0744.
- ^ Fu, Fei-Xue; Zhang, Yaohong; Warner, Mark E.; Feng, Yuanyuan; Sun, Jun; Hutchins, David A. (2008). "A comparison of future increased CO2 and temperature effects on sympatric Heterosigma akashiwo and Prorocentrum minimum". Harmful Algae. 7: 76–90. doi:10.1016/j.hal.2007.05.006.
- ^ Reinfelder, John R. (2011). "Carbon Concentrating Mechanisms in Eukaryotic Marine Phytoplankton". Annual Review of Marine Science. 3: 291–315. Bibcode:2011ARMS....3..291R. doi:10.1146/annurev-marine-120709-142720. PMID 21329207.
- ^ Fileman, E.S.; Cummings, D.G.; Llewellyn, C.A. (2002). "Microplankton community structure and the impact of microzooplankton grazing during an Emiliania huxleyi bloom, off the Devon coast". Journal of the Marine Biological Association of the United Kingdom. 82 (3): 359–368. doi:10.1017/S0025315402005593. S2CID 85890446.
- ^ Olson, M.Brady; Strom, Suzanne L. (2002). "Phytoplankton growth, microzooplankton herbivory and community structure in the southeast Bering Sea: Insight into the formation and temporal persistence of an Emiliania huxleyi bloom". Deep Sea Research Part II: Topical Studies in Oceanography. 49 (26): 5969–5990. Bibcode:2002DSRII..49.5969O. doi:10.1016/S0967-0645(02)00329-6.
- ^ Mayers, K.M.J.; Poulton, A.J.; Daniels, C.J.; Wells, S.R.; Woodward, E.M.S.; Tarran, G.A.; Widdicombe, C.E.; Mayor, D.J.; Atkinson, A.; Giering, S.L.C. (2019). "Growth and mortality of coccolithophores during spring in a temperate Shelf Sea (Celtic Sea, April 2015)". Progress in Oceanography. 177: 101928. Bibcode:2019PrOce.17701928M. doi:10.1016/j.pocean.2018.02.024. S2CID 135347218.
- ^ Mayers, Kyle M. J.; Poulton, Alex J.; Bidle, Kay; Thamatrakoln, Kimberlee; Schieler, Brittany; Giering, Sarah L. C.; Wells, Seona R.; Tarran, Glen A.; Mayor, Dan; Johnson, Matthew; Riebesell, Ulf; Larsen, Aud; Vardi, Assaf; Harvey, Elizabeth L. (2020). "The Possession of Coccoliths Fails to Deter Microzooplankton Grazers". Frontiers in Marine Science. 7. doi:10.3389/fmars.2020.569896.
- ^ Hansen, FC; Witte, HJ; Passarge, J. (1996). "Grazing in the heterotrophic dinoflagellate Oxyrrhis marina: Size selectivity and preference for calcified Emiliania huxleyi cells". Aquatic Microbial Ecology. 10: 307–313. doi:10.3354/ame010307.
- ^ a b Harvey, Elizabeth L.; Bidle, Kay D.; Johnson, Matthew D. (2015). "Consequences of strain variability and calcification in Emiliania huxleyion microzooplankton grazing". Journal of Plankton Research: fbv081. doi:10.1093/plankt/fbv081.
- ^ a b Strom, Suzanne L.; Bright, Kelley J.; Fredrickson, Kerri A.; Cooney, Elizabeth C. (2018). "Phytoplankton defenses: Do Emiliania huxleyi coccoliths protect against microzooplankton predators?". Limnology and Oceanography. 63 (2): 617–627. Bibcode:2018LimOc..63..617S. doi:10.1002/lno.10655. S2CID 90415703.
- ^ Mejia, R. (2011), "Will Ion Channels Help Coccolithophores Adapt to Ocean Acidification?", PLOS Biology, 9 (6): e1001087, doi:10.1371/journal.pbio.1001087, PMC 3119655, PMID 21713029
- ^ Mackinder; Wheeler, Glen; Schroeder, Declan; Riebesell, Ulf; Brownlee, Colin; et al. (2010), "Molecular Mechanisms Underlying Calcification in Coccolithophores", Geomicrobiology Journal, 27 (6–7): 585–595, doi:10.1080/01490451003703014, S2CID 85403507
- ^ Bates; Michaels, Anthony F.; Knap, Anthony H.; et al. (1996), "Alkalinity changes in the Sargasso Sea; geochemical evidence of calfication?", Marine Chemistry, 51 (4): 347–358, doi:10.1016/0304-4203(95)00068-2
- ^ a b Marsh, M.E. (2003), "Regulation of CaCO3 formation in coccolithophores", Comparative Biochemistry and Physiology B, 136 (4): 743–754, doi:10.1016/s1096-4959(03)00180-5, PMID 14662299
- ^ a b Beaufort, L.; et al. (2011), "Sensitivity of coccolithophores to carbonate chemistry and ocean acidification", Nature, 476 (7358): 80–3, doi:10.1038/nature10295, PMID 21814280, S2CID 4417285
- ^ Tyrell, T.; et al. (1999), "Optical impacts of oceanic coccolithophore blooms", Journal of Geophysical Research, 104 (C2): 3223–3241, Bibcode:1999JGR...104.3223T, doi:10.1029/1998jc900052
- ^ "Can seashells save the world?". Independent.co.uk. 22 April 2008.
- ^ "cal.mar.o". Archived from the original on 2020-12-30. Retrieved 2021-04-24.
- ^ Taylor, A.R.; Chrachri, A.; Wheeler, G.; Goddard, H.; Brownlee, C. (2011). "A voltage-gated H+ channel underlying pH homeostasis in calcifying coccolithophores". PLOS Biology. 9 (6): e1001085. doi:10.1371/journal.pbio.1001085. PMC 3119654. PMID 21713028.
- ^ Self-Trail, J.M.; et al. (2012), "Calcareous Nannofossil Assemblage Changes Across the Paleocene-Eocene Thermal Maximum: Evidence from a Shelf Setting", Marine Micropaleontology, 92–93: 61–80, Bibcode:2012MarMP..92...61S, doi:10.1016/j.marmicro.2012.05.003
- ^ Lloyd, G.T.; et al. (2011), "Quantifying the deep-sea rock and fossil record bias using coccolithophores", Geological Society, London, Special Publications, 358 (1): 167–177, Bibcode:2011GSLSP.358..167L, doi:10.1144/sp358.11, S2CID 129049029
- ^ Charlson, Robert J.; Lovelock, James E.; Andreae, Meinrat O.; Warren, Stephen G. (1987). "Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate". Nature. 326 (6114): 655–661. Bibcode:1987Natur.326..655C. doi:10.1038/326655a0. S2CID 4321239.
- ^ Lovelock, James (2007). The Revenge of Gaia. Penguin. ISBN 978-0-14-102597-1.
- ^ Larsen, S. H. (2005). "Solar variability, dimethyl sulphide, clouds, and climate". Global Biogeochemical Cycles. 19 (1): GB1014. Bibcode:2005GBioC..19.1014L. doi:10.1029/2004GB002333.
외부 링크
상세 정보의 출처
- Nannotax3 – 콕석소체 및 기타 나노화석 분류에 대한 설명.
- INA - 국제 난노플랑크톤 협회
- Emiliania huxleyi 홈페이지
콕콜리소포어 소개
- 캘리포니아 대학교 버클리.고생물학 박물관: "프림네시오피타 입문"
- 고생물학 포털:석회질 나노플랭크톤
- Radio Lab – 콕콜리소포어에 관한 팟캐스트