클로스트리듐디피실독소B
Clostridium difficile toxin B| 독소 B | |||||||
|---|---|---|---|---|---|---|---|
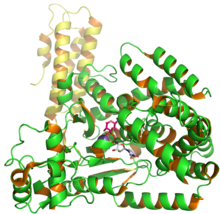 PDB 엔트리 2BVM에서 [1]UDP 및 글루소스를 나타내는 C. 디피실글루코실전달효소 Toxin B의 구조. | |||||||
| 식별자 | |||||||
| 유기체 | |||||||
| 기호. | 톡스B | ||||||
| Alt. | tcdB | ||||||
| 엔트레즈 | 4914074 | ||||||
| PDB | 2 BVM | ||||||
| RefSeq(프로트) | YP_001087135.1 | ||||||
| 유니프로트 | P18177 | ||||||
| 기타 데이터 | |||||||
| EC 번호 | 2.4.1.- | ||||||
| 염색체 | 게놈: 0.79~0.8Mb | ||||||
| |||||||
| TcdB독소N말단나선도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | TcdB_N | ||||||||
| 팜 | PF12918 | ||||||||
| |||||||||
| TcdA/TcdB 촉매 글리코실전달효소 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | TcdA_TcdB | ||||||||
| 팜 | PF12919 | ||||||||
| |||||||||
| 펩티드가수분해효소 C80 패밀리 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | 펩티드가수분해효소_C80 | ||||||||
| 팜 | PF11713 | ||||||||
| 인터프로 | IPR020974 | ||||||||
| |||||||||
| TcdA/TcdB 모공 형성 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호. | TcdA_TcdB_pore | ||||||||
| 팜 | PF12920 | ||||||||
| TCDB | 1. C.57 | ||||||||
| OPM 슈퍼 패밀리 | 199 | ||||||||
| OPM단백질 | 6분기 | ||||||||
| |||||||||
클로스트리듐 디피실 독소 B는 클로스트리듐 디피실이라고 알려진 클로스트리디오이데스 디피실 박테리아에 의해 생성된 세포독소이다.C. 디피실(difficile)에 의해 생성되는 두 가지 주요 독소 중 하나이며, 다른 하나는 관련된 장독소(Toxin A)입니다.둘 다 매우 강력하고 [2][3]치명적이다.
구조.
독소 B(TcdB)는 분자량이 270 kDa이고 등전점 pl이 4.[4]1인 세포독소이다.독소 B는 촉매, 시스테인 단백질 분해효소, 전위 및 수용체 [5]결합의 네 가지 다른 구조적 도메인을 가지고 있습니다.N 말단 글루코실전달효소 촉매 도메인은 아미노산 잔류물 1~544를 포함하고, 시스테인 단백질 분해효소 도메인은 잔류물 545~801을 포함한다.또한 전위 영역은 802~1664의 아미노산 잔기를 포함하고 수용체 결합 영역은 C 말단 영역의 일부이며 1665~[5]2366의 아미노산 잔기를 포함한다.
독소 B의 글리코실화 활성은 N 말단 촉매 영역(잔류 1~544)에서 발생한다.이 영역은 세포독성 [6]활성과는 무관하게 기질을 글리코실화한다.단, 수용체 결합 영역의 작은 결실은 독소 B [6]활성의 감쇠를 일으킨다.전위 영역은 소수성 줄기와 같은 구조를 포함하고 있으며, 이는 [5]모공을 가로지르는 막 형성에 잔류물 958–1130을 도울 수 있다.C 말단 반복 영역(CRR)을 포함하는 수용체 결합 영역은 TcdB 막 상호작용을 증가시키지만 모공 형성에 [7]참여하지 않습니다.또한 시스테인 단백질 분해효소 및 전위 영역은 모두 전위 및 수용체 [8]결합에 중요한 기능적 역할을 하는 복잡한 구조를 가지고 있다.그러나 아미노산의 전위 영역을 삭제하면 세포독성 활성이 4배 감소한다.시스테인 단백질 분해효소 및 대부분의 전위 부위는 TcdB 및 세포막을 [8]가로지르는 다른 독소에 대한 접근을 보여주는 소수성 단백질을 가지고 있습니다.
수용체 결합 도메인
TcdB의 C 말단(그림 2의 녹색 영역)에는 아미노산 잔기 1831–2366을 [9]포함하는 복합 반복 올리고펩타이드(CROPs)로 알려진 영역이 포함되어 있다.이러한 CROP는 아미노산의 19~24회, 아미노산, 독소 A 및 독소 [9][10]B의 약 31회(LRs)의 짧은 반복을 구성합니다.TcdB CROPS 영역은 19개의 SR과 4개의 LR로 구성됩니다.이 SRs 및 LRs 영역은 세포 [9]표면의 설탕 부분을 결합하는 데 도움이 되는 세포벽 결합 모티브의 형성을 가능하게 합니다.
정화
C. 디피실 세포배양에서 독소 B를 정제하기 위해 뇌심장 주입 육수를 사용하는 것은 독소 [11]B의 합성을 촉진하기 때문이다.여과방법은 C. difficile의 상등액에서 독소 B의 정화를 용이하게 한다.상등액의 독소 농도는 생물 세포 수에 비례한다.많은 연구에서 대부분의 독소는 후기 로그 단계 또는 초기 정지 단계에서 방출되므로 독소 B는 [2]세포에 의해 지속적으로 분비된다.독소 B를 정제하는 데는 여러 가지 방법이 있지만, 대부분의 연구는 겔 여과 또는 이온 교환 크로마토그래피 대신 초여과된 황산암모늄 농도 또는 침전을 포함하는 방법을 사용한다.또, 이온 교환 크로마토그래피법의 효과는, TcdA와 TcdB의 구별에 도움이 된다.
기능.
글루코실전달효소(glucosyl transferase)의 촉매 트레오닌 잔기가 표적 세포 내부의 Rho 패밀리, Rac 및 Cdc42와 같은 작은 GTPas군을 비활성화하면 신호 전달 메커니즘이 교란되어 액틴 세포골격, 세포 접합부 및 아포토시스(apotosis)의 기능 부전으로 이어진다.[12][13][14]Rho는 액틴 응력 섬유의 활성을 유도한다.라크 단백질은 막 러플링과 NADPH-옥시다아제 호중구의 활동을 조절한다.Cdc42는 필로포디아의 F액틴 필라멘트 형성을 조절한다.
세포독성
포유동물 세포에서 TcdB의 존재가 세포 형태학과 세포 신호 전달에 빠른 변화를 가져온다는 것이 여러 연구에서 입증되었다.짧은 시간 내에, 세포는 TcdB와 TcdA의 작은 용량으로 플라크의 모습을 보인다.게다가 세포의 죽음은 세포가 중독된 후 이러한 독소의 주요 영향이다.Donta 등에 의한 연구는 TcdB가 중국 햄스터 난소 세포, 인간 자궁경부 상피 세포, 쥐 부신 세포, 쥐 간 세포 및 쥐 성상 세포와 같은 다른 포유동물 세포에 심각한 영향을 미친다는 것을 전달하였다(그림3).[15][16]
세포독성 활성은 세포유형에 기초하며, 세포유형은 4배에서 200배까지 다양할 수 있다.일반적으로 세포가 TcdB에 감염되면, 그들은 구조적인 건전성뿐만 아니라 F-actin 필라멘트의 [17]감소도 잃는다.TcdB에 의한 세포 반올림은 2시간 이내(그림4), 세포 사멸에 관한 한 약 24시간이 [15]소요될 수 있다.클로스트리듐 디피실 관련 설사(CDAD)와 관련하여 세포는 일단 세포골격 액틴 필라멘트의 무결성을 잃으면 정상적인 기능도 상실하기 때문에 세포병성 효과는 실제 세포사보다 더 중요하다.

소규모 GTPas에 대한 영향
이 섹션의 사실적 정확성은 논란의 여지가 있다.(2013년 6월 (이 및 ) |
숙주 세포 내에서 TcdB에 의한 세포독성 활성의 원인은 주로 수용체[citation needed] 엔도사이토시스를 통해 매개된다.산성 엔도솜은 독소 B가 세포로 들어갈 수 있게 한다.이 현상은 독소가 숙주[citation needed] 세포로 들어갈 수 있도록 하는 결합 수용체 영역에 의해 일어난다.TcdB는 숙주세포의 세포질 접근성을 통해 예를 들어 Rho 패밀리 멤버 Rac 및 Cdc42의 트레오닌 35 및 Rho의 [18][19]트레오닌 37의 글리코실화 과정에 의해 소량의 GTPase(그림 5)를 비활성화한다.이러한 Rho GTPases는 액틴 세포골격의 구성을 담당하는 진핵세포의 세포골격에서 널리 발견되는데, 이는 세포 반올림 및 막 블리딩의 결과로 액틴 필라멘트의 축합을 유발하기 때문이다(그림 3). 이는 궁극적으로 아포토시스(apoptosisis)[20][21]로 이어진다.TcdB는 세포 역학과 형태학에 중요한 변화를 일으킨다.그림 3은 세포 표면에 대한 독소 B의 영향을 나타낸다; 막 블리핑(검은 화살표).[22]또한 TcdB는 Rho GTPases를 비활성화한다.그 결과 세포 접합이 파괴되어 독소 B의 상피 투과성과 내강 내 유체 축적이 향상된다.클로스트리듐 디피실 관련 설사(CDAD)에 걸리는 주요 원인물질 중 하나이다(그림 5).[23][24]
또한 UDP-포도당의 TcdB에 의한 가수분해 속도는 TcdA의 [25]약 5배이다.언제 TcdB 화법과 다른 작은 GTPases에 묶어 여러 연구에 의하면, 화법은 플라스마 막의 세포질 쪽에서 발생한다 prenylation과 carboxymethylation를 통해 번역 후 변형을 표시했습니다, 따라서, GTP의 GDP.[26]에 교환, 화장실에 가야 해 GDPGTP-bound(적극적인)에 GDP-bound(inactiv 것 hydrolyzes.e)(그림 5).또한 이 교환 활성은 세포의 [27]세포질에서 구아닌 인자에 의해 조절된다.
신호 경로 장애
Rho, Rac 및 Cdc42의 세포조절은 세포골격의 액틴 필라멘트 부근에 영향을 미치며(그림 4),[17] 이러한 작은 GTPases는 mitogen-activated protein kinase(MAPKs)[28]를 통해 신호를 조절하는 세포주기에 통합된다.액틴 필라멘트에 관여하지 않는 세포의 일부 생리적인 부분은 당장 세포 반올림이나 세포 사멸을 일으키지 않을 수 있지만, 하류 경로 활동에서는 액틴 필라멘트의 악화와 마지막으로 세포 [17]사멸을 초래할 수 있다.
1993년 쇼산 등에 의해 수행된 연구는 TcdB를 가진 세포가 포스포리파아제 A2 활성을 변화시켰다는 것을 보여주었다.이것은 액틴 세포 [29]골격의 교란으로부터 독립된 사건이었다.쇼산 외 연구진은 또한 TcdB가 포스포리파아제 [29]D를 통해 Rho 단백질을 비활성화함으로써 수용체 신호 전달 활성을 억제했음을 보여주었다.
모공 형성
TcdB는 클로트린 매개 엔도사이토시스([30]Clathrin-mediated endocytosis)를 통해 세포 내부에 접근하며, 독소 B가 세포체의 일부일 때 글루코실전달효소는 내막을 통과하여 pH를 감소시키고 전이를 유도하며, 최종적으로 전위영역 잔기의 형태학적 변화를 초래한다(958~1130).[31]소수성 영역은 숙주막에 내장되어 글루코실전달효소 도메인이 [31]통과할 수 있는 모공을 형성합니다.세포가 산성 환경에서 TcdB에 감염되면 독소를 감소시켜 형태 재배열을 일으킨다(그림 6).[31]산성 pH의 결과로 TcdB는 트립토판의 원래 형광, 단백질 분해효소 감수성 및 소수성 [31]표면에서 명확한 차이를 보인다.또 다른 그룹은 산성화가 독소의 구조 변화를 가져오고, 더 중요한 것은 [7]모공을 형성하는데 도움을 준다는 것을 보여주었다.추정 전위 영역(그림 2)은 약 801~1400개의 아미노산을 구성하며, 이 중 잔류물 958~1130은 소수성으로 막 통과 [20]기공을 형성한다.대부분의 연구는 C. 디피실 [31]독소의 모공 형성 활성을 나타내기 위해 TcdB 균주 630을 사용했다.
pH에 의해 유발됨
TcdB의 단백질 분해 분해 효과가 세포 표면에서 일어나는지 산성 엔도솜에서 일어나는지 알아보기 위해 연구는 엔도솜의 v형 H-ATPases를 차단하는 것으로 알려진 바필로마이신 A1을 사용했다.이것은 엔도솜의 [31]산도를 감소시킨다.TcdB의 생리학적 흡수 경로는 TcdB에 [31]의한 세포변성 활성을 방지한다.37℃에서 TcdB를 세포 표면에 결합시킨 후 5분간 세포들이 산성 상태(pH 4.0)일 때 형상 재배열과 반올림 현상이 관찰되었다.그러나 유사한 매개 변수를 사용하여 중성 pH(7.0)에서 추가로 1시간 동안 둥근 세포를 배양한 경우에는 반올림이 [15][31]관찰되지 않았다.두 연구 모두 독소 B가 단백질 분해 분열 특성을 가지고 있다는 것을 보여주었는데,[7][15][31] 이것은 세포에 접근하는 데 매우 중요하다.산성 엔도솜 pH가 있으면 TcdB의 위상변화가 일어난다(그림 6).[7]
유전학
TcdB 단백질을 코드하는 유전자 tcdB는 염색체 영역인 19.6kb 내에 위치한다.이는 병원성 또는 PaLoc의 궤적으로 알려져 있습니다(그림 2).[32][33]tcdB의 ORF(Open Reading Frame) 길이는 7,[17]098 뉴클레오티드입니다.PaLoc 영역의 주요 독소 유전자 외에 PaLoc 영역에는 tcdR(L), tcdC(R) 및 tcdE의 세 가지 부가 유전자가 있다는 것을 언급하는 것이 중요하다.이 유전자들은 TcdA와 TcdB 발현을 조절하는데 도움을 준다.그들은 또한 [17]세포에서 독소를 분비하거나 배출하는 것을 돕는다.tcdB와 tcdA 사이에 위치한 코드 유전자 tcdE는 홀린 단백질과 유사하므로 TcdE는 TcdA의 방출 또는 분비를 촉진하는 촉진제 유전자로 작용하여 숙주 세포막의 [17]투과성을 증가시킨다.
독소 검출
C. 디피실에는 다양한 플라스미드의 크기가 있습니다.검출된 분자량은 2.7x106~100x10이지만6 플라스미드 크기는 독성과 상관관계가 없다.C. 디피시일의 독소 B를 검출하기 위해 임상의는 PMC [2][3]환자의 대변 시료에서 유래한 세포 배양 어세이(cell culture assay)를 광범위하게 사용한다.세포배양측정법은 소량의 독소 B가 세포 라운딩을 일으킬 수 있기 때문에 C. 디피실 독성을 검출하기 위한 "골드 스탠다드"로 간주되며(그림 4), TCDB에 [2][3]의한 CDAD와 상관관계를 갖는 것이 임상실험실의 큰 장점이다.PMC 환자 대변 검체에서 대형 클로스트리디얼 독소(LCTs)의 세포독성 활성이 발견되었지만, 독소 B의 활성은 독소 [2]A에 비해 더 해로운 세포독성 효과가 있었다.따라서 독소 A는 독소 [2][3]B에서 분리되지 않을 때 활성이 감쇠된다.C. 디피실 독성의 검출은 매우 민감하지만, 세포 배양 분석을 사용하면 임상 실험실에서 이 문제를 극복할 수 있습니다. 즉, 독소 B를 1pg/mL만큼 적게 사용하면 세포 [2][3]반올림을 일으키기에 충분합니다.이는 배양 조직 분석을 사용하여 PMC [2]환자의 독성을 검출하는 데 있어 가장 큰 장점입니다.임상 실험실에서 PMC 환자의 대변에서 독소 B의 세포독성 활성을 검출하기 위해 검사 마이크로미터 플레이트 효소 연결 면역흡수제(ELISA) 및 기타 기술을 사용하려고 시도했지만 결과는 세포 배양 측정이 사용된 [2][3][34]것만큼 정확하지 않습니다.
생산 요인
연구 결과에 따르면 배양 배지에 항균제(예: 클린다마이신)를 첨가함으로써 C. 디피실 배양에서 세포독성 활성이 4~[35][36]8배 증가하였다.게다가, PMC의 원인에 대한 항생제의 역할을 알고 있기 때문에, 많은 초기 연구들은 독소의 항균제 생산 효과에 초점을 맞췄다.그 결과, 연구는 반코마이신과 페니실린의 억제되지 않는 성질이 C.[37] 디피실린의 배양에서 독소 생성을 증가시키고 있다는 결론을 내릴 수 있었다.독소 생성량은 유기체의 배지 사용과 관련이 있었다.또 다른 연구는 TcdB의 높은 수준의 독소 생산이 뇌와 심장 주입 [38][39]육수와 같은 복합 매체에서 관찰되었음을 보여주었다.고독성 독소를 분리하여 높은 수준의 독소가 생성되었다.반대로, 약한 독성의 분리를 통해 낮은 수준의 독소가 생성되었다.따라서 독소의 생산이 공동 조절되었음을 알 수 있다.독소를 발현하는 신호를 조절하는 데 환경이 관여하는 메커니즘은 이해되지 않지만, 시험관내 연구에 따르면 독소의 발현은 이화물 억제와 스트레스(예:[40][41][42] 항생제)에 의해 강화된다.또 다른 연구는 잘 특징지어지는 배지에서 비오틴을 제한하면 TcdB의 생산량이 64배, TcdA의 생산량이 35배 증가한다는 것을 보여주었다.이것은 C. 디피실 및 0.05nM의 [41]작은 비오틴 용량으로 수행되었다.몇몇 다른 초기 연구들은 독소의 생산이 TcdA나 TcdB의 [42]스트레스나 이화물 억제와 관련이 있다는 이론을 반대해왔다.또한, 많은 연구들이 다른 연구들과 다른 주요 이유는 C. 디피실 분리주에서는 독소 생산이 발생하지 않기 때문이라고 말한다.
임상적 의의
많은 초기 연구들은 독소 A가 항생제 관련 설사(AAD)를 일으키는 주요 독소 단백질이라고 제안해 왔다. 하지만 지난 10여 년 동안의 연구 과학자들은 독소 B 또는 TcdB가 어느 누가 예상했던 것보다 질병에서 더 중요한 역할을 한다는 것을 보여주었다.이를 통해 독소 B는 혈관 투과성을 높이고 출혈을 유도하는 장상피세포의 단단한 접합부를 여는 주요 독성 인자로 밝혀졌다.따라서 종양괴사인자α(TNFα)와 염증성 인터류킨이 가성대장염(PMC)과 항생제 관련 설사(AAD)[2][3][43]의 주요 원인물질로 확립된다.
독소 A와 독신 B의 관여는 C. 디피실(difficile)에 의해 야기되는 질병을 결정하는 핵심 요소이다.임상 실험실은 항체와 세포독성 [44]검사를 바탕으로 환자의 대변에서 이러한 독소를 확인했다.이러한 박테리아 독소는 Clostridium sordelii 출혈 독소(TcsH), 치사 독소(TcsL) 및 Clostridium novi 알파 독소(Tcnα)와 관련이 있는 것으로 나타나므로 이 코호트는 독소 클로스트리디알의 큰 패밀리이다.[17]이러한 독소의 유사성 때문에, 연구원들은 그것들을 대형 클로스트리디얼 독소(LCTs)[9]의 과로 분류했다.
TcdB를 가진 베즐로톡수맵의 메커니즘
베즐로톡수맵은 클로스트리듐 디피실 감염의 재발 방지를 위해 설계된 인간 모노클로널 항체이다.TcdB의 N말단의 X선 결정화 구조에 의해 독소는 글루코실전달효소 도메인(GTD), 시스테인단백질가수분해효소(CROP) 도메인의 3개 도메인으로 구성된다.베즐로톡수맵은 TcdB의 CROP 도메인 내의 2개의 상동성 부위에 특이적으로 결합한다.X선 결정학에 의한 구조 분석 결과, 항체 결합이 부분적으로 추정 탄수화물 결합 포켓을 막는 것으로 나타났다.베즐로톡수맵은 포유동물 [45]세포에 대한 TcdB의 결합을 차단한다.
가성 대장염의 역할
PMC 질환의 초기 단계에서, 많은 연구들은 TcdA가 TcdB보다 더 강력하다고 추측해왔다.이는 TcdA의 독소 생산이 항생제 맹장염을 [38][46]가진 TcdB보다 더 심각했던 생체 내 실험에서 추론되었다.나중에, 몇몇 연구들은 TcdB가 PMC와 ADD의 질병에서 주요한 역할을 한다는 것을 보여주었다.이 연구는 C. 디피실(C. difficile)이 TcdA를 생성하지 않았음에도 불구하고 여전히 [47]TcdA의 증상을 보인다는 것을 증명했다.또한 TcdB의 정제된 형태는 TcdA에 비해 더 치명적인 장독소이며, 장상피가 심각하게 손상되어 급성 [48]염증 반응을 일으킨다는 것이 이후 연구에서 밝혀졌다.독소에 대한 더 나은 이해로, 연구원들은 TcdB가 TcdA보다 CDI를 유발하는 주요 독성 인자라고 말할 수 있었다.그러나 TcdA가 장에 존재하면 TcdB의 활동이 보다 광범위한 영향을 미치도록 촉진하여 결과적으로 여러 장기 [49]시스템에 영향을 미칩니다.게다가, 햄스터들이 TcdA에 대한 예방접종을 받았을 때, 그것은 햄스터들이 C. 디피실 질병으로부터 완전히 보호되지 않았다는 것을 보여주었고, TcdB가 매우 치명적이고 [50]강력하다는 결론을 내리기 위한 이 리드 연구들이 있었다.또한 소량의 TcdA와 치사량의 TcdB를 정맥 내 또는 복강 내 주입하는 것은 동물의 죽음을 초래하는 데 충분한 것으로 입증되었다.따라서 TcdA는 [50]장에서 나오는 TcdB의 촉진제 역할을 합니다.
「 」를 참조해 주세요.
레퍼런스
- ^ Reinert DJ, Jank T, Aktories K, Schulz GE (September 2005). "Structural basis for the function of Clostridium difficile toxin B". Journal of Molecular Biology. 351 (5): 973–81. doi:10.1016/j.jmb.2005.06.071. PMID 16054646.
- ^ a b c d e f g h i j Lyerly DM, Krivan HC, Wilkins TD (January 1988). "Clostridium difficile: its disease and toxins". Clinical Microbiology Reviews. 1 (1): 1–18. doi:10.1128/cmr.1.1.1. PMC 358025. PMID 3144429.
- ^ a b c d e f g Bartlett JG (1990). "Clostridium difficile: clinical considerations". Reviews of Infectious Diseases. 12 Suppl 2: S243–51. doi:10.1093/clinids/12.Supplement_2.S243. PMID 2406876.
- ^ von Eichel-Streiber C (1997). "Enterotoxin A and cytotoxin B (Clostridium difficile)". In Montecucco C, Rappuoli R (eds.). Guidebook to protein toxins and their use in cell biology. Oxford [Oxfordshire]: Oxford University Press. p. 72. ISBN 978-0-19-859954-8.
- ^ a b c Albesa-Jové D, Bertrand T, Carpenter EP, Swain GV, Lim J, Zhang J, Haire LF, Vasisht N, Braun V, Lange A, von Eichel-Streiber C, Svergun DI, Fairweather NF, Brown KA (March 2010). "Four distinct structural domains in Clostridium difficile toxin B visualized using SAXS". Journal of Molecular Biology. 396 (5): 1260–70. doi:10.1016/j.jmb.2010.01.012. PMID 20070948.
- ^ a b Hofmann F, Busch C, Prepens U, Just I, Aktories K (April 1997). "Localization of the glucosyltransferase activity of Clostridium difficile toxin B to the N-terminal part of the holotoxin". Journal of Biological Chemistry. 272 (17): 11074–8. doi:10.1074/jbc.272.17.11074. PMID 9111001.
- ^ a b c d Barth H, Pfeifer G, Hofmann F, Maier E, Benz R, Aktories K (April 2001). "Low pH-induced formation of ion channels by Clostridium difficile toxin B in target cells". Journal of Biological Chemistry. 276 (14): 10670–6. doi:10.1074/jbc.M009445200. PMID 11152463.
- ^ a b Jank T, Aktories K (May 2008). "Structure and mode of action of clostridial glucosylating toxins: the ABCD model". Trends in Microbiology. 16 (5): 222–9. doi:10.1016/j.tim.2008.01.011. PMID 18394902.
- ^ a b c d von Eichel-Streiber C, Boquet P, Sauerborn M, Thelestam M (October 1996). "Large clostridial cytotoxins--a family of glycosyltransferases modifying small GTP-binding proteins". Trends in Microbiology. 4 (10): 375–82. doi:10.1016/0966-842X(96)10061-5. PMID 8899962.
- ^ Jank T, Giesemann T, Aktories K (April 2007). "Rho-glucosylating Clostridium difficile toxins A and B: new insights into structure and function". Glycobiology. 17 (4): 15R–22R. doi:10.1093/glycob/cwm004. PMID 17237138.
- ^ Meador J, Tweten RK (July 1988). "Purification and characterization of toxin B from Clostridium difficile". Infection and Immunity. 56 (7): 1708–14. doi:10.1128/iai.56.7.1708-1714.1988. PMC 259466. PMID 3384474.
- ^ Aktories K, Just I (December 1995). "Monoglucosylation of low-molecular-mass GTP-binding Rho proteins by clostridial cytotoxins". Trends in Cell Biology. 5 (12): 441–3. doi:10.1016/S0962-8924(00)89107-2. PMID 14732022.
- ^ Dillon ST, Rubin EJ, Yakubovich M, Pothoulakis C, LaMont JT, Feig LA, Gilbert RJ (April 1995). "Involvement of Ras-related Rho proteins in the mechanisms of action of Clostridium difficile toxin A and toxin B". Infection and Immunity. 63 (4): 1421–6. doi:10.1128/iai.63.4.1421-1426.1995. PMC 173169. PMID 7890404.
- ^ Wilkins TD, Lyerly DM (February 1996). "Clostridium difficile toxins attack Rho". Trends in Microbiology. 4 (2): 49–51. doi:10.1016/0966-842X(96)81508-3. PMID 8820565.
- ^ a b c d Pfeifer G, Schirmer J, Leemhuis J, Busch C, Meyer DK, Aktories K, Barth H (November 2003). "Cellular uptake of Clostridium difficile toxin B. Translocation of the N-terminal catalytic domain into the cytosol of eukaryotic cells". Journal of Biological Chemistry. 278 (45): 44535–41. doi:10.1074/jbc.M307540200. PMID 12941936.
- ^ Donta ST, Sullivan N, Wilkins TD (June 1982). "Differential effects of Clostridium difficile toxins on tissue-cultured cells". Journal of Clinical Microbiology. 15 (6): 1157–8. doi:10.1128/jcm.15.6.1157-1158.1982. PMC 272271. PMID 7107845.
- ^ a b c d e f g Voth DE, Ballard JD (April 2005). "Clostridium difficile toxins: mechanism of action and role in disease". Clinical Microbiology Reviews. 18 (2): 247–63. doi:10.1128/CMR.18.2.247-263.2005. PMC 1082799. PMID 15831824.
- ^ Just I, Selzer J, Wilm M, von Eichel-Streiber C, Mann M, Aktories K (June 1995). "Glucosylation of Rho proteins by Clostridium difficile toxin B". Nature. 375 (6531): 500–3. doi:10.1038/375500a0. PMID 7777059. S2CID 4334048.
- ^ Just I, Wilm M, Selzer J, Rex G, von Eichel-Streiber C, Mann M, Aktories K (June 1995). "The enterotoxin from Clostridium difficile (ToxA) monoglucosylates the Rho proteins". Journal of Biological Chemistry. 270 (23): 13932–6. doi:10.1074/jbc.270.23.13932. PMID 7775453.
- ^ a b von Eichel-Streiber C, Warfolomeow I, Knautz D, Sauerborn M, Hadding U (November 1991). "Morphological changes in adherent cells induced by Clostridium difficile toxins" (PDF). Biochemical Society Transactions. 19 (4): 1154–60. doi:10.1042/bst0191154. PMID 1794484.
- ^ Thelestam M, Chaves-Olarte E (2000). "Cytotoxic Effects of the Clostridium difficile Toxins". Cytotoxic effects of the Clostridium difficile toxins. Current Topics in Microbiology and Immunology. Vol. 250. pp. 85–96. doi:10.1007/978-3-662-06272-2_4. ISBN 978-3-642-08668-7. PMID 10981358.
- ^ Fiorentini C, Fabbri A, Falzano L, Fattorossi A, Matarrese P, Rivabene R, Donelli G (June 1998). "Clostridium difficile toxin B induces apoptosis in intestinal cultured cells". Infection and Immunity. 66 (6): 2660–5. doi:10.1128/IAI.66.6.2660-2665.1998. PMC 108253. PMID 9596731.
- ^ Feltis BA, Wiesner SM, Kim AS, Erlandsen SL, Lyerly DL, Wilkins TD, Wells CL (December 2000). "Clostridium difficile toxins A and B can alter epithelial permeability and promote bacterial paracellular migration through HT-29 enterocytes". Shock. 14 (6): 629–34. doi:10.1097/00024382-200014060-00010. PMID 11131913.
- ^ Johal SS, Solomon K, Dodson S, Borriello SP, Mahida YR (June 2004). "Differential effects of varying concentrations of Clostridium difficile toxin A on epithelial barrier function and expression of cytokines". The Journal of Infectious Diseases. 189 (11): 2110–9. doi:10.1086/386287. PMID 15143480.
- ^ Ciesla WP, Bobak DA (June 1998). "Clostridium difficile toxins A and B are cation-dependent UDP-glucose hydrolases with differing catalytic activities". Journal of Biological Chemistry. 273 (26): 16021–6. doi:10.1074/jbc.273.26.16021. PMID 9632652.
- ^ Adamson P, Marshall CJ, Hall A, Tilbrook PA (October 1992). "Post-translational modifications of p21rho proteins". Journal of Biological Chemistry. 267 (28): 20033–8. doi:10.1016/S0021-9258(19)88661-1. PMID 1400319.
- ^ Zhou K, Wang Y, Gorski JL, Nomura N, Collard J, Bokoch GM (July 1998). "Guanine nucleotide exchange factors regulate specificity of downstream signaling from Rac and Cdc42". Journal of Biological Chemistry. 273 (27): 16782–6. doi:10.1074/jbc.273.27.16782. PMID 9642235.
- ^ Zhang Y, Dong C (November 2007). "Regulatory mechanisms of mitogen-activated kinase signaling". Cellular and Molecular Life Sciences. 64 (21): 2771–89. doi:10.1007/s00018-007-7012-3. PMID 17726577. S2CID 21440134.
- ^ a b Shoshan MC, Florin I, Thelestam M (May 1993). "Activation of cellular phospholipase A2 by Clostridium difficile toxin B". Journal of Cellular Biochemistry. 52 (1): 116–24. doi:10.1002/jcb.240520115. PMID 8320270. S2CID 2724637.
- ^ Papatheodorou P, Zamboglou C, Genisyuerek S, Guttenberg G, Aktories K (May 2010). "Clostridial glucosylating toxins enter cells via clathrin-mediated endocytosis". PLOS ONE. 5 (5): e10673. doi:10.1371/journal.pone.0010673. PMC 2871790. PMID 20498856.
- ^ a b c d e f g h i Qa'Dan M, Spyres LM, Ballard JD (May 2000). "pH-induced conformational changes in Clostridium difficile toxin B". Infection and Immunity. 68 (5): 2470–4. doi:10.1128/IAI.68.5.2470-2474.2000. PMC 97448. PMID 10768933.
- ^ Carter GP, Rood JI, Lyras D (January 2012). "The role of toxin A and toxin B in the virulence of Clostridium difficile". Trends in Microbiology. 20 (1): 21–9. doi:10.1016/j.tim.2011.11.003. PMID 22154163.
- ^ Braun V, Hundsberger T, Leukel P, Sauerborn M, von Eichel-Streiber C (November 1996). "Definition of the single integration site of the pathogenicity locus in Clostridium difficile". Gene. 181 (1–2): 29–38. doi:10.1016/S0378-1119(96)00398-8. PMID 8973304.
- ^ Musher DM, Manhas A, Jain P, Nuila F, Waqar A, Logan N, Marino B, Graviss EA (August 2007). "Detection of Clostridium difficile toxin: comparison of enzyme immunoassay results with results obtained by cytotoxicity assay". Journal of Clinical Microbiology. 45 (8): 2737–9. doi:10.1128/JCM.00686-07. PMC 1951241. PMID 17567791.
- ^ Nakamura S, Mikawa M, Tanabe N, Yamakawa K, Nishida S (1982). "Effect of clindamycin on cytotoxin production by Clostridium difficile". Microbiology and Immunology. 26 (11): 985–92. doi:10.1111/j.1348-0421.1982.tb00248.x. PMID 7167065.
- ^ George RH, Johnson M, Youngs D, Burdon DW (1980). "Induction of Clostridium difficile toxin by antibiotics". Current Chemotherapy and Infectious Diseases. 2 (1): 955–56.
- ^ Onderdonk AB, Lowe BR, Bartlett JG (October 1979). "Effect of environmental stress on Clostridium difficile toxin levels during continuous cultivation". Applied and Environmental Microbiology. 38 (4): 637–41. doi:10.1128/aem.38.4.637-641.1979. PMC 243552. PMID 44176.
- ^ a b Lyerly DM, Sullivan NM, Wilkins TD (January 1983). "Enzyme-linked immunosorbent assay for Clostridium difficile toxin A". Journal of Clinical Microbiology. 17 (1): 72–8. doi:10.1128/jcm.17.1.72-78.1983. PMC 272577. PMID 6338036.
- ^ Sullivan NM, Pellett S, Wilkins TD (March 1982). "Purification and characterization of toxins A and B of Clostridium difficile". Infection and Immunity. 35 (3): 1032–40. doi:10.1128/iai.35.3.1032-1040.1982. PMC 351151. PMID 7068210.
- ^ Dupuy B, Sonenshein AL (January 1998). "Regulated transcription of Clostridium difficile toxin genes". Molecular Microbiology. 27 (1): 107–20. doi:10.1046/j.1365-2958.1998.00663.x. PMID 9466260.
- ^ a b Yamakawa K, Karasawa T, Ikoma S, Nakamura S (February 1996). "Enhancement of Clostridium difficile toxin production in biotin-limited conditions". Journal of Medical Microbiology. 44 (2): 111–4. CiteSeerX 10.1.1.623.71. doi:10.1099/00222615-44-2-111. PMID 8642571.
- ^ a b Mani N, Dupuy B (May 2001). "Regulation of toxin synthesis in Clostridium difficile by an alternative RNA polymerase sigma factor". Proceedings of the National Academy of Sciences of the United States of America. 98 (10): 5844–9. doi:10.1073/pnas.101126598. PMC 33301. PMID 11320220.
- ^ Bartlett JG (May 1994). "Clostridium difficile: history of its role as an enteric pathogen and the current state of knowledge about the organism". Clinical Infectious Diseases. 18 Suppl 4: S265–72. doi:10.1093/clinids/18.Supplement_4.S265. PMID 8086574.
- ^ Carter GP, Rood JI, Lyras D (January 2012). "The role of toxin A and toxin B in the virulence of Clostridium difficile". Trends in Microbiology. 20 (1): 21–9. doi:10.1016/j.tim.2011.11.003. PMID 22154163.
- ^ Orth P, Xiao L, Hernandez LD, Reichert P, Sheth PR, Beaumont M, et al. (June 2014). "Mechanism of action and epitopes of Clostridium difficile toxin B-neutralizing antibody bezlotoxumab revealed by X-ray crystallography". The Journal of Biological Chemistry. 289 (26): 18008–21. doi:10.1074/jbc.m114.560748. PMC 4140266. PMID 24821719.
- ^ Arnon SS, Mills DC, Day PA, Henrickson RV, Sullivan NM, Wilkins TD (January 1984). "Rapid death of infant rhesus monkeys injected with Clostridium difficile toxins A and B: physiologic and pathologic basis". Journal of Pediatrics. 104 (1): 34–40. doi:10.1016/S0022-3476(84)80585-5. PMID 6690674.
- ^ Drudy D, Fanning S, Kyne L (January 2007). "Toxin A-negative, toxin B-positive Clostridium difficile". The Journal of Infectious Diseases. 11 (1): 5–10. doi:10.1016/j.ijid.2006.04.003. PMID 16857405.
- ^ Savidge TC, Pan WH, Newman P, O'Brien M, Anton PM, Pothoulakis C (August 2003). "Clostridium difficile toxin B is an inflammatory enterotoxin in human intestine". Gastroenterology. 125 (2): 413–20. doi:10.1016/S0016-5085(03)00902-8. PMID 12891543.
- ^ Dobson G, Hickey C, Trinder J (June 2003). "Clostridium difficile colitis causing toxic megacolon, severe sepsis and multiple organ dysfunction syndrome". Intensive Care Medicine. 29 (6): 1030. doi:10.1007/s00134-003-1754-7. PMID 12734650. S2CID 33185625.
- ^ a b Lyerly, DM; Roberts, MD; Phelps, CJ; Wilkins, TD (January 1986). "Purification and properties of toxins A and B of Clostridium difficile". FEMS Microbiology Letters. 33 (1): 31–35. doi:10.1111/j.1574-6968.1986.tb01206.x.