루이사이트
Lewisite | |||
| | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 [(E)-2-클로로에텐-1-일] 이염화알소나스 | |||
| 기타 이름 클로로비닐알신2염화물 2-클로로에테닐디클로로아르신 (E)-2-클로로비닐라손2염화물 (E)-2-클로로비닐디클로로아르신 디클로로(E)-2-클로로비닐)알신 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 켐스파이더 | |||
| 메쉬 | 루이사이트 | ||
PubChem CID | |||
| 유니 | |||
| UN 번호 | 2810 | ||
| |||
| |||
| 특성. | |||
| CHASCL223 | |||
| 몰 질량 | 207.32g/표준 | ||
| 밀도 | 1.89g/cm3 | ||
| 녹는점 | - 18 °C (0 °F, 255 K) | ||
| 비등점 | 190 °C (374 °F, 463 K) | ||
| 물과 반응하다 | |||
| 용해성 | 에테르, 탄화수소, THF | ||
| 증기압 | 0.58mmHg(25°C) | ||
| 위험 요소 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 요소 | 인화성, 고독성, 부식성, 방광제 | ||
| NFPA 704(파이어 다이아몬드) | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
Lewisite(L)는 유기알레르기 화합물이다.그것은 한때 미국, 일본[2], 독일, 소련에서[3] 화학 무기로 제조되어 방광제(수포제)와 폐 자극제 역할을 했다.순수한 형태로는 무색이고 무취이지만, 루이사이트의 불순한 샘플은 제라늄과 [4][5]유사한 독특한 냄새를 가진 노란색, 갈색, 보라색-검은색, 녹색 또는 호박색 유성 액체이다.
화학 반응
화합물은 적절한 촉매가 존재하는 상태에서 아세틸렌에 삼염화 비소를 첨가하여 제조됩니다.
- AsCl3 + CH22 → ClCHCHAsCl2 (Lewisite)
루이사이트는 다른 염화 비소와 마찬가지로 물에 가수분해되어 염산과 클로로비닐알센 산화물(강도가 낮은 블리스터제)[5]을 형성합니다.
- ClCHCHAsCl2 + 22 HO → ClCHCHAs(OH)2 + 2 HCl
이 반응은 알칼리성 용액에서 가속화되며 아세틸렌과 [5]비산트리소듐을 형성한다.
루이사이트는 금속과 반응하여 수소가스를 형성한다.가연성은 있지만 [5]발화하기는 어렵습니다.
작용 메커니즘
루이사이트는 피루브산 탈수소효소의 E3 성분의 자살 억제제이다.ATP를 생산하는 효율적인 방법으로서 피루브산 탈수소효소는 피루브산의 아세틸-CoA로의 전환에 관여한다.그 후 후자는 TCA 사이클에 들어갑니다.말초 신경계 병리학은 신경계가 본질적으로 포도당을 유일한 이화성 [6]연료로 의존하기 때문에 루이사이트 노출에서 주로 발생한다.

일반 의류와 라텍스 고무장갑을 쉽게 침투할 수 있습니다.피부에 닿으면 즉시 따끔거리고 타는 듯한 통증과 가려움증이 24시간 동안 지속될 수 있습니다.몇 분 안에 발진이 생기고 그 약물은 피부를 통해 흡수된다.액체가 가득 찬 큰 물집(머스타드 가스 노출로 인한 물집과 유사)은 약 12시간 후에 발생하며 2~3일 [4][5]동안 통증을 유발한다.이는 심각한 화학적 화상이며, 2~3시간 이내에 피부의 붉은 영역에 작은 물집이 생기면서 시작되며, 최초 노출 후 12-18시간 동안 전체 붉은 영역을 포함하면서 악화된다.액체 루이사이트는 루이사이트 [5]증기보다 효과가 빠르다.충분한 흡수는 치명적인 간 괴사를 일으킬 수 있다.
루이사이트에 노출된 사람들은 루이사이트 쇼크로 알려진 굴절성 저혈압(저혈압)에 걸릴 수 있으며, 비소 [7]독성의 일부 특징을 가지고 있다.Lewisite는 모세혈관을 손상시키고, 그 후 누출이 일어나 혈압을 유지하는 데 필요한 혈액량, 즉 저혈당증이라고 불리는 상태를 감소시킨다.혈압이 낮을 때, 신장은 충분한 산소를 공급받지 못하고 [5]손상될 수 있다.
가장 일반적인 노출 경로인 흡입은 호흡기 전체에 화끈거리는 통증과 자극, 코피, 후두염, 재채기, 기침, 구토, 호흡곤란(디스피어)을 유발하며, 심한 노출의 경우 치명적인 폐부종, 폐렴 또는 호흡부전을 일으킬 수 있다.섭취하면 심한 통증, 메스꺼움, 구토 및 조직 [4][5]손상이 발생합니다.눈 노출의 결과는 따가움, 타는 듯한 통증, 강한 자극에서부터 눈꺼풀과 장딴지의 눈꺼풀과 장딴지의 부종과 함께 각막의 물집과 흉터에 이르기까지 다양하다.눈이 부어서 더 이상 노출되지 않도록 눈을 보호할 수 있습니다.루이사이트에 눈이 노출되는 가장 심각한 결과는 지구 천공과 [5]실명이다.일반화된 증상으로는 불안감, 무기력함, 저체온증, 저혈압 등이 있다.
비소는 국제암연구기구(ISC)가 호흡기 발암물질로 분류했지만 루이사이트가 발암물질이라는 [8]사실은 확인되지 않았다.
Lewisite는 냄새 감지 임계값보다 낮은 수준에서 호흡기에 손상을 일으킨다.초기 조직 손상은 통증을 [5]일으킨다.
가수분해는 클로로비닐알손산, CVAA로 이어진다.
치료
디메르카프롤이라고도 불리는 영국의 항레위스는 루이사이트의 해독제이다.전신 독성을 방지하기 위해 주입할 수 있지만 피부, 눈 또는 점막에 대한 부상을 예방하지는 못합니다.화학적으로 디메르카프롤은 루이사이트에서 비소와 결합한다.땅콩 [5]알레르기가 있는 사람에게는 금물이다.
루이사이트 노출에 대한 다른 치료법은 주로 도움이 된다.루이사이트 노출의 응급 처치는 노출된 부위의 오염 제거 및 세척으로 구성됩니다.필요에 따라 기도 관리, 인공호흡 보조, 활력징후 모니터링과 같은 다른 방법을 사용할 수 있습니다.고급 관리 설정에서 보조 관리에는 유체 및 전해질 교체가 포함될 수 있습니다.튜브가 식도를 다치거나 관통할 수 있기 때문에 위세척은 [5]금지되어 있습니다.
장기적인 효과
한 번의 급성 노출로, 루이사이트를 흡입한 사람은 만성 호흡기 질환에 걸릴 수 있다; 루이사이트에 대한 눈 노출은 영구적인 시각 장애나 [5]실명을 야기할 수 있다.
루이사이트에 대한 만성적인 노출은 비소 중독(비소 함량 때문에)과 루이사이트 알레르기의 발생을 야기할 수 있습니다.또한 노출 부위에 따라 결막염, 빛에 대한 혐오증, 시각장애, 이중시력(복시), 찢기(눈물), 건성 점막, 마늘 입냄새, 코와 입의 화끈거리는 통증, 독성 뇌증, 말초성 장기에 영구적인 손상을 일으킬 수 있습니다.유로파시, 발작, 메스꺼움, 구토, 만성폐쇄성폐질환(COPD), 기관지염, 피부염, 피부궤양, 기저세포암,[5] 편평상피암 등이 있습니다.
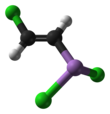
화학 조성
루이사이트는 염화비소 위에 다른 수의 염화비닐기를 가진 분자의 혼합물이 될 수 있다: 루이사이트 자체(2-클로로비닐) 염화비스(2-클로로비닐) 카르신(2-클로로비닐)[9]과 함께.또한 때로는 이성질 불순물이 존재하기도 한다. 루이사이트 자체는 대부분 트랜스-2-클로로비닐라손 이염화물이지만 시스 입체 이성질체 및 구성 이성질체(1-클로로비닐라손 이염화물)도 [10]존재할 수 있다.
실험 및 계산 연구에 따르면 트랜스-2-클로로 이성질체가 가장 안정적이며, 탄소-비소 결합은 비소 상의 단일 쌍이 비닐기와 [10]근사적으로 정렬된 구조를 가지고 있다.
역사
루이스는 1904년 줄리어스 아서 니우랜드에 의해 박사학위 [11][12][13]과정 중에 합성되었다.그의 논문에서, 그는 아세틸렌과 삼염화 비소의 반응을 묘사했고, 이것은 루이사이트의 [14]형성을 이끌었다.그 결과로 생긴 화합물에 노출되어 니우랜드는 너무 아파서 며칠 [12]동안 병원에 입원했다.
루이스는 미국의 화학자이자 군인 윈포드 리 루이스 (1878–1943)[15]의 이름을 따서 지어졌다.1918년, 줄리어스 아서 뉴랜드의 논문 고문인 존 그리핀은 워싱턴 D.C.[16]의 가톨릭 대학 화학 실험실인 말로니 홀에서 루이스의 논문에 관심을 끌었다.그리고 나서 루이스는 증류를 통해 이 화합물을 정화하려고 시도했지만 혼합물이 가열되면서 HCl로 [16]씻겨질 때까지 폭발하는 것을 발견했다.
루이스는 미국 오하이오주 클리블랜드(클리블랜드 플랜트) 이스트 131번가와 태프트 [15][17]애비뉴의 한 시설에서 비밀 무기로 개발됐으며 머스터드 가스의 코드였던 G-34라는 이름을 붙여 머스터드 [18]가스와 혼동했다.1918년 11월 1일 오하이오주 [19]윌러비에 있는 공장에서 생산이 시작되었다.제1차 세계 대전에서는 사용되지 않았지만, 영국은 1920년대에 "[20]죽음의 이슬"로 실험했습니다.
제1차 세계대전 이후 미국은 가연성이 없다는 이유로 음탕함에 관심을 갖게 되었다.제2차 세계대전 전까지는 M1의 군사기호를 사용하다가 이후 L로 바뀌었다.제2차 세계대전 중 루이사이트를 사용한 현장 실험에서는 높은 습도에서는 가수 분해 속도와 화학물질의 특징적인 냄새 때문에 사상자 농도를 달성할 수 없었음이 입증되었으며, 열상으로 인해 병사들은 마스크를 착용하고 오염 지역을 [citation needed]피해야 했다.미국은 약 2만 톤의 루이사이트를 생산했는데, 주로 머스타드 가스용 부동액이나 특별한 상황에서 보호복에 침투하기 위해 수중에 보관하고 있었다.
루이스는 머스터드 가스 변종 HT(유황 머스타드와 오 머스타드의 60:40 혼합물)로 대체되었고 1950년대에 쓸모없다고 선언되었다.루이사이트 중독은 영국식 항레위사이트(디메르카프롤)로 효과적으로 치료할 수 있다.대부분의 비축된 루이사이트는 표백제로 중화되어 [21]멕시코만에 버려졌다.일부는 [22]유타주 솔트레이크시티 외곽에 위치한 데세레트 화학공장에 남아 있었지만 2012년 1월 18일 현재 모든 미국 비축품이 파괴되었다.
1993년 화학무기협약 부칙 1에 의해 시설당 연간 100g 이상의 양의 생산이 금지되었다.1997년 조약이 발효됐을 때 양국은 6747t의 세계 비축량을 발표했다.2015년 말까지 신고된 비축량의 98%가 [23]폐기되었다.
2001년, 루이스는 워싱턴 D.C.[24]에 있는 제1차 세계 대전 무기 폐기장에서 발견되었다.
일본인의 중국 내 음탕한 예금 논란
2006년 중반 중국과 일본은 제2차 세계대전 당시 일본군이 남긴 중국 동북부 지역의 음용 비축량을 처분하는 협상을 벌이고 있었다.사람들은 지난 20년 동안 이 [25]비축물들에 우연히 노출되어 죽었다.
「 」를 참조해 주세요.
레퍼런스
- ^ Lewisite I - 복합 요약, PubChem.
- ^ Mitchell, Jon (27 July 2013). "A drop in the ocean: the sea-dumping of chemical weapons in Okinawa" – via Japan Times Online.
- ^ "Russia Completes Destruction of First 10 Tons of Lewisite - Analysis - NTI". www.nti.org.
- ^ a b c U.S. National Research Council, Committee on Review and Evaluation of the Army Non-Stockpile Chemical Materiel Disposal Program (1999). Disposal of Chemical Agent Identification Sets. National Academies Press. p. 16. ISBN 0-309-06879-7.
- ^ a b c d e f g h i j k l m n "CDC - The Emergency Response Safety and Health Database: Blister Agent: LEWISITE (L) - NIOSH". www.cdc.gov. Retrieved 2016-01-14.
- ^ Berg, J.; Tymoczko, J. L.; Stryer, L. (2007). Biochemistry (6th ed.). New York: Freeman. pp. 494–495. ISBN 978-0-7167-8724-2.
- ^ 주, 주, 주, 주, 드크루즈, 주, 파루치, K. K., 바르마, 주, 싱, 주, 카틱, V.화학전 요원들.환경.독극물약골.2008, 26, 113-122
- ^ 도이(東;), 핫토리(;;), 요코야마(;山), 오나리(;;), 가네하라(;原), 마스다(;田), 오타키(大,), 코노(小野), 폐암 발병률에 대한 겨자가스 피폭의 영향(종적 연구).미국 역학 저널 2011, 173, 659-666.
- ^ McNutt, Patrick M.; Tracey L., Hamilton (2015). "Ocular toxicity of chemical warfare agents". Handbook of Toxicology of Chemical Warfare Agents. Academic Press. pp. 535–555.
- ^ a b Urban, Joseph J.; von Tersch, Robert L. (1999). "Conformational analysis of the isomers of lewisite". J. Phys. Org. Chem. 12 (2): 95–102. doi:10.1002/(SICI)1099-1395(199902)12:2<95::AID-POC91>3.0.CO;2-V.
- ^ Julius Arthur Nieuwland(1904) 노트르담 대학(인디아나 주 노트르담) 박사논문 아세틸렌의 반응.
- ^ a b Vilensky, J. A. (2005). Dew of Death - The Story of Lewisite, America's World War I Weapon of Mass Destruction. Indiana University Press. p. 4. ISBN 0253346126.
- ^ Vilensky, J. A.; Redman, K. (2003). "British Anti-Lewisite (Dimercaprol): An Amazing History". Annals of Emergency Medicine. 41 (3): 378–383. doi:10.1067/mem.2003.72. PMID 12605205.
- ^ 빌렌스키, J. "니우랜드 신부와 죽음의 이슬"
- ^ a b "Deadliest Poison Discovered By An American". Early County News. May 29, 1919. p. 7. Retrieved July 30, 2020.
- ^ a b Vilensky, J. A. (2005). Dew of Death - The Story of Lewisite, America's World War I Weapon of Mass Destruction. Indiana University Press. pp. 21–23. ISBN 0253346126.
- ^ Upton 네이티브의 역할은 최선의 방어였습니다.WWI는 Wayback Machine에서 2007년 12월 18일 아카이브되었습니다.
- ^ 조엘 A. 빌렌스키, 죽음의 이슬: 미국의 제1차 세계 대전 대량 살상 무기 루이스의 이야기 (인디아나 주 블루밍턴:Indiana University Press, 2005), 36페이지.
- ^ Vilensky, J. A. (2005). Dew of Death - The Story of Lewisite, America's World War I Weapon of Mass Destruction. Indiana University Press. p. 50. ISBN 0253346126.
- ^ Tabangcura, D. Jr.; Daubert, G. P. "British anti-Lewisite Development". Molecule of the Month. University of Bristol School of Chemistry.
- ^ 코드 레드 - 대량살상무기 온라인 자원; - 블리스터 에이전트
- ^ "Commander: World is safer with chemical stockpile gone".
- ^ Organisation for the Prohibition of Chemical Weapons (30 November 2016). "Annex 3". Report of the OPCW on the Implementation of the Convention on the Prohibition of the Development, Production, Stockpiling and Use of Chemical Weapons and on Their Destruction in 2015 (Report). p. 42. Retrieved 8 March 2017.
- ^ Tucker, J. B. (2001). "Chemical weapons: Buried in the backyard" (PDF). Bulletin of the Atomic Scientists. 57 (5): 51–56. doi:10.2968/057005014.
- ^ 2012-03-05 웨이백 머신에 보관된 중국의 유기 화학 무기(ACW)