폴로늄
Polonium | ||||||||||||||||||||||||||||||
| 폴로늄 | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 발음 | /pəˈ로 ʊ니 əm/ | |||||||||||||||||||||||||||||
| 동소체 | α, β | |||||||||||||||||||||||||||||
| 외모 | 은빛의 | |||||||||||||||||||||||||||||
| 매스넘버 | [209] | |||||||||||||||||||||||||||||
| 주기율표의 폴로늄 | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
| 원자번호 (Z) | 84 | |||||||||||||||||||||||||||||
| 그룹. | 16족(칼코겐) | |||||||||||||||||||||||||||||
| 기간 | 6교시 | |||||||||||||||||||||||||||||
| 블록 | p-블록 | |||||||||||||||||||||||||||||
| 전자구성 | [Xe] 4f14 5d10 6s2 6p4 | |||||||||||||||||||||||||||||
| 쉘당 전자수 | 2, 8, 18, 32, 18, 6 | |||||||||||||||||||||||||||||
| 물성 | ||||||||||||||||||||||||||||||
| 단계 STP에서 | 단단한 | |||||||||||||||||||||||||||||
| 융점 | 527 K (254 °C, 489 °F) | |||||||||||||||||||||||||||||
| 끓는점 | 1235 K (962 °C, 1764 °F) | |||||||||||||||||||||||||||||
| 밀도 (근처) | α-Po: 9.196 g/cm3 β-Po: 9.398 g/cm3 | |||||||||||||||||||||||||||||
| 핵융합열 | ca. 13 kJ/mol | |||||||||||||||||||||||||||||
| 기화열 | 102.91 kJ/mol | |||||||||||||||||||||||||||||
| 몰 열용량 | 26.4J/(mol·K) | |||||||||||||||||||||||||||||
증기압
| ||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||
| 산화상태 | -2, +2, +4, +5,[1] +6(암포테릭 산화물) | |||||||||||||||||||||||||||||
| 전기음성도 | 폴링 스케일: 2.0 | |||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||
| 원자 반지름 | 경험: 오후 168시 | |||||||||||||||||||||||||||||
| 공유 반지름 | 140±4pm | |||||||||||||||||||||||||||||
| 반데르발스 반지름 | 197시 | |||||||||||||||||||||||||||||
| 기타속성 | ||||||||||||||||||||||||||||||
| 자연발생 | 썩어서 | |||||||||||||||||||||||||||||
| 결정구조 | 입방의 α-Po | |||||||||||||||||||||||||||||
| 결정구조 | 마름모꼴 β-Po | |||||||||||||||||||||||||||||
| 열팽창 | 23.5 µm/(m⋅K) (at 25 °C) | |||||||||||||||||||||||||||||
| 열전도율 | 20 W/(m⋅K) (?) | |||||||||||||||||||||||||||||
| 전기저항 | α-Po: 0.40 µΩ⋅m (at 0 °C) | |||||||||||||||||||||||||||||
| 자기순서 | 비자성의 | |||||||||||||||||||||||||||||
| CAS 번호 | 7440-08-6 | |||||||||||||||||||||||||||||
| 역사 | ||||||||||||||||||||||||||||||
| 명명 | 폴로니아 다음으로, 라틴어로 폴란드를 뜻하며, 마리 퀴리의 고향. | |||||||||||||||||||||||||||||
| 디스커버리 | 피에르와 마리 퀴리 (1898) | |||||||||||||||||||||||||||||
| 1차 격리 | 빌리 마크왈드 (1902) | |||||||||||||||||||||||||||||
| 폴로늄 동위 원소 | ||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
폴로늄은 화학 원소로 기호 Po와 원자 번호 84를 가지고 있습니다. 폴로늄은 안정한 동위원소가 없는 희귀하고 방사성이 높은 금속(금속성으로 분류되기도 하지만)으로 셀레늄, 텔루륨과 화학적으로 유사한 칼코겐이며 주기율표의 수평 이웃 금속(탈륨, 납, 비스무트)과 유사합니다. 모든 동위원소의 반감기가 짧기 때문에, 우라늄 광석에 존재하는 폴로늄-210이 천연 우라늄-238의 두 번째 딸이기 때문에, 그것의 자연 발생은 아주 작은 미량의 우라늄 광석에 국한됩니다. 폴로늄-209의 124년 반감기와 같이 수명이 더 긴 동위원소가 존재하지만, 생성하기가 훨씬 더 어렵습니다. 오늘날 폴로늄은 보통 비스무트의 중성자 조사에 의해 밀리그램 단위로 생산됩니다. 화학 결합의 방사성 분해와 방사성 자체 가열을 초래하는 강력한 방사능 때문에 화학 물질은 대부분 미량 규모에서만 연구되었습니다.
폴로늄은 1898년 7월 18일 마리 스콰도프스카 퀴리와 피에르 퀴리에 의해 발견되었는데, 이는 우라늄 광석 피치블렌드에서 추출되어 강한 방사능만으로 확인된 최초의 원소였습니다. 폴로늄은 마리 퀴리의 조국인 폴란드의 이름을 따서 지어졌습니다. 폴로늄은 거의 응용되지 않았으며, 그것들은 우주 탐사선의 히터, 정전기 방지 장치, 중성자와 알파 입자의 근원, 그리고 알렉산더 리트비넨코의 중독과 같은 방사능과 관련이 있습니다. 그것은 인간에게 매우 위험합니다.
특성.
210Po는 138.4일의 반감기를 가진 알파 방출체로, 안정한 딸 동위원소인 Pb로 직접 붕괴합니다. 1밀리그램의 Po는 5그램의 Ra만큼의 알파 입자를 초당 방출하는데,[3] 이것은 이것이 라듐보다 5,000배나 더 많은 방사능을 가진다는 것을 의미합니다. Po의 몇 가지 퀴리(1큐리는 37기가베크렐, 1Ci = 37GBq와 동일)는 주변 공기의 이온화로 인해 파란색 광채를 발산합니다.
알파 방출량 100,000개 중 약 1개는 핵에 여기를 일으켜 최대 에너지가 803keV인 감마선을 방출합니다.[4][5]
솔리드 스테이트 폼
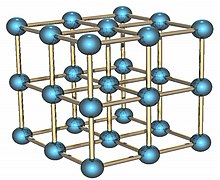
폴로늄은 두 개의 금속 동소체에 존재하는 방사성 원소입니다. 알파 형태는 STP(우주 그룹 Pm3m, no. 221)에서 단일 원자 기반의 단순한 입방정 구조의 유일한 알려진 예입니다. 단위 셀의 가장자리 길이는 335.2 피코미터이며 베타 형태는 능면체입니다.[6][7][8] 폴로늄의 구조는 X선 회절과[9][10] 전자 회절이 특징입니다.[11]
210시료를[citation needed] 공기 중에서 55°C(131°F)로 가열하면 45시간 만에 50%가 기화되어 이원자성 Po2 분자가 생성되는데, 폴로늄의 녹는점은 254°C(489°F), 끓는점은 962°C(1,764°F)입니다.[12][13][1] 폴로늄이 어떻게 작용하는지에 대한 가설은 한 가지가 아닙니다. 한 가지 제안은 폴로늄 원자의 작은 클러스터가 알파 붕괴에 의해 흩어진다는 것입니다.[14]
화학
폴로늄의 화학적 성질은 텔루륨의 화학적 성질과 비슷하지만 이웃 비스무트와 약간의 유사성을 보이기도 합니다. 폴로늄은 묽은 산에서는 쉽게 녹지만 알칼리에는 약간만 녹습니다. 폴로늄 용액은 먼저 Po2+ 이온에 의해 분홍색으로 변하지만, 폴로늄에서 나오는 알파 방사선이 용매를 이온화시켜 Po를2+ Po로4+ 변환시키기 때문에 급격히 노란색으로 변합니다. 폴로늄은 또한 분해 후 알파입자를 방출하기 때문에 이 과정은 흡수된 알파입자로 인해 유리제품에 의한 기포 및 열과 빛의 방출을 동반하며, 따라서 폴로늄 용액은 휘발성을 띠며 밀봉되지 않으면 수일 내에 증발됩니다.[15][16] pH 1 정도에서 폴로늄 이온은 옥살산, 시트르산, 타르타르산 등의 산에 의해 쉽게 가수분해되고 착화됩니다.[17]
화합물
폴로늄은 일반적인 화합물이 없고 거의 모든 화합물이 합성적으로 생성되며 그 중 50개 이상이 알려져 있습니다.[18] 폴로늄 화합물 중에서 가장 안정적인 부류는 폴로늄 화합물로 두 원소의 직접 반응에 의해 제조됩니다. NaPo는2 반불화물 구조를 가지고 있고, Ca, Ba, Hg, Pb 및 란탄화물의 폴로니드는 NaCl 격자를 형성하고, BePo 및 CdPo는 wurtzite 및 MgPo는 니켈 비소 구조를 가지고 있습니다. ~300°C에서 분해되는 HgPo와 1000°C 이상의 온도에서 녹는 란타넘족 폴로니즈를 제외하고는 대부분의 폴로니즈는 가열 시 약 600°C까지 분해됩니다. 예를 들어, 프라세오디뮴(PrPo)의 폴로나이드는 1250°C에서 녹고, 툴륨(TmPo)의 폴로나이드는 2200°C에서 녹습니다.[19] PbPo는 폴로늄 알파가 붕괴하여 납을 형성하기 때문에 자연적으로 발생하는 극소수의 폴로늄 화합물 중 하나입니다.[20]
폴로늄 하이드라이드(Polonium Hydride, PoH
2)는 상온에서 해리되기 쉬운 휘발성 액체로 열적으로 불안정합니다.[19] 물은 상온에서 액체인 유일하게 알려진 수소 칼코게나이드이지만, 이는 수소 결합 때문입니다. 세 가지 산화물인 PoO, PoO2 및 PoO는3 폴로늄의 산화 생성물입니다.[21]
구조 PoX2, PoX4 및 PoF의6 할로겐화물이 알려져 있습니다. 이들은 상응하는 할로겐화수소, 즉 HCl의 PoClX, HBr의 PoBrX 및 HI의 PoI에4 용해됩니다.[22] 폴로늄 디할라이드는 원소의 직접 반응 또는 SO와2 PoCl4 및 HS와2 PoBr의4 환원에 의해 상온에서 형성됩니다. 테트라할라이드는 이산화 폴로늄과 HCl, HBr 또는 HI를 반응시켜 얻을 수 있습니다.[23]
Other polonium compounds include the polonite, potassium polonite; various polonate solutions; and the acetate, bromate, carbonate, citrate, chromate, cyanide, formate, (II) or (IV) hydroxide, nitrate, selenate, selenite, monosulfide, sulfate, disulfate or sulfite salts.[22][24]
제한된 유기 폴로늄 화학은 대부분 디알킬 및 디알릴 폴로늄(RPo2), 트리알릴 폴로늄 할라이드(ArPoX3) 및 디알릴 폴로늄 디할라이드(ArPoX22)로 제한됩니다.[25][26] 폴로늄은 또한 2,3-부탄디올 및 티오우레아와 같은 일부 킬레이트제와 가용성 화합물을 형성합니다.[25]
| 공식 | 색. | m.p(°C) | 승화 온도(°C) | 대칭 | 피어슨 기호 | 공간군 | 아니요. | a(pm) | b(pm) | c(pm) | Z | ρ(g/cm) | 참고인의 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 응가 | 블랙입니다. | ||||||||||||
| 똥2 | 담황색 | 500(12월) | 885 | FCC | cF12 | Fm3m | 225 | 563.7 | 563.7 | 563.7 | 4 | 8.94 | [28] |
| PoH2 | -35.5 | ||||||||||||
| PoC2 | 짙은 루비색 빨강 | 355 | 130 | orthorhombic | oP3 | Pmmm | 47 | 367 | 435 | 450 | 1 | 6.47 | [29] |
| PoBr2 | 보랏빛 갈색의 | 270(12월) | [30] | ||||||||||
| PoC4 | 노란 색 | 300 | 200 | 단사정계의 | [29] | ||||||||
| PoBr4 | 빨간. | 330(12월) | FCC | cF100 | Fm3m | 225 | 560 | 560 | 560 | 4 | [30] | ||
| PoI4 | 블랙입니다. | [31] |
동위 원소
폴로늄에는 알려진 42개의 동위원소가 있는데 모두 방사성을 띠고 있습니다. 그들은 186에서 227 u 범위의 원자 질량을 가지고 있습니다. Po (반감기 138.376 일)는 가장 널리 이용 가능하고 천연 비스무트에 의한 중성자 포획을 통해 만들어집니다. 더 긴 수명의 Po(반수명 124년, 모든 폴로늄 동위원소 중 가장 긴 수명)[2]와 Po(반수명 2.9년)는 사이클로트론에서 납 또는 비스무트의 알파, 양성자 또는 중수소 충격을 통해 만들어질 수 있습니다.[32]
역사
가칭 "라듐 F"로 불리는 폴로늄은 1898년 7월 마리 퀴리와 피에르 퀴리에 의해 발견되었으며,[33][34] 마리 퀴리의 고향인 폴란드(라틴어: 폴로니아)에서 이름을 따왔습니다.[35][36] 당시 폴란드는 러시아, 독일, 오스트리아-헝가리의 분단 상태였으며 독립 국가로 존재하지 않았습니다. 퀴리의 희망은 그 요소의 이름을 그녀의 고향의 이름을 따서 지으면 독립성이 부족하다는 것을 널리 알릴 수 있기를 바라는 것이었습니다. 폴로늄은 정치적 논쟁을 강조하기 위해 명명된 최초의 원소일 수 있습니다.[37]
이 원소는 퀴리 부부가 피치블렌드 방사능의 원인을 조사하던 중 처음으로 발견한 원소입니다. 방사성 원소인 우라늄과 토륨을 제거한 피치블렌데는 우라늄과 토륨을 합친 것보다 방사능이 더 강했습니다. 이로 인해 퀴리 부부는 추가적인 방사성 원소를 찾아 나섰습니다. 그들은 1898년 7월에 처음으로 피치블렌드에서 폴로늄을 분리했고, 5개월 후에는 라듐도 분리했습니다.[15][33][38] 1902년 독일 과학자 빌리 마크왈드는 3밀리그램의 폴로늄을 분리하는 데 성공했지만, 당시 그는 폴로늄을 "라디오 텔루륨"이라고 부르는 새로운 원소라고 믿었고, 1905년이 되어서야 폴로늄과 동일하다는 것이 입증되었습니다.[39][40]
폴로늄은 제2차 세계대전 중 맨해튼 프로젝트의 데이턴 프로젝트의 일환으로 미국에서 생산되었습니다. 폭탄의 구형 구덩이 중심에 있는 '우르친' 개시제의 핵심 성분은 폴로늄과 베릴륨이었습니다.[41] '우르친'은 신속한 임계 순간에 핵 연쇄 반응을 일으켜 무기가 흐르지 않도록 했습니다. '우르친'은 초기 미국 무기에 사용되었고, 이후 미국 무기들도 같은 목적으로 펄스 중성자 발생기를 사용했습니다.[41]
폴로늄의 기본 물리학의 많은 부분이 전쟁 이후까지 분류되었습니다. 포형 핵무기에 폴로늄-베릴륨(Po-Be) 개시제가 사용된 사실은 1960년대까지 분류되었습니다.[42]
원자력 위원회와 맨해튼 프로젝트는 1943년에서 1947년 사이에 로체스터 대학에서 5명의 사람들에게 폴로늄을 이용한 인간 실험에 자금을 지원했습니다. 사람들은 폴로늄의 배설을 연구하기 위해 9~22 마이크로큐리(330~810kBq)의 폴로늄을 투여받았습니다.[43][44][45]
발생 및 생산
폴로늄은 모든 동위원소의 반감기가 짧기 때문에 자연계에서 매우 희귀한 원소입니다. 210에서 218을 포함하는 9개의 동위원소는 붕괴 생성물로서 미량으로 존재합니다: Po, Po 및 Po는 U의 붕괴 사슬에서 발생하고, Po 및 Po는 U의 붕괴 사슬에서 발생하고, Po 및 Po는 Th의 붕괴 사슬에서 발생하고, Po 및 Po는 Np의 붕괴 사슬에서 발생합니다. (원시 Np는 생존하지 않지만, 그 흔적은 n을 통해 지속적으로 재생됩니다.)2n) 자연적인 U)[46]에서의 녹아웃 반응 이 중 Po는 유일하게 3분보다 긴 반감기를 갖는 동위원소입니다.[47]
폴로늄은 우라늄 광석에서 미터톤당 약 0.1mg(10분의10 1)으로 발견될 수 있으며,[48][49] 이는 라듐의 풍부함의 약 0.2%입니다. 지각의 양은 해롭지 않습니다. 폴로늄은 인산염 비료로 재배한 담배 잎에서 나오는 담배 연기에서 발견되었습니다.[50][51][52]
폴로늄은 적은 농도로 존재하기 때문에 천연 소스에서 분리하는 것은 지루한 과정입니다. 20세기 전반에 수행된 추출된 원소 중 가장 큰 배치는 40Ci(1.5TBq)(9mg)의 폴로늄-210을 함유하고 있으며 라듐 생산에서 37톤의 잔류물을 처리하여 얻은 것입니다.[53] 현재 폴로늄은 보통 비스무트에 고에너지 중성자나 양성자를 조사하여 얻어집니다.[15][54]
1934년, 한 실험은 자연 Bi가 중성자를 폭격할 때 Bi가 생성되고 그 후 베타 마이너스 붕괴를 통해 Po로 붕괴된다는 것을 보여주었습니다. 베릴륨과 같은 가벼운 원소 핵을 포함하는 특정 비스무트 염을 조사함으로써, 캐스캐이딩(α,n) 반응을 유도하여 Po를 대량으로 생성할 수도 있습니다.[55] 최종 정제는 열화학적으로 수행되고 액체-액체 추출 기술이 뒤따릅니다.[56] 폴로늄은 원자로에서 발견되는 높은 중성자 플럭스를 사용하는 이 공정에서 밀리그램 단위로 만들어질 수 있습니다.[54] 매년 약 100g 정도만 생산되는데, 거의 전부가 러시아에서 생산되어 폴로늄은 매우 희귀합니다.[57][58]
이 과정은 소련 해군의 K-27에 사용되는 것과 같은 납-비스무트 기반 액체 금속 냉각 원자로에서 문제를 일으킬 수 있습니다. 이러한 원자로에서는 Po가 냉각수에서 방출될 수 있는 원치 않는 가능성에 대처하기 위한 조치가 이루어져야 합니다.[59][60]
폴로늄의 수명이 더 긴 동위원소인 Po와 Po는 사이클로트론을 사용하여 비스무트의 양성자 또는 중수소 충격에 의해 형성될 수 있습니다. 백금에 탄소핵을 조사하면 중성자가 더 부족하고 불안정한 다른 동위원소를 형성할 수 있습니다.[61]
적용들
폴로늄을 기반으로 한 알파 입자의 공급원은 구소련에서 생산되었습니다.[62] 이러한 소스는 알파 방사선의 감쇠를 통해 산업용 코팅의 두께를 측정하는 데 적용되었습니다.[63]
강렬한 알파 방사선 때문에, 1그램의 Po 샘플은 자발적으로 500°C (932°F) 이상까지 가열되어 약 140와트의 전력을 생산합니다. 따라서 Po는 원자 열원으로 사용되어 열전 물질을 통해 방사성 동위원소 열전 발전기에 전력을 공급합니다.[3][15][64][65] 예를 들어, Po 열원은 달 밤 동안 내부 구성 요소를 따뜻하게 유지하기 위해 루노크호드 1호(1970)와 루노크호드 2호(1973) 달 탐사선과 코스모스 84호와 90호 위성(1965)에 사용되었습니다.[62][66]
폴로늄이 방출하는 알파 입자는 산화 베릴륨을 사용하여 알파 입자 100만 개당 93개의 중성자 비율로 중성자로 변환될 수 있습니다.[64] Po-BeO 혼합물은 핵분열 기반 중성자 소스보다 낮은 1.13 ± 0.05의 감마선 대 중성자 생산 비율을 갖는 수동 중성자 소스로 사용됩니다.[67] 중성자 공급원으로 사용되는 Po-BeO 혼합물 또는 합금의 예로는 핵무기[15][68] 및 유정의 검사를 위한 중성자 트리거 또는 개시제가 있습니다. 이러한 유형의 소스는 1,850Ci(68TBq)의 개별 활동으로 소련에서 매년 약 1500개가 사용되었습니다.[69]
폴로늄은 또한 코팅을 적용하기 전에 사진 플레이트, 섬유 공장, 종이 롤, 시트 플라스틱 및 기판(자동차 등)의 정전기 전하를 제거하는 브러시 또는 더 복잡한 도구의 일부였습니다.[70] 폴로늄이 방출하는 알파 입자는 주변 표면의 전하를 중화하는 공기 분자를 이온화합니다.[71][72] 일부 정전기 방지 브러시는 정전기를 중화하기 위한 하전 입자의 공급원으로 최대 500 마이크로큐리(20 MBq)의 Po를 포함합니다.[73] 미국에서는 단위당 500μCi(19MBq) 이하의 Pop(밀봉) 장치를 "일반 라이센스"에 따라 얼마든지 구입할 수 [74]있으므로 구매자를 어떤 기관에서도 등록할 필요가 없습니다. 폴로늄은 반감기가 짧기 때문에 거의 매년 이러한 장치를 교체해야 합니다. 또한 방사능이 강하기 때문에 대부분 덜 위험한 베타 입자 공급원으로 대체되었습니다.[3]
극소량의 Po는 실험실에서 사용되기도 하며, 일반적으로 4–40 kBq(0.11–1.08 μCi) 정도의 밀봉된 소스의 형태로 기판 또는 수지 또는 폴리머 매트릭스에 폴로늄을 증착한 상태로, NRC 및 유사한 당국의 허가에서 종종 위험한 것으로 간주되지 않기 때문에 면제됩니다. 소량의 Po는 실험실 실험을 위한 "바늘 공급원"으로 미국에서 대중에게 판매하기 위해 제조되며 과학 공급 회사에 의해 소매됩니다. 폴로늄은 도금층으로 금과 같은 물질로 도금되어 있으며, 이는 폴로늄이 방출되는 것을 방지하고 독성 위험을 나타내면서 알파 방사선(구름실과 같은 실험에 사용됨)이 통과할 수 있도록 합니다.[citation needed]
폴로늄 스파크 플러그는 1940년부터 1953년까지 파이어스톤에 의해 판매되었습니다. 플러그에서 나오는 방사선의 양은 극소량이었고 소비자에게 위협이 되지는 않았지만, 폴로늄의 짧은 반감기와 도체에 축적되면 엔진 성능을 향상시키는 방사선을 차단할 수 있기 때문에 이러한 플러그의 이점은 약 한 달 후에 빠르게 감소했습니다. (앞에 나온 알프레드 매튜 허바드의 라듐 플러그와 폴로늄 스파크 플러그의 전제는 방사선이 실린더 내 연료의 이온화를 향상시켜 모터가 더 빠르고 효율적으로 발사되도록 한다는 것이었습니다.)[75][76]
생물학 및 독성
개요
폴로늄은 유해할 수 있으며 생물학적 역할이 없습니다.[15] 폴로늄-210은 시안화수소보다 약 250,000배 더 독성이 강합니다(Po의 LD는50 평균 성인의 경우 1마이크로그램 미만이며, 시안화수소의[77] 경우 약 250밀리그램입니다). 주요 위험은 (알파 방출기와 같은) 강한 방사능으로 인해 안전하게 다루기 어렵다는 것입니다. 마이크로그램 양에서도 Po를 취급하는 것은 극도로 위험하여 전문 장비(고성능 필터가 장착된 음압 알파 글로브 박스), 적절한 모니터링 및 오염을 방지하기 위한 엄격한 취급 절차가 필요합니다. 폴로늄이 내뿜는 알파입자는 표피에 침투하지 않아 몸 밖에 남아 있는 한 위험하지 않지만 폴로늄을 섭취하거나 흡입하거나 흡수하면 유기조직에 쉽게 손상을 입힙니다. 내화학성 및 손상되지 않은 장갑을 착용하는 것은 피부를 통해 직접 폴로늄이 경피적으로 확산되는 것을 피하기 위한 필수 예방 조치입니다. 농축된 질산으로 전달된 폴로늄은 부적절한 장갑(예: 라텍스 장갑)을 통해 쉽게 확산될 수 있으며, 또는 산이 장갑을 손상시킬 수 있습니다.[78]
폴로늄은 독성 화학적 성질을 가지고 있지 않습니다.[79]
일부 미생물은 메틸코발라민의 작용으로 폴로늄을 메틸화할 수 있다고 보고되었습니다.[80][81] 이것은 수은, 셀레늄, 텔루륨이 생물체 내에서 메틸화되어 유기금속 화합물이 생성되는 것과 유사합니다. 쥐에서 폴로늄-210의 대사를 조사한 연구에 따르면 섭취한 폴로늄-210의 0.002~0.009%만이 휘발성 폴로늄-210으로 배설되는 것으로 나타났습니다.[82]
급성효과
급성 방사선 피폭의 치사량(LD) 중앙값은 약 4.5 Sv입니다. 허용된 유효 선량당량 Po는 섭취 시 0.51 µ Sv/Bq, 흡입 시 2.5 µ Sv/Bq입니다. 치명적인 4.5Sv 용량은 8.8MBq(240μCi), 약 50나노그램(ng) 또는 약 10ng의 1.8MBq(49μCi)를 흡입하면 발생할 수 있습니다. 따라서 포 1그램은 이론적으로 2천만 명을 독살할 수 있으며, 그 중 1천만 명이 사망할 것입니다. 몇 주에 걸쳐 퍼지는 방사선 노출(인간의 폴로늄 생물학적 반감기는 30~50일[85])은 순간 선량보다 다소 손상이 덜하기 때문에 Po의 실제 독성은 이러한 추정치보다 낮습니다. Po의 중간 치사량은 15 메가베크렐 (0.41 mCi) 또는 0.089 마이크로그램 (μg)으로 여전히 매우 적은 양인 것으로 추정됩니다.[86][87] 비교를 위해 테이블 소금 1알은 약 0.06mg = 60μg입니다.
장기(만성) 효과
급성 영향 외에도 방사선 노출(내부 및 외부 모두)은 Sv당 5-10%의 암으로 인한 장기 사망 위험을 가지고 있습니다.[83] 일반인은 실내 공기 중 라돈 딸로서 소량의 폴로늄에 노출되는데, 매년 미국에서 발생하는 폐암 사망자 중 15,000~22,000명으로 추정되는 대부분이[89] Po와 Po 동위원소에 의해 실내 라돈으로 인한 것으로 추정됩니다.[90] 담배 흡연은 폴로늄에 추가적인 노출을 유발합니다.[91]
규제 노출 한계 및 취급
섭취된 Po의 최대 허용 신체 부담은 1.1kBq(30nCi)에 불과하며, 이는 입자 질량이 6.8피코그램에 불과합니다. 공기 중 Po의 최대 허용 작업장 농도는 약 10 Bq/m(3×10 µ Ci/cm)입니다. 인간의 폴로늄의 표적 장기는 비장과 간입니다.[93] 비장(150g)과 간(1.3~3kg)은 신체의 다른 부분보다 훨씬 작기 때문에 폴로늄이 이러한 중요한 기관에 집중되어 있으면 세슘이나 삼중수소(TO2)와 같이 전신에 골고루 퍼지면 (평균적으로) 전신이 겪을 선량보다 생명에 더 큰 위협이 됩니다.[citation needed]
210Po는 산업에서 널리 사용되며 규제나 제한 없이 쉽게 사용할 수 있습니다.[94]}[95]미국에서는[95] 2007년 원자력규제위원회가 운영하는 추적시스템을 도입해 폴로늄-210(치명량 5,000회분)을 16퀴리(590GBq) 이상 구매한 것으로 등록했습니다. IAEA "규제 강화 검토중인 것으로 알려졌습니다... 폴로늄 보고 요건을 1.6 퀴리(59GBq)로 10배 강화할 수도 있다는 이야기가 나오고 있습니다."[96] 2013년 현재, 이 물질은 방사성 물질 면허 없이도 보유할 수 있는 NRC 면제량으로서 이용 가능한 유일한 알파 방출 부산물 물질입니다.[citation needed]
폴로늄과 그 화합물은 방사성 물질이 새어나가지 않도록 HEPA 필터가 장착된 특수 알파 글로브 박스 내부에서 주의하여 취급해야 합니다. 천연 고무(라텍스)로 만들어진 장갑은 폴로늄이 유리에 흡착되는 것을 최소화하면서 용액 속에 보관하는 데 일반적으로 사용되는 농축 질산(예: 6M HNO3)에 의한 화학 공격을 제대로 견디지 못합니다. 폴로늄으로부터의 오염(손상되지 않은 라텍스 막을 통한 Po 용액의 확산 또는 더 나쁜 것)에 대한 충분한 보호 기능을 제공하지 못합니다. 라텍스가 산 또는 주변광으로부터의 UV에 의해 분해되기 시작할 때 생성되는 작은 구멍 및 균열을 통한 직접적인 접촉; 추가적인 수술 장갑이 필요함(강산 및 염기 취급 시 주요 장갑을 보호하기 위해 글로브박스 내부), 또한 Po 오염 또는 장갑 결함을 통한 직접 접촉으로부터 작업자의 손을 보호하기 위해 외부에서. 화학적으로 더 저항력이 있고 밀도가 높은 네오프렌 및 부틸 장갑은 천연 고무보다 폴로늄이 방출하는 알파 입자를 더 잘 차폐합니다.[97] Po 용액을 취급할 때는 천연 고무 장갑을 사용하지 않는 것이 좋습니다.
중독사례
폴로늄 중독이 발생할 수 있는 경우는 매우 위험한 특성을 가지고 있음에도 불구하고 드물습니다. 자연 상태에서의 극도의 희소성, 모든 동위원소의 짧은 반감기, 상당한 양을 얻기 위해 필요한 전문 시설 및 장비, 실험실 사고에 대한 안전 예방 조치 등으로 인해 유해한 노출 사건이 발생할 가능성이 낮습니다. 이와 같이 폴로늄 노출에 의한 방사선 중독 사례는 소수만 확인되고 있습니다.[citation needed]
20세기
직업적 폴로늄 노출의 위험성에 대한 우려에 대응하여, 생물학적 행동을 연구하기 위해 1944년부터 1947년까지 로체스터 대학의 5명의 인간 자원봉사자에게 Po의 양을 투여했습니다. 이 연구들은 맨해튼 프로젝트와 AEC의 자금 지원을 받았습니다. 네 명의 남녀가 참여했는데, 모두 말기 암을 앓고 있었고, 나이는 30대 초반에서 40대 초반까지 다양했습니다. 모두 실험자들이 일과 사고를 통해 폴로늄에 노출되지 않은 피실험자들을 원했기 때문에 선택되었습니다.[98] 210포는 입원한 4명의 환자에게 주사되었고, 5분의 1에게 경구 투여되었습니다. 투여된 용량(모두 0.17~0.30μCi kg−1 범위) 중 어느 것도 치명적인 양에 접근하지 못했습니다.[99][98]
폴로늄 중독으로 인한 사망은 1954년 7월 10일 소련에서 처음으로 기록되었습니다.[100][101] 신원이 확인되지 않은 41세 남성이 6월 29일 심한 구토와 발열을 주소로 진료를 받기 위해 내원했으며, 전날에는 포를 함유한 캡슐이 감압되어 에어로졸 형태로 분산되기 시작한 지역에서 5시간 동안 작업했습니다. 이 기간 동안 공기 중 Po의 총 섭취량은 0.11GBq(4.5MBq 흡입으로 추정된50 LD의 거의 25배)로 추정되었습니다. 치료에도 불구하고 상태가 계속 악화되어 노출 사건 발생 13일 만에 사망하였습니다.[100]
1955년부터 1957년까지 윈드스케일 파일스는 폴로늄 210을 출시했습니다. 윈드스케일 화재는 바람이 부는 땅의 방사성 물질 오염 여부를 검사할 필요성을 가져왔고, 이렇게 발견되었습니다. 폴로늄-210의 추정치는 8.8 테라베크렐(240 Ci)입니다.
1956년 백혈병으로 사망한 Irène Joliot-Curie가 폴로늄의 방사선 효과에 기인했다는 주장도 제기되었습니다. 그녀는 1946년 그녀의 실험실 벤치에서 그 원소의 밀봉된 캡슐이 폭발했을 때 우연히 노출되었습니다.[102]
또한 1957-1969년 동안 이스라엘에서 발생한 여러 사망은 Po 노출로 인한 것으로 주장되었습니다.[103] 1957년 바이츠만 연구소에서 누수가 발견되었습니다. 방사성 물질을 연구한 물리학자 사데 박사의 손에서 포의 흔적이 발견됐습니다. 의학적 검사에서 유해성은 없었지만 골수는 포함되지 않았습니다. 그의 학생들 중 한 명인 Sadeh와 두 명의 동료들은 이후 몇 년 동안 다양한 암으로 사망했습니다. 이 문제는 비밀리에 조사되었지만 유출과 사망자 사이의 연관성에 대한 공식적인 인정은 없었습니다.[104]
1979년 7월 16일 발생한 처치 록 우라늄 공장 유출 사고로 폴로늄-210이 방출된 것으로 알려졌습니다. 보고서는 동물들이 대조군 동물의 조직보다 납-210, 폴로늄-210 및 라듐-226의 농도가 더 높았다고 밝혔습니다.[105]
21세기
2001년 영국으로 망명한 전직 러시아 FSB 요원 알렉산더 리트비넨코의 2006년 사망 원인은 치사량의 포에 중독된 것으로 밝혀졌습니다.[106][107] 이후 두 명의 러시아 전직 보안 요원인 안드레이 루고보이와 드미트리 코툰이 고의로 포를 투여했을 가능성이 있는 것으로 밝혀졌습니다.[108][109] 이처럼 리트비넨코의 죽음은 폴로늄의 극심한 독성이 악의적인 의도로 사용된 최초의 (그리고 현재까지 유일하게) 확인된 사례입니다.[110][111][112]
2011년, 2004년 11월 11일 불확실한 원인으로 사망한 팔레스타인 지도자 야세르 아라파트의 사망도 고의적인 폴로늄 중독에서 비롯되었다는 주장이 제기되었고,[113][114] 2012년 7월, 스위스 로잔에 있는 방사선 물리학 연구소(Institute de Radiophysique)에 의해 아라파트의 옷과 개인 소지품에서 정상보다 몇 배나 많은 Po 농도가 검출되었습니다.[115][116] 아라파트의 증상이 설사와 구토를 동반한 급성 위장염이었음에도 불구하고,[117] 연구소의 대변인은 아라파트의 의료 보고서에 설명된 증상이 포독과 일치하지 않았으며, 결론을 내릴 수 없었다고 말했습니다.[116] 2013년에 연구팀은 아라파트의 갈비뼈와 골반에서 폴로늄의 양이 평균의 18배에서 36배까지 감소했음을 발견했습니다.[118][119][120] 법의학자 데이브 바클레이(Dave Barclay)는 "제 생각에는 그의 병의 원인이 폴로늄 중독인 것이 확실합니다... 우리가 가진 것은 스모킹 건입니다. 그것은 그의 병을 일으키고 악의를 가지고 그에게 주어진 것입니다."[117][118] 그 후 프랑스와 러시아 팀은 높아진 Po 수치가 고의적인 중독의 결과가 아니며 아라파트의 사망을 초래하지 않았다고 주장했습니다.[121][122]
러시아 사업가 로만 체포프가 폴로늄으로 살해됐다는 의혹도 제기됐습니다. 그는 알렉산데르 리트비넨코와 비슷한 증상을 보였습니다.[123]
치료
영국의 안티 르위사이트(이머카프롤)와 같은 킬레이트제를 사용하여 사람을 오염시킬 수 있다고 제안되었습니다.[124] 한 실험에서 쥐들에게 치명적인 용량인 1.45 MBq/kg(8.7 ng/kg)의 Po를 투여했는데, 처리되지 않은 쥐들은 모두 44일 후에 죽었지만, 90%의 쥐들은 킬레이트제 HOEt를 처리했습니다.TTC는 5개월 동안 살아 있었습니다.[125]
생물학적 시료에서의 검출
폴로늄-210은 입원 환자의 중독 진단을 확인하거나 의료법적 사망 조사에서 증거를 제공하기 위해 알파 입자 분광법에 의해 생물학적 표본에서 정량화될 수 있습니다. 환경원에 대한 일상적인 노출로 인한 건강한 사람의 폴로늄-210의 기본 소변 배설량은 보통 5-15mBq/일 범위입니다. 30 mBq/day를 초과하는 수준은 방사성핵종에 과도하게 노출될 가능성이 있습니다.[126]
인간과 생물권에서의 발생
폴로늄-210은 우라늄-238 붕괴 사슬에 위치하기 때문에 인간 조직을 포함한 생물권에 널리 퍼져 있습니다. 지구 지각에 있는 천연 우라늄-238은 라듐-226을 포함한 일련의 고체 방사성 중간체를 통해 방사성 비활성 기체 라돈-222로 붕괴되고, 그 중 일부는 3.8일의 반감기 동안 대기로 확산됩니다. 그곳에서 폴로늄-210까지 몇 단계를 더 거쳐 붕괴되는데, 138일의 반감기 동안 많은 부분이 지구 표면으로 다시 씻겨 내려오면서 생물권에 진입한 후 최종적으로 안정적인 납-206으로 붕괴됩니다.[127][128][129]
1920년대 초, 프랑스 생물학자 앙투안 라카사뉴는 동료 마리 퀴리가 제공한 폴로늄을 사용하여 이 원소가 토끼 조직, 특히 간, 신장 및 고환에서 고농도로 흡수되는 특정 패턴을 가지고 있음을 보여주었습니다.[130] 보다 최근의 증거에 따르면, 이러한 행동은 주기율표의 16족에서도 황을 함유한 아미노산 또는 관련 분자에서[131] 폴로늄이 동족 황을 대체하고 유사한 분포 패턴이 인체 조직에서 발생한다는 것을 시사합니다.[132] 폴로늄은 실제로 모든 인간에게 자연적으로 존재하는 원소이며, 예를 들어 지리적, 문화적으로 매우 다양하고 특히 북극 거주자의 수준이 높습니다.[133]
담배
담배의 폴로늄-210은 전 세계적으로 폐암의 많은 사례에 기여합니다. 이 폴로늄의 대부분은 대기에서 담배 잎에 퇴적된 납-210에서 유래하며, 납-210은 라돈-222 가스의 생성물이며, 대부분은 담배 토양에 적용된 비료로 인한 라듐-226의 붕괴에서 비롯된 것으로 보입니다.[52][134][135][136][137]
폴로늄이 담배 연기에 존재한다는 것은 1960년대 초부터 알려져 왔습니다.[138][139] 세계에서 가장 큰 담배 회사들 중 일부는 40년 동안 이 물질을 제거하는 방법을 연구했지만 소용이 없었습니다. 결과가 발표된 적이 없습니다.[52]
음식.
폴로늄은 먹이 사슬, 특히 해산물에서 발견됩니다.[140][141]
참고 항목
참고문헌
- ^ a b Thayer, John S. (2010). "Relativistic Effects and the Chemistry of the Heavier Main Group Elements". Relativistic Methods for Chemists. Challenges and Advances in Computational Chemistry and Physics. 10: 78. doi:10.1007/978-1-4020-9975-5_2. ISBN 978-1-4020-9974-8.
- ^ a b Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ a b c "Polonium" (PDF). Argonne National Laboratory. Archived from the original (PDF) on 3 July 2007. Retrieved 5 May 2009.
- ^ 그린우드, 페이지 250
- ^ "210PO α decay". Nuclear Data Center, Korea Atomic Energy Research Institute. 2000. Retrieved 5 May 2009.
- ^ 그린우드, 페이지 753
- ^ Miessler, Gary L.; Tarr, Donald A. (2004). Inorganic Chemistry (3rd ed.). Upper Saddle River, N.J.: Pearson Prentice Hall. p. 285. ISBN 978-0-13-120198-9.
- ^ "The beta Po (A_i) Structure". Naval Research Laboratory. 20 November 2000. Archived from the original on 4 February 2001. Retrieved 5 May 2009.
- ^ Desando, R. J.; Lange, R. C. (1966). "The structures of polonium and its compounds—I α and β polonium metal". Journal of Inorganic and Nuclear Chemistry. 28 (9): 1837–1846. doi:10.1016/0022-1902(66)80270-1.
- ^ Beamer, W. H.; Maxwell, C. R. (1946). "The Crystal Structure of Polonium". Journal of Chemical Physics. 14 (9): 569. doi:10.1063/1.1724201. hdl:2027/mdp.39015086430371.
- ^ Rollier, M. A.; Hendricks, S. B.; Maxwell, L. R. (1936). "The Crystal Structure of Polonium by Electron Diffraction". Journal of Chemical Physics. 4 (10): 648. Bibcode:1936JChPh...4..648R. doi:10.1063/1.1749762.
- ^ Wąs, Bogdan; Misiak, Ryszard; Bartyzel, Mirosław; Petelenz, Barbara (2006). "Thermochromatographic separation of 206,208Po from a bismuth target bombarded with protons" (PDF). Nukleonika. 51 (Suppl. 2): s3–s5.
- ^ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Condit, Ralph H.; Gray, Leonard W.; Mitchell, Mark A. (2014). Pseudo-evaporation of high specific activity alpha-emitting materials. EFCOG 2014 Safety Analysis Workshop. Lawrence Livermore National Laboratory. OSTI 1162255.
- ^ a b c d e f Emsley, John (2001). Nature's Building Blocks. New York: Oxford University Press. pp. 330–332. ISBN 978-0-19-850341-5.
- ^ Bagnall, 페이지 206
- ^ Keller, Cornelius; Wolf, Walter; Shani, Jashovam. "Radionuclides, 2. Radioactive Elements and Artificial Radionuclides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.o22_o15. ISBN 978-3527306732.
- ^ Bagnall, p. 199
- ^ a b 그린우드, 페이지 766
- ^ Weigel, F. (1959). "Chemie des Poloniums". Angewandte Chemie. 71 (9): 289–316. Bibcode:1959AngCh..71..289W. doi:10.1002/ange.19590710902.
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ a b Figgins, P.E. (1961) 미국 원자력 위원회, National Academy of Sciences, Pop. 13-14 Google Books
- ^ a b 그린우드, 페이지 765, 771, 775
- ^ Bagnall, pp. 212–226
- ^ a b Zingaro, Ralph A. (2011). "Polonium: Organometallic Chemistry". Encyclopedia of Inorganic and Bioinorganic Chemistry. John Wiley & Sons. pp. 1–3. doi:10.1002/9781119951438.eibc0182. ISBN 9781119951438.
- ^ Murin, A. N.; Nefedov, V. D.; Zaitsev, V. M.; Grachev, S. A. (1960). "Production of organopolonium compounds by using chemical alterations taking place during the β-decay of RaE" (PDF). Dokl. Akad. Nauk SSSR (in Russian). 133 (1): 123–125. Retrieved 12 April 2020.
- ^ Wiberg, Egon; Holleman, A. F. and Wiberg, Nils Inorganic Chemistry, Academic Press, 2001, p. 594, ISBN 0-12-352651-5.
- ^ Bagnall, K. W.; d'Eye, R. W. M. (1954). "The Preparation of Polonium Metal and Polonium Dioxide". J. Chem. Soc.: 4295–4299. doi:10.1039/JR9540004295.
- ^ a b Bagnall, K. W.; d'Eye, R. W. M.; Freeman, J. H. (1955). "The polonium halides. Part I. Polonium chlorides". Journal of the Chemical Society (Resumed): 2320. doi:10.1039/JR9550002320.
- ^ a b Bagnall, K. W.; d'Eye, R. W. M.; Freeman, J. H. (1955). "The polonium halides. Part II. Bromides". Journal of the Chemical Society (Resumed): 3959. doi:10.1039/JR9550003959.
- ^ Bagnall, K. W.; d'Eye, R. W. M.; Freeman, J. H. (1956). "657. The polonium halides. Part III. Polonium tetraiodide". Journal of the Chemical Society (Resumed): 3385. doi:10.1039/JR9560003385.
- ^ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (New ed.). New York, NY: Oxford University Press. p. 415. ISBN 978-0-19-960563-7.
- ^ a b Curie, P.; Curie, M. (1898). "Sur une substance nouvelle radio-active, contenue dans la pechblende" [On a new radioactive substance contained in pitchblende] (PDF). Comptes Rendus (in French). 127: 175–178. Archived from the original on 23 July 2013.
{{cite journal}}: CS1 maint : 잘못된 URL (링크) 영어 번역 - ^ Krogt, Peter van der. "84. Polonium – Elementymology & Elements Multidict". elements.vanderkrogt.net. Retrieved 26 April 2017.
- ^ Pfützner, M. (1999). "Borders of the Nuclear World – 100 Years After Discovery of Polonium". Acta Physica Polonica B. 30 (5): 1197. Bibcode:1999AcPPB..30.1197P.
- ^ Adloff, J. P. (2003). "The centennial of the 1903 Nobel Prize for physics". Radiochimica Acta. 91 (12–2003): 681–688. doi:10.1524/ract.91.12.681.23428. S2CID 120150862.
- ^ Kabzinska, K. (1998). "Chemical and Polish aspects of polonium and radium discovery". Przemysł Chemiczny. 77 (3): 104–107.
- ^ Curie, P.; Curie, M.; Bémont, G. (1898). "Sur une nouvelle substance fortement radio-active contenue dans la pechblende" [On a new, strongly radioactive substance contained in pitchblende] (PDF). Comptes Rendus (in French). 127: 1215–1217. Archived from the original (PDF) on 22 July 2013. 2009년 8월 6일 Wayback Machine에서 보관된 영문 번역본
- ^ "Polonium and Radio-Tellurium". Nature. 73 (549): 549. 1906. Bibcode:1906Natur..73R.549.. doi:10.1038/073549b0.
- ^ Neufeldt, Sieghard (2012). Chronologie Chemie: Entdecker und Entdeckungen. John Wiley & Sons. ISBN 9783527662845.
- ^ a b 핵무기 FAQ, 섹션 4.1, 버전 2.04: 1999년 2월 20일. Nuclearweaponarchive.org . 2013-04-28에 검색되었습니다.
- ^ US Department of Energy Office of Declassification (1 January 2001). "Restricted data declassification decisions, 1946 to the present (RDD-7)". FAS Project on Government Secrecy (1991-2021), fas.org. Retrieved 30 January 2024.
- ^ 미국의 핵 기니피그: 미국 시민들에 대한 30년간의 방사선 실험이 웨이백 머신에 보관된 2013-07-30. 미국. 의회 하원. 에너지 및 상업 위원회. 에너지 절약 및 전력에 관한 소위원회, 1986, 식별자 Y 4.En 2/3:99-NN, 전자 출판일 2010, Nevada University of Nevada, Reno, unr.edu
- ^ "인간 피험자의 폴로늄 대사에 관한 연구", 폴로늄, 라듐, 플루토늄을 이용한 생물학 연구 제3장, 국가, 원자력 에너지 시리즈, 제VI-3권, 맥그로힐, 1950, "미국 핵 기니피그..", 1986년 하원 에너지 및 상업 위원회 보고서
- ^ 모스, 윌리엄과 에크하르트, 로저(1995) "인간 플루토늄 주입 실험", 로스 알라모스 과학, 23번.
- ^ Peppard, D. F.; Mason, G. W.; Gray, P. R.; Mech, J. F. (1952). "Occurrence of the (4n + 1) series in nature" (PDF). Journal of the American Chemical Society. 74 (23): 6081–6084. doi:10.1021/ja01143a074.
- ^ Carvalho, F.; Fernandes, S.; Fesenko, S.; Holm, E.; Howard, B.; Martin, P.; Phaneuf, P.; Porcelli, D.; Pröhl, G.; Twining, J. (2017). The Environmental Behaviour of Polonium. Technical reports series. Vol. 484. Vienna: International Atomic Energy Agency. p. 1. ISBN 978-92-0-112116-5.
{{cite book}}:journal=무시됨(도움말) - ^ 그린우드, 페이지 746
- ^ 바그널, 198쪽
- ^ Kilthau, Gustave F. (1996). "Cancer risk in relation to radioactivity in tobacco". Radiologic Technology. 67 (3): 217–222. PMID 8850254.
- ^ "Alpha Radioactivity (210 Polonium) and Tobacco Smoke". Archived from the original on 9 June 2013. Retrieved 5 May 2009.
- ^ a b c Monique, E. Muggli; Ebbert, Jon O.; Robertson, Channing; Hurt, Richard D. (2008). "Waking a Sleeping Giant: The Tobacco Industry's Response to the Polonium-210 Issue". American Journal of Public Health. 98 (9): 1643–50. doi:10.2105/AJPH.2007.130963. PMC 2509609. PMID 18633078.
- ^ Adloff, J. P. & MacCordick, H. J. (1995). "The Dawn of Radiochemistry". Radiochimica Acta. 70/71: 13–22. doi:10.1524/ract.1995.7071.special-issue.13. S2CID 99790464.Adloff, J. P. & MacCordick, H. J. (1995). "The Dawn of Radiochemistry". Radiochimica Acta. 70/71: 13–22. doi:10.1524/ract.1995.7071.special-issue.13. S2CID 99790464.에 전재된.
- ^ a b 그린우드, 페이지 249
- ^ Lim, Solomon (2023). "Neutronic Chain Reactions for Polonium-210 Production". SSRN. doi:10.2139/ssrn.4469519. S2CID 264176122.
- ^ Schulz, Wallace W.; Schiefelbein, Gary F.; Bruns, Lester E. (1969). "Pyrochemical Extraction of Polonium from Irradiated Bismuth Metal". Ind. Eng. Chem. Process Des. Dev. 8 (4): 508–515. doi:10.1021/i260032a013.
- ^ "Q&A: Polonium-210". RSC Chemistry World. 27 November 2006. Retrieved 12 January 2009.
- ^ "Most Polonium Made Near the Volga River". The Moscow Times – News. 11 January 2007.
- ^ Usanov, V. I.; Pankratov, D. V.; Popov, É. P.; Markelov, P. I.; Ryabaya, L. D.; Zabrodskaya, S. V. (1999). "Long-lived radionuclides of sodium, lead-bismuth, and lead coolants in fast-neutron reactors". Atomic Energy. 87 (3): 658–662. doi:10.1007/BF02673579. S2CID 94738113.
- ^ Naumov, V. V. (November 2006). За какими корабельными реакторами будущее?. Атомная стратегия (in Russian). 26.
- ^ Atterling, H.; Forsling, W. (1959). "Light Polonium Isotopes from Carbon Ion Bombardments of Platinum". Arkiv för Fysik. 15 (1): 81–88. OSTI 4238755.
- ^ a b "Радиоизотопные источники тепла". Archived from the original on 1 May 2007. Retrieved 1 June 2016. (러시아어로) npc.sarov.ru
- ^ Bagnall, 225페이지
- ^ a b 그린우드, 251페이지
- ^ Hanslmeier, Arnold (2002). The sun and space weather. Springer. p. 183. ISBN 978-1-4020-0684-5.
- ^ Wilson, Andrew (1987). Solar System Log. London: Jane's Publishing Company Ltd. p. 64. ISBN 978-0-7106-0444-6.
- ^ Ritter, Sebastian (2021). "Comparative Study of Gamma to Neutron Ratios of various (alpha, neutron) Neutron Sources". arXiv:2111.02774 [nucl-ex].
- ^ Rhodes, Richard (2002). Dark Sun: The Making of the Hydrogen Bomb. New York: Walker & Company. pp. 187–188. ISBN 978-0-684-80400-2.
- ^ Красивая версия "самоубийства" Литвиненко вследствие криворукости (in Russian). stringer.ru (2006-11-26).
- ^ Boice, John D.; Cohen, Sarah S.; et al. (2014). "Mortality Among Mound Workers Exposed to Polonium-210 and Other Sources of Radiation, 1944–1979". Radiation Research. 181 (2): 208–28. Bibcode:2014RadR..181..208B. doi:10.1667/RR13395.1. OSTI 1286690. PMID 24527690. S2CID 7350371.
- ^ "Static Control for Electronic Balance Systems" (PDF). Archived from the original (PDF) on 10 November 2013. Retrieved 5 May 2009.
- ^ "BBC News : College breaches radioactive regulations". 12 March 2002. Retrieved 5 May 2009.
- ^ "Staticmaster Ionizing Brushes". AMSTAT Industries. Archived from the original on 26 September 2009. Retrieved 5 May 2009.
- ^ "General domestic licenses for byproduct material". Retrieved 5 May 2009.
- ^ "Radioactive spark plugs". Oak Ridge Associated Universities. 20 January 1999. Retrieved 7 October 2021.
- ^ Pittman, Cassandra (3 February 2017). "Polonium". The Instrumentation Center. University of Toledo. Retrieved 23 August 2018.
- ^ "Safety data for hydrogen cyanide". Physical & Theoretical Chemistry Lab, Oxford University. Archived from the original on 11 February 2002.
- ^ Bagnall, 202-6페이지
- ^ "Polonium-210: Effects, symptoms, and diagnosis". Medical News Today. 28 July 2017.
- ^ Momoshima, N.; Song, L. X.; Osaki, S.; Maeda, Y. (2001). "Formation and emission of volatile polonium compound by microbial activity and polonium methylation with methylcobalamin". Environ Sci Technol. 35 (15): 2956–2960. Bibcode:2001EnST...35.2956M. doi:10.1021/es001730. PMID 11478248.
- ^ Momoshima, N.; Song, L. X.; Osaki, S.; Maeda, Y. (2002). "Biologically induced Po emission from fresh water". J Environ Radioact. 63 (2): 187–197. doi:10.1016/S0265-931X(02)00028-0. PMID 12363270.
- ^ Li, Chunsheng; Sadi, Baki; Wyatt, Heather; Bugden, Michelle; et al. (2010). "Metabolism of 210Po in rats: volatile 210Po in excreta". Radiation Protection Dosimetry. 140 (2): 158–162. doi:10.1093/rpd/ncq047. PMID 20159915.
- ^ a b "Health Impacts from Acute Radiation Exposure" (PDF). Pacific Northwest National Laboratory. Retrieved 5 May 2009.
- ^ "Nuclide Safety Data Sheet: Polonium–210" (PDF). hpschapters.org. Retrieved 5 May 2009.
- ^ Naimark, D.H. (4 January 1949). "Effective half-life of polonium in the human". Technical Report MLM-272/XAB, Mound Lab., Miamisburg, OH. OSTI 7162390.
- ^ Carey Sublette (14 December 2006). "Polonium Poisoning". Retrieved 5 May 2009.
- ^ Harrison, J.; Leggett, Rich; Lloyd, David; Phipps, Alan; et al. (2007). "Polonium-210 as a poison". J. Radiol. Prot. 27 (1): 17–40. Bibcode:2007JRP....27...17H. doi:10.1088/0952-4746/27/1/001. PMID 17341802. S2CID 27764788.
The conclusion is reached that 0.1–0.3 GBq or more absorbed to blood of an adult male is likely to be fatal within 1 month. This corresponds to ingestion of 1–3 GBq or more, assuming 10% absorption to blood
- ^ Yasar Safkan. "Approximately how many atoms are in a grain of salt?". PhysLink.com: Physics & Astronomy.
- ^ Health Risks of Radon and Other Internally Deposited Alpha-Emitters: BEIR IV. National Academy Press. 1988. p. 5. ISBN 978-0-309-03789-1.
- ^ Health Effects of Exposure to Indoor Radon. Washington: National Academy Press. 1999. Archived from the original on 19 September 2006.
- ^ "The Straight Dope: Does smoking organically grown tobacco lower the chance of lung cancer?". 28 September 2007. Retrieved 11 October 2020.
- ^ "Nuclear Regulatory Commission limits for 210Po". U.S. NRC. 12 December 2008. Retrieved 12 January 2009.
- ^ "PilgrimWatch – Pilgrim Nuclear – Health Impact". Archived from the original on 5 January 2009. Retrieved 5 May 2009.
- ^ Zimmerman, Peter. "The smoky bomb threat - Opinion - International Herald Tribune". New York Times. Retrieved 1 January 2024.
- ^ Bastian, R.K.; Bachmaier, J.T.; Schmidt, D.W.; Salomon, S.N.; Jones, A.; Chiu, W.A.; Setlow, L.W.; Wolbarst, A.W.; Yu, C. (1 January 2004). "Radioactive Materials in Biosolids: National Survey, Dose Modeling & POTW Guidance". Proceedings of the Water Environment Federation. 2004 (1): 777–803. doi:10.2175/193864704784343063.
- ^ Zimmerman, Peter D. (19 December 2006). "The Smoky Bomb Threat". The New York Times. Retrieved 19 December 2006.
- ^ Bagnall, 페이지 204.
- ^ a b Moss, William; Eckhardt, Roger (1995). "The human plutonium injection experiments" (PDF). Los Alamos Science. 23: 177–233.
- ^ Fink, Robert (1950). Biological studies with polonium, radium, and plutonium. National Nuclear Energy Series (in Russian). Vol. VI-3. McGraw-Hill. ISBN 5-86656-114-X.
- ^ a b Gasteva, G. N. (2001). "Ostraja lučevaja boleznʹ ot postuplenija v organizm polonija" [Acute radiation sickness by ingestion of polonium into the body]. In Ilʹin, L. A. (ed.). Radiacionnaja medicina: rukovodstvo dlja vračej-issledovatelej i organizatorov zdravooxranenija, Tom 2 (Radiacionnye poraženija čeloveka) [Radiation medicine: a guide for medical researchers and healthcare managers, Volume 2 (Radiation damage to humans)] (in Russian). IzdAT. pp. 99–107. ISBN 5-86656-114-X.
- ^ Harrison, John; Leggett, Rich; Lloyd, David; Phipps, Alan; Scott, Bobby (2 March 2007). "Polonium-210 as a poison". Journal of Radiological Protection. 27 (1): 17–40. Bibcode:2007JRP....27...17H. doi:10.1088/0952-4746/27/1/001. PMID 17341802. S2CID 27764788.
- ^ Manier, Jeremy (4 December 2006). "Innocent chemical a killer". The Daily Telegraph (Australia). Archived from the original on 6 January 2009. Retrieved 5 May 2009.
- ^ Karpin, Michael (2006). The bomb in the basement: How Israel went nuclear and what that means for the world. Simon and Schuster. ISBN 978-0-7432-6594-2.
- ^ Maugh, Thomas; Karen Kaplan (1 January 2007). "A restless killer radiates intrigue". Los Angeles Times. Retrieved 17 September 2008.
- ^ Jere Millard, Bruce Gallaher, David Baggett, Steven Gary (September 1983). "The Church Rock uranium mill tailings spill a health and environmental assessment, page 32" (PDF). Retrieved 30 January 2024.
{{cite web}}: CS1 maint: 다중 이름: 작성자 목록(링크) - ^ Geoghegan, Tom (24 November 2006). "The mystery of Litvinenko's death". BBC News.
- ^ "UK requests Lugovoi extradition". BBC News. 28 May 2007. Retrieved 5 May 2009.
- ^ "Report". The Litvinenko Inquiry. Retrieved 21 January 2016.
- ^ Addley, Esther; Harding, Luke (21 January 2016). "Litvinenko 'probably murdered on personal orders of Putin'". The Guardian. Retrieved 21 January 2016.
- ^ Boggan, Steve (5 June 2007). "Who else was poisoned by polonium?". The Guardian. Retrieved 28 August 2021.
- ^ Poort, David (6 November 2013). "Polonium: a silent killer". Al Jazeera News. Retrieved 28 August 2021.
- ^ Froidevaux, Pascal; Bochud, François; Baechler, Sébastien; Castella, Vincent; Augsburger, Marc; Bailat, Claude; Michaud, Katarzyna; Straub, Marietta; Pecchia, Marco; Jenk, Theo M.; Uldin, Tanya; Mangin, Patrice (February 2016). "²¹⁰Po poisoning as possible cause of death: forensic investigations and toxicological analysis of the remains of Yasser Arafat". Forensic Science International. 259: 1–9. doi:10.1016/j.forsciint.2015.09.019. PMID 26707208. S2CID 207751390.
- ^ "الأخبار – ضابط فلسطيني: خصوم عرفات قتلوه عربي". Al Jazeera. 17 January 2011. Archived from the original on 4 July 2012. Retrieved 5 June 2021.
- ^ "George Galloway and Alex Goldfarb on Litvinenko inquiry". Newsnight. 21 January 2016. Event occurs at 1:53. BBC. Archived from the original on 30 October 2021. Retrieved 28 March 2018.
- ^ Froidevaux, P.; Baechler, S. B.; Bailat, C. J.; Castella, V.; Augsburger, M.; Michaud, K.; Mangin, P.; Bochud, F. O. O. (2013). "Improving forensic investigation for polonium poisoning". The Lancet. 382 (9900): 1308. doi:10.1016/S0140-6736(13)61834-6. PMID 24120205. S2CID 32134286.
- ^ a b 바트, 카타리나 (2012-07-03). 스위스 연구소는 Wayback Machine에서 Archived 2015-10-07의 Arafat의 효과에서 폴로늄을 발견합니다. 로이터.
- ^ a b Paul Taylor (7 November 2013). "Palestinian leader Yasser Arafat was murdered with polonium: widow". NBC News. Reuters.
- ^ a b Poort, David; Silverstein, Ken (6 November 2013). "Swiss study: Polonium found in Arafat's bones". www.aljazeera.com. Retrieved 12 February 2023.
- ^ "Swiss Team: Arafat Poisoned to Death With Polonium". Haaretz. 6 November 2013. Retrieved 12 February 2023.
- ^ (프랑스어로) Luis Lema, "Yasser Arafat, la valse des 동위원소", Le Temps, 2014년 5월 24일 토요일, p. 3.
- ^ 이사첸코프, 바딤 (2013-12-27) 러시아: 아라파트의 죽음은 방사선에 의한 것이 아닙니다. 연합통신사.
- ^ "Arafat did not die of poisoning, French tests conclude". Reuters. 3 December 2013. Retrieved 1 September 2021.
- ^ "The Putin bodyguard riddle". The Sunday Times. 3 December 2006.
- ^ "Guidance for Industry. Internal Radioactive Contamination — Development of Decorporation Agents" (PDF). US Food and Drug Administration. Retrieved 7 July 2009.
- ^ Rencováa J.; Svoboda V.; Holuša R.; Volf V.; et al. (1997). "Reduction of subacute lethal radiotoxicity of polonium-210 in rats by chelating agents". International Journal of Radiation Biology. 72 (3): 341–8. doi:10.1080/095530097143338. PMID 9298114.
- ^ Baselt, R. 독성 약물 및 화학 물질의 사람 내 처분 2013-06-16 Achared at Wayback Machine, 10th Edition, Biomedical Publications, Seal Beach, CA.
- ^ Hill, C. R. (1960). "Lead-210 and Polonium-210 in Grass". Nature. 187 (4733): 211–212. Bibcode:1960Natur.187..211H. doi:10.1038/187211a0. PMID 13852349. S2CID 4261294.
- ^ Hill, C. R. (1963). "Natural occurrence of unsupported radium-F (Po-210) in tissue". Health Physics. 9: 952–953. PMID 14061910.
- ^ Heyraud, M.; Cherry, R. D. (1979). "Polonium-210 and lead-210 in marine food chains". Marine Biology. 52 (3): 227–236. doi:10.1007/BF00398136. S2CID 58921750.
- ^ Lacassagne, A. & Lates, J. (1924) Bulletin d'Histologie Applicée à la Physiologie et à la Pathologie, 1, 279.
- ^ Vasken Aposhian, H.; Bruce, D. C. (1991). "Binding of Polonium-210 to Liver Metallothionein". Radiation Research. 126 (3): 379–382. Bibcode:1991RadR..126..379A. doi:10.2307/3577929. JSTOR 3577929. PMID 2034794.
- ^ Hill, C. R. (1965). "Polonium-210 in man". Nature. 208 (5009): 423–8. Bibcode:1965Natur.208..423H. doi:10.1038/208423a0. PMID 5867584. S2CID 4215661.
- ^ Hill, C. R. (1966). "Polonium-210 Content of Human Tissues in Relation to Dietary Habit". Science. 152 (3726): 1261–2. Bibcode:1966Sci...152.1261H. doi:10.1126/science.152.3726.1261. PMID 5949242. S2CID 33510717.
- ^ Martell, E. A. (1974). "Radioactivity of tobacco trichomes and insoluble cigarette smoke particles". Nature. 249 (5454): 214–217. Bibcode:1974Natur.249..215M. doi:10.1038/249215a0. PMID 4833238. S2CID 4281866.
- ^ Martell, E. A. (1975). "Tobacco Radioactivity and Cancer in Smokers: Alpha interactions with chromosomes of cells surrounding insoluble radioactive smoke particles may cause cancer and contribute to early atherosclerosis development in cigarette smokers". American Scientist. 63 (4): 404–412. Bibcode:1975AmSci..63..404M. JSTOR 27845575. PMID 1137236.
- ^ Tidd, M. J. (2008). "The big idea: polonium, radon and cigarettes". Journal of the Royal Society of Medicine. 101 (3): 156–7. doi:10.1258/jrsm.2007.070021. PMC 2270238. PMID 18344474.
- ^ 번바우어, 윌리엄 (2008-09-07) "방사선 위험을 은폐한 큰 담배" 더 에이지, 호주 멜버른
- ^ Radford EP Jr; Hunt VR (1964). "Polonium 210: a volatile radioelement in cigarettes". Science. 143 (3603): 247–9. Bibcode:1964Sci...143..247R. doi:10.1126/science.143.3603.247. PMID 14078362. S2CID 23455633.
- ^ Kelley TF (1965). "Polonium 210 content of mainstream cigarette smoke". Science. 149 (3683): 537–538. Bibcode:1965Sci...149..537K. doi:10.1126/science.149.3683.537. PMID 14325152. S2CID 22567612.
- ^ Ota, Tomoko; Sanada, Tetsuya; Kashiwara, Yoko; Morimoto, Takao; et al. (2009). "Evaluation for Committed Effective Dose Due to Dietary Foods by the Intake for Japanese Adults". Japanese Journal of Health Physics. 44: 80–88. doi:10.5453/jhps.44.80.
- ^ Smith-Briggs, JL; Bradley, EJ (1984). "Measurement of natural radionuclides in U.K. diet". Science of the Total Environment. 35 (3): 431–40. Bibcode:1984ScTEn..35..431S. doi:10.1016/0048-9697(84)90015-9. PMID 6729447.
서지학
- Bagnall, K. W. (1962). "The Chemistry of Polonium". Advances in Inorganic Chemistry and Radiochemistry. Vol. 4. New York: Academic Press. pp. 197–226. doi:10.1016/S0065-2792(08)60268-X. ISBN 978-0-12-023604-6. Retrieved 14 June 2012.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. ISBN 978-0080379418.