피크로톡신
Picrotoxin
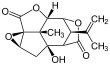
피크로톡신(왼쪽) 및 피크로틴(오른쪽) | |||
| 임상자료 | |||
|---|---|---|---|
| ATC 코드 |
| ||
| 식별자 | |||
| CAS 번호 | |||
| 펍켐 CID | |||
| IUPHAR/BPS | |||
| 드러그뱅크 | |||
| 켐스파이더 | |||
| 유니 | |||
| 케그 | |||
| 체비 | |||
| 켐벨 | |||
| CompTox 대시보드 (EPA) | |||
| ECHA InfoCard | 100.004.288 | ||
| 화학 및 물리적 데이터 | |||
| 3D 모델(JSmol) | |||
| |||
| |||
| | |||
피크로톡신(Picrotoxin, cocculin)은 독성이 있는 결정 식물 화합물이다. 1812년 프랑스의 약사 겸 화학자 피에르 프랑수아 기욤 불레이(1777–1869)에 의해 처음 격리되었다.[1] 피크로톡신(picrotoxin)이라는 이름은 그리스어 '피크로스'(bitter)와 '독소'(poison)의 합성어다.[2] 피크로톡신은 화학적으로 합성될 수도 있지만 두 가지 다른 화합물의 혼합물인 피크로톡신은 아나미르타 고치큘루스 식물의 열매에서 자연적으로 발생한다.
피크로톡신은 억제 신경전달물질인 GABA와의 상호작용 때문에 흥분제 및 경련제로 작용한다. 주로 중추신경계에 영향을 미쳐 충분한 양으로 발작과 호흡마비를 일으킨다.
화학구조 및 합성
피크로톡신은 피크로톡신(CHO15166; CAS# 17617-45-7)과 피크로틴(CHO15187; CAS# 21416-53)의 두 화합물을 등극으로 혼합한 것이다.[3] 두 화합물 중 피크로틴의 활성도가 떨어진다.[4]
피크로톡신은 인도와 동남아시아의 다른 지역에서 온 등반 식물인 아나미르타 고치쿠스 열매에서 자연적으로 발생한다. 이 식물은 흰 나무의 큰 줄기와 달콤한 향기가 나는 꽃으로 유명하다. 그것은 일반적으로 건조되는 작은 돌 과일인 코쿨루스 인디쿠스를 생산한다.[citation needed]
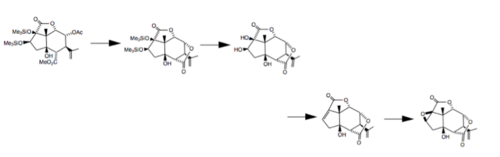
현재, 피크로톡신 합성은 5개 정도 되는데, 그 중 하나는 스크립스 소재 선비 연구소에 의해 2020년 6월에 최근에 출판되었다.[5] 이 분자와 마찬가지로, 이 합성에는 입체 화학적 템플릿으로 카르보네를 사용하는 것이 포함되었다. 이 전략은 다순환 코어의 빠른 형성을 채택했고, 목표 분자를 생산하기 위해 주요 탄소 원자의 산화 상태를 조작했다. 일부 연구에서는 사이클로알케닐 계통의 사이클로오작동화에 의해 만들어질 수 있다고 제안하고 있다. 동역학적으로 제어되는 조건에서, 이 과정은 일반적으로 엑소 사이클화를 초래하고 피크로톡신에서 발견되는 것과 같은 브리지 링 시스템을 형성한다.[6] 또한 피크로톡신을 구성하는 두 분자인 피크로틴과 피크로틴을 위한 여러 합성이 제안되었다. 1980년, 피크로틴을 피크로틴으로 변환하는 과정이 발견되었다. 이 합성은 피리딘에 있는 삼불화수소 무수화물 피크로톡신을 처리하여 성분을 분리하는 것으로 시작한다.[7]
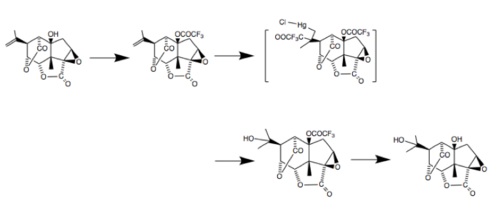
1988년 일본 도호쿠 대학 연구진이 (----picrotoxin)과 (-----picrotin)의 총 입체 합성(+-5β-hydroxycarvone)을 완성했다. 이 합성에서는, 8개의 비대칭 중심들이 여러 가지 다른 반응을 이용하여 시스 퓨즈 하이드린탄 링 시스템에 입체적으로 준비되었다: 2차 중심부를 도입하기 위한 클라젠 재배열, 에폭시 케톤을 이용한 오르가노셀렌늄 매개 감소, 글리시드 에스테르의 입체적 구조.[8] 이 과정의 마지막 단계는 아래와 같다.[9]
피크로톡신은 피크로톡신 골격의 특정 특징을 간직하고 있는 dl-피크로톡사디엔(dl-picrotoxadiene)의 생성 등 여러 합성 공정에서 출발 재료로도 사용되어 왔다.[10]
작용기전
어떤 갑각류 근육 섬유는 흥분성 및 억제성 내경을 가지고 있다. 피크로톡신 블록 억제. [11] 피크로톡신이 시냅스에 작용하는 메커니즘에 대해서는 서로 다르지만 관련된 두 가지 이론이 제안되었다. 한 가지 이론은 GABAA 수용체 염화물 채널,[12] 특히 감마-아미노부티르산 활성 염화물 이오노포레에 대해 비경쟁적 채널 차단제 역할을 한다는 것이다.[13] 2006년의 한 연구는 구조적으로 GABA와 비슷하지는 않지만, 피크로톡신은 GABA에 의해 활성화된 염화 채널을 통해 이온 흐름을 막는다는 것을 발견했다. 그것은 GABA 인식 사이트에서가 아니라 이온 채널 자체 내에서 작용하는 것 같다. GABA가 활성화한 채널을 억제하기 때문에 바비투라테스, 벤조디아제핀 등 GABA 강화 약물을 해독제로 사용할 수 있다.[14]
다른 연구에서는 독소가 GABA 수용체에 비경쟁적 대항제, 즉 억제제 역할을 대신한다는 것을 제시하고 있다. 뉴랜드와 컬-캔디의 연구는 충분한 농도에서 피크로톡신이 GABA 전류의 진폭을 줄인다는 것을 발견했다. 그들의 데이터는 피크로톡신이 단순히 전압 게이트 채널 차단기 역할을 할 가능성은 낮지만, 채널 개방의 빈도는 줄였다. 오히려 피크로톡신(binds)이 "작용제 결합형 수용체 형태에 우선한다"는 사실을 발견했다. 이는 피크로톡신 농도가 낮은 상황에서도 GABA에 대한 뉴런의 반응이 줄어든다는 것을 의미한다.[15]
독성
피크로톡신은 중추신경계와 호흡기 자극제 역할을 한다. 설치류와 다른 포유류뿐만 아니라 물고기와 인간에게도 매우 독성이 있다. 화학 물질의 독성 영향 등록부에 따르면, LDLo 즉, 가장 낮은 치사량이 0.357mg/kg이다. 피크로톡신 중독의 증상은 기침, 호흡곤란, 두통, 어지럼증, 혼란, 위장병, 메스꺼움 또는 구토, 심박수와 혈압의 변화 등이다. 삼킬 경우 특히 위험하지만, 전신 효과는 흡입이나 피부 내 병변을 통해 혈류로 흡수되는 결과로도 나타날 수 있다.[16] 피크로톡신은 경련제 역할도 한다. 더 큰 용량에서, 특히 높은 용량은 호흡기 마비로 인해 궁극적으로 치명적인 것으로 판명되는 등, 클로닉 발작이나 심장 부정맥을 유발하는 것으로 밝혀졌다.[17]
임상 애플리케이션 및 기타 용도
그것의 독성 때문에, 피크로톡신은 현재 연구 도구로 가장 흔하게 사용된다. 그러나 GABA 수용체에 대한 길항제 효과 때문에 중추신경계 자극제로 사용되어 왔다. 이전에 CNS 억제제, 특히 바비투라이트에 의한 중독에 대한 해독제로도 사용되었다.[18]
피크로톡신은 일반적으로 쓰이지 않지만, 농약과 페디큘라제로서 모두 효과적이다. 19세기에는 하드멀럼을 준비하는 데 사용되었는데, 이것은 맥주에 첨가되어 더욱 취하게 만들었다. 이 준비는 그 이후로 불법화되었다.[citation needed]
충분한 양으로 포유류에 대한 잠재적인 독성에도 불구하고, 피크로톡신은 말에서 수행 촉진제로 쓰이기도 한다. 미국 쿼터호스협회에 의해 불법적인 "클래스 I 물질"로 분류된다. '등급 I'로 분류되는 물질은 성능에 영향을 미칠 가능성이 높고, 등신약에 치료적 사용이 없다.[19] 2010년, 쿼터 말 조련사 로버트 디미트는 그의 말인 스톨리 시그니처가 이 물질에 양성반응을 보인 후 중단되었다. 인간과 마찬가지로, 그것은 바비투라테 중독에 대항하기 위해 사용된다.[20]
참고 항목
참조
- ^ Boullay PF (1812). "Analyse chimique de la Coque du Levant, Menispermum cocculus". Bulletin de Pharmacie (in French). 4: 5–34.
Menispermum cocculus" has been renamed "Anamirta cocculus"
- ^ (볼레이, 1812), 페이지 31.
- ^ Law V, Knox C, Djoumbou Y, Jewison T, Guo AC, Liu Y, et al. "Picrotoxin". DrugBank. DrugBank. Retrieved April 26, 2017.
- ^ Gammill R, Tulinsky J (1994). "The Chemistry and Pharmacology of GABAA and GABAB Ligands". Current Medicinal Chemistry. 1 (3): 242. Retrieved April 26, 2017.
- ^ Crossley SW, Tong G, Lambrecht MJ, Burdge HE, Shenvi RA (July 2020). "Synthesis of (-)-Picrotoxinin by Late-Stage Strong Bond Activation". Journal of the American Chemical Society. 142 (26): 11376–11381. doi:10.1021/jacs.0c05042. PMC 8011636. PMID 32573211.
- ^ Trost B, Fleming I (1991). Comprehensive Organic Synthesis (Volume 4 ed.). Oxford, UK: Pergamon Press. p. 373. ISBN 9780080405957. Retrieved May 7, 2017.
- ^ Corey E, Pearce H (1980). "Total Synthesis of Picrotin". Tetrahedron Letters. 21 (19): 1823–1824. doi:10.1016/s0040-4039(00)92789-8.
- ^ Miyashita M, Suzuki T, Yoshikoshi A (May 1989). "Stereoselective total synthesis of (-)-picrotoxinin and (-)-picrotin". Journal of the American Chemical Society. 111 (10): 3728–3734. doi:10.1021/ja00192a035.
- ^ Trost B, Krische M (1996). "Picrotoxinin". Journal of the American Chemical Society. 118: 233. doi:10.1021/ja953060r. Retrieved May 7, 2017.
- ^ Conroy H (June 1952). "Picrotoxin. II. The Skeleton of Picrotoxinin. The Total Synthesis of dl-Picrotoxadiene". Journal of the American Chemical Society. 74 (12): 3046–3051. doi:10.1021/ja01132a028.
- ^ W. G. Van der Kloot; J. Robbins; I. Cooke (1958). "Blocking by picrotoxin of peripheral inhibition in crayfish". Science. 127: 52l–522.
- ^ Rho JM, Donevan SD, Rogawski MA (December 1996). "Direct activation of GABAA receptors by barbiturates in cultured rat hippocampal neurons". The Journal of Physiology. 497 ( Pt 2) (2): 509–22. doi:10.1113/jphysiol.1996.sp021784. PMC 1161000. PMID 8961191.
- ^ Law V, Knox C, Djoumbou Y, Jewison T, Guo AC, Liu Y, et al. "Picrotoxin". DrugBank. DrugBank. Retrieved April 26, 2017.
- ^ Olsen RW (April 2006). "Picrotoxin-like channel blockers of GABAA receptors". Proceedings of the National Academy of Sciences of the United States of America. 103 (16): 6081–2. Bibcode:2006PNAS..103.6081O. doi:10.1073/pnas.0601121103. PMC 1458832. PMID 16606858.
- ^ Newland CF, Cull-Candy SG (February 1992). "On the mechanism of action of picrotoxin on GABA receptor channels in dissociated sympathetic neurones of the rat". The Journal of Physiology. 447: 191–213. doi:10.1113/jphysiol.1992.sp018998. PMC 1176032. PMID 1317428.
- ^ "Picrotoxin" (PDF). Santa Cruz Biotechnology. Retrieved April 26, 2017.
- ^ "Picrotoxin". Toxnet. U.S. National Laboratory of Medicine. Retrieved April 26, 2017.
- ^ Nilsson E, Eyrich B (2009). "On treatment of barbiturate poisoning". Acta Medica Scandinavica. 137 (6): 381–9. doi:10.1111/j.0954-6820.1950.tb12129.x. PMID 15432128.
- ^ "Uniform Classification Guidelines for Foreign Substances and Recommended Penalties and Model Rule" (PDF). Association of Racing Commissioners International, Inc. Retrieved April 26, 2017.
- ^ Lemoreaux P (September 2, 2017). "Two Quarter Horse trainers suspended for drug violations at Prairie Meadows". Daily Racing Form. Daily Racing Form. Retrieved April 26, 2017.
추가 읽기
- Ehrenberger K, Benkoe E, Felix D (1982). "Suppressive action of picrotoxin, a GABA antagonist, on labyrinthine spontaneous nystagmus and vertigo in man". Acta Oto-Laryngologica. 93 (1–6): 269–73. doi:10.3109/00016488209130882. PMID 7064710.
- Dupont L, Dideberg O, Lamotte-Brasseur J, Angenot L (1976). "Structure cristalline et moléculaire de la picrotoxine, C15H16O6·C15H18O7". Acta Crystallographica B (in French). 32 (11): 2987–2993. doi:10.1107/S0567740876009424.
- Olsen RW, DeLorey TM (1999). "GABA Receptor Physiology and Pharmacology". In Siegel GJ, Agranoff BW, Albers RW, et al. (eds.). Basic Neurochemistry: Molecular, Cellular and Medical Aspects (6th ed.). Philadelphia, PA, USA: Lippincott-Raven.