콜레라 독소
Cholera toxin콜레라 독소(콜레라겐이라고도 하며 때로는 CTX, Ctx 또는 CT라고도 함)는 비브리오 콜레라에 [1][2]의해 분비되는 AB5 복합체이다.CTX는 콜레라 [3]감염의 특징인 크고 묽은 설사의 원인이다.그것은 열가연성 장독소 계열의 일원이다.
역사
콜레라 독소는 1959년 인도 미생물학자 Sambhu Nath [4]De에 의해 발견되었다.
구조.
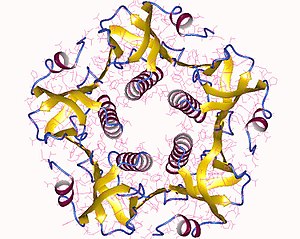
완전한 독소는 A 서브유닛(파트 A, 효소, P01555)의 단일 복사본과 AB로 표시된5 B 서브유닛(파트 B, 수용체 결합, P01556)의 5개 복사본으로 구성된 헥사머이다.서브유닛 B는 결합하고 서브유닛 A는 아데닐산환가수분해효소를 활성화하는 G단백질을 활성화한다.독소의 3차원 구조는 1995년 [5]장 외 연구진에 의해 X선 결정학을 사용하여 측정되었다.
5개의 B 서브유닛(각각의 무게 11kDa)은 5원환을 형성합니다.28kDa인 A 서브유닛에는 두 개의 중요한 세그먼트가 있다.사슬의 A1 부분(CTA1)은 ADP-리보실화 G단백질인 구상 효소 페이로드이며, A2 사슬(CTA2)은 B 서브유닛 [6]고리의 중앙 기공에 포근하게 위치한 확장된 알파 나선을 형성한다.
이 구조는 대장균의 일부 변종에서 분비되는 열가연성 장독소와 모양, 메커니즘 및 배열이 유사합니다.
병인 발생
콜레라 독소는 다음과 같은 메커니즘으로 작용합니다.우선 콜레라 독소의 B 서브유닛 고리는 표적세포 표면의 GM1 간글리오시드에 결합한다.만약 어떤 세포에 GM1이 없다면, 독소는 [7][8][9]지질 대신 단백질에 부착된 루이스 Y와 루이스 X와 같은 다른 종류의 글리칸과 결합할 가능성이 높다.일단 결합되면 독소 복합체 전체가 세포에 의해 엔도사이팅되고 디술피드 브릿지의 환원에 의해 콜레라 독소 A1(CTA1) 사슬이 방출된다.엔도솜은 골지 기기로 이동되며, 골지 기구는 A1 단백질이 엔도플러스망 샤페론, 이황화 단백질 이성질화효소에 의해 인식된다.그런 다음 A1 사슬이 펼쳐져 막으로 전달되고, Ero1은 단백질 이황화물 이성질화효소 [10]복합체의 산화에 의해 A1 단백질의 방출을 유발한다.A1단백질은 ER에서 Sec61채널에 의해 세포질 내로 이동함에 따라 리폴드되어 유비퀴티화에 의한 불활성화를 회피한다.
그런 다음 CTA1은 ADP-리보실화 인자 6(Arf6)이라고 불리는 인간 파트너 단백질과 자유롭게 결합할 수 있으며, Arf6에 결합하면 활성 부위를 노출시키고 촉매 활성을 [11]가능하게 하는 CTA1의 형상 변화를 촉진합니다.CTA1 단편은 NAD를 사용하여 Gs 알파 서브유닛(Gαs) 단백질의 ADP-리보실화를 촉매한다.ADP-리보실화는 Gαs 서브유닛의 GTP 가수분해 촉매 활성을 GDP + P로i 상실시켜 Gα를s 활성 상태로 유지한다.Gαs 활성화 증가는 아데닐산 시클라아제 활성을 증가시켜 세포 내 3', 5'-사이클릭 AMP(cAMP) 농도를 정상보다 100배 이상으로 증가시키고 세포내 PKA를 과다 활성화시킨다.이러한 활성 PKA는 낭포성 섬유화 막전도조절기(CFTR) 염화물 채널 단백질을 인산화하여 ATP 매개 염화물 이온의 유출을 유도하고 HO, Na+, K+ 및 HCO를23− 장내강으로 분비시킨다.또한 Na의+ 유입과 장구로의 물의 유입을 감소시킨다.복합적인 효과는 장에서 시간당 2리터까지 빠른 유체 손실을 초래하고, 심각한 탈수증과 쌀뜨물 [12]변을 포함한 콜레라와 관련된 다른 요인들을 야기합니다.
Bordetella pertussis에 의해 생성된 백일해독소(AB단백질5)는 Gαi 서브유닛을 ADP-리보실화시켜 cAMP [13]생성을 억제할 수 없게 한다는 점을 제외하고는 유사한 방식으로 작용한다.
기원.
콜레라 독소를 코드하는 유전자는 수평 유전자 이식에 의해 담즙에 도입된다.독성이 강한 콜레라 균주는 CTXφ 박테리오파지로 [14]알려진 바이러스를 보유하고 있다.
적용들
B 서브유닛은 상대적으로 독성이 없는 것으로 보이기 때문에 연구자들은 세포와 분자생물학에서 B 서브유닛의 많은 응용을 찾아냈다.그것은 신경 추적기로 [15]일상적으로 사용된다.
배양된 설치류 신경줄기세포를 콜레라 독소에 의한 처리로 전사인자 Hes3의 국부적 변화를 유도하여 그 [16]수를 증가시킨다.
GM1 간글리오시드는 세포 표면의 지질 뗏목에서 발견됩니다.형광 태그로 표시되거나 이후 항체로 표적이 된 B 서브유닛 복합체를 사용하여 뗏목을 식별할 수 있다.
백신
현재 콜레라 백신은 두 가지가 있습니다.두코랄, 산솔.두 백신 모두 전멸된 콜레라 세포를 사용하지만, 듀코랄은 또한 재조합 콜레라 독소 β(rCTB)를 함유하고 있다.일부 연구에 따르면 rCTB를 포함하면 소아(2-10)의 백신 효과가 개선되고 보호 기간이 늘어날 수 있다.여기에는 [17]성능 저하로부터 rCTB를 보호하고 저장하는 비용이 포함됩니다.
백신 보조제
CTB 서브유닛의 또 다른 적용은 다른 백신에 대한 백신 보조제로서도 가능하다.CTB와 항원을 결합하면 백신 반응이 개선되는 것으로 나타났다.현재 CTB의 보조적 잠재력은 대형 동물 모델에서 보여졌기 때문에 더 많은 연구가 필요하다.이것은 CTB가 많은 종류의 질병에 대한 백신 접종을 위한 보조제로 사용될 수 있도록 할 것이다.여기에는 세균 및 바이러스 감염, 알레르기 및 당뇨병이 포함될 수 있습니다.주목할 점은 CTB가 점막 체액 면역 반응을 유도하는 것으로 나타났기 때문에 HIV와 같은 점막 바이러스에 대한 백신이 잠재적인 [17]표적이 된다는 것이다.
막생물학
지질 뗏목
콜레라 독소는 GM1 간글리오시드에 우선적으로 결합하는 것으로 나타났기 때문에 이 특성은 막 연구에 활용될 수 있다.지질 뗏목은 크기와 수명이 다양할 뿐만 아니라 세포의 매우 역동적인 구성요소의 일부이기 때문에 연구하기가 어렵다.콜레라 독소β를 지표로 하여 지질 [18]뗏목의 성질과 기능을 보다 잘 이해할 수 있습니다.
엔도사이토시스
엔도사이토시스는 크게 클라트린 의존성과 클라트린 비의존성으로 나뉘는데, 콜레라 독소는 두 경로를 모두 이용한다.콜레라 독소는 여러 경로로 내구성세포증을 통해 세포로 들어가는 것으로 나타났다.이러한 경로에는 caveolae, clathrin 코팅된 피트, Clarathrin-Independent Carriers(CLICs) 및 GPI-Enched Endocytic Compartments(GEECs) 경로, Arf6 매개 엔도피린 매개 엔도사이토시스(FEME) 경로가 포함된다.콜레라 독소가 어떻게 이러한 내구성 경로를 유발하는지 완전히 이해되지는 않지만 콜레라 독소가 이러한 경로를 유발한다는 사실은 이러한 메커니즘을 [18]조사하기 위한 중요한 지표로서 독소를 사용할 수 있게 한다.
역행 트래픽
콜레라 독소의 가장 중요한 측면 중 하나는 역행 교통 메커니즘으로 세포막에서 다시 골기 통과 네트워크와 소포체로 독소를 운반하는 것입니다.콜레라 독소와 GM1종 모두 형광 태그를 부착할 수 있기 때문에 역행 트래픽의 메커니즘을 감시할 수 있다.이것에 의해, 메카니즘을 리얼타임으로 감시할 수 있는 가능성이 열립니다.이것은 세포 내 수송이 어떻게 작동하는지 그리고 단백질과 지질 분류가 세포 내 이동 [18]경로에서 어떻게 작용하는지에 대한 새로운 발견을 열 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Ryan KJ; Ray CG, eds. (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. p. 375. ISBN 978-0-8385-8529-0.
- ^ Faruque SM; Nair GB, eds. (2008). Vibrio cholerae: Genomics and Molecular Biology. Caister Academic Press. ISBN 978-1-904455-33-2.
- ^ Aizpurua-Olaizola, Oier; Sastre Torano, Javier; Pukin, Aliaksei; Fu, Ou; Boons, Geert Jan; de Jong, Gerhardus J.; Pieters, Roland J. (2018). "Affinity capillary electrophoresis for the assessment of binding affinity of carbohydrate-based cholera toxin inhibitors". Electrophoresis. 39 (2): 344–347. doi:10.1002/elps.201700207. ISSN 1522-2683. PMID 28905402. S2CID 33657660.
- ^ De, S. N., Sarkar, J. K., Tribedi, B. P. 콜레라 독소의 작용에 대한 실험적 연구.J. Pathol.박테리올63: 707–717, 1951.
- ^ Zhang R, Scott D, Westbrook M, Nance S, Spangler B, Shipley G, Westbrook E (1995). "The three-dimensional crystal structure of cholera toxin". J Mol Biol. 251 (4): 563–73. doi:10.1006/jmbi.1995.0456. PMID 7658473.
- ^ De Haan L, Hirst TR (2004). "Cholera toxin: a paradigm for multi-functional engagement of cellular mechanisms (Review)". Mol. Membr. Biol. 21 (2): 77–92. doi:10.1080/09687680410001663267. PMID 15204437. S2CID 22270979.
- ^ Amberlyn M Wands; Akiko Fujita (October 2015). "Fucosylation and protein glycosylation create functional receptors for cholera toxin". eLife. doi:10.7554/eLife.09545.
- ^ Cervin J, Wands AM, Casselbrant A, Wu H, Krishnamurthy S, Cvjetkovic A, et al. (2018) GM1 간글리오시드 비의존성 콜레라 독소에 의한 중독.PLoS 패스 로그 14 (2): e1006862.https://doi.org/10.1371/journal.ppat.1006862
- ^ 푸코실화 분자는 숙주 세포에 결합하는 콜레라 독소를 경쟁적으로 방해한다; Amberlyn M.완즈, 제이콥 서빈, 허황, 예장, 윤규상, 차드 A.브루티감, 마리아 맷슨 제보, 페르 비외르클룬드, 빌 왈레니우스, 다니엘 K.똑똑해, 클레이 S.Bennett, Pernilla Wittung-Stafshede, Nicole S. Sampson, Ulf Yrlid 및 Jennifer J. Kohler; ACS 전염병 기사: 10.1021/acsinfec.7b00085
- ^ 차이, 빌리, 그리고 톰 에이.랩포트접히지 않은 콜레라 독소는 Ero1에 의해 산화되면 ER막으로 옮겨져 단백질 이황화물 이성질화효소로부터 방출된다.세포생물학 저널 159.2 (2002) : 207-216.
- ^ O'Neal C, Jobling M, Holmes R, Hol W (2005). "Structural basis for the activation of cholera toxin by human ARF6-GTP". Science. 309 (5737): 1093–6. Bibcode:2005Sci...309.1093O. doi:10.1126/science.1113398. PMID 16099990. S2CID 8669389.
- ^ Joaquín Sánchez; Jan Holmgren (February 2011). "Cholera toxin – A foe & a friend" (PDF). Indian Journal of Medical Research. Vol. 133. p. 158. Archived from the original (PDF) on 2013-02-03. Retrieved 2013-06-09.
- ^ Boron, W. F., & Boulpaep, E. L. (2009)의료생리학: 세포 및 분자적 접근법(2차 개정).필라델피아, 펜실베이니아: 손더스/엘세비어.
- ^ Davis B, Waldor M (2003). "Filamentous phages linked to virulence of Vibrio cholerae". Curr Opin Microbiol. 6 (1): 35–42. doi:10.1016/S1369-5274(02)00005-X. PMID 12615217.
- ^ Pierre-Hervé Luppi. "The Discovery of Cholera-Toxin as a Powerful Neuroanatomical Tool". Retrieved 2011-03-23.
- ^ Androutsellis-Theotokis A, Walbridge S, Park DM, Lonser RR, McKay RD (2010). "Cholera toxin regulates a signaling pathway critical for the expansion of neural stem cell cultures from the fetal and adult rodent brains". PLOS ONE. 5 (5): e10841. Bibcode:2010PLoSO...510841A. doi:10.1371/journal.pone.0010841. PMC 2877108. PMID 20520777.
- ^ a b Baldauf KJ, Royal JM, Hamorsky KT, Matoba N.콜레라 독소 B: 여러 가지 의약 용도를 가진 하나의 서브 유닛.독소(베이스).2015년 3월 20일;7일 (3):974-96.doi:10.3390/toxins7030974.PMID: 25802972, PMCID: PMC4379537.
- ^ a b c Kenworthy AK, Schmieder SS, Raghunathan K, Tiwari A, Wang T, Kelly CV, Lenser WI.막생물학의 탐침으로서의 콜레라 독소.독소(베이스).2021년 8월 3일; 13일 (8): 543.doi: 10.3390/toxins13080543.PMID: 34437414, PMCID: PMC8402489.
1. De SN. Vibrio cholerae의 무균 배양 여과물의 장독성.자연.1959;183:1533–4.
외부 링크
- McDowall, Jennifer (Sep 2005). "Cholera toxin". Protein of the Month (POTM). Protein Data Bank in Europe (PDBe). Archived from the original on April 27, 2019.
- Goodsell, David (Sep 2005). "Cholera Toxin". RCSB Protein Data Bank. Molecule of the Month (MOTM). Protein Data Bank (PDB). doi:10.2210/rcsb_pdb/mom_2005_9. Archived from the original on October 25, 2011.
- 미국 국립 의학 도서관의 콜레라+독신 의학 주제 제목(MeSH)
- PDB for UniProt: P01555(콜레라 엔테로톡신 서브유닛 A)에서 PDBe-KB에서 구할 수 있는 모든 구조 정보의 개요.
- PDB for UniProt: P01556(콜레라 엔테로톡신 서브유닛 B)에서 PDBe-KB에서 사용 가능한 모든 구조 정보의 개요.