디포스겐
Diphosgene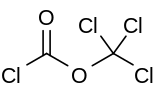 | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 트리클로로메틸카본오클로로이드산염 | |
| 기타 이름 트리클로로메틸클로로포름산염 | |
| 식별자 | |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.007.242 |
| EC 번호 |
|
펍켐 CID | |
| RTECS 번호 |
|
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| CCLO242 | |
| 어금질량 | 197.82 g/190 |
| 외관 | 상온의 액체. |
| 밀도 | 1.65 g/cm3 |
| 녹는점 | -57°C(-71°F, 216K) |
| 비등점 | 128°C(262°F, 401K) |
| 불용성인 | |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 독성의 |
| GHS 라벨 표시: | |
  | |
| 위험 | |
| H300, H314, H330 | |
| P260, P264, P270, P271, P280, P284, P301+P310, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P320, P321, P330, P363, P403+P233, P405, P501 | |
| 플래시 포인트 | 32°C(90°F, 305K) |
| 관련 화합물 | |
관련 화합물 | COCl2, Cl2 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
Diphosgene은 ClCocCl이라는 공식을 가진 화학 화합물이다.23 이 무색의 액체는 유기 화합물의 합성에 있어서 귀중한 시약이다. 디포스젠은 포스겐과 관련돼 있고 독성이 비교가 되지만 액체여서 더 편리하게 취급하는 반면 포스겐은 기체다.
생산 및 사용
Diphosgene은 UV 조명 하에서 클로로포름산 메틸의 급진적인 염소화에 의해 준비된다.[1]
- Cl-CO-OCH3 + 3 Cl2 - (hv)→ Cl-CO-OCCl + 3 HCl
또 다른 방법은 메틸 포메이트의 급진적인 염소 처리다.[2]
- H-CO-OCH3 + 4 Cl2 —(hv)→ Cl-CO-OCCl3 + 4 HCl
Diphosgene은 가열 시 또는 숯으로 촉매에 의해 포스겐으로 전환된다. 전통적으로 포스겐에 의존하는 반응에 유용하다. 예를 들어 아민은 이소시아네이트로, 2차 아민은 카르바모일염화물로, 카복실산은 산성염화물로, 포마미드는 이소시아네이드로 변환한다. 디프호스겐은 포스겐의 두 가지 등가물의 출처 역할을 한다.
- 2 RNH2 + CLCl → 2 RNCO + 4 HCl
α-아미노산 디포스겐은 조건에 따라 염화-이소시아네이트, OCNCHRCOCl 또는 N-카르복시-아미노산을 무수화한다.[3]
습한 공기 중에 HCl을 방출하기 위해 가수분해한다.
디포스진은 포스겐보다 다루기 쉽기 때문에 일부 실험실 준비물에 사용된다.
전쟁에서의 역할
디프호스겐은 원래 포스겐을 처음 사용한 지 몇 달 후 화학전의 폐활제로 개발되었다. 제1차 세계대전 당시 독일이 포탄에서 독가스로 사용했던 것이다. 첫 번째로 기록된 전장 사용은 1916년 5월이었다.[4] 디포스진은 증기가 당시 사용하던 방독면 필터들을 파괴할 수 있기 때문에 개발되었다.
안전
디프호스겐은 20℃에서 10mm Hg(1.3 kPa)의 비교적 높은 증기압을 가지며 300℃ 전후로 포스겐으로 분해된다. 디포스겐에 대한 노출은 포스겐과 위험성이 유사하다.
참고 항목
참조
- ^ Keisuke Kurita and Yoshio Iwakura (1979). "Trichloromethyl Chloroformate as a Phosgene Equivalent: 3-Isocyanatopropanoyl Chloride". Organic Syntheses. 59: 195.; Collective Volume, 6, p. 715
- ^ Lohs, K. H.: 신디시체 Gifte; 베를린 (동쪽), 1974년 (독일)
- ^ Kurita, K. "Trichloromethyl Cloroformate" (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289X.
- ^ Jones, Simon; Hook, Richard (2007). World War I Gas Warfare Tactics and Equipment. Osprey Publishing. ISBN 978-1-84603-151-9.
외부 링크
- 의료 가이드
- NATO 가이드, 치료 조언 포함
- 물질 안전 데이터 시트(PDF, 포스겐 및 디포스겐의 경우 하나로 처리됨.
- 특히 디프호스겐을 위한 MSDS


