아니솔레
Anisole| | |||
 | |||
| 이름 | |||
|---|---|---|---|
| IUPAC 이름 메톡시벤젠[1] | |||
| 우선 IUPAC 이름 아니솔레[1] | |||
| 기타 이름 메틸페닐에테르[1] 페녹시메탄 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 506892 | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| ECHA 정보 카드 | 100.002.615 | ||
| EC 번호 |
| ||
| 2964 | |||
| 케그 | |||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 2222 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C7H8O | |||
| 몰 질량 | 108.140g/g−1/g | ||
| 외모 | 무색 액체 | ||
| 밀도 | 0.995 g/cm3 | ||
| 녹는점 | -37°C(-35°F, 236K) | ||
| 비등점 | 154 °C (309 °F, 427 K) | ||
| 용해성 | 불용해 | ||
자화율(δ) | - 72.79/10−63 cm/세로 | ||
| 위험 요소 | |||
| GHS 라벨링: | |||
  | |||
| 경고 | |||
| H226, H315, H319 | |||
| P210, , , , , , , , , , , , , , , , | |||
| NFPA 704(파이어 다이아몬드) | |||
| 치사량 또는 농도(LD, LC): | |||
LD50(중간선량) | 3700mg/kg (랫드, 경구) | ||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
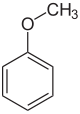
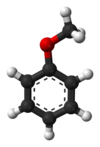
아니솔 또는 메톡시벤젠은 CHOCH라는 공식의365 유기 화합물이다.아니스 씨앗을 연상시키는 냄새를 가진 무채색의 액체이며, 실제로 많은 유도체가 천연향과 인공향에서 발견됩니다.이 화합물은 주로 합성되어 만들어지며 다른 합성 화합물의 전구체이다.에테르입니다.아니솔은 실용적이고 교육적인 [2]가치를 지닌 표준 시약이다.
윌리엄슨 에테르 합성에 의해 제조될 수 있으며, 페녹사이드 나트륨은 할로겐화메틸과 반응하여 아니솔을 생성한다.
반응성
아니솔은 벤젠보다 빠른 속도로 친전자성 방향족 치환반응을 일으켜 니트로벤젠보다 반응이 빠르다.메톡시기는 Ortho/para 유도기이며, 이는 이들 세 부위에서 친전자성 치환이 우선적으로 발생함을 의미한다.아니솔 대 벤젠의 향상된 친핵성은 메톡시기의 영향을 반영하며, 이는 고리를 더 전자적으로 풍부하게 만든다.메톡시기는 산소의 전기음성에도 불구하고 유도 전자 인출 그룹보다는 중합체 전자 공여체로서 고리의 파이 구름에 강하게 영향을 미친다.좀 더 정량적으로 표현하면 애니솔 패러 치환에 대한 해밋 상수는 -0.27이다.
아니솔은 아세트산 무수물과 반응하여 4-메톡시아세토페논을 생성한다.
- CHOCH365 + (CHCO3)2O → CHCHC364(O)CH3 + CHCOH32
대부분의 아세토페논과 달리 메톡시기의 영향을 반영하여 메톡시아세토페논은 두 번째 아세틸화를 겪는다.많은 관련 반응이 입증되었다.예를 들어 PS는410 아니솔을 Lawesson의 시약인 [(CHOCH364)PS2]2[3]로 변환한다.
또한 아니솔은 전자가 풍부한 고리를 나타내며, 금속 카르보닐과 쉽게 γ-복합체를 형성한다. 예를 들어 Cr(γ-아니솔6)(3[4]CO).
에테르 결합은 매우 안정적이지만 메틸기는 요오드산으로 제거할 수 있습니다.
- CHOCH365 + HI → HOCH65 + CHI3
아니솔의 자작환원은 1-메톡시시클로헥사-1,4-디엔을 얻는다.[5]
준비
아니솔은 디메틸 황산염 또는 [6][7]염화메틸로 페녹시드나트륨을 메틸화함으로써 제조된다.
- 265−+ CHONA + (CHO3)2SO2 → 2 CHOCH653 + NaSO24
적용들
아니솔은 향수, 곤충 페로몬, [7]의약품의 선구자이다.예를 들어 애니솔로부터 합성애닛홀을 준비한다.
안전.
아니솔은 [8]쥐에서 LD가50 3700mg/kg으로 비교적 무독성이다.그것의 주된 위험은 가연성이다.[8]
「 」를 참조해 주세요.
- 어넷홀
- 브로모아니솔레
- 부틸화 히드록시아니솔
- 에테르
- 에틸페닐에테르
- 페놀
- 2,4,6-트리클로로아니솔(코르크 페인트)
참조
- ^ a b c Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. 702–703. doi:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
Anisole, C6H5-O-CH3, is the only name in the class of ethers which is retained both as a preferred IUPAC name and for use in general nomenclature. For preferred IUPAC names, no substitution is allowed; for general nomenclature substitution is allowed on the ring and on the side chain under certain conditions (see P-34.1.1.4).
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Thomsen, K. Clausen, S. Scheibye, S.-O. Lawesson (1984). "Thiation with 2,4-Bis(4-Methoxyphenyl)-1,3,2,4- Dithiadiphosphetane 2,4-Disulfide: N-Methylthiopyrrolidone". Organic Syntheses. 62: 158. doi:10.15227/orgsyn.062.0158.
{{cite journal}}: CS1 maint: 여러 이름: 작성자 목록(링크) - ^ E. Peter Kündig (2004). "Synthesis of Transition Metal η6-Arene Complexes". Topics Organomet Chem. Topics in Organometallic Chemistry. 7: 3–20. doi:10.1007/b94489. ISBN 978-3-540-01604-5.
- ^ A. J. Birch and K. B. Chamberlain (1977). "Tricarbonyl[(2,3,4,5-η)-2,4-Cyclohexadien-1-one]Iron and Tricarbonyl[(1,2,3,4,5-η)-2-Methoxy-2,4-Cyclohexadien-1-yl]Iron(1+) Hexafluorophosphate(1−) from Anisole". Organic Syntheses. 57: 107. doi:10.15227/orgsyn.057.0107.
- ^ G. S. Hiers and F. D. Hager (1929). "Anisole". Organic Syntheses. 9: 12. doi:10.15227/orgsyn.009.0012.
- ^ a b Helmut Fiege, Heinz-Werner Voges, 하마모토 도시카즈, 우메무라 스미오, 이와타 타다오, 히사야 미키, 후지타 야스히로, 한스-요세프 부이치, 도로테아 가르베, 윌프리드 파울루스 '페놀'파생상품 백과'doi: 10.1002/14356007.a19_313
- ^ a b 2010년 7월 1일 Wayback Machine에서 MSDS 아카이브 완료