히포캄푸스
Hippocampus| 히포캄푸스 | |
|---|---|
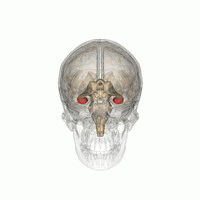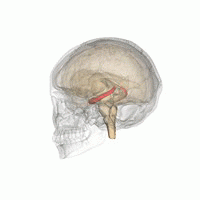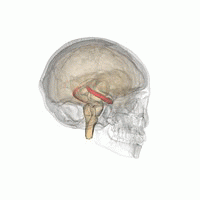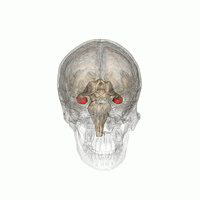 | |
 해마 (가장 낮은 분홍색 구근) 변연계의 일부로서. | |
| 세부 사항 | |
| 일부 | 측두엽 |
| 식별자 | |
| 라틴어 | 해마 |
| MeSH | D006624 |
| 뉴로네임즈 | 3157 |
| NeuroLex ID | birnlex_721 |
| TA98 | A14.1.09.321 |
| TA2 | 5518 |
| FMA | 275020 |
| 신경해부학의 해부학 용어 | |
해마(: hippocampi; 라틴어로 그리스 ἱππόκ αμ πος, '해마'를 뜻함)는 인간과 다른 척추동물의 뇌를 구성하는 주요 요소입니다. 인간과 다른 포유류들은 뇌의 양쪽에 하나씩 두 개의 해마를 가지고 있습니다. 해마는 변연계의 일부로, 단기 기억에서 장기 기억으로, 그리고 탐색을 가능하게 하는 공간 기억에서 정보를 통합하는 데 중요한 역할을 합니다. 해마는 인간뿐만[1][2][3] 아니라 다른 영장류에서도 신피질에 신경돌기가 있는 할당 피질에 위치합니다.[4] 해마는 내측 팔륨과 마찬가지로 모든 척추동물에서 볼 수 있는 구조입니다.[5] 인간의 경우, 그것은 두 개의 주요 서로 맞물리는 부분을 포함하고 있습니다: 적절한 해마 (암몬의 뿔이라고도 함)[6][7]와 상아질 회전목.
알츠하이머병(및 다른 형태의 치매)에서 해마는 손상을 입은 뇌의 첫 번째 영역 중 하나입니다.[8] 단기 기억 상실과 방향감각 상실은 초기 증상 중에 포함됩니다. 해마의 손상은 산소 결핍(hyp 산소 결핍), 뇌염 또는 측두엽 뇌전증으로 인해 발생할 수도 있습니다. 양측 해마 손상이 심한 사람들은 새로운 기억을 형성하고 유지할 수 없는 전단계 기억상실증을 경험할 수 있습니다.
해마에는 다양한 신경세포 유형이 층층으로 깔끔하게 정리되어 있어 신경생리학을 연구하는 모델 시스템으로 자주 사용되어 왔습니다. LTP(Long-term potentation)로 알려진 신경 가소성의 형태는 처음에 해마에서 발생하는 것으로 밝혀졌으며 종종 이 구조에서 연구되었습니다. LTP는 뇌에 기억이 저장되는 주요 신경 메커니즘 중 하나라고 널리 알려져 있습니다.
모델 유기체로서의 설치류에서 해마는 공간 기억과 항해를 담당하는 뇌 시스템의 일부로서 광범위하게 연구되었습니다. 쥐와 쥐의 해마에 있는 많은 뉴런들은 장소 세포로서 반응합니다: 즉, 그들은 동물이 환경의 특정 부분을 통과할 때 폭발적인 활동 전위를 발사합니다. 해마 장소 세포는 활동이 관성 나침반 역할을 하는 머리 방향 세포와 광범위하게 상호 작용하고 인접한 장피질의 격자 세포와 추측적으로 상호 작용합니다.
이름.

측심실의 측심각의 바닥을 따라 이어지는 능선에 대한 최초의 설명은 베네치아의 해부학자 율리우스 카이사르 아란지(Julius Caesar Aranzi, 1587)가 처음에는 누에, 다음에는 해마(라틴 해마, 그리스 ἱππόκ αμ πος, ἵππος, '말' + κάμ πος, '바다 괴물')에 비유한 데서 비롯되었습니다. 이 구조를 처음으로 설명한 독일 해부학자 뒤베르노이(1729)도 "해마"와 "누에벌레" 사이에서 흔들었습니다. "람의 뿔"은 1732년 덴마크 해부학자 야코프 윈슬뢰브에 의해 제안되었고, 10년 후 그의 동료 파리인 외과의사 데 가렌지오는 암모니스의 뿔을 사용했는데,[10] 이 뿔은 흔히 숫양의 머리를 가진 것으로 표현되었습니다.[11]
페스 해마라는 용어와 함께 또 다른 언급이 등장했는데, 이는 1672년 디메르브뢰크로 거슬러 올라갈 수 있으며, 이는 말의 앞다리와 물고기의 꼬리를 가진 바다 괴물인 신화 해마의 접힌 등 앞다리와 물갈퀴가 있는 발의 모양과 비교를 소개합니다. 그런 다음 해마는 페스 해마 메이저(pes hippami major)로 설명되었으며, 후두뿔에 인접한 볼록한 부분이 있으며, 페스 해마 마이너(pes hippami minor)로 설명되고 나중에 칼카라비스(calcaravis)로 이름이 변경되었습니다.[10][12] 해마를 메이저(hippocampus major)로, 칼카라비스(calcaravis)를 마이너(hippocampus major)로 개명한 것은 1786년 펠릭스 비크-다지르(Félix Vicq-d'Azyr)가 뇌 일부의 명명법을 체계화했기 때문입니다. 메이어는 1779년 하마라는 용어를 잘못 사용했고, 1829년 카를 프리드리히 부르다흐(Karl Friedrich Burdach)가 이 오류를 해결할 때까지 몇몇 다른 저자들이 따라 다녔습니다. 1861년에 해마 마이너는 위대한 해마 질문으로 풍자된 토마스 헨리 헉슬리와 리처드 오언 사이의 인류 진화에 대한 논쟁의 중심이 되었습니다. 해마 마이너라는 용어는 해부학 교과서에서 사용되지 않았고 1895년 노미나 해부학에서 공식적으로 제거되었습니다.[13] 오늘날 이 구조물은 해마라고 불리는 데,[10] 해마 하위 필드 CA1-CA4의 이름에 코르누 암모니스(즉, '암몬의 뿔')라는 용어가 남아 있습니다.[14][6]
변연계와의 관계
변연계라는 용어는 1952년 폴 맥린(Paul MacLean[15])에 의해 피질의 깊은 가장자리(경계를 의미하는 라틴어 림버스)를 따라 늘어선 구조를 설명하기 위해 도입되었습니다. 여기에는 해마, 결절 피질, 후각 피질 및 편도체가 포함됩니다. 폴 맥린(Paul MacLean)은 후에 변연계 구조가 감정의 신경적 기초를 구성한다고 제안했습니다. 해마는 해부학적으로 감정적 행동과 관련된 뇌의 부분인 중격, 시상하부 유방체 및 시상의 전방 핵 복합체와 연결되어 있으며 일반적으로 변연계의 일부로 받아들여집니다.[16]
해부학


해마는 회백질 조직의 융기로 볼 수 있으며, 하등 또는 측두각 영역의 각 측심실 바닥에서 상승합니다.[17][18] 이 능선은 대뇌 피질이 내측 측두엽으로 안쪽으로 접히는 것으로도 볼 수 있습니다.[19] 해마는 파라히포캠프 회전목에 의해 가려져서 해부에서만 볼 수 있습니다.[19][20] 피질은 6개 층에서 해마를 구성하는 서너 개 층으로 얇아집니다.[21]
해마 형성이라는 용어는 해마 고유 및 관련 부분을 나타내는 데 사용됩니다. 하지만 어떤 부분이 포함되어 있는지에 대해서는 합의가 이루어지지 않고 있습니다. 가끔 해마는 치은과와 치은을 포함한다고 합니다. 일부 참고 문헌에는 해마 형성의 치은회와 아고막이 포함되며,[1] 다른 참고 문헌에는 치은회, 파라수비강 및 내피질도 포함됩니다.[2] 해마 형성 내의 신경 레이아웃과 경로는 모든 포유류에서 매우 유사합니다.[3]
치륜을 포함한 해마는 구부러진 관 모양으로 해마에 비유되고, 숫양의 뿔에 비유되는데, 고대 이집트의 신이 종종 그렇게 묘사한 후에 코르누 암모니스라는 이름이 붙여졌습니다. 약칭 CA는 해마 하위 필드 CA1, CA2, CA3 및 CA4의 이름을 지정하는 데 사용됩니다.[20] 피질이 촘촘한 U자 모양으로 말리는 촘촘한 피라미드 뉴런의 단일층으로 좁아지는 부위로 구분할 수 있습니다. "U" – CA4의 한쪽 가장자리는 뒤쪽을 향하는 구부러진 치아 회전판에 내장되어 있습니다. 해마는 (영장류에서) 앞과 뒤 부분 또는 다른 동물에서 배와 등 부분을 가지고 있는 것으로 묘사됩니다. 두 부분 모두 구성은 비슷하지만 서로 다른 신경 회로에 속합니다.[22] 쥐에서, 두 개의 해마는 한 쌍의 바나나를 닮았고, 포닉스(해마 커미션이라고도 함)의 커미션에 의해 줄기에 결합되었습니다. 영장류의 경우, 측두엽의 기저부 부근인 하단의 해마 부위가 상단의 부위보다 훨씬 넓습니다. 이것은 단면에서 해마가 절단 각도와 위치에 따라 여러 가지 다른 모양을 보일 수 있음을 의미합니다.[citation needed]
치은회를 포함한 해마의 단면에는 여러 층이 표시됩니다. 치아 회전근에는 세 개의 세포 층(또는 힐러스가 포함된 경우 네 개)이 있습니다. 층은 분자층, 내부 분자층, 과립층 및 힐러스(hilus)의 바깥쪽에서 나옵니다. 해마 고유의 CA3는 지층으로 알려진 다음과 같은 세포층을 가지고 있습니다: lacunosum-molecularare, radiatum, lucidum, pyramidal 및 orientes. CA2와 CA1에도 루시드럼 지층을 제외하고는 이러한 층이 있습니다.[23][24]
해마에 대한 입력은 (다양한 피질 및 피질하 구조에서) 천공 경로를 통해 내막 피질에서 나옵니다. 내피질(EC)은 뇌간뿐만 아니라 많은 피질 및 피질하 구조와 강하고 상호적으로 연결되어 있습니다. (전측 및 정중선 그룹에서) 서로 다른 시상 핵, 중격 핵, 시상하부의 상악 핵, 뇌간의 하악 핵 및 유전자좌 코룰레우스는 모두 축삭을 EC로 보내 신피질과 다른 연결, 해마 사이의 인터페이스 역할을 합니다.[citation needed]
EC는 해마와 인접한 피질 영역인 [2]파라히포캄팔 자이러스에 위치하고 있습니다.[25] 이 회오리는 해마를 숨깁니다. 측두엽 회전근은 복잡한 물체의 시각적 인식에 중요한 역할을 하는 후두엽 피질과 인접해 있습니다. 기억에 기여한다는 실질적인 증거도 있는데, 해마의 기여와 구분할 수 있습니다. 완전 기억상실증은 해마와 파라히포캄푸스가 모두 손상되었을 때만 발생하는 것이 분명합니다.[25]
회로

해마에 대한 주요 입력은 내막 피질(EC)을 통해 이루어지는 반면, 주요 출력은 CA1을 통해 서브쿨럼으로 전달됩니다.[26] 정보는 직접 경로와 간접 경로의 두 가지 주요 경로를 통해 CA1에 도달합니다. 층 III에서 시작되는 EC의 축삭은 직접 천공 경로의 기원이며 CA1 뉴런의 가장 원위부 정점 수상돌기에 시냅스를 형성합니다. 반대로, 층 II에서 기원한 축삭은 간접 경로의 기원이며, 정보는 트리시냅틱 회로를 통해 CA1에 도달합니다. 이 경로의 초기 부분에서 축삭은 천공 경로를 통해 치열의 과립 세포(첫 번째 시냅스)로 돌출됩니다. 그 이후로 정보는 이끼가 낀 섬유를 통해 CA3(두 번째 시냅스)로 이동합니다. 거기서 샤퍼 콜래터라 불리는 CA3 축삭은 세포체의 깊은 부분을 떠나 정점 수상돌기까지 루프를 형성한 다음 CA1(세 번째 시냅스)까지 확장됩니다.[26] CA1의 축삭은 다시 내막 피질로 돌출하여 회로를 완성합니다.[27]
CA3의 바스켓 세포는 피라미드 세포로부터 흥분성 입력을 받은 다음 피라미드 세포에 억제 피드백을 제공합니다. 이러한 반복 억제는 해마의 흥분 반응을 약화시킬 수 있는 단순 피드백 회로입니다. 피라미드 세포는 일부 메모리 처리 미세 회로에서 발견되는 중요한 메커니즘인 반복 여기를 제공합니다.[28]
다른 여러 연결은 해마 기능에 중요한 역할을 합니다.[20] EC로의 출력을 넘어, 추가적인 출력 경로는 전전두엽 피질을 포함한 다른 피질 영역으로 갑니다. 주요 출력은 포닉스를 통해 측면 중격 부위와 시상하부의 유방체(포닉스가 해마와 상호 연결됨)로 이동합니다.[19] 해마는 세로토닌, 노르에피네프린, 도파민 시스템에서 조절 입력을 받고 시상의 핵 통일체에서 CA1 필드로 이동합니다. 매우 중요한 투영은 콜린성 및 감마 아미노 부티르산(GABA) 자극 섬유(GABAergic fiber)를 해마의 모든 부위로 보내는 중격 핵에서 나옵니다. 중간 중격 핵의 입력은 해마의 생리적 상태를 조절하는 데 중요한 역할을 합니다. 이 핵의 파괴는 해마 세타 리듬을 없애고 특정 유형의 기억을 심각하게 손상시킵니다.[29]
지역

해마의 부위는 기능적으로나 해부학적으로 구별되는 것으로 나타났습니다. 등쪽 해마(DH), 배쪽 해마(VH) 및 중간 해마는 서로 다른 기능을 수행하고 다양한 경로로 돌출되며 다양한 정도의 장소 세포를 갖습니다.[30] 등해마는 공간 기억, 언어 기억, 개념 정보 학습의 역할을 합니다. 방사형 팔 미로를 사용하여 DH의 병변은 공간 기억 장애를 유발하는 반면 VH 병변은 그렇지 않은 것으로 나타났습니다. 그것의 돌출 경로는 중간 중격 핵과 상악 핵을 포함합니다.[31] 등쪽 해마는 또한 배쪽과 중간 해마 영역보다 더 많은 장소 세포를 가지고 있습니다.[32]
중간 해마는 복측 해마와 배측 해마 모두와 중복되는 특성을 가지고 있습니다.[30] 전방 추적 방법을 사용하여 Cenquizca와 Swanson(2007)은 중간 투영을 두 개의 주요 후각 피질 영역과 내측 전전두 피질의 예비 대뇌 영역으로 위치시켰습니다. 이 지역은 장소 셀의 수가 가장 적습니다. 복부 해마는 공포 조절 및 정의적 과정에서 기능합니다.[33] Anagnostaras et al. (2002)는 배쪽 해마의 변화가 등쪽 해마와 배쪽 해마에 의해 편도체로 전송되는 정보의 양을 감소시켜 결과적으로 쥐의 공포 상태를 변화시키는 것을 보여주었습니다.[34] 역사적으로 해마가 후각에 관여한다는 가설이 가장 일찍부터 널리 알려져 있었습니다.[35] 이 아이디어는 후각구에서 해마에 대한 직접적인 투영을 발견하지 못한 일련의 해부학적 연구에 의해 의심을 받게 되었습니다.[36] 그러나 이후 연구에서 후각구가 측면 내막 피질의 복부 부분으로 돌출되어 있으며, 복부 해마의 CA1 필드는 축삭을 주 후각구,[37] 전방 후각 핵 및 원발성 후각 피질로 보낸다는 것이 확인되었습니다. 해마 후각 반응, 특히 냄새에 대한 기억에서 해마의 역할에 대한 관심은 계속되고 있지만, 오늘날 후각이 주요 기능이라고 믿는 전문가는 거의 없습니다.[38][39]
기능.
해마 기능 이론
수년 동안 해마 기능에 대한 세 가지 주요 아이디어인 반응 억제, 에피소드 기억 및 공간 인지가 문헌을 지배했습니다. 행동 억제 이론(John O'Keefe와 Lynn Nadel이 "제동을 쾅!"이라고 표현함)[40]은 1960년대까지 매우 인기가 있었습니다. 그것은 두 가지 관찰에서 정당성의 많은 부분을 도출했습니다: 첫째, 해마 손상을 입은 동물은 과활성적인 경향이 있다는 것; 둘째, 해마 손상을 입은 동물은 이전에 배운 반응을 억제하는 방법을 배우는데 종종 어려움을 겪으며, 특히 반응이 수동 회피 테스트에서처럼 조용히 있어야 한다는 것입니다. 영국 심리학자 제프리 그레이(Jeffrey Gray)는 이러한 사고방식을 불안에서 해마의 역할에 대한 본격적인 이론으로 발전시켰습니다.[41] 억제 이론은 현재 세 가지 중에서 가장 인기가 없습니다.[42]
두 번째 주요 사상선은 해마를 기억과 연관시킵니다. 비록 그것은 역사적인 선구자들을 가지고 있었지만, 이 생각은 미국 신경 외과 의사 윌리엄 비처 스코빌과 영국계 캐나다 신경 심리학자 브렌다 밀너가[43] 미국인 헨리 몰레슨의 간질 발작을 완화하려고 했을 때 해마가 외과적으로 파괴된 결과를 묘사한 유명한 보고서에서 비롯되었습니다.[44] 2008년 사망할 때까지 "환자 H.M."으로 알려져 있었습니다. 예상치 못한 수술의 결과는 심각한 전방악화와 부분 역행성 기억상실증이었습니다. 몰레슨은 수술 후 새로운 에피소드 기억을 형성할 수 없었고 수술 직전에 일어난 어떤 사건도 기억할 수 없었습니다. 하지만 그는 수년 전에 일어났던 사건들에 대한 기억을 간직하고 있습니다. 그의 어린 시절로 거슬러 올라갑니다. 이 사건은 매우 광범위한 전문적인 관심을 끌어서 몰레슨은 의학사에서 가장 집중적으로 연구된 주제가 되었습니다.[45] 그 후 몇 년 동안 비슷한 수준의 해마 손상과 기억상실증(사고 또는 질병으로 인한)을 가진 다른 환자들도 연구되었으며 수천 개의 실험에서 해마의 시냅스 연결의 활동에 의한 변화의 생리학을 연구했습니다. 해마가 기억에 있어서 어떤 종류의 중요한 역할을 한다는 보편적인 합의가 있습니다. 그러나 이 역할의 정확한 성격에 대해서는 아직 널리 논의되고 있습니다.[46][47] 최근의 이론은 해마가 공간 인지에서의 역할에 의문을 제기하지 않고, 상아질의 신생 과립 세포에서 표현을 연관시키고 내피질에서 생성된 상 세차운동에 의존하여 CA3에서 순차적으로 표현을 배열함으로써 새로운 에피소드 기억을 인코딩한다고 제안했습니다.[48]

세 번째 중요한 해마 기능 이론은 해마를 우주와 연관시킵니다. 공간 이론은 원래 미국 심리학자 E.C의 영향을 받은 오키프와 나델에 의해 옹호되었습니다. 인간과 동물의 "인지 지도"에 대한 톨만의 이론. 오키프(O'Keefe)와 그의 제자 도스트롭스키(Dostrovsky)는 1971년 쥐 해마에서 자신의 환경 내에서 쥐의 위치와 관련된 활동을 보여주는 것으로 보이는 뉴런을 발견했습니다.[49] 다른 조사관들의 회의론에도 불구하고, 오키프와 그의 동료들, 특히 린 나델은 이 질문을 계속 조사했고, 결국 그들의 매우 영향력 있는 1978년 책 인지 지도로서의 해마로 이어졌습니다.[50] 이제 해마 기능이 공간 코딩에서 중요한 역할을 한다는 것은 거의 보편적인 합의가 있지만 세부 사항은 널리 논의되고 있습니다.[51]
이후의 연구는 기억과 공간 인지 사이에서 분리되는 해마 기능의 두 가지 주요 관점 사이의 단절을 연결하는 데 초점을 맞추고 있습니다. 일부 연구에서는 이러한 영역이 거의 수렴에 가까운 지점으로 확장되었습니다. 두 개의 서로 다른 견해를 조화시키기 위해 해마 기능에 대한 더 넓은 견해가 제시되고 있으며, 경험의 조직(1948년 톨만의 원래 개념에 따라 정신적 매핑)과 모든 인지 영역에 관여하는 것으로 보이는 방향성 행동을 모두 포괄하는 역할을 하는 것으로 보입니다. 해마의 기능은 광범위한 인지 지도의 사용을 포함하는 역할에 기억과 공간적 관점을 모두 통합하는 더 넓은 시스템으로 볼 수 있습니다.[52] 이는 행동을 안내하는 복잡한 인지 메커니즘과 목적을 확인하려는 톨만의 원래 목표에서 탄생한 목적적 행동주의와 관련이 있습니다.[53]
또한 해마 뉴런의 스파이킹 활동이 공간적으로 연관되어 있다는 것이 제안되었으며, 기억과 계획의 메커니즘이 모두 탐색의 메커니즘에서 진화했으며 이들의 뉴런 알고리즘은 기본적으로 동일하다는 것이 제안되었습니다.[54]
많은 연구에서 기능적 자기 공명 영상(fMRI)과 같은 신경 영상 기술을 사용했으며 접근-회피 충돌에서 기능적 역할이 주목되었습니다. 전방 해마는 접근-회피 갈등 처리 하에서 의사 결정에 관여하는 것으로 보입니다. 기억, 공간 인지 및 갈등 처리 기능은 상호 배타적이지 않고 함께 작동하는 것으로 볼 수 있다고 제안합니다.[55]
기억 속의 역할
심리학자와 신경과학자들은 일반적으로 해마가 경험된 사건(에피소드 또는 자전적 기억)에 대한 새로운 기억 형성에 중요한 역할을 한다는 데 동의합니다.[47][56] 이 기능의 일부는 새로운 사건, 장소 및 자극 감지에 해마가 관여하는 것입니다.[57] 일부 연구자들은 해마를 일반적인 선언 기억(예를 들어, 명시적으로 언어화할 수 있는 기억)을 담당하는 더 큰 측두엽 기억 시스템의 일부로 간주합니다. 여기에는 에피소드 기억 외에 사실에 대한 기억이 포함됩니다.[46] 해마는 편도체에서 정서적 맥락을 암호화하기도 합니다. 이것이 부분적으로 감정적인 사건이 발생한 장소로 돌아가는 것이 그 감정을 불러일으킬 수 있는 이유입니다. 에피소드적 기억과 장소 사이에는 깊은 감정적 연관성이 있습니다.[58]
양쪽 대칭으로 인해 뇌는 각 대뇌 반구에 해마가 있습니다. 해마의 손상이 한쪽 반구에서만 일어나고 다른 반구에서는 구조가 그대로 유지되면 뇌는 거의 정상적인 기억 기능을 유지할 수 있습니다.[59] 양쪽 반구에서 해마가 심하게 손상되면 새로운 기억을 형성하는 데 심각한 어려움이 발생하며(전후등급 기억상실증), 종종 손상이 발생하기 전에 형성된 기억에도 영향을 미칩니다(역후등급 기억상실증). 퇴행 효과는 보통 뇌 손상 이전으로 거슬러 올라가지만, 어떤 경우에는 더 오래된 기억이 남아 있습니다. 이러한 오래된 기억의 보존은 시간이 지남에 따라 통합이 해마에서 뇌의 다른 부분으로 기억을 이전하는 것을 포함한다는 생각으로 이어집니다.[56]: Ch. 1 해마의 신경독성 병변이 있는 영장류에게 해마 세포의 해마 내 이식을 이용한 실험 결과, 해마는 기억의 형성과 회상에는 필요하지만 기억의 저장에는 필요하지 않다는 것을 보여주었습니다.[60] 사람의 해마 여러 부위의 부피가 감소하면 특정 기억력 장애가 발생하는 것으로 나타났습니다. 특히 언어적 기억 유지의 효율성은 오른쪽과 왼쪽 해마의 앞쪽 부분과 관련이 있습니다. 해마의 오른쪽 머리는 언어적 기억을 떠올리는 동안 행정 기능과 조절에 더 많이 관여합니다. 왼쪽 해마의 꼬리는 언어적 기억력과 밀접한 관련이 있는 경향이 있습니다.[61]
해마의 손상은 새로운 기술을 배울 수 있는 능력(예: 악기 연주 또는 특정 유형의 퍼즐 해결)과 같은 일부 유형의 기억에 영향을 미치지 않습니다. 이 사실은 그러한 능력이 다른 종류의 기억 (절차적 기억)과 다른 뇌 영역에 의존한다는 것을 암시합니다. 또한 기억상실증 환자는 의식적 지식이 없는 상태에서도 경험을 위해 종종 "묵시적" 기억을 보여줍니다. 예를 들어, 환자들은 한 번도 본 적이 없다고 말하면서도 가장 최근에 본 두 얼굴 중 어떤 얼굴이 정확한 답을 줄 수 있는지 추측해보라고 요청했습니다. 일부 연구자들은 해마에 의존하는 의식적 회상과 내측 측두엽의 일부에 의존하는 친숙함을 구분합니다.[62]
쥐가 격렬한 학습 이벤트에 노출되면 한 번의 훈련 후에도 평생 기억에 남을 수 있습니다. 그러한 사건의 기억은 해마에 처음 저장되는 것처럼 보이지만 이 저장은 일시적입니다. 기억의 장기적인 저장의 대부분은 전방 시굴 피질에서 일어나는 것으로 보입니다.[63] 이처럼 강도 높은 학습 이벤트를 실험적으로 적용했을 때, 학습 후 1시간과 24시간에 쥐의 해마 신경 유전체에 5,000개 이상의 다른 메틸화된 DNA 영역이 나타났습니다.[64] 메틸화 패턴의 이러한 변경은 유전체의 CpG 풍부한 영역에서 새로운 5-메틸시토신 부위의 형성으로 인해 하향 조절된 많은 유전자에서 발생했습니다. 또한, 많은 다른 유전자들이 상향 조절되었는데, 이는 종종 DNA에서 이전에 존재했던 5-메틸사이토신(5mCs)에서 메틸기가 제거되었기 때문일 수 있습니다. 5mC의 탈메틸화는 TET 효소뿐만 아니라 DNA 염기 절제 복구 경로의 효소를 포함하여 여러 단백질이 함께 작용하여 수행될 수 있습니다(학습 및 기억의 후생유전학 참조).

자유롭게 움직이는 쥐와 쥐에 대한 연구에 따르면 많은 해마 뉴런이 제자리 들판에 모여 있는 장소 세포 역할을 하며, 이러한 불은 동물이 특정 위치를 통과할 때 활동 전위를 터뜨립니다. 해마의 이 장소와 관련된 신경 활동은 구속 의자에 앉아 방을 옮겨 놓은 원숭이들에게서도 보고되었습니다.[65] 하지만, 그 장소 세포들은 방 안에 있는 원숭이의 실제 위치보다는 원숭이가 어디를 보고 있었는지와 관련하여 발사되었을 수 있습니다.[66] 수년에 걸쳐 많은 양의 정보를 제공한 설치류의 장소 반응에 대한 많은 연구가 수행되었습니다.[51] 장소 세포 반응은 해마의 피라미드 세포와 치환의 과립 세포에 의해 나타납니다. 더 작은 비율의 다른 세포는 억제성 인터뉴런이며, 이들은 종종 훨씬 약한 발사 속도에서 장소 관련 변화를 보입니다. 표현에는 공간 지형이 거의 없습니다. 일반적으로 해마에서 서로 옆에 누워있는 세포는 상관없는 공간 발화 패턴을 가지고 있습니다. 장소 세포는 일반적으로 쥐가 장소 필드 밖에서 움직일 때 거의 침묵하지만 쥐가 중심 근처에 있을 때는 40Hz까지 지속되는 속도에 도달합니다. 무작위로 선택된 30~40개의 장소 세포에서 샘플링된 신경 활동은 쥐의 위치가 높은 신뢰도로 재구성될 수 있도록 충분한 정보를 전달합니다. 장소 필드의 크기는 해마의 길이를 따라 구배가 다양한데, 등쪽 끝의 세포는 가장 작은 필드를 나타내고, 중앙 부근의 세포는 더 큰 필드를 나타내고, 배쪽 끝의 세포는 환경 전체를 덮는 필드를 나타냅니다.[51] 어떤 경우에는 해마 세포의 발사 속도가 장소뿐만 아니라 쥐가 이동하는 방향, 쥐가 이동하는 목적지 또는 기타 작업과 관련된 변수에 따라 달라집니다.[67] 장소 셀의 발화는 위상 세차라고 하는 과정인 국소 세타파와 관련하여 시간이 지정됩니다.[68]
사람의 경우 약물 내성 뇌전증 환자를 대상으로 한 연구에서 위치별 발화 패턴을 가진 세포가 보고된 바 있습니다. 그들은 외과적 절제술을 목적으로 발작의 근원을 국소화하기 위해 침습적인 절차를 받고 있었습니다. 환자들은 해마에 진단 전극을 심은 다음 컴퓨터를 사용하여 가상 현실 마을을 돌아다녔습니다.[69] 내비게이션의 유사한 뇌 영상 연구는 해마가 활동적이라는 것을 보여주었습니다.[70] 택시 기사를 대상으로 한 연구가 수행되었습니다. 런던의 블랙 택시 운전사들은 운전 면허를 따기 위해 The Knowledge로 알려진 엄격한 테스트를 통과하기 위해 많은 장소들의 위치와 그들 사이의 가장 빠른 경로를 배워야 합니다. 해마의 후방 부위가 일반인보다 이들 운전자에게서 더 크고, 운전자 역할을 하는 시간과 이 부위의 부피 증가 사이에 양의 상관관계가 존재한다는 연구 결과가 나왔습니다. 또한 해마의 전체 부피는 변화가 없는 것으로 나타났는데, 이는 후방부에서 보이는 증가가 전방부를 희생시켜 이루어졌기 때문에 상대적으로 크기가 감소한 것으로 나타났습니다. 해마 비율의 이러한 차이로 인한 부작용은 보고되지 않았습니다.[71] 또 다른 연구는 맹인들에게서 반대되는 결과를 보여주었습니다. 목격된 개체에 비해 오른쪽 해마의 앞쪽 부분은 더 크고 뒤쪽 부분은 더 작았습니다.[72]
뇌에는 내측 내피질에 존재하는 속도 세포와 같이 해마 자체에 있거나 해마와 강하게 연결되어 있는 여러 탐색 세포가 있습니다. 이 세포들은 함께 공간 기억의 역할을 하는 네트워크를 형성합니다. 1970년대에 발견된 그러한 세포들 중 첫 번째는 장소 세포들이었고, 이것은 해마가 인지 지도에서 환경에 대한 신경 표현을 하는 역할을 한다는 아이디어로 이어졌습니다.[50] 해마가 제 기능을 하지 못할 때, 방향성이 영향을 받습니다. 사람들은 그들이 어떻게 한 장소에 도착했는지 그리고 어떻게 더 나아가야 하는지를 기억하는데 어려움을 겪을 수 있습니다. 길을 잃는 것은 기억상실증의 흔한 증상입니다.[73] 동물을 대상으로 한 연구에 따르면 일부 공간 기억 과제, 특히 숨겨진 목표로 가는 길을 찾아야 하는 과제의 초기 학습과 장기 유지를 위해서는 온전한 해마가 필요합니다.[74][75][76][77] 설치류 뇌에서 해마 또는 내막 피질에 있는 장소 세포를 발견한 이후로 다른 세포들이 발견되었습니다. 이들은 헤드 방향 셀, 그리드 셀 및 경계 셀로 할당되었습니다.[51][78] 속도 세포는 해마 격자 세포에 입력을 제공하는 것으로 생각됩니다.
접근-회피 갈등처리에서의 역할
접근-회피 갈등은 보상하거나 처벌할 수 있는 상황이 제시되고 그에 따른 의사결정이 불안과 관련이 있을 때 발생합니다.[79] 접근-회피 의사결정 연구의 fMRI 결과는 장기 기억이나 공간 인지로 설명되지 않는 기능적 역할에 대한 증거를 발견했습니다. 전반적인 연구 결과에 따르면 전방 해마는 갈등에 민감하며 불확실한 조건에서 의사 결정에 중요한 것으로 보이는 더 큰 피질 및 피질하 네트워크의 일부일 수 있습니다.[79]
리뷰는 분쟁 과제에 해마가 관여한다는 것을 보여주는 많은 연구를 언급합니다. 저자들은 충돌 처리가 공간 탐색 및 메모리의 기능과 어떻게 관련이 있으며 이러한 모든 기능이 상호 배타적일 필요가 없는지 이해하는 것이 한 가지 과제라고 제안합니다.[55]
사회적 기억에서의 역할
해마는 사회적 기억에 대한 역할로 다시 주목을 받았습니다. 왼쪽 후방, 왼쪽 전방 또는 오른쪽 전방 해마에 깊이 전극이 있는 간질성 인간 피험자는 아마도 인식 가능한 유명인의 얼굴과 함께 제시될 때 구별되고 개별적인 세포 반응을 보여줍니다.[80] 얼굴과 목소리의 정체성 사이의 연관성은 리세우스 원숭이의 해마와 유사하게 매핑되었습니다. CA1과 CA3의 단일 뉴런은 MRI에 의한 사회적 자극 인식에 강하게 반응했습니다. CA2는 구별되지 않았으며 연구에서 청구된 CA1 세포의 비율을 포함할 수 있습니다.[81] 해마의 등쪽 CA2 및 배쪽 CA1 하위 영역은 사회적 기억 처리와 관련이 있습니다. CA2 피라미드 뉴런의 유전적 비활성화는 쥐에서 온전한 사회성을 유지하면서 사회적 기억의 현저한 손실을 초래합니다.[82] 마찬가지로, 복부 CA1 피라미드 뉴런은 쥐의 광유전학적 제어 하에서 사회적 기억에 중요한 것으로 입증되었습니다.[83][84]
뇌전도

해마는 두 가지 주요 "모드"의 활동을 보여주는데, 각각은 뇌파(EEG)에 의해 측정된 신경 집단 활동의 뚜렷한 패턴 및 전기 활동의 파동과 관련이 있습니다. 이 모드들은 그들과 연관된 뇌파 패턴의 이름을 따서 지어졌습니다: theta와 큰 불규칙 활동 (LIA). 아래에 설명된 주요 특징은 가장 광범위하게 연구된 동물인 쥐를 위한 것입니다.[85]
세타 모드는 활성화된 경고 동작(특히 이동) 상태와 REM(꿈꾸는) 수면 중에도 나타납니다.[86] 세타 모드에서 뇌파는 6~9Hz의 주파수 범위를 가진 큰 규칙적인 파동에 의해 지배되고, 해마 뉴런의 주요 그룹(피라미드 세포 및 과립 세포)은 희박한 집단 활동을 보이며, 이는 짧은 시간 간격에서 대다수의 세포가 침묵한다는 것을 의미합니다. 나머지 작은 부분은 비교적 높은 속도로 발사되지만, 가장 활동적인 부분의 경우 1초 동안 최대 50개의 스파이크가 발생합니다. 활성 세포는 일반적으로 30분에서 몇 초 동안 활성 상태를 유지합니다. 쥐가 행동하면 활성 세포가 조용해지고 새로운 세포가 활성화되지만 전체 활성 세포의 비율은 다소 일정하게 유지됩니다. 많은 상황에서 세포 활동은 동물의 공간적 위치에 의해 크게 결정되지만 다른 행동 변수도 분명히 영향을 미칩니다.
리아 모드는 저속파(꿈꾸지 않는) 수면 중에 나타나며, 휴식 또는 식사와 같은 깨어있는 움직이지 않는 상태에서도 나타납니다.[86] LIA 모드에서 뇌파는 25-50밀리초 동안 지속되는 뇌파 신호의 무작위로 큰 편향을 이루는 날카로운 파동에 의해 지배됩니다. 날카로운 파동은 세트로 자주 발생하며, 세트는 최대 5개 이상의 개별 날카로운 파동을 포함하고 최대 500ms까지 지속됩니다. 해마 내 뉴런의 스파이킹 활동은 급격한 파동 활동과 높은 상관관계가 있습니다. 대부분의 뉴런은 날카로운 파동 사이에 발사율이 감소하지만, 급격한 파동 동안 해마 개체군의 10%까지 발사율이 극적으로 증가합니다.
영장류 해마에서 강력한 세타 리듬성을 보기 어려웠다는 점을 제외하면, 이 두 가지 해마 활동 모드는 쥐뿐만 아니라 영장류에서도 볼 수 있습니다. 그러나 신경 개체군 활동에는 질적으로 유사한 급격한 파동과 유사한 상태 의존적 변화가 있습니다.[87]
세타 리듬

세타파를 생성하는 기본 전류는 주로 장피질, CA3 및 피라미드 세포의 수상돌기의 조밀하게 채워진 신경층에 의해 생성됩니다. 세타파는 뇌파에서 볼 수 있는 가장 큰 신호 중 하나로 해마 세타 리듬으로 알려져 있습니다.[88] 어떤 상황에서는 뇌파가 3~10Hz의 규칙적인 파동에 의해 지배되며, 종종 몇 초 동안 계속됩니다. 이것들은 임계 이하의 막 전위를 반영하고 해마 뉴런의 스파이킹을 강력하게 조절하고 진행파 패턴으로 해마 전반에 걸쳐 동기화합니다.[89] 트리시냅틱 회로는 많은 뇌 영역과 상호 작용하는 해마의 신경 전달 릴레이입니다. 설치류 연구에서 트리시냅틱 회로가 해마 세타 리듬을 생성한다고 제안되었습니다.[90]
세타 리듬성은 토끼와 설치류에서 매우 분명하며 고양이와 개에게도 분명히 존재합니다. 세타가 영장류에게 보여질 수 있는지 여부는 아직 명확하지 않습니다.[91] 쥐(가장 광범위하게 연구된 동물)에서 세타는 주로 두 가지 상태에서 볼 수 있습니다: 첫째, 동물이 걷고 있거나 다른 방식으로 주변 환경과 활발하게 상호 작용할 때; 둘째, REM 수면 중.[92] 세타의 기능은 수많은 이론이 제시되었지만 아직 설득력 있게 설명되지 않았습니다.[85] 가장 인기 있는 가설은 학습과 기억과 관련이 있다는 것입니다. 예를 들어, 세타 리듬이 뉴런의 자극을 받을 때 시냅스에 미치는 자극의 효과를 형성하는 단계를 들 수 있습니다. 여기서 의미하는 것은 시냅스 가소성에 의존하는 학습과 기억의 측면에 세타 리듬이 영향을 미칠 수 있다는 것입니다.[93] 세타 시스템의 중심 노드인 중격의 병변은 기억의 심각한 장애를 유발한다는 것은 잘 알려져 있습니다.[94] 그러나 중격은 단순히 세타의 조절기 이상이며 해마에 대한 콜린성 돌출의 주요 공급원이기도 합니다.[20] 중격 병변이 세타 리듬을 제거함으로써 구체적으로 효과를 발휘한다는 것은 확인되지 않았습니다.[95]
날카로운 파도
수면 중이나 휴식 중에 동물이 주변과 교전하지 않을 때 해마 뇌파는 세타파보다 진폭이 다소 큰 불규칙한 느린 파동의 패턴을 보입니다. 이 패턴은 날카로운 파도라고 불리는 큰 파도에 의해 때때로 중단됩니다.[96] 이러한 이벤트는 CA3 및 CA1의 피라미드 셀에서 50~100밀리초 동안 지속되는 스파이크 활동의 폭발과 관련이 있습니다. 이들은 또한 쥐의 주파수가 150~200Hz 범위인 "리플"(ripple)이라고 불리는 짧은 수명의 고주파 뇌파 진동과 관련이 있으며, 함께 날카로운 파동과 리플로 알려져 있습니다. 날카로운 파동은 수면 중에 가장 자주 발생하는데, 이는 평균 초당 1회 정도의 속도로 발생하지만 매우 불규칙한 시간적 패턴으로 발생합니다. 급격한 파동은 비활성 깨어있는 상태에서는 빈도가 적고 일반적으로 더 작습니다. 사람과 원숭이에서도 날카로운 파도가 관측된 바 있습니다. 마카크에서 날카로운 파도는 강하지만 쥐처럼 자주 일어나지는 않습니다.[87]
날카로운 파도의 가장 흥미로운 측면 중 하나는 기억과 연관되어 있는 것처럼 보인다는 것입니다. 윌슨(Wilson)과 맥노턴([97]McNaughton)은 1994년과 수많은 이후의 연구에서 해마 장소 세포가 중첩된 공간 발사장을 가질 때(따라서 종종 거의 동시에 발사됨) 행동 세션 후 수면 중에 상관된 활동을 보이는 경향이 있다고 보고했습니다. 일반적으로 재활성화라고 알려진 이러한 상관관계 향상은 주로 급격한 파도에서 발생하는 것으로 밝혀졌습니다.[98] 실제로 날카로운 파동은 해마 내 시냅스 연결의 강화에 의해 행동 중에 기억되었던 신경 활동 패턴의 재활성화라고 제안되었습니다.[99] 이 아이디어는 부사키 등이 주장하는 "2단계 기억" 이론의 핵심 구성 요소를 형성하는데,[100] 기억은 행동하는 동안 해마 안에 저장되었다가 나중에 수면 중에 신피질로 전달된다고 제안합니다. Hebbian 이론의 날카로운 파동은 해마 출력 경로의 피질 표적에서 시냅스 변화를 유도하는 것으로 제안되는 시냅스 후 세포에 의한 지속적으로 반복되는 자극으로 간주됩니다.[101] 수면 중 또는 움직이지 않는 동안 날카로운 파동과 파문을 억제하면 행동 수준에서 표현되는 기억을 방해할 수 있지만,[102][103] 공간적으로 요구되지 않는 작업에서 날카로운 파동과 파문이 폐지된 수면 후에도 새로 형성된 CA1 플레이스 셀 코드가 다시 나타날 수 있습니다.[104]
장기강화
심리학자들은 적어도 라모니 카할(Ramony Cajal, 1852-1934) 시대부터 뇌가 동시에 활동하는 뉴런 사이의 연결 강도를 변화시켜 기억을 저장한다고 추측했습니다.[105] 이 아이디어는 1949년 도널드 헵에 의해 공식화되었지만 수년 동안 설명되지 않은 채로 남아 있었습니다.[106] 1973년, 팀 블리스(Tim Bliss)와 테르제 뢰모(Terje Lømo)는 토끼 해마에서 Hebb의 사양을 충족하는 것으로 보이는 현상, 즉 짧은 강한 활성화에 의해 유도되고 몇 시간 또는 며칠 또는 그 이상 지속되는 시냅스 반응성의 변화를 설명했습니다.[107] 이 현상은 곧 장기 강화(LTP)라고 불립니다. 장기 기억의 후보 메커니즘으로서 LTP는 이후 집중적으로 연구되어 왔으며, 이에 대해 많은 것이 학습되었습니다. 그러나 LTP를 유발할 수 있는 세포 내 신호 전달 캐스케이드의 복잡성과 다양성은 보다 완전한 이해를 방해하는 것으로 인정됩니다.[108]
해마는 촘촘하고 날카롭게 정의된 뉴런층 때문에 LTP를 연구하기에 특히 유리한 부위이지만 다른 많은 뇌 영역에서도 유사한 유형의 활동 의존적 시냅스 변화가 관찰되었습니다.[109] 가장 잘 연구된 형태의 LTP는 해마의 CA1에서 관찰되었으며 수지상 가시에서 종료되고 신경전달물질 글루타메이트를 사용하는 시냅스에서 발생합니다.[108] 시냅스 변화는 시냅스 전 활성화와 시냅스 후 탈분극이 동시에 일어나는 경우에만 칼슘이 시냅스 후 척추로 들어갈 수 있는 특별한 특성을 가진 세포 표면 수용체인 NMDA(N-methyl-D-aspartate) 수용체에 따라 달라집니다.[110] NMDA 수용체를 방해하는 약물은 LTP를 차단하고 일부 유형의 기억, 특히 공간 기억에 큰 영향을 미칩니다. LTP 메커니즘을 비활성화하도록 변형된 유전자 변형 쥐도 일반적으로 심각한 기억력 결함을 보입니다.[110]
장애
노화
알츠하이머병과 다른 형태의 치매(해마 파괴가 가장 초기 징후[111] 중 하나임)와 같은 나이와 관련된 질병은 기억을 포함한 많은 유형의 인지에 심각한 영향을 미칩니다. 정상적인 노화조차도 에피소드 기억 및 작업 기억(또는 단기 기억)을 포함한 일부 유형의 기억의 점진적인 감소와 관련이 있습니다. 해마가 기억에 중심적인 역할을 하는 것으로 생각되기 때문에 해마의 노화로 인해 나이와 관련된 감소가 발생할 수 있다는 가능성에 대해 상당한 관심이 있었습니다.[112]: 105 일부 초기 연구에서는 노인의 해마에서 뉴런의 상당한 손실을 보고했지만, 이후 더 정밀한 기술을 사용한 연구에서는 최소한의 차이만 발견했습니다.[112] 마찬가지로 일부 MRI 연구에서는 노인에게서 해마의 수축이 보고되었지만 다른 연구에서는 이 결과를 재현하는 데 실패했습니다. 그러나 해마의 크기와 기억 성능 사이에는 신뢰할 수 있는 관계가 있으므로 나이와 관련된 수축이 있는 곳에서는 기억 성능이 손상됩니다.[112]: 107 기억 과제는 젊은 층에 비해 노인층에서 해마 활성화가 덜 일어나는 경향이 있다는 보고도 있습니다.[112]: 107 또한 2011년 발표된 무작위 대조 시험에서는 유산소 운동이 55세에서 80세 사이의 성인에서 해마의 크기를 증가시키고 공간 기억력을 향상시킬 수 있다는 것을 발견했습니다.[113]
스트레스
해마는 글루코코르티코이드 수용체를 많이 함유하고 있어 대부분의 다른 뇌 부위보다 장기적인 스트레스에 취약합니다.[114] 인간이 심각하고 오래 지속되는 외상성 스트레스를 경험했다는 증거는 뇌의 다른 부분보다 해마의 위축을 더 많이 보여줍니다.[115] 이러한 효과는 외상 후 스트레스 장애에서 나타나며,[116] 조현병과[117] 중증 우울증에서 보고된 해마 위축에 기여할 수 있습니다.[118] 어린이의 전방 해마 부피는 부모 가족 소득과 양의 상관관계가 있으며 이 상관관계는 소득 관련 스트레스에 의해 매개되는 것으로 생각됩니다.[119] 최근 연구에서도 우울증으로 인한 위축이 밝혀졌지만, 이는 다른 증상 완화에 효과가 없더라도 항우울제로 중단할 수 있습니다.[120]
만성 스트레스로 인해 글루코코르티코이드, 특히 코르티솔의 수치가 상승하는 것은 해마의 신경 위축의 원인으로 보입니다. 이 위축은 쿠싱 증후군에서도 볼 수 있는 해마 부피를 더 작게 만듭니다. 쿠싱증후군에서 코티솔 수치가 높은 것은 일반적으로 다른 질환을 위해 복용한 약물의 결과입니다.[121][122] 신경 발생 장애로 인해 신경 손실도 발생합니다. 더 작은 해마 부피에 기여하는 또 다른 요인은 증가된 글루코코르티코이드에 반응하여 수지상이 길이가 짧아지고 수가 감소하는 수지상 수축입니다. 이 수지상 수축은 가역적입니다.[122] 쿠싱증후군에서 코티솔을 줄이기 위한 약물 치료 후 해마 부피가 최대 10%[121] 회복되는 것으로 나타났습니다. 이러한 변화는 덴드라이트의 개질 때문인 것으로 보입니다.[122] 이 수지상 복원은 스트레스를 제거할 때도 발생할 수 있습니다. 그러나 출생 직후 발생하는 스트레스가 평생 지속되는 방식으로 해마 기능에 영향을 미칠 수 있다는 쥐를 이용한 연구에서 주로 도출된 증거가 있습니다.[123]: 170–171
스트레스에 대한 성별에 따른 반응은 쥐에서도 해마에 영향을 미치는 것으로 입증되었습니다. 수컷 쥐의 만성 스트레스는 CA3 영역에서 수지상 수축과 세포 손실을 나타냈지만 암컷에서는 나타나지 않았습니다. 이는 신경 보호 난소 호르몬 때문인 것으로 생각되었습니다.[124][125] 쥐의 경우 스트레스 조건에서 해마의 DNA 손상이 증가합니다.[126]
뇌전증


해마는 새로운 뉴런이 생성되는 몇 안 되는 뇌 영역 중 하나입니다. 이 신경 발생 과정은 치은회에만 국한됩니다.[127] 새로운 뉴런의 생성은 운동에 의해 긍정적인 영향을 받거나 간질 발작에 의해 부정적인 영향을 받을 수 있습니다.[127]
측두엽 뇌전증의 발작은 새로운 뉴런의 정상적인 발달에 영향을 미치고 조직 손상을 일으킬 수 있습니다. 이러한 조직 손상의 가장 흔한 유형은 중간 측두엽에 특이적인 암몬의 뿔경화증을 포함한 해마 경화증입니다.[128][129] 그러나 뇌전증이 보통 해마의 이상에 의해 발생하는지, 아니면 발작의 누적 효과에 의해 해마가 손상되었는지는 아직 명확하지 않습니다. 그러나 반복적인 발작이 동물에게 인위적으로 유발되는 실험 환경에서는 해마 손상이 빈번한 결과입니다. 이것은 해마에 흥분성 글루타메이트 수용체가 집중된 결과일 수 있습니다. 과도한 흥분성은 세포 독성 및 세포 사멸을 초래할 수 있습니다.[122] 또한 해마가 일생 동안 새로운 뉴런이 계속 생성되는 부위이고,[127] 이 과정에서 이상이 생기는 것과도 관련이 있을 수 있습니다.[122]
조현병
조현병의 원인은 잘 알려져 있지 않지만, 뇌 구조의 이상이 수없이 보고되고 있습니다. 가장 철저하게 조사된 변화는 대뇌 피질을 포함하지만 해마에 대한 영향도 설명되었습니다. 많은 보고에서 조현병 환자의 해마 크기가 감소한 것을 발견했습니다.[131][132] 왼쪽 해마가 오른쪽보다 더 큰 영향을 받는 것 같습니다.[131] 주목되는 변화는 대부분 비정상적인 발달의 결과로 받아들여지고 있습니다. 해마의 변화가 조현병의 가장 중요한 특징인 정신병적 증상을 일으키는 데 어떤 역할을 하는지는 불분명합니다. 동물을 이용한 실험 작업을 바탕으로 해마 기능 장애가 기저 신경절에서 도파민 방출의 변화를 일으켜 전전두엽 피질의 정보 통합에 간접적인 영향을 미칠 수 있다고 제안되었습니다.[133] 또한 해마 기능 장애가 자주 관찰되는 장기 기억의 장애를 설명할 수 있다고 제안되었습니다.[134]
MRI 연구에서는 조현병 환자의 뇌 용적이 줄어들고 뇌실이 커진다는 것을 발견했지만, 연구원들은 그 수축이 조현병 때문인지 아니면 약물 때문인지는 알지 못합니다.[135][136] 해마와 시상의 부피가 감소하는 것으로 나타났으며, 팔리두스의 부피가 증가합니다. 피질 패턴이 변경되고 특히 전두엽과 측두엽에서 피질의 부피와 두께가 감소하는 것이 관찰되었습니다. 보이는 많은 변화가 비정상적인 신경 발달이 있다는 이론에 무게를 두는 장애의 시작에 존재한다는 것이 추가로 제안되었습니다.[137]
해마는 신경 및 생리학적 효과 모두에서 조현병 병리학의 중심으로 여겨져 왔습니다.[131] 조현병의 기저에는 비정상적인 시냅스 연결이 있다는 것이 일반적으로 받아들여지고 있습니다. 몇 가지 증거는 해마[131] 내의 시냅스 조직과 연결성의 변화와 관련이 있습니다. 많은 연구들은 해마 내의 시냅스 회로와 전전두엽 피질에서의 활동에서 기능 장애를 발견했습니다. 글루탐산 경로는 크게 영향을 받는 것으로 나타났습니다. 하위 필드 CA1은 다른 하위 필드 중 가장 관련이 적은 것으로 [131][138]보이며 CA4 및 하위 커리큘럼은 다른 곳에서 가장 관련이 있는 영역으로 보고되었습니다.[138] 리뷰는 병리 현상이 유전학, 잘못된 신경 발달 또는 비정상적인 신경 가소성 때문일 수 있다고 결론 내렸습니다. 조현병은 알려진 어떤 신경퇴행성 질환에 의한 것이 아니라는 결론이 추가로 나왔습니다.[131] 만성 조현병 노인 환자의 해마에서 산화적 DNA 손상이 상당히 증가합니다.[139]
일시적인 지구기억상실증
일시적인 세계 기억 상실은 단기 기억의 극적이고, 갑작스럽고, 일시적이고, 거의 완전한 상실입니다. 허혈, 뇌전증, 편두통, 뇌정맥 혈류 장애 등 다양한 원인이 제시되어 기억에 관여하는 해마와 같은 구조의 허혈로 이어집니다.
어떤 원인에 대한 과학적 증거도 없습니다. 그러나 에피소드 후 12시간에서 24시간 동안 촬영한 확산 가중 MRI 연구 결과 해마에 점과 같은 작은 병변이 있는 것으로 나타났습니다. 이러한 발견은 대사 스트레스에 의해 취약해진 CA1 뉴런의 가능한 의미를 시사했습니다.[140]
PTSD
일부 연구에서는 해마 부피 감소와 외상 후 스트레스 장애(PTSD)의 상관관계를 보여줍니다.[143][144][145] PTSD를 앓고 있는 베트남 전쟁 참전 용사들을 대상으로 한 연구에서는 그러한 증상을 겪지 않은 참전 용사들에 비해 해마의 부피가 20% 감소한 것으로 나타났습니다.[146] 1988년(독일 람슈타인) 에어쇼 비행기 추락 사고로 정신적 충격을 받은 만성 PTSD 환자에게서는 이 결과가 재현되지 않았습니다.[147] PTSD를 앓고 있는 베트남 참전용사의 비전투 쌍둥이 형제도 다른 대조군에 비해 해마가 작았던 것도 그 상관관계의 본질에 의문이 제기되는 경우입니다.[148] 2016년 연구에서는 해마가 작으면 외상 후 스트레스 장애의 위험이 증가하고, 해마가 크면 효과적인 치료가 가능하다는 이론을 강화했습니다.[149]
소두증
해마 위축은 소두증을 가진 쥐에서 특징지어졌으며,[150] 인간 점 돌연변이를 요약하는 WDR62 돌연변이를 가진 쥐 모델은 해마 발달과 신경 발생에 결핍을 보였습니다.[151]
다른 동물들
기타 포유류
해마는 에키드나와 같은 단일점에서 인간과 같은 영장류에 이르기까지 포유류의 범위에 걸쳐 대체로 유사한 모습을 하고 있습니다.[152] 해마 크기 대 신체 크기 비율은 광범위하게 증가하여 영장류의 경우 에키드나의 경우보다 약 두 배 더 큽니다. 그러나 신피질 대 신체 크기 비율에 가까운 곳에서는 증가하지 않습니다. 따라서 해마는 영장류보다 설치류의 피질 맨틀에서 훨씬 더 많은 부분을 차지합니다. 성인 인간의 경우 뇌 양쪽에 있는 해마의 부피는 신피질의 부피가 320~420cm인3 것에 비해 약 3.0~3.5cm입니다3.[153]
해마의 크기와 공간 기억 사이에도 일반적인 관계가 있습니다. 유사한 종들을 비교할 때, 공간 기억 능력이 더 큰 종들은 해마 부피가 더 큰 경향이 있습니다.[154] 이 관계는 성별 차이로도 확장됩니다. 수컷과 암컷이 공간 기억 능력에서 강한 차이를 보이는 종에서는 해마 부피에서도 상응하는 차이를 보이는 경향이 있습니다.[155]
기타척추동물
포유류가 아닌 종들은 포유류의 해마처럼 보이는 뇌 구조를 가지고 있지 않지만, 그들과 상동성으로 여겨지는 뇌 구조를 가지고 있습니다. 앞서 지적한 바와 같이 해마는 본질적으로 배반골의 일부입니다. 포유류만이 완전히 발달한 피질을 가지고 있지만, 팔륨이라고 불리는 그 구조는 모든 척추동물, 심지어 람프리나 먹장어와 같은 가장 원시적인 척추동물에도 존재합니다.[156] 팔륨은 보통 안쪽, 옆쪽, 등쪽의 세 구역으로 나뉩니다. 내측 팔륨은 해마의 전구체를 형성합니다. 층이 S자 모양으로 휘어지거나 치상회에 의해 감싸지지 않기 때문에 시각적으로는 해마와 닮지 않았지만, 상동성은 강한 화학적 및 기능적 친화성으로 표시됩니다. 이제 이러한 해마 유사 구조가 조류, 파충류, 어류의 공간 인지에 관여한다는 증거가 있습니다.[157]
새들
조류의 경우, 대부분의 해부학자들이 내측 고막 영역을 "조류 해마"라고 부를 정도로 대응 관계가 충분히 확립되어 있습니다.[158] 수많은 종의 새들이 강력한 공간 기술, 특히 먹이를 보관하는 새들을 가지고 있습니다. 먹이를 잡는 새들은 다른 종류의 새들보다 해마가 더 크고 해마의 손상이 공간 기억력에 장애를 일으킨다는 증거가 있습니다.[159]
물고기.
물고기에 대한 이야기는 더 복잡합니다. (현존하는 종의 대부분을 차지하는) 텔레오스트 피쉬에서는 다른 종류의 척추동물에 비해 전뇌가 왜곡되어 있습니다. 대부분의 신경해부학자들은 텔레오스트 전뇌가 양말이 뒤집힌 것처럼 본질적으로 구부러져 있다고 생각합니다. 그래서 대부분의 척추동물들은 뇌실 옆, 내부에 있는 구조물들이, 텔레오스트 피쉬의 바깥쪽에서 발견되며, 그 반대의 경우도 마찬가지입니다.[160] 이것의 결과 중 하나는 전형적인 척추동물의 안쪽 팔륨("hippocampal" zone")이 전형적인 물고기의 옆쪽 팔륨과 일치하는 것으로 생각된다는 것입니다. 여러 종류의 물고기(특히 금붕어)는 실험적으로 강력한 공간 기억 능력을 가지고 있으며 심지어 그들이 사는 지역의 "인지 지도"를 형성하는 것으로 나타났습니다.[154] 측면 팔륨의 손상이 공간 기억력을 손상시킨다는 증거가 있습니다.[161][162] 안쪽 팔륨이 상어나 가오리 같은 더 원시적인 척추동물이나 심지어는 램프리나 먹장어 등에서도 비슷한 역할을 하는지는 아직 밝혀지지 않았습니다.[163]
곤충과 연체동물
문어와 같은 몇몇 종류의 곤충들과 연체동물들도 강력한 공간 학습과 항해 능력을 가지고 있지만, 이것들은 포유류의 공간 체계와는 다르게 작용하는 것으로 보입니다. 따라서 그들이 공통의 진화적 기원을 가지고 있다고 생각할 만한 충분한 이유는 아직 없습니다. 또한 뇌 구조에서 "hipp 오캄푸스"와 유사한 것을 확인할 수 있을 만큼 충분히 유사하지도 않습니다. 하지만 어떤 사람들은 이 곤충의 버섯 몸이 해마와 비슷한 기능을 하고 있을 수도 있다고 제안했습니다.[164]
계산 모델
다양한 유기체에서 해마에 대한 철저한 연구, 형태학, 연결성, 생리학 및 계산 모델에 대한 포괄적인 데이터베이스가 수집되었습니다.[165]
추가 이미지
- 코로나 T1 MRI 영상에서 녹색으로 강조된 해마
- 시상 T1 MRI 영상에서 녹색으로 강조된 해마
- 횡단 T1 MRI 영상에서 녹색으로 강조된 해마
참고문헌
- ^ a b Martin JH (2003). "Lymbic system and cerebral circuits for emotions, learning, and memory". Neuroanatomy: text and atlas (third ed.). McGraw-Hill Companies. p. 382. ISBN 978-0071212373. Archived from the original on 2020-03-27. Retrieved 2016-12-16.
- ^ a b c Amaral D, Lavenex P (2007). "Hippocampal neuroanatomy". In Anderson P, Morris R, Amaral, Bliss T, O'Keefe J (eds.). The hippocampus book (first ed.). New York: Oxford University Press. p. 37. ISBN 978-0195100273. Archived from the original on 2020-03-16. Retrieved 2016-12-15.
- ^ a b Anderson P, Morris R, Amaral, Bliss T, O'Keefe J (2007). "The hippocampal formation". In Anderson P, Morris R, Amaral, Bliss T, O'Keefe J (eds.). The hippocampus book (first ed.). New York: Oxford University Press. p. 3. ISBN 978-0195100273. Archived from the original on 2020-03-15. Retrieved 2016-12-15.
- ^ Bachevalier J (December 2019). "Nonhuman primate models of hippocampal development and dysfunction". Proceedings of the National Academy of Sciences of the United States of America. 116 (52): 26210–26216. Bibcode:2019PNAS..11626210B. doi:10.1073/pnas.1902278116. PMC 6936345. PMID 31871159.
- ^ Bingman VP, Salas C, Rodriguez F (2009). "Evolution of the Hippocampus". In Binder MD, Hirokawa N, Windhorst U (eds.). Encyclopedia of Neuroscience. Berlin, Heidelberg: Springer. pp. 1356–1360. doi:10.1007/978-3-540-29678-2_3158. ISBN 978-3-540-29678-2.
- ^ a b "Search Results for ammon's horn". Oxford Reference. Retrieved 9 December 2021.
- ^ Colman AM (21 May 2015). "dentate gyrus". A Dictionary of Psychology. Oxford University Press. doi:10.1093/acref/9780199657681.001.0001. ISBN 978-0-19-965768-1. Retrieved 10 December 2021.
- ^ Dubois B, Hampel H, Feldman HH, Scheltens P, Aisen P, Andrieu S, et al. (March 2016). "Preclinical Alzheimer's disease: Definition, natural history, and diagnostic criteria". Alzheimer's & Dementia. 12 (3): 292–323. doi:10.1016/j.jalz.2016.02.002. PMC 6417794. PMID 27012484.
- ^ 1980년 라즐로 세레스의 준비.
- ^ a b c Duvernoy HM (2005). "Introduction". The Human Hippocampus (3rd ed.). Berlin: Springer-Verlag. p. 1. ISBN 978-3-540-23191-2. Archived from the original on 2016-08-28. Retrieved 2016-03-05.
- ^ "cornu ammonis". TheFreeDictionary.com. Archived from the original on 2016-12-20. Retrieved 2016-12-17.
- ^ Owen CM, Howard A, Binder DK (December 2009). "Hippocampus minor, calcar avis, and the Huxley-Owen debate". Neurosurgery. 65 (6): 1098–1104, discussion 1104–1105. doi:10.1227/01.neu.0000359535.84445.0b. PMID 19934969. S2CID 19663125.
- ^ Gross CG (October 1993). "Hippocampus minor and man's place in nature: a case study in the social construction of neuroanatomy". Hippocampus. 3 (4): 403–415. doi:10.1002/hipo.450030403. PMID 8269033. S2CID 15172043.
- ^ Pang CC, Kiecker C, O'Brien JT, Noble W, Chang RC (April 2019). "Ammon's Horn 2 (CA2) of the Hippocampus: A Long-Known Region with a New Potential Role in Neurodegeneration". The Neuroscientist. 25 (2): 167–180. doi:10.1177/1073858418778747. PMID 29865938. S2CID 46929253.
- ^ Roxo MR, Franceschini PR, Zubaran C, Kleber FD, Sander JW (2011). "The limbic system conception and its historical evolution". TheScientificWorldJournal. 11: 2428–2441. doi:10.1100/2011/157150. PMC 3236374. PMID 22194673.
- ^ "Chapter 9: Limbic System". www.dartmouth.edu. Archived from the original on 2007-11-05. Retrieved 2016-12-16.
- ^ Andersen P, Morris R, Amaral D, Bliss T, O'Keefe J (2006). The Hippocampus Book. Oxford University Press. ISBN 978-0199880133. Archived from the original on 13 April 2021. Retrieved 25 October 2020.
- ^ Alberts DA (2012). Dorland's illustrated medical dictionary (32nd ed.). Philadelphia, PA: Saunders/Elsevier. p. 860. ISBN 978-1416062578.
- ^ a b c Purves D (2011). Neuroscience (5th ed.). Sunderland, MA: Sinauer. pp. 730–735. ISBN 978-0878936953.
- ^ a b c d Amaral D, Lavenex P (2006). "Ch 3. Hippocampal Neuroanatomy". In Andersen P, Morris R, Amaral D, Bliss T, O'Keefe J (eds.). The Hippocampus Book. Oxford University Press. ISBN 978-0-19-510027-3.
- ^ Purves D (2011). Neuroscience (5th ed.). Sunderland, Mass.: Sinauer. p. 590. ISBN 978-0878936953.
- ^ Moser MB, Moser EI (1998). "Functional differentiation in the hippocampus". Hippocampus. 8 (6): 608–619. doi:10.1002/(SICI)1098-1063(1998)8:6<608::AID-HIPO3>3.0.CO;2-7. PMID 9882018. S2CID 32384692.
- ^ Murakami G, Tsurugizawa T, Hatanaka Y, Komatsuzaki Y, Tanabe N, Mukai H, et al. (December 2006). "Comparison between basal and apical dendritic spines in estrogen-induced rapid spinogenesis of CA1 principal neurons in the adult hippocampus". Biochemical and Biophysical Research Communications. 351 (2): 553–558. doi:10.1016/j.bbrc.2006.10.066. PMID 17070772.
CA1 neurons consist of four regions, i.e., the stratum oriens, the cell body, the stratum radiatum, and the stratum lacunosum-moleculare
- ^ Rissman RA, Nocera R, Fuller LM, Kordower JH, Armstrong DM (February 2006). "Age-related alterations in GABA(A) receptor subunits in the nonhuman primate hippocampus". Brain Research. 1073–1074: 120–130. doi:10.1016/j.brainres.2005.12.036. PMID 16430870. S2CID 13600454.
- ^ a b Eichenbaum H, Yonelinas AP, Ranganath C (2007). "The medial temporal lobe and recognition memory". Annual Review of Neuroscience. 30: 123–152. doi:10.1146/annurev.neuro.30.051606.094328. PMC 2064941. PMID 17417939.
- ^ a b Kandel ER, Schwartz JH, Jessell TM, Siegelbaum SA, Hudspeth AJ (2012). Principles of Neural Science (5th ed.). New York: McGraw-Hill Medical. pp. 1490–1491. ISBN 9780071390118. OCLC 820110349.
- ^ Purves D (2011). Neuroscience (5th ed.). Sunderland, Mass.: Sinauer. p. 171. ISBN 978-0878936953.
- ^ Byrne JH. "Section 1, Intro Chapter". Introduction to Neurons and Neuronal Networks. Neuroscience Online: An Electronic Textbook for the Neurosciences. Department of Neurobiology and Anatomy – The University of Texas Medical School at Houston. Archived from the original on 2013-12-03.
- ^ Winson J (July 1978). "Loss of hippocampal theta rhythm results in spatial memory deficit in the rat". Science. 201 (4351): 160–163. Bibcode:1978Sci...201..160W. doi:10.1126/science.663646. PMID 663646.
- ^ a b Fanselow MS, Dong HW (January 2010). "Are the dorsal and ventral hippocampus functionally distinct structures?". Neuron. 65 (1): 7–19. doi:10.1016/j.neuron.2009.11.031. PMC 2822727. PMID 20152109.
- ^ * Pothuizen HH, Zhang WN, Jongen-Rêlo AL, Feldon J, Yee BK (February 2004). "Dissociation of function between the dorsal and the ventral hippocampus in spatial learning abilities of the rat: a within-subject, within-task comparison of reference and working spatial memory". The European Journal of Neuroscience. 19 (3): 705–712. doi:10.1111/j.0953-816X.2004.03170.x. PMID 14984421. S2CID 33385275.
- ^ Jung MW, Wiener SI, McNaughton BL (December 1994). "Comparison of spatial firing characteristics of units in dorsal and ventral hippocampus of the rat". The Journal of Neuroscience. 14 (12): 7347–7356. doi:10.1523/JNEUROSCI.14-12-07347.1994. PMC 6576902. PMID 7996180.
- ^ Cenquizca LA, Swanson LW (November 2007). "Spatial organization of direct hippocampal field CA1 axonal projections to the rest of the cerebral cortex". Brain Research Reviews. 56 (1): 1–26. doi:10.1016/j.brainresrev.2007.05.002. PMC 2171036. PMID 17559940.
- ^ Anagnostaras SG, Gale GD, Fanselow MS (2002). "The hippocampus and Pavlovian fear conditioning: reply to Bast et al" (PDF). Hippocampus. 12 (4): 561–565. doi:10.1002/hipo.10071. PMID 12201641. S2CID 733197. Archived from the original (PDF) on 2005-02-16.
- ^ Finger S (2001). "Defining and controlling the circuits of emotion". Origins of neuroscience: a history of explorations into brain function. Oxford/New York: Oxford University Press. p. 286. ISBN 978-0195065039.
- ^ Finger S (2001). Origins of Neuroscience: A History of Explorations Into Brain Function. Oxford University Press US. p. 183. ISBN 978-0-19-514694-3.
- ^ van Groen T, Wyss JM (December 1990). "Extrinsic projections from area CA1 of the rat hippocampus: olfactory, cortical, subcortical, and bilateral hippocampal formation projections". The Journal of Comparative Neurology. 302 (3): 515–528. doi:10.1002/cne.903020308. PMID 1702115. S2CID 7175722.
- ^ Eichenbaum H, Otto TA, Wible CG, Piper JM (1991). "Ch 7. Building a model of the hippocampus in olfaction and memory". In Davis JL, Eichenbaum H (eds.). Olfaction. MIT Press. ISBN 978-0-262-04124-9.
- ^ Vanderwolf CH (December 2001). "The hippocampus as an olfacto-motor mechanism: were the classical anatomists right after all?". Behavioural Brain Research. 127 (1–2): 25–47. doi:10.1016/S0166-4328(01)00354-0. PMID 11718883. S2CID 21832964.
- ^ Nadel L, O'Keefe J, Black A (June 1975). "Slam on the brakes: a critique of Altman, Brunner, and Bayer's response-inhibition model of hippocampal function". Behavioral Biology. 14 (2): 151–162. doi:10.1016/S0091-6773(75)90148-0. PMID 1137539.
- ^ Gray JA, McNaughton N (2000). The Neuropsychology of Anxiety: An Enquiry into the Functions of the Septo-Hippocampal System. Oxford University Press.
- ^ Best PJ, White AM (1999). "Placing hippocampal single-unit studies in a historical context". Hippocampus. 9 (4): 346–351. doi:10.1002/(SICI)1098-1063(1999)9:4<346::AID-HIPO2>3.0.CO;2-3. PMID 10495017. S2CID 18393297.
- ^ Scoville WB, Milner B (February 1957). "Loss of recent memory after bilateral hippocampal lesions". Journal of Neurology, Neurosurgery, and Psychiatry. 20 (1): 11–21. doi:10.1136/jnnp.20.1.11. PMC 497229. PMID 13406589.
- ^ Carey B (2008-12-04). "H. M., an Unforgettable Amnesiac, Dies at 82". The New York Times. Archived from the original on 2018-06-13. Retrieved 2009-04-27.
- ^ Squire LR (January 2009). "The legacy of patient H.M. for neuroscience". Neuron. 61 (1): 6–9. doi:10.1016/j.neuron.2008.12.023. PMC 2649674. PMID 19146808.
- ^ a b Squire LR (April 1992). "Memory and the hippocampus: a synthesis from findings with rats, monkeys, and humans". Psychological Review. 99 (2): 195–231. doi:10.1037/0033-295X.99.2.195. PMID 1594723. S2CID 14104324.
- ^ a b Eichenbaum H, Cohen NJ (1993). Memory, Amnesia, and the Hippocampal System. MIT Press.
- ^ Kovács KA (September 2020). "Episodic Memories: How do the Hippocampus and the Entorhinal Ring Attractors Cooperate to Create Them?". Frontiers in Systems Neuroscience. 14: 559168. doi:10.3389/fnsys.2020.559186. PMC 7511719. PMID 33013334.
- ^ O'Keefe J, Dostrovsky J (November 1971). "The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat". Brain Research. 34 (1): 171–175. doi:10.1016/0006-8993(71)90358-1. PMID 5124915.
- ^ a b O'Keefe J, Nadel L (1978). The Hippocampus as a Cognitive Map. Oxford University Press. Archived from the original on 2011-03-24. Retrieved 2008-10-23.
- ^ a b c d Moser EI, Kropff E, Moser MB (2008). "Place cells, grid cells, and the brain's spatial representation system". Annual Review of Neuroscience. 31: 69–89. doi:10.1146/annurev.neuro.31.061307.090723. PMID 18284371. S2CID 16036900.
- ^ Schiller D, Eichenbaum H, Buffalo EA, Davachi L, Foster DJ, Leutgeb S, et al. (October 2015). "Memory and Space: Towards an Understanding of the Cognitive Map". The Journal of Neuroscience. 35 (41): 13904–13911. doi:10.1523/JNEUROSCI.2618-15.2015. PMC 6608181. PMID 26468191.
- ^ Eichenbaum H (December 2001). "The hippocampus and declarative memory: Cognitive mechanisms and neural codes". Behavioural Brain Research. 127 (1–2): 199–207. doi:10.1016/s0166-4328(01)00365-5. PMID 11718892. S2CID 20843130.
- ^ Buzsáki G, Moser EI (February 2013). "Memory, navigation and theta rhythm in the hippocampal-entorhinal system". Nature Neuroscience. 16 (2): 130–138. doi:10.1038/nn.3304. PMC 4079500. PMID 23354386.
- ^ a b Ito R, Lee AC (October 2016). "The role of the hippocampus in approach-avoidance conflict decision-making: Evidence from rodent and human studies". Behavioural Brain Research. 313: 345–357. doi:10.1016/j.bbr.2016.07.039. PMID 27457133.
- ^ a b Squire LR, Schacter DL (2002). The Neuropsychology of Memory. Guilford Press.
- ^ VanElzakker M, Fevurly RD, Breindel T, Spencer RL (December 2008). "Environmental novelty is associated with a selective increase in Fos expression in the output elements of the hippocampal formation and the perirhinal cortex". Learning & Memory. 15 (12): 899–908. doi:10.1101/lm.1196508. PMC 2632843. PMID 19050162.
- ^ Gluck M, Mercado E, Myers C (2014). Learning and Memory From Brain to Behavior (Second ed.). New York: Kevin Feyen. p. 416. ISBN 978-1429240147.
- ^ Di Gennaro G, Grammaldo LG, Quarato PP, Esposito V, Mascia A, Sparano A, et al. (June 2006). "Severe amnesia following bilateral medial temporal lobe damage occurring on two distinct occasions". Neurological Sciences. 27 (2): 129–133. doi:10.1007/s10072-006-0614-y. PMID 16816912. S2CID 7741607.
- ^ Virley D, Ridley RM, Sinden JD, Kershaw TR, Harland S, Rashid T, et al. (December 1999). "Primary CA1 and conditionally immortal MHP36 cell grafts restore conditional discrimination learning and recall in marmosets after excitotoxic lesions of the hippocampal CA1 field". Brain: A Journal of Neurology. 122 (12): 2321–2335. doi:10.1093/brain/122.12.2321. PMID 10581225.
- ^ Sozinova EV, Kozlovskiy SA, Vartanov AV, Skvortsova VB, Pirogov YA, Anisimov NV, et al. (September 2008). "The role of hippocampal parts in verbal memory and activation processes". International Journal of Psychophysiology. 69 (3): 312. doi:10.1016/j.ijpsycho.2008.05.328.
- ^ Diana RA, Yonelinas AP, Ranganath C (September 2007). "Imaging recollection and familiarity in the medial temporal lobe: a three-component model". Trends in Cognitive Sciences. 11 (9): 379–386. doi:10.1016/j.tics.2007.08.001. PMID 17707683. S2CID 1443998.
- ^ Frankland PW, Bontempi B, Talton LE, Kaczmarek L, Silva AJ (May 2004). "The involvement of the anterior cingulate cortex in remote contextual fear memory". Science. 304 (5672): 881–883. Bibcode:2004Sci...304..881F. doi:10.1126/science.1094804. PMID 15131309. S2CID 15893863.
- ^ Duke CG, Kennedy AJ, Gavin CF, Day JJ, Sweatt JD (July 2017). "Experience-dependent epigenomic reorganization in the hippocampus". Learning & Memory. 24 (7): 278–288. doi:10.1101/lm.045112.117. PMC 5473107. PMID 28620075.
- ^ Matsumura N, Nishijo H, Tamura R, Eifuku S, Endo S, Ono T (March 1999). "Spatial- and task-dependent neuronal responses during real and virtual translocation in the monkey hippocampal formation". The Journal of Neuroscience. 19 (6): 2381–2393. doi:10.1523/JNEUROSCI.19-06-02381.1999. PMC 6782547. PMID 10066288.
- ^ Rolls ET, Xiang JZ (2006). "Spatial view cells in the primate hippocampus and memory recall". Reviews in the Neurosciences. 17 (1–2): 175–200. doi:10.1515/REVNEURO.2006.17.1-2.175. PMID 16703951. S2CID 147636287.
- ^ Smith DM, Mizumori SJ (2006). "Hippocampal place cells, context, and episodic memory". Hippocampus. 16 (9): 716–729. CiteSeerX 10.1.1.141.1450. doi:10.1002/hipo.20208. PMID 16897724. S2CID 720574.
- ^ O'Keefe J, Recce ML (July 1993). "Phase relationship between hippocampal place units and the EEG theta rhythm". Hippocampus. 3 (3): 317–330. doi:10.1002/hipo.450030307. PMID 8353611. S2CID 6539236.
- ^ Ekstrom AD, Kahana MJ, Caplan JB, Fields TA, Isham EA, Newman EL, et al. (September 2003). "Cellular networks underlying human spatial navigation" (PDF). Nature. 425 (6954): 184–188. Bibcode:2003Natur.425..184E. CiteSeerX 10.1.1.408.4443. doi:10.1038/nature01964. PMID 12968182. S2CID 1673654. Archived from the original on 2021-10-20. Retrieved 2013-01-24.
- ^ Duarte IC, Ferreira C, Marques J, Castelo-Branco M (2014-01-27). "Anterior/posterior competitive deactivation/activation dichotomy in the human hippocampus as revealed by a 3D navigation task". PLOS ONE. 9 (1): e86213. Bibcode:2014PLoSO...986213D. doi:10.1371/journal.pone.0086213. PMC 3903506. PMID 24475088.
- ^ Maguire EA, Gadian DG, Johnsrude IS, Good CD, Ashburner J, Frackowiak RS, et al. (April 2000). "Navigation-related structural change in the hippocampi of taxi drivers". Proceedings of the National Academy of Sciences of the United States of America. 97 (8): 4398–4403. Bibcode:2000PNAS...97.4398M. doi:10.1073/pnas.070039597. PMC 18253. PMID 10716738.
- ^ Leporé N, Shi Y, Lepore F, Fortin M, Voss P, Chou YY, et al. (July 2009). "Pattern of hippocampal shape and volume differences in blind subjects". NeuroImage. 46 (4): 949–957. doi:10.1016/j.neuroimage.2009.01.071. PMC 2736880. PMID 19285559.
- ^ Chiu YC, Algase D, Whall A, Liang J, Liu HC, Lin KN, et al. (2004). "Getting lost: directed attention and executive functions in early Alzheimer's disease patients". Dementia and Geriatric Cognitive Disorders. 17 (3): 174–180. doi:10.1159/000076353. PMID 14739541. S2CID 20454273.
- ^ Morris RG, Garrud P, Rawlins JN, O'Keefe J (June 1982). "Place navigation impaired in rats with hippocampal lesions". Nature. 297 (5868): 681–683. Bibcode:1982Natur.297..681M. doi:10.1038/297681a0. PMID 7088155. S2CID 4242147.
- ^ Sutherland RJ, Kolb B, Whishaw IQ (August 1982). "Spatial mapping: definitive disruption by hippocampal or medial frontal cortical damage in the rat". Neuroscience Letters. 31 (3): 271–276. doi:10.1016/0304-3940(82)90032-5. PMID 7133562. S2CID 20203374.
- ^ Sutherland RJ, Weisend MP, Mumby D, Astur RS, Hanlon FM, Koerner A, et al. (2001). "Retrograde amnesia after hippocampal damage: recent vs. remote memories in two tasks". Hippocampus. 11 (1): 27–42. doi:10.1002/1098-1063(2001)11:1<27::AID-HIPO1017>3.0.CO;2-4. PMID 11261770. S2CID 142515.
- ^ Clark RE, Broadbent NJ, Squire LR (2005). "Hippocampus and remote spatial memory in rats". Hippocampus. 15 (2): 260–272. doi:10.1002/hipo.20056. PMC 2754168. PMID 15523608.
- ^ Solstad T, Boccara CN, Kropff E, Moser MB, Moser EI (December 2008). "Representation of geometric borders in the entorhinal cortex". Science. 322 (5909): 1865–1868. Bibcode:2008Sci...322.1865S. doi:10.1126/science.1166466. PMID 19095945. S2CID 260976755.
- ^ a b O'Neil EB, Newsome RN, Li IH, Thavabalasingam S, Ito R, Lee AC (November 2015). "Examining the Role of the Human Hippocampus in Approach-Avoidance Decision Making Using a Novel Conflict Paradigm and Multivariate Functional Magnetic Resonance Imaging". The Journal of Neuroscience. 35 (45): 15039–15049. doi:10.1523/jneurosci.1915-15.2015. PMC 6605357. PMID 26558775.
- ^ Quiroga RQ, Reddy L, Kreiman G, Koch C, Fried I (June 2005). "Invariant visual representation by single neurons in the human brain". Nature. 435 (7045): 1102–1107. Bibcode:2005Natur.435.1102Q. doi:10.1038/nature03687. PMID 15973409. S2CID 1234637.
- ^ Sliwa J, Planté A, Duhamel JR, Wirth S (March 2016). "Independent Neuronal Representation of Facial and Vocal Identity in the Monkey Hippocampus and Inferotemporal Cortex". Cerebral Cortex. 26 (3): 950–966. doi:10.1093/cercor/bhu257. PMID 25405945.
- ^ Hitti FL, Siegelbaum SA (April 2014). "The hippocampal CA2 region is essential for social memory". Nature. 508 (7494): 88–92. Bibcode:2014Natur.508...88H. doi:10.1038/nature13028. PMC 4000264. PMID 24572357.
- ^ Okuyama T, Kitamura T, Roy DS, Itohara S, Tonegawa S (September 2016). "Ventral CA1 neurons store social memory". Science. 353 (6307): 1536–1541. Bibcode:2016Sci...353.1536O. doi:10.1126/science.aaf7003. PMC 5493325. PMID 27708103.
- ^ Meira T, Leroy F, Buss EW, Oliva A, Park J, Siegelbaum SA (October 2018). "A hippocampal circuit linking dorsal CA2 to ventral CA1 critical for social memory dynamics". Nature Communications. 9 (1): 4163. Bibcode:2018NatCo...9.4163M. doi:10.1038/s41467-018-06501-w. PMC 6178349. PMID 30301899.
- ^ a b Buzsáki G (2006). Rhythms of the Brain. Oxford University Press. ISBN 978-0-19-530106-9.
- ^ a b Buzsáki G, Chen LS, Gage FH (1990). "Chapter 19 Chapter Spatial organization of physiological activity in the hippocampal region: Relevance to memory formation". Spatial organization of physiological activity in the hippocampal region: relevance to memory formation. Progress in Brain Research. Vol. 83. pp. 257–268. doi:10.1016/S0079-6123(08)61255-8. ISBN 9780444811493. PMID 2203100.
- ^ a b Skaggs WE, McNaughton BL, Permenter M, Archibeque M, Vogt J, Amaral DG, et al. (August 2007). "EEG sharp waves and sparse ensemble unit activity in the macaque hippocampus". Journal of Neurophysiology. 98 (2): 898–910. doi:10.1152/jn.00401.2007. PMID 17522177. S2CID 941428.
- ^ Buzsáki G (January 2002). "Theta oscillations in the hippocampus". Neuron. 33 (3): 325–340. doi:10.1016/S0896-6273(02)00586-X. PMID 11832222. S2CID 15410690.
- ^ Lubenov EV, Siapas AG (May 2009). "Hippocampal theta oscillations are travelling waves" (PDF). Nature. 459 (7246): 534–539. Bibcode:2009Natur.459..534L. doi:10.1038/nature08010. PMID 19489117. S2CID 4429491. Archived (PDF) from the original on 2018-07-23. Retrieved 2019-07-13.
- ^ Komisaruk BR (March 1970). "Synchrony between limbic system theta activity and rhythmical behavior in rats". Journal of Comparative and Physiological Psychology. 70 (3): 482–492. doi:10.1037/h0028709. PMID 5418472.
- ^ Cantero JL, Atienza M, Stickgold R, Kahana MJ, Madsen JR, Kocsis B (November 2003). "Sleep-dependent theta oscillations in the human hippocampus and neocortex". The Journal of Neuroscience. 23 (34): 10897–10903. doi:10.1523/JNEUROSCI.23-34-10897.2003. PMC 6740994. PMID 14645485.
- ^ Vanderwolf CH (April 1969). "Hippocampal electrical activity and voluntary movement in the rat". Electroencephalography and Clinical Neurophysiology. 26 (4): 407–418. doi:10.1016/0013-4694(69)90092-3. PMID 4183562.
- ^ Huerta PT, Lisman JE (August 1993). "Heightened synaptic plasticity of hippocampal CA1 neurons during a cholinergically induced rhythmic state". Nature. 364 (6439): 723–725. Bibcode:1993Natur.364..723H. doi:10.1038/364723a0. PMID 8355787. S2CID 4358000.
- ^ Numan R, Feloney MP, Pham KH, Tieber LM (December 1995). "Effects of medial septal lesions on an operant go/no-go delayed response alternation task in rats". Physiology & Behavior. 58 (6): 1263–1271. doi:10.1016/0031-9384(95)02044-6. PMID 8623030. S2CID 876694. Archived from the original on 2021-04-27. Retrieved 2020-03-09.
- ^ Kahana MJ, Seelig D, Madsen JR (December 2001). "Theta returns". Current Opinion in Neurobiology. 11 (6): 739–744. doi:10.1016/S0959-4388(01)00278-1. PMID 11741027. S2CID 43829235.
- ^ Buzsáki G (November 1986). "Hippocampal sharp waves: their origin and significance". Brain Research. 398 (2): 242–252. doi:10.1016/0006-8993(86)91483-6. PMID 3026567. S2CID 37242634.
- ^ Wilson MA, McNaughton BL (July 1994). "Reactivation of hippocampal ensemble memories during sleep". Science. 265 (5172): 676–679. Bibcode:1994Sci...265..676W. doi:10.1126/science.8036517. PMID 8036517. S2CID 890257.
- ^ Jackson JC, Johnson A, Redish AD (November 2006). "Hippocampal sharp waves and reactivation during awake states depend on repeated sequential experience". The Journal of Neuroscience. 26 (48): 12415–12426. doi:10.1523/JNEUROSCI.4118-06.2006. PMC 6674885. PMID 17135403.
- ^ Sutherland GR, McNaughton B (April 2000). "Memory trace reactivation in hippocampal and neocortical neuronal ensembles". Current Opinion in Neurobiology. 10 (2): 180–186. doi:10.1016/S0959-4388(00)00079-9. PMID 10753801. S2CID 146539.
- ^ Buzsáki G (January 1989). "Two-stage model of memory trace formation: a role for "noisy" brain states". Neuroscience. 31 (3): 551–570. doi:10.1016/0306-4522(89)90423-5. PMID 2687720. S2CID 23957660.
- ^ Buzsáki G (1989). "Two-stage model of memory trace formation: a role for "noisy" brain states". Neuroscience. 31 (3): 551–570. doi:10.1016/0306-4522(89)90423-5. PMID 2687720. S2CID 23957660.
- ^ Girardeau G, Benchenane K, Wiener SI, Buzsáki G, Zugaro MB (October 2009). "Selective suppression of hippocampal ripples impairs spatial memory". Nature Neuroscience. 12 (10): 1222–1223. doi:10.1038/nn.2384. PMID 19749750. S2CID 23637142.
- ^ Ego-Stengel V, Wilson MA (January 2010). "Disruption of ripple-associated hippocampal activity during rest impairs spatial learning in the rat". Hippocampus. 20 (1): 1–10. doi:10.1002/hipo.20707. PMC 2801761. PMID 19816984.
- ^ Kovács KA, O'Neill J, Schoenenberger P, Penttonen M, Ranguel Guerrero DK, Csicsvari J (19 Nov 2016). "Optogenetically Blocking Sharp Wave Ripple Events in Sleep Does Not Interfere with the Formation of Stable Spatial Representation in the CA1 Area of the Hippocampus". PLOS ONE. 11 (10): e0164675. Bibcode:2016PLoSO..1164675K. doi:10.1371/journal.pone.0164675. PMC 5070819. PMID 27760158.
- ^ Ramón y Cajal S (1894). "The Croonian Lecture: La Fine Structure des Centres Nerveux". Proceedings of the Royal Society. 55 (331–335): 444–468. Bibcode:1894RSPS...55..444C. doi:10.1098/rspl.1894.0063.
- ^ Hebb DO (1949). Organization of Behavior: a Neuropsychological Theory. New York: John Wiley. ISBN 0-471-36727-3.
- ^ Bliss TV, Lomo T (July 1973). "Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path". The Journal of Physiology. 232 (2): 331–356. doi:10.1113/jphysiol.1973.sp010273. PMC 1350458. PMID 4727084.
- ^ a b Malenka RC, Bear MF (September 2004). "LTP and LTD: an embarrassment of riches". Neuron. 44 (1): 5–21. doi:10.1016/j.neuron.2004.09.012. PMID 15450156. S2CID 79844.
- ^ Cooke SF, Bliss TV (July 2006). "Plasticity in the human central nervous system". Brain. 129 (Pt 7): 1659–1673. doi:10.1093/brain/awl082. PMID 16672292.
- ^ a b Nakazawa K, McHugh TJ, Wilson MA, Tonegawa S (May 2004). "NMDA receptors, place cells and hippocampal spatial memory". Nature Reviews. Neuroscience. 5 (5): 361–372. doi:10.1038/nrn1385. PMID 15100719. S2CID 7728258.
- ^ Hampel H, Bürger K, Teipel SJ, Bokde AL, Zetterberg H, Blennow K (January 2008). "Core candidate neurochemical and imaging biomarkers of Alzheimer's disease". Alzheimer's & Dementia. 4 (1): 38–48. doi:10.1016/j.jalz.2007.08.006. PMID 18631949. S2CID 11395948.
- ^ a b c d Prull MW, Gabrieli JD, Bunge SA (2000). "Ch 2. Age-related changes in memory: A cognitive neuroscience perspective". In Craik FI, Salthouse TA (eds.). The handbook of aging and cognition. Erlbaum. ISBN 978-0-8058-2966-2.
- ^ Erickson KI, Voss MW, Prakash RS, Basak C, Szabo A, Chaddock L, et al. (February 2011). "Exercise training increases size of hippocampus and improves memory". Proceedings of the National Academy of Sciences of the United States of America. 108 (7): 3017–3022. Bibcode:2011PNAS..108.3017E. doi:10.1073/pnas.1015950108. PMC 3041121. PMID 21282661.
- ^ Joëls M (April 2008). "Functional actions of corticosteroids in the hippocampus". European Journal of Pharmacology. 583 (2–3): 312–321. doi:10.1016/j.ejphar.2007.11.064. PMID 18275953.
- ^ Woon FL, Sood S, Hedges DW (October 2010). "Hippocampal volume deficits associated with exposure to psychological trauma and posttraumatic stress disorder in adults: a meta-analysis". Progress in Neuro-Psychopharmacology & Biological Psychiatry. 34 (7): 1181–1188. doi:10.1016/j.pnpbp.2010.06.016. PMID 20600466. S2CID 34575365.
- ^ Karl A, Schaefer M, Malta LS, Dörfel D, Rohleder N, Werner A (2006). "A meta-analysis of structural brain abnormalities in PTSD". Neuroscience and Biobehavioral Reviews. 30 (7): 1004–1031. doi:10.1016/j.neubiorev.2006.03.004. PMID 16730374. S2CID 15511760.
- ^ Wright IC, Rabe-Hesketh S, Woodruff PW, David AS, Murray RM, Bullmore ET (January 2000). "Meta-analysis of regional brain volumes in schizophrenia". The American Journal of Psychiatry. 157 (1): 16–25. doi:10.1176/ajp.157.1.16. PMID 10618008. S2CID 22522434.
- ^ www.depressiondatabase.org 의 MRI 데이터베이스도 참조하십시오. Wayback Machine에서 아카이브된 2011-09-29.
- ^ Decker AL, Duncan K, Finn AS, Mabbott DJ (August 2020). "Children's family income is associated with cognitive function and volume of anterior not posterior hippocampus". Nature Communications. 11 (1): 4040. Bibcode:2020NatCo..11.4040D. doi:10.1038/s41467-020-17854-6. PMC 7423938. PMID 32788583.
- ^ Campbell S, Macqueen G (November 2004). "The role of the hippocampus in the pathophysiology of major depression". Journal of Psychiatry & Neuroscience. 29 (6): 417–426. PMC 524959. PMID 15644983.
- ^ a b Starkman MN, Giordani B, Gebarski SS, Berent S, Schork MA, Schteingart DE (December 1999). "Decrease in cortisol reverses human hippocampal atrophy following treatment of Cushing's disease". Biological Psychiatry. 46 (12): 1595–1602. doi:10.1016/s0006-3223(99)00203-6. PMID 10624540. S2CID 7294913.
- ^ a b c d e Institute of Medicine (US) Forum on Neuroscience and Nervous System Disorders (2011). Overview of the Glutamatergic System. National Academies Press (US). Archived from the original on 1 September 2018. Retrieved 5 February 2017.
- ^ Garcia-Segura LM (2009). Hormones and Brain Plasticity. Oxford University Press US. ISBN 978-0-19-532661-1.
- ^ Conrad CD (2008). "Chronic stress-induced hippocampal vulnerability: the glucocorticoid vulnerability hypothesis". Reviews in the Neurosciences. 19 (6): 395–411. doi:10.1515/revneuro.2008.19.6.395. PMC 2746750. PMID 19317179.
- ^ Ortiz JB, McLaughlin KJ, Hamilton GF, Baran SE, Campbell AN, Conrad CD (August 2013). "Cholesterol and perhaps estradiol protect against corticosterone-induced hippocampal CA3 dendritic retraction in gonadectomized female and male rats". Neuroscience. 246: 409–421. doi:10.1016/j.neuroscience.2013.04.027. PMC 3703463. PMID 23618757.
- ^ Consiglio AR, Ramos AL, Henriques JA, Picada JN (May 2010). "DNA brain damage after stress in rats". Progress in Neuro-Psychopharmacology & Biological Psychiatry. 34 (4): 652–656. doi:10.1016/j.pnpbp.2010.03.004. PMID 20226828. S2CID 38959073.
- ^ a b c Kuruba R, Hattiangady B, Shetty AK (January 2009). "Hippocampal neurogenesis and neural stem cells in temporal lobe epilepsy". Epilepsy & Behavior. 14 (Suppl 1): 65–73. doi:10.1016/j.yebeh.2008.08.020. PMC 2654382. PMID 18796338.
- ^ Thom M (August 2014). "Review: Hippocampal sclerosis in epilepsy: a neuropathology review". Neuropathology and Applied Neurobiology. 40 (5): 520–543. doi:10.1111/nan.12150. PMC 4265206. PMID 24762203.
- ^ Chang BS, Lowenstein DH (September 2003). "Epilepsy". The New England Journal of Medicine. 349 (13): 1257–1266. doi:10.1056/NEJMra022308. PMID 14507951.
- ^ Sloviter RS (February 2005). "The neurobiology of temporal lobe epilepsy: too much information, not enough knowledge". Comptes Rendus Biologies. 328 (2): 143–153. doi:10.1016/j.crvi.2004.10.010. PMID 15771000.
- ^ a b c d e f Harrison PJ (June 2004). "The hippocampus in schizophrenia: a review of the neuropathological evidence and its pathophysiological implications". Psychopharmacology. 174 (1): 151–162. doi:10.1007/s00213-003-1761-y. PMID 15205886. S2CID 12388920.
- ^ Antoniades M, Schoeler T, Radua J, Valli I, Allen P, Kempton MJ, et al. (March 2018). "Verbal learning and hippocampal dysfunction in schizophrenia: A meta-analysis" (PDF). Neuroscience and Biobehavioral Reviews. 86: 166–175. doi:10.1016/j.neubiorev.2017.12.001. PMC 5818020. PMID 29223768. Archived (PDF) from the original on 2018-07-25. Retrieved 2018-11-23.
- ^ Goto Y, Grace AA (November 2008). "Limbic and cortical information processing in the nucleus accumbens". Trends in Neurosciences. 31 (11): 552–558. doi:10.1016/j.tins.2008.08.002. PMC 2884964. PMID 18786735.
- ^ Boyer P, Phillips JL, Rousseau FL, Ilivitsky S (April 2007). "Hippocampal abnormalities and memory deficits: new evidence of a strong pathophysiological link in schizophrenia". Brain Research Reviews. 54 (1): 92–112. doi:10.1016/j.brainresrev.2006.12.008. PMID 17306884. S2CID 44832178.
- ^ Ho BC, Andreasen NC, Ziebell S, Pierson R, Magnotta V (February 2011). "Long-term antipsychotic treatment and brain volumes: a longitudinal study of first-episode schizophrenia". Archives of General Psychiatry. 68 (2): 128–137. doi:10.1001/archgenpsychiatry.2010.199. PMC 3476840. PMID 21300943.
- ^ Fusar-Poli P, Smieskova R, Kempton MJ, Ho BC, Andreasen NC, Borgwardt S (September 2013). "Progressive brain changes in schizophrenia related to antipsychotic treatment? A meta-analysis of longitudinal MRI studies". Neuroscience and Biobehavioral Reviews. 37 (8): 1680–1691. doi:10.1016/j.neubiorev.2013.06.001. PMC 3964856. PMID 23769814.
- ^ Haukvik UK, Hartberg CB, Agartz I (April 2013). "Schizophrenia--what does structural MRI show?". Tidsskrift for den Norske Laegeforening. 133 (8): 850–853. doi:10.4045/tidsskr.12.1084. PMID 23612107.
- ^ a b Harrison PJ, Eastwood SL (2001). "Neuropathological studies of synaptic connectivity in the hippocampal formation in schizophrenia". Hippocampus. 11 (5): 508–519. doi:10.1002/hipo.1067. PMID 11732704. S2CID 2502525.
- ^ Nishioka N, Arnold SE (2004). "Evidence for oxidative DNA damage in the hippocampus of elderly patients with chronic schizophrenia". The American Journal of Geriatric Psychiatry. 12 (2): 167–175. doi:10.1097/00019442-200403000-00008. PMID 15010346.
- ^ a b Szabo K (2014). "Transient global amnesia". The Hippocampus in Clinical Neuroscience. Frontiers of Neurology and Neuroscience. Vol. 34. pp. 143–149. doi:10.1159/000356431. ISBN 978-3-318-02567-5. PMID 24777137. Archived from the original on 2021-09-23. Retrieved 2018-08-15.
- ^ Lewis SL (August 1998). "Aetiology of transient global amnesia". Lancet. 352 (9125): 397–399. doi:10.1016/S0140-6736(98)01442-1. PMID 9717945. S2CID 12779088.
- ^ Chung CP, Hsu HY, Chao AC, Chang FC, Sheng WY, Hu HH (June 2006). "Detection of intracranial venous reflux in patients of transient global amnesia". Neurology. 66 (12): 1873–1877. doi:10.1212/01.wnl.0000219620.69618.9d. PMID 16801653. S2CID 39724390.
- ^ Bonne O, Vythilingam M, Inagaki M, Wood S, Neumeister A, Nugent AC, et al. (July 2008). "Reduced posterior hippocampal volume in posttraumatic stress disorder". The Journal of Clinical Psychiatry. 69 (7): 1087–1091. doi:10.4088/jcp.v69n0707. PMC 2684983. PMID 18572983.
- ^ Apfel BA, Ross J, Hlavin J, Meyerhoff DJ, Metzler TJ, Marmar CR, et al. (March 2011). "Hippocampal volume differences in Gulf War veterans with current versus lifetime posttraumatic stress disorder symptoms". Biological Psychiatry. 69 (6): 541–548. doi:10.1016/j.biopsych.2010.09.044. PMC 3259803. PMID 21094937. Archived from the original on 2019-12-04. Retrieved 2017-08-14.
- ^ "Hippocampal volume and resilience in posttramatic stress disorder". ScienceDaily. 23 March 2011. Archived from the original on 4 December 2019. Retrieved 14 August 2017.
- ^ Carlson NR (2014). Physiology of Behavior (11 ed.). Pearson Education. p. 624. ISBN 978-1-292-02320-5.
- ^ Jatzko A, Rothenhöfer S, Schmitt A, Gaser C, Demirakca T, Weber-Fahr W, et al. (August 2006). "Hippocampal volume in chronic posttraumatic stress disorder (PTSD): MRI study using two different evaluation methods" (PDF). Journal of Affective Disorders. 94 (1–3): 121–126. doi:10.1016/j.jad.2006.03.010. PMID 16701903. Archived (PDF) from the original on 2013-10-19. Retrieved 2017-08-14.
- ^ Stern R (September–October 2019). "The New Phrenology". Skeptical Inquirer. Vol. 43, no. 5. Center for Inquiry. pp. 52–56. Archived from the original on 2020-04-29. Retrieved 2020-03-20.
- ^ Rubin M, Shvil E, Papini S, Chhetry BT, Helpman L, Markowitz JC, et al. (June 2016). "Greater hippocampal volume is associated with PTSD treatment response". Psychiatry Research. Neuroimaging. 252: 36–39. doi:10.1016/j.pscychresns.2016.05.001. PMC 4896219. PMID 27179314.
- ^ Bilgüvar K, Oztürk AK, Louvi A, Kwan KY, Choi M, Tatli B, et al. (September 2010). "Whole-exome sequencing identifies recessive WDR62 mutations in severe brain malformations". Nature. 467 (7312): 207–210. Bibcode:2010Natur.467..207B. doi:10.1038/nature09327. PMC 3129007. PMID 20729831.
- ^ Shohayeb B, Ho UY, Hassan H, Piper M, Ng DC (2020). "The Spindle-Associated Microcephaly Protein, WDR62, Is Required for Neurogenesis and Development of the Hippocampus". Frontiers in Cell and Developmental Biology. 8: 549353. doi:10.3389/fcell.2020.549353. PMC 7517699. PMID 33042990.
- ^ West MJ (1990). "Chapter 2 Stereological studies of the hippocampus: A comparison of the hippocampal subdivisions of diverse species including hedgehogs, laboratory rodents, wild mice and men". Stereological studies of the hippocampus: a comparison of the hippocampal subdivisions of diverse species including hedgehogs, laboratory rodents, wild mice and men. Progress in Brain Research. Vol. 83. pp. 13–36. doi:10.1016/S0079-6123(08)61238-8. ISBN 9780444811493. PMID 2203095.
- ^ * Suzuki M, Hagino H, Nohara S, Zhou SY, Kawasaki Y, Takahashi T, et al. (February 2005). "Male-specific volume expansion of the human hippocampus during adolescence". Cerebral Cortex. 15 (2): 187–193. doi:10.1093/cercor/bhh121. PMID 15238436.
- ^ a b Jacobs LF (2003). "The evolution of the cognitive map". Brain, Behavior and Evolution. 62 (2): 128–139. doi:10.1159/000072443. PMID 12937351. S2CID 16102408.
- ^ Jacobs LF, Gaulin SJ, Sherry DF, Hoffman GE (August 1990). "Evolution of spatial cognition: sex-specific patterns of spatial behavior predict hippocampal size". Proceedings of the National Academy of Sciences of the United States of America. 87 (16): 6349–6352. Bibcode:1990PNAS...87.6349J. doi:10.1073/pnas.87.16.6349. PMC 54531. PMID 2201026.
- ^ Aboitiz F, Morales D, Montiel J (October 2003). "The evolutionary origin of the mammalian isocortex: towards an integrated developmental and functional approach". The Behavioral and Brain Sciences. 26 (5): 535–552. doi:10.1017/S0140525X03000128. PMID 15179935. S2CID 6599761.
- ^ Rodríguez F, López JC, Vargas JP, Broglio C, Gómez Y, Salas C (2002). "Spatial memory and hippocampal pallium through vertebrate evolution: insights from reptiles and teleost fish". Brain Research Bulletin. 57 (3–4): 499–503. doi:10.1016/S0361-9230(01)00682-7. PMID 11923018. S2CID 40858078.
- ^ Colombo M, Broadbent N (June 2000). "Is the avian hippocampus a functional homologue of the mammalian hippocampus?". Neuroscience and Biobehavioral Reviews. 24 (4): 465–484. doi:10.1016/S0149-7634(00)00016-6. PMID 10817844. S2CID 22686204.
- ^ Shettleworth SJ (2003). "Memory and hippocampal specialization in food-storing birds: challenges for research on comparative cognition". Brain, Behavior and Evolution. 62 (2): 108–116. doi:10.1159/000072441. PMID 12937349. S2CID 23546600.
- ^ Nieuwenhuys R (1982). "An Overview of the Organization of the Brain of Actinopterygian Fishes". Am. Zool. 22 (2): 287–310. doi:10.1093/icb/22.2.287.
- ^ Portavella M, Vargas JP, Torres B, Salas C (2002). "The effects of telencephalic pallial lesions on spatial, temporal, and emotional learning in goldfish". Brain Research Bulletin. 57 (3–4): 397–399. doi:10.1016/S0361-9230(01)00699-2. PMID 11922997. S2CID 41144358.
- ^ Vargas JP, Bingman VP, Portavella M, López JC (November 2006). "Telencephalon and geometric space in goldfish". The European Journal of Neuroscience. 24 (10): 2870–2878. doi:10.1111/j.1460-9568.2006.05174.x. PMID 17156211. S2CID 23884328.
- ^ Docampo-Seara A, Lagadec R, Mazan S, Rodríguez MA, Quintana-Urzainqui I, Candal E (November 2018). "Study of pallial neurogenesis in shark embryos and the evolutionary origin of the subventricular zone". Brain Structure & Function. 223 (8): 3593–3612. doi:10.1007/s00429-018-1705-2. hdl:10347/17636. PMID 29980930.
- ^ Mizunami M, Weibrecht JM, Strausfeld NJ (December 1998). "Mushroom bodies of the cockroach: their participation in place memory". The Journal of Comparative Neurology. 402 (4): 520–537. doi:10.1002/(SICI)1096-9861(19981228)402:4<520::AID-CNE6>3.0.CO;2-K. PMID 9862324. S2CID 44384958.
- ^ "The Hippocampome".
추가읽기
![]() 이 기사는 2016년 외부 학술 동료 심사를 위해 위키저널 오브 메디슨에 제출되었습니다(심사자 보고서). 업데이트된 콘텐츠는 CC-BY-SA-3.0 라이선스(2017)로 위키백과 페이지에 재통합되었습니다. 검토한 레코드 버전은 다음과 같습니다.
이 기사는 2016년 외부 학술 동료 심사를 위해 위키저널 오브 메디슨에 제출되었습니다(심사자 보고서). 업데이트된 콘텐츠는 CC-BY-SA-3.0 라이선스(2017)로 위키백과 페이지에 재통합되었습니다. 검토한 레코드 버전은 다음과 같습니다.
- Broglio C, Gómez A, Durán E, Ocaña FM, Jiménez-Moya F, Rodríguez F, et al. (September 2005). "Hallmarks of a common forebrain vertebrate plan: specialized pallial areas for spatial, temporal and emotional memory in actinopterygian fish". Brain Research Bulletin. 66 (4–6): 277–281. doi:10.1016/j.brainresbull.2005.03.021. PMID 16144602. S2CID 7550915.
- Burke SN, Barnes CA (January 2006). "Neural plasticity in the ageing brain". Nature Reviews. Neuroscience. 7 (1): 30–40. doi:10.1038/nrn1809. PMID 16371948. S2CID 1784238.
- Cho RY, Gilbert A, Lewis DA (2005). "Ch 22. The neurobiology of schizophrenia". In Charney DS, Nestler EJ (eds.). Neurobiology of Mental Illness. Oxford University Press US. ISBN 978-0-19-518980-3.
- de Olmos J, Hardy H, Heimer L (September 1978). "The afferent connections of the main and the accessory olfactory bulb formations in the rat: an experimental HRP-study". The Journal of Comparative Neurology. 181 (2): 213–244. doi:10.1002/cne.901810202. PMID 690266. S2CID 30279710.
- Gorwood P, Corruble E, Falissard B, Goodwin GM (June 2008). "Toxic effects of depression on brain function: impairment of delayed recall and the cumulative length of depressive disorder in a large sample of depressed outpatients". The American Journal of Psychiatry. 165 (6): 731–739. doi:10.1176/appi.ajp.2008.07040574. PMID 18381906.
- Hebb DO (1949). Organization of Behavior: a Neuropsychological Theory. New York: John Wiley. ISBN 978-0-471-36727-7.
- Kötter R, Stephan KE (1997). "Useless or helpful? The "limbic system" concept". Reviews in the Neurosciences. 8 (2): 139–145. doi:10.1515/REVNEURO.1997.8.2.139. PMID 9344183. S2CID 956575.
- Maguire EA, Burgess N, Donnett JG, Frackowiak RS, Frith CD, O'Keefe J (May 1998). "Knowing where and getting there: a human navigation network". Science. 280 (5365): 921–924. Bibcode:1998Sci...280..921M. CiteSeerX 10.1.1.23.4963. doi:10.1126/science.280.5365.921. PMID 9572740.
- McNaughton BL, Battaglia FP, Jensen O, Moser EI, Moser MB (August 2006). "Path integration and the neural basis of the 'cognitive map'". Nature Reviews. Neuroscience. 7 (8): 663–678. doi:10.1038/nrn1932. PMID 16858394. S2CID 16928213.
- O'Kane G, Kensinger EA, Corkin S (2004). "Evidence for semantic learning in profound amnesia: an investigation with patient H.M". Hippocampus. 14 (4): 417–425. doi:10.1002/hipo.20005. PMID 15224979. S2CID 7952612.
- Pearce JM (September 2001). "Ammon's horn and the hippocampus". Journal of Neurology, Neurosurgery, and Psychiatry. 71 (3): 351. doi:10.1136/jnnp.71.3.351. PMC 1737533. PMID 11511709.
- Rosenzweig ES, Barnes CA (February 2003). "Impact of aging on hippocampal function: plasticity, network dynamics, and cognition". Progress in Neurobiology. 69 (3): 143–179. doi:10.1016/S0301-0082(02)00126-0. PMID 12758108. S2CID 16771869.
- Skaggs WE, McNaughton BL, Wilson MA, Barnes CA (1996). "Theta phase precession in hippocampal neuronal populations and the compression of temporal sequences". Hippocampus. 6 (2): 149–172. doi:10.1002/(SICI)1098-1063(1996)6:2<149::AID-HIPO6>3.0.CO;2-K. PMID 8797016. S2CID 15813385.
- Wechsler RT, Morss AM, Wustoff CJ, Caughey AB (2004). Blueprints notes & cases: Neuroscience. Oxford: Blackwell Publishing. p. 37. ISBN 978-1-4051-0349-7. Archived from the original on 2016-08-28. Retrieved 2016-03-05.
- Alberini CM (ed.). Hippocampus. Wiley. ISBN 978-0-471-10994-5.
- Derdikman D, Knierim JJ, eds. (2014). Space, Time and Memory in the Hippocampal Formation. Springer. ISBN 978-3-7091-1292-2.
외부 링크
- BrainMaps 프로젝트에서 "히포캠푸스"를 포함한 염색된 뇌 조각 이미지
- 해마 뇌절편도
- 해마 – 세포 중심 데이터베이스
- Temporal-lobe.com 쥐의 파라히포캄팔-hipp오캄팔 영역의 상호작용도
- BrainNavigator를 통해 Wayback Machine에서 보관된 2012-03-09의 Hippocampus 검색





